Índice
Un azeótropo es una mezcla de dos o más líquidos cuya composición en el vapor es igual a la del líquido en ebullición. En la práctica, se comporta como si fuera un compuesto puro en destilación, lo que impide su separación por una simple destilación convencional.
En el punto azeotrópico, la mezcla no puede enriquecerse más en ningún componente por destilación simple. Para separarla, se recurre a destilación azeotrópica, un tercer componente “arrastrador”, tamices moleculares u otras técnicas.
Ejemplos de azeótropos
| Componente A | Componente B | Azeótropo | ||
| P.e. (ºC) | % (peso) | P.e. (ºC) | % (peso) | P.e. (ºC) |
| H2O (100) | 1.3 | Éter dietílico (34.5) | 98.7 | 34.2 |
| H2O (100) | 1.4 | Pentano (36.1) | 98.6 | 34.6 |
| MeOH (64.7) | 12.1 | Acetona (56.1) | 87.9 | 55.5 |
| MeOH (64.7) | 72.5 | Tolueno (110.7) | 27.5 | 63.5 |
| EtOH (78.3) | 68.0 | Tolueno (110.7) | 32.0 | 76.7 |
| H2O (100) | 13.5 | Tolueno (110.7) | 86.5 | 84.1 |
¿Qué es la destilación azeotrópica?
Es un procedimiento para eliminar agua u otro líquido de un crudo de reacción por destilación conjunta con un disolvente orgánico inmiscible (el “arrastrador”). Al formar un nuevo azeótropo y dos fases, se facilita la separación del componente indeseado.

Separación del azeótropo agua/tolueno con Dean-Stark
Si la reacción usa tolueno (menos denso que agua), el vapor de reflujo contiene el azeótropo tolueno/agua. Al condensar, cae a la trampa Dean-Stark donde se decantan dos fases: tolueno arriba y agua abajo. El brazo lateral devuelve tolueno al matraz y el agua se purga por la llave inferior.

Historia: Dean-Stark fue propuesto (1920) por E.W. Dean y D.D. Stark para determinar agua en petróleo.
Ejemplos de aplicación
Muchas reacciones de equilibrio que generan agua (p. ej., acetalización) se benefician del arrastre para desplazar el equilibrio hacia producto:
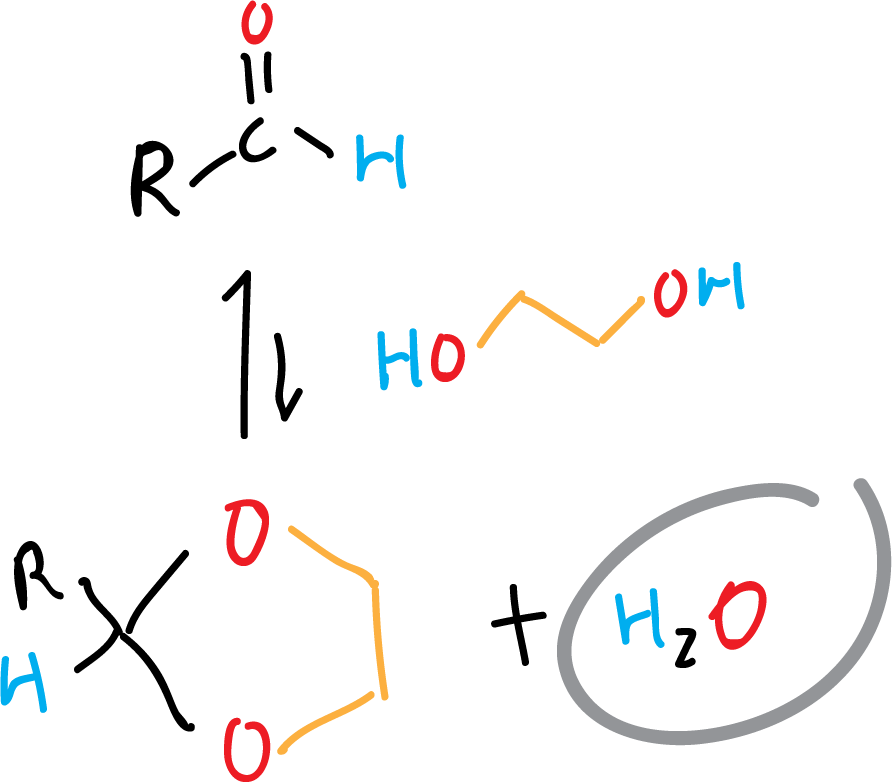
¿Cómo “romper” un azeótropo?
- Arrastrador (tercer componente): modifica volatilidades relativas (destilación azeotrópica).
- Tamices moleculares: deshidratación selectiva (p. ej., EtOH/H2O 96% → etanol anhidro). Más sobre tamices.
- Otras: extracción L-L, pervaporación, cambio de presión, destilación extractiva.
Resumen rápido
- En el punto azeotrópico, destilar no separa. Necesitas cambiar el sistema (tercer componente, tamiz, presión…).
- Para eliminar agua durante una reacción: tolueno + Dean-Stark.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier. ISBN 978-0-12-803893-2.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
