Written by J.A. Dobado | Last Updated on 1 año
¿Qué son las Estructuras de Lewis?
Gilbert Newton Lewis propuso que para que una molécula fuera estable su capa de valencia debería estar completa. El hidrógeno, con 1 electrón en un orbital s, necesita sólo 1 electrón para completar su capa de valencia. Sin embargo, como el carbono presenta 4 electrones de valencia, necesitará completar los 4 orbitales de valencia (s , px, py, pz) con otros 4 electrones adicionales, hasta alcanzar un total de 8 electrones de valencia (regla del octeto). Esta configuración electrónica es especialmente estable y similar a la de un gas noble.
Índice
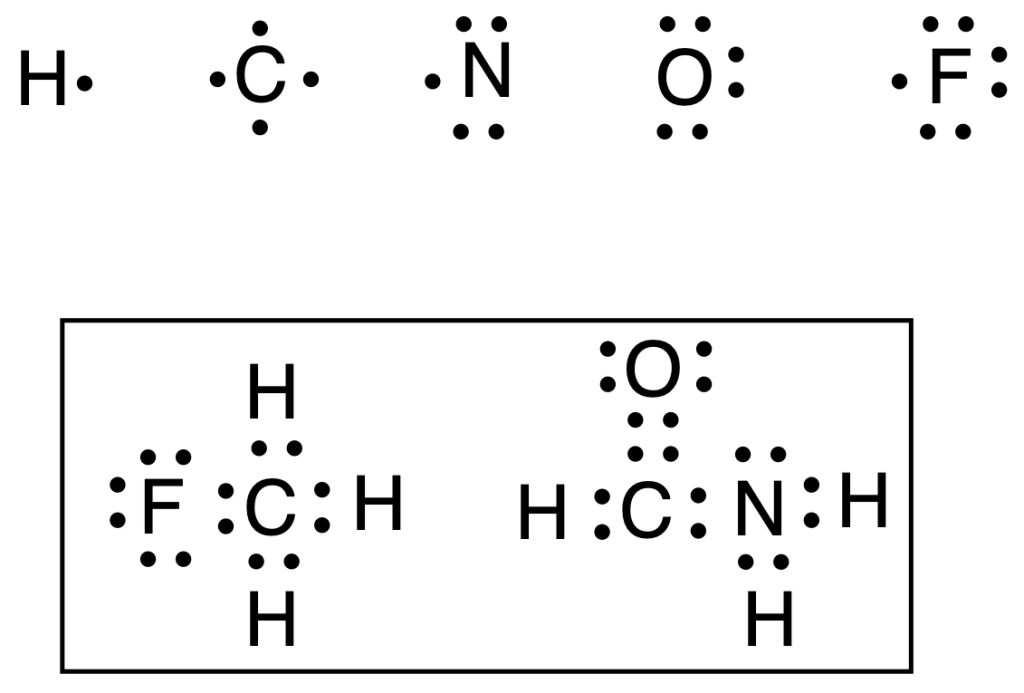
Para visualizar esto, G.N. Lewis desarrolló un sistema de representación donde los electrones de valencia se indican, alrededor de los átomos, con puntos (·) y un par de electrones con dos puntos (:). Todavía, se continúa considerando como una de la formas más famosas de estructura y representación de las moléculas orgánicas.
Por ejemplo, en la figura superior, se representan los átomos de hidrógeno, carbono, nitrógeno, oxígeno y flúor con sus electrones de valencia (1, 4, 5, 6 y 7, respectivamente), así como las estructuras de Lewis para las moléculas de CH3F (fluorometano) y HCONH2 (formamida).
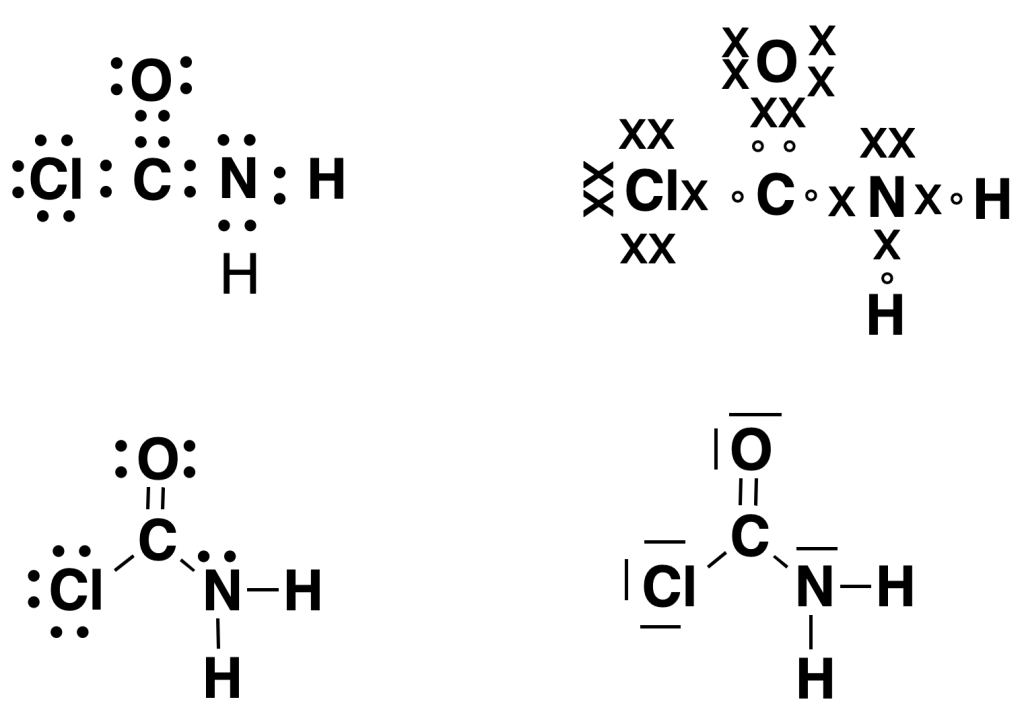
Alternativamente, se pueden representar los electrones con los símbolos (o) y (x) para visualizar más claramente su «procedencia«.
Además, para simplificar aún más las estructuras, en lugar de puntos se dibujan líneas (–) para representar los enlaces y puntos para los electrones que no forman enlace (electrones no enlazantes). En otros textos aparecen este tipo de representaciones sólo con líneas.
En la siguiente figura se muestran distintas formas de representación de Lewis para la molécula ClCONH2. Independientemente de la forma de dibujar los electrones, todas ellas ponen de manifiesto que el oxígeno presenta dos pares de electrones sin compartir y forma un enlace doble con el carbono, que el nitrógeno tiene sólo un par de electrones sin compartir y que el cloro posee tres.
Resumiendo, las estructuras de Lewis muestran, de forma gráfica y sencilla, el número y tipo de enlaces de una molécula (conectividad), así como el número de pares de electrones sin compartir, o electrones desapareados.
Carga formal
La carga formal de un átomo es la carga que tendría dicho átomo considerando que todos los enlaces presentes en dicho átomo fuesen covalentes puros.
La carga formal en un átomo se calcula mediante la siguiente fórmula:
carga formal de un átomo = (nº e– de valencia) – (nº e– no enlazados) – ½ (nº e– enlazados)
Por ejemplo, la carga formal del átomo de carbono es 0 en el metano, y la calculamos de la siguiente manera:
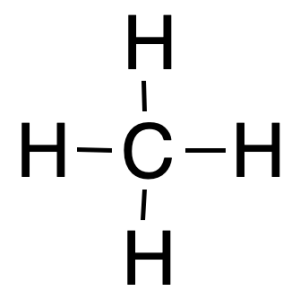
El número de electrones de valencia del carbono es 4.
No presenta ningún electrón no enlazados en el carbono.
Los electrones enlazados del carbono son 8.
Por tanto, lacarga formal del carbono será cero = (4) – (0) – ½(8) = 0
Estructuras resonantes
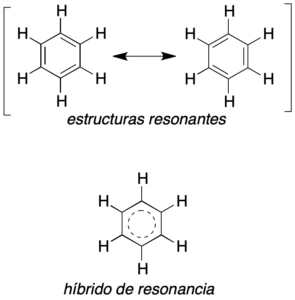
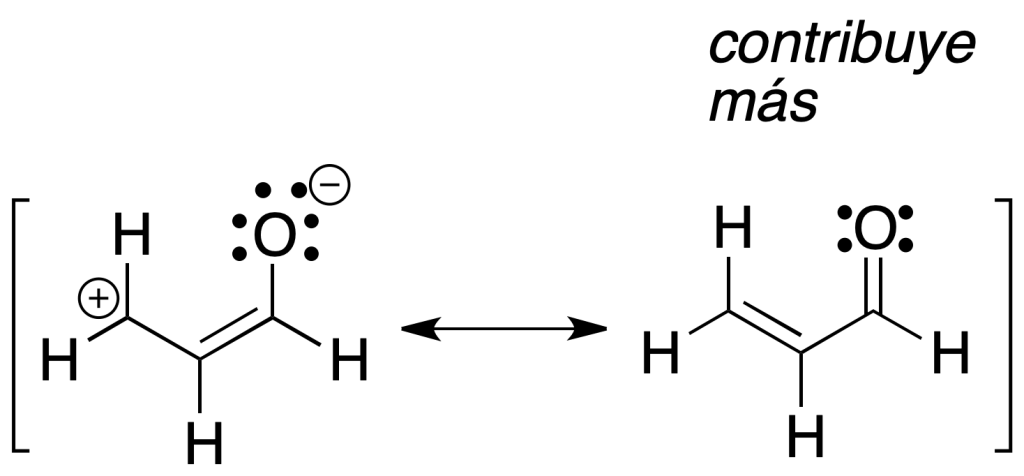
Dentro de la estructura y representación de las moléculas orgánicas, hay muchas que presentan unas propiedades particulares debido a una especial distribución de la densidad electrónica. Entre estos cabe destacar los compuestos aromáticos, por ejemplo benceno. Dichos compuestos se pueden describir mediante varias estructuras de Lewis, y se denominan estructuras resonantes, y difieren sólo en la distribución de sus electrones (no la de los átomos). Por ejemplo el benceno se puede representar, principalmente, por dos estructuras resonantes que se indican en la figura.
Hay que resaltar que las dos describen al benceno, siendo en realidad una estructura con características intermedias (por ejemplo, la longitud de los enlaces C-C sería intermedia entre la de un enlace sencillo y uno doble). Las estructuras resonantes se suelen indicar entre paréntesis y se relacionan con una flecha de doble punta, que no debe de confundirse con sistemas en equilibrio, reacciones, etc.
Además, no debemos cambiar las posiciones nucleares y la orientación de la molécula en dichas estructuras. El híbrido de resonancia sería una estructura única que representa esta situación.
Las diferentes estructuras resonantes tienen una mayor o menor contribución al híbrido de resonancia dependiendo de la estabilidad de cada una de ellas (las estructuras con menor energía contribuyen más), y dicha contribución se puede evaluar cualitativamente teniendo en cuenta las siguientes consideraciones:
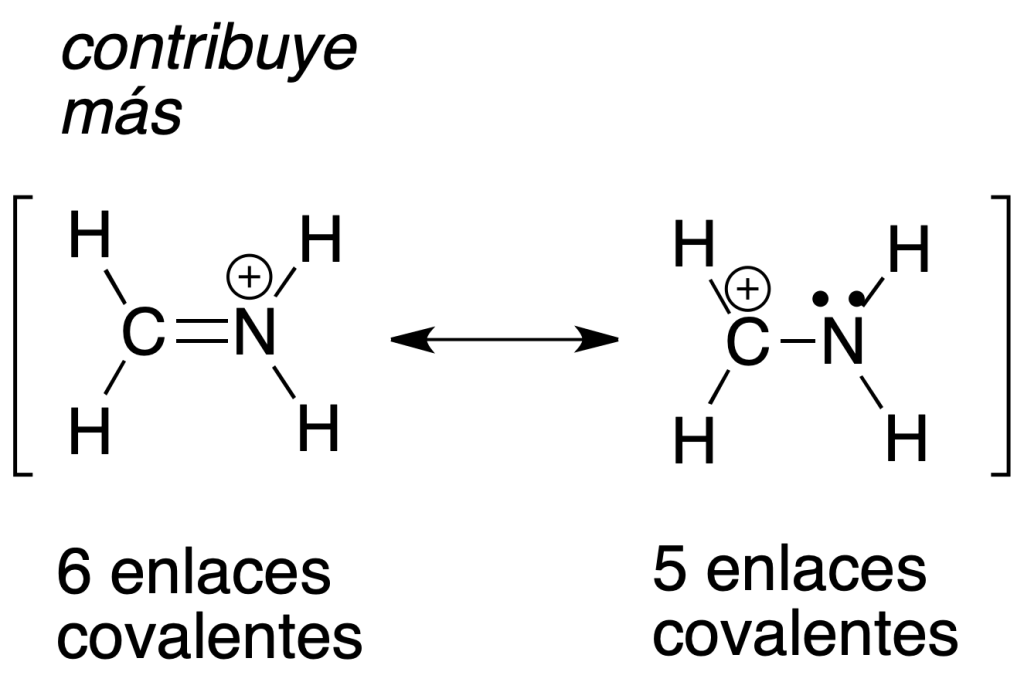
a) La estructura resonante más estable (que contribuye más) es la que presente el mayor número de enlaces covalentes.
b) La estructura resonante más estable (que contribuye más) es la que presente el mayor número de octetes (2 y 1 en el caso anterior).
c) Las estructuras sin carga son más estables (contribuyen más) que las que presentan separación de cargas.
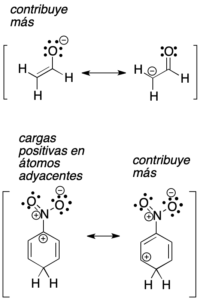
d) Al comparar dos estructuras resonantes con carga, será más estable la que tenga su carga negativa sobre el átomo más electronegativo.
e) Al comparar dos estructuras resonantes con carga, será más estable la que tenga una mínima separación de cargas de distinto signo. Además, es más inestable la estructura con la misma carga sobre átomos adyacentes.
Ejemplos de estructuras de Lewis
Molécula de acetona
La acetona tiene formula molecular CH3COCH3 y carga formal cero.
- Primer paso: Escoger el átomo central. En este caso, el átomo de carbono carbonílico (azul). Situar todos los demás átomos al rededor añadiendo los electrones de valencia con los símbolos «x» y «o». Asegurándonos de que en átomos contiguos tengamos de distinto tipo para no confundirnos.
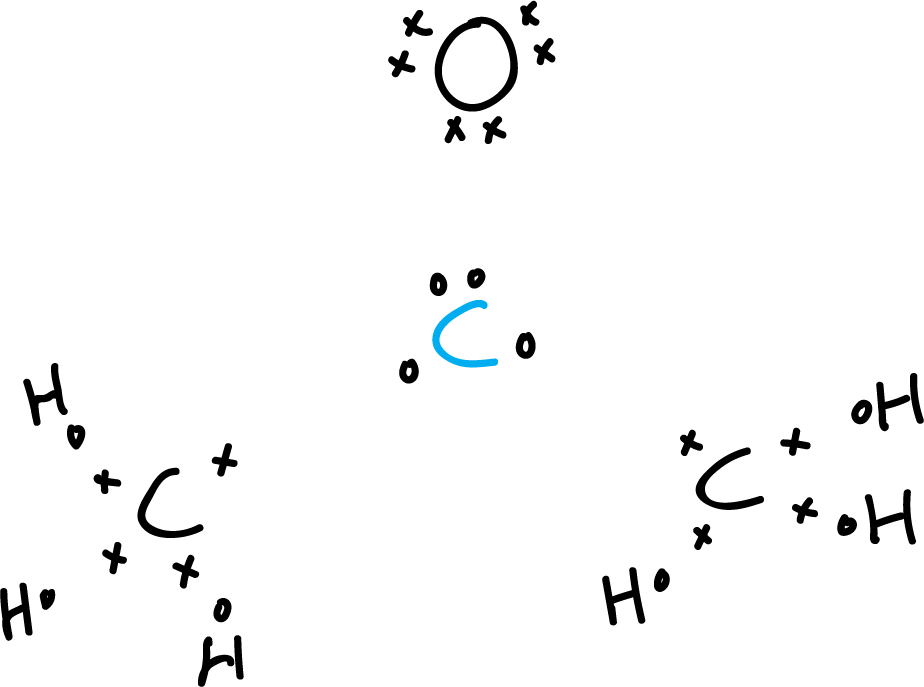
- Segundo paso: Contar los electrones de valencia. Los carbonos presentan cuatro electrones de valencia y
el oxígeno presenta 6, y los seis hidrógenos 1, cada uno respectivamente.
Esto hace un total de (3 × 4) + (6 × 1) + (1 × 6)= 24.
La acetona no presenta ninguna carga neta, extra o de menos debida a iones negativos o positivos.
Por tanto, el número total de electrones es de 24. Dibujamos los enlaces de valencia que nos resultan (líneas naranjas).
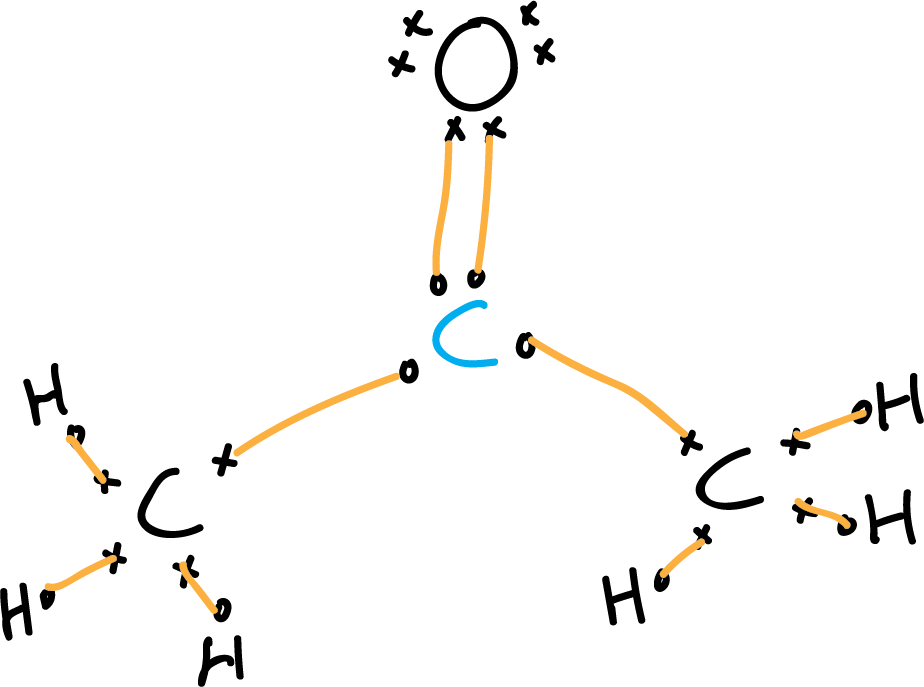
- Tercer paso: Localizar los pares de electrones y ajustar a la regla del octeto.
Los carbonos se enlazan al carbono central (carbono carbonílico señalado en azul).
Hacemos lo mismo con el nitrógeno y con los hidrógenos.
Se buscan los electrones necesarios para cumplir la regla del octeto.
Como los cuatro átomos (tres carbonos y un oxígeno)
deben cumplirla, el número total sería 4 x 8 = 32 electrones para cumplir la regla del octeto,
pero hay que restarles los 6 electrones de los hidrógenos (32 – 6 = 26), con lo que nos quedan 26 electrones.
De acuerdo a los cálculos anteriores el número de electrones
enlazantes serían 26 – 24 = 1 que corresponden a un par mas del doble enlace del grupo carbonilo. Dibujamos los pares de electrones sin copartir (líneas verdes).
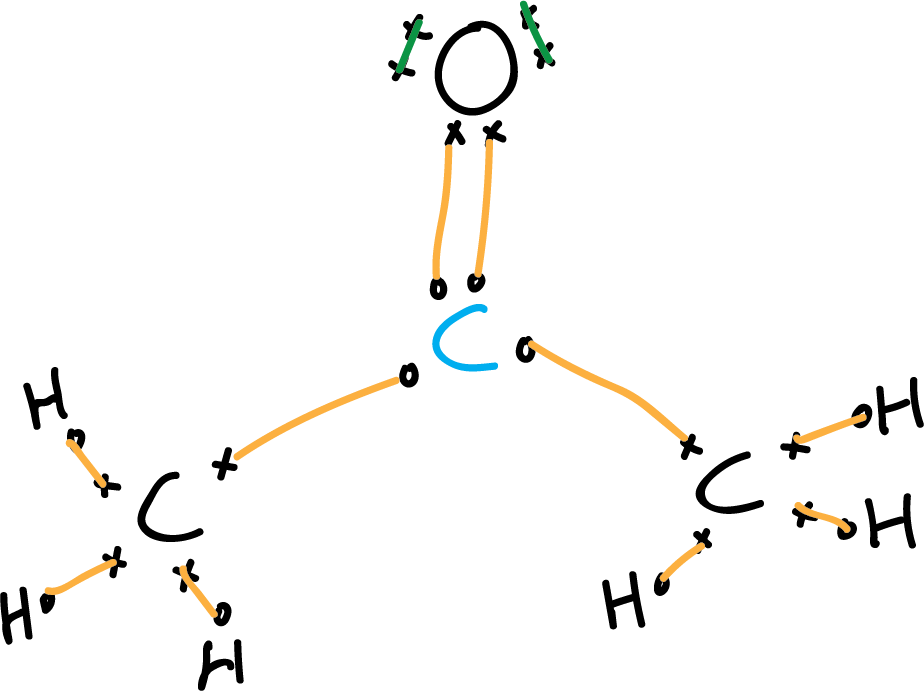
- Cuarto paso: Electrones no enlazantes (pares de electrones sin compartir).
Para localizar los electrones no enlazantes simplemente se calcula la diferencia entre los electrones de valencia totales menos los enlazantes: 32 – (26 + 2) = 4 electrones que corresponden a 2 pares de electrones, los cuales se ubican bajo la premisa del cumplimiento de la regla del octeto se asignan al oxígeno. (Se puede simplificar el dibujo eliminando los electrones).
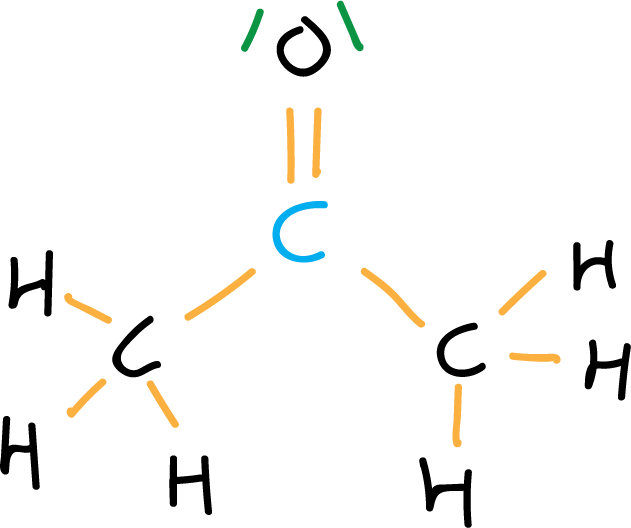
- Quinto paso: Carga formal. en el caso de que exista carga formal se ubica en el correspondiente átomo. En este caso la carga formal es cero. Generalmente, se simplifica aún más la representacion de la molécula de acetona eliminando los enlaces C-H, y representando los pares de electrones por puntos.
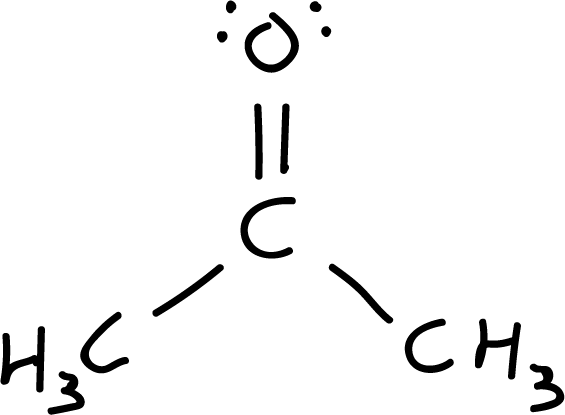
- Sexto paso: Estructuras resonantes. Se exploran estructuras resonantes reubicando cargas y enlaces. Se parte de la estructura I, se mueve un par de electrones del doble enlace carbonilo hacia el oxígeno (átomo más electronegativo), resultando en la estructura resonante II, que presenta una carga positiva en el carbono y otra negativa en el oxígeno (carga neta es cero).
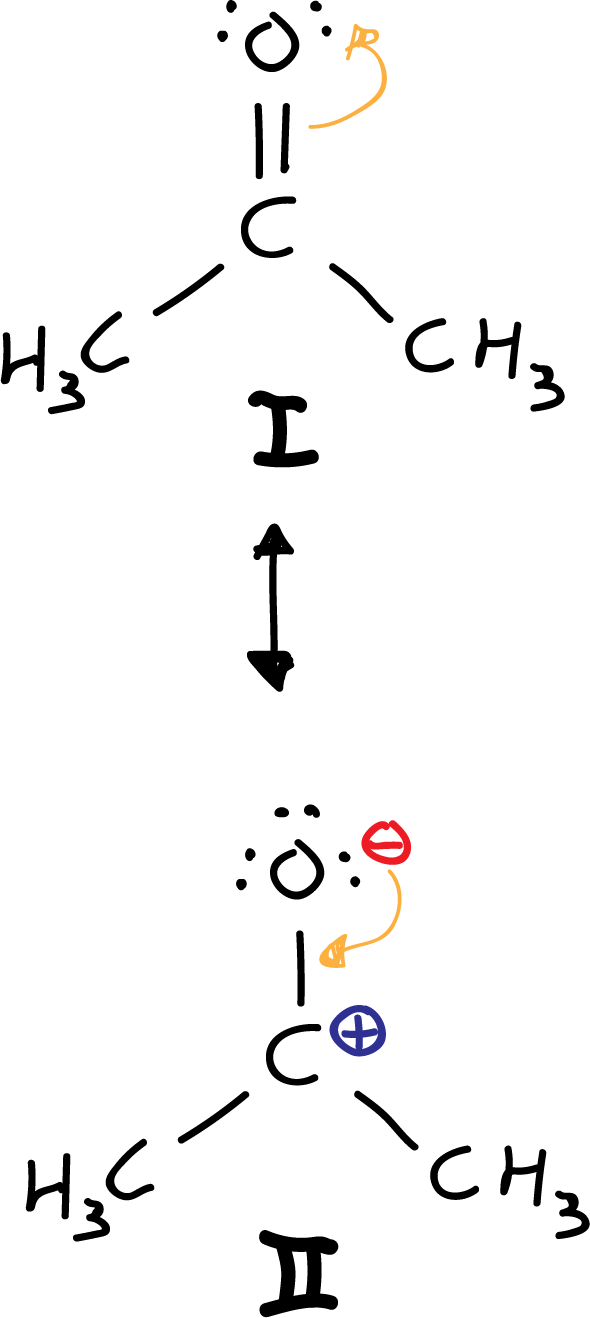
Otra opción sería mover, de la estructura I, un par de electrones del doble enlace carbonilo hacia el oxígeno. Sin embargo, debido a que el carbono es menos electronegativo (véase tabla de electronegatividad) que el oxígeno, la estructura resonante III queda descartada, porque resulta con un carbono electronegativo y un oxígeno electropositivo.
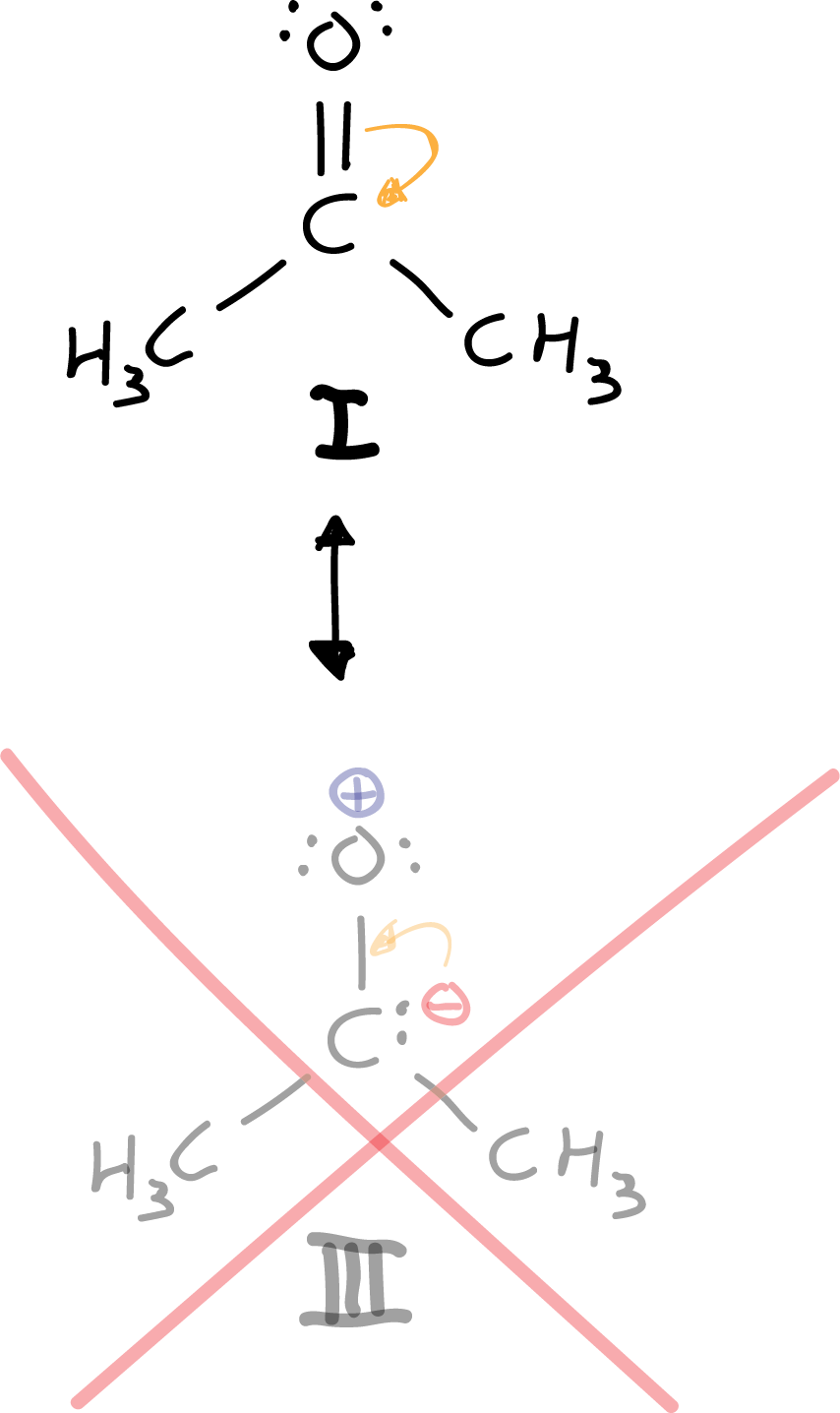
Solo hay una estructura resonante que cumple con la regla del octeto, y es la estructura I. Ni la estructura II ni la III la cumplen, pero la III. Además se descarta a priori debido a que se estamos poniendo carga negativa a un átomo que no es el más electronegativo de la molécula.