Written by J.A. Dobado | Last Updated on 1 año
¿Que es un azeótropo?
Un azeótropo es una mezcla de dos o más componentes, cuya proporciones son tales que el vapor producido por evaporación parcial tiene la misma composición que el líquido. Por tanto, se comportan en la destilación como si fuesen un compuesto puro (véase Tabla 1).
Índice
Cuando en una mezcla se encuentra en el punto del azeótropo (mezcla azeotrópica), dicha mezcla no puede ser destilable o separada en sus componentes.
Por tanto, cuando se quiere separar un aceótropo por destilación se le añade a la mezcla un tercer componente adicional (denominado «arrastrador»). El efecto conseguido es el de cambiar la volatilidad de uno de los componentes del azeótropo en mayor medida que el otro, permitiendo que se produzca dicha separación.
Ejemplos de azeótropos
Hay multitud de combinaciones entre dos disolventes que resultan en una mezcla azeotrópica, y en la Tabla 1 se resumen los más comunes.
| Componente A | Componente B | Azeótropo | ||
| P.e. (ºC) | % (peso) | P.e. (ºC) | % (peso) | P.e. (ºC) |
| H2O (100) | 1.3 | Éter dietílico (34.5) | 98.7 | 34.2 |
| H2O (100) | 1.4 | Pentano (36.1) | 98.6 | 34.6 |
| MeOH (64.7) | 12.1 | Acetona (56.1) | 87.9 | 55.5 |
| MeOH (64.7) | 72.5 | Tolueno (110.7) | 27.5 | 63.5 |
| EtOH (78.3) | 68.0 | Tolueno (110.7) | 32.0 | 76.7 |
| H2O (100) | 13.5 | Tolueno (110.7) | 86.5 | 84.1 |
¿Que es la destilación azeotrópica?
La destilación azeotrópica es un procedimiento útil para eliminar un líquido de un crudo de reacción por destilación conjunta con un disolvente orgánico inmiscible.
Esta técnica se suele usar en reacciones de equilibrio en donde se genera agua como subproducto de la reacción. La eliminación de agua desplazará el equilibrio de la reacción hacia el lado del producto.

Separación del azeótropo agua/tolueno
Si la reacción se lleva a cabo por ejemplo con tolueno, que es menos denso que el agua, el vapor en el condensador de reflujo estará formado por una mezcla azeotrópica de tolueno y agua. Cuando esta mezcla se condensa, cae en el denominado Dean-Stark, formándose dos fases la capa superior estará constituida por tolueno y la inferior por agua.

Cuando el nivel de líquido en la trampa de Dean-Stark llega a la parte superior del brazo lateral, el tolueno fluye de nuevo hacia el matraz de reacción. El agua se puede eliminar a través de una llave en la parte inferior de la trampa Dean-Stark.
El equipo Dean-Stark Fue inventado en 1920 por los Químicos de Estados Unidos, Ernest Woodward Dean (1888–1959) y David Dewey Stark (1893–1979), aplicado a la determinación de agua en el petróleo.
Ejemplos de aplicación
La destilación azeotrópica se utiliza, también, en reacciones de equilibrio de deshidratación. Debido a que algunas presentan no solo un equilibrio que revierte la reacción al aparecer agua, sino que el proceso es rápido. Ejemplos de este ttipo de reacciones son la formación de dioxolanos a partir de aldehídos como se indica en el esquema.
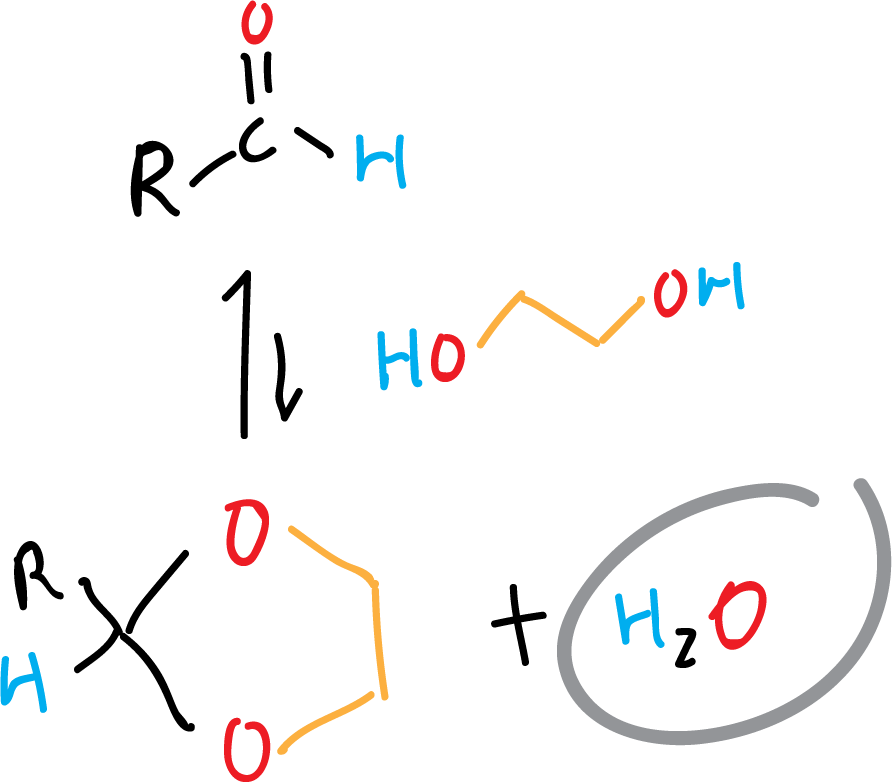
Al eliminar el agua de la reacción, mediante destilación azeotrópica, el equilibrio se desplaza favorablemente hacia la formación de los productos.
Rotura de un azeótropo
Los azeótropos de bajo punto de ebullición, no pueden purificarse completamente por destilación, para obtener el componente más volatil. Alternativamente, se puede separar el componente más volátil puro «rompiendo el azeótropo«.
Esto se consigue con un método distinto a la destilación, empleando tamices moleculares. El empleo de tamices moleculares se utiliza para romper el azeótropo EtOH/H2O (96%) y conseguir el alcohol anhidro, quedando el agua absorbida en los tamices moleculares. Los tamices se pueden reutilizar posteriormente mediante deshidratación utilizando un horno.
Video de la destilación azeotrópica
Resumen
La destilación azeotrópica es una técnica especial en la que se adiciona otro componente para romper las interacciones intermoleculares, resultando en una mezcla hetereogénea (ya que produce dos fases con líquidos inmiscibles y nuevo azeótropo). Por ejemplo, se puede añadir tolueno (mejor que benceno que es cancerígeno) a una mezcla azeotrópica de etanol/agua, para separar el agua del azeótropo.
El equipo Dean-Stark se pueden realizar las destilaciones azeotrópicas en el laboratorio, y también está especialmente indicado para separar agua de una reacción, como por ejemplo en mezclas tolueno/agua.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
