Índice
Written by J.A. Dobado | Last Updated on 1 año
¿Qué es el número de oxidación?
El número de oxidación es una carga ficticia asignada a los átomos para indicar su posible carga neta y rastrear los electrones en una reacción. Ayuda a determinar si una reacción es redox. Solo para iones elementales coincide con su carga real.
El número de oxidación es necesario para poder formular y nombrar correctamente a un compuesto.
Valencia
La valencia es un termino (obsoleto) que indica el número de enlaces que presenta un elemento en un compuesto químico. Es el número de electrones que le faltan o tiene que ceder un elemento químico para completar su último nivel de energía. Normalmente, los elementos químicos presentan una o más valencias. Actualmente, se ha reemplazado este termino por el concepto de números de oxidación y que realmente representa lo mismo.
Reglas para asignar el número de oxidación
A continuación se describen una serie de reglas para asignar el número de oxidación a diferentes átomos:
- El número de oxidación de un elemento en su estado libre es cero, 0. Por ejemplo: H2, O2, P4, etc. = 0.
- El número de oxidación de iónes monoatómicos es igual a la carga de dichos iones. Por ejemplo: Na+ = +1, Ca2+ = +2; Cl– = -1.
- El número de oxidación del hidrógeno es +1 en todos sus compuestos, excepto en los hidruros metálicos que es -1. Por ejemplo: NaH.
- El número de oxidación del oxígeno es -2 en todos sus compuestos, excepto en los peróxidos don de es -1. Por ejemplo: H2O2 o Na2O2. El oxígeno combinado con flúor tiene un número de oxidación de -2. Por ejemplo: OF2.
- El número de oxidación para los metales alcalinos (Li, Na, K, Rb …) es +1, y para los alcalinoterreos (Be, Mg, Ca, Sr …) +2. El flúor es el elemento más electronegativo de todos correspondiéndole un número de oxidación de -1.
- En las combinaciones entre los no-metales (sin hidrógeno ni oxígeno), el elemento menos metálico presenta un número de oxidación negativo (siendo el valor numérico igual a la carga del ión negativo mas frecuente). Por ejemplo: en el tetracloruro de carbono, CCl4, el cloro presenta un número de oxidación de -1 y el carbono de +4. (véase regla siguiente).
- Los números de oxidación de los elementos restantes, se calculan a partir de las reglas anteriores, teniendo en cuenta la suma algebraica de los número de oxidación debe de ser cero para moléculas neutras, e igual a la carga neta para los iones poliatómicos.
Tabla periódica con los números de oxidación
En la siguiente figura se recopilan los números de oxidación del los elementos de la tabla periódica.
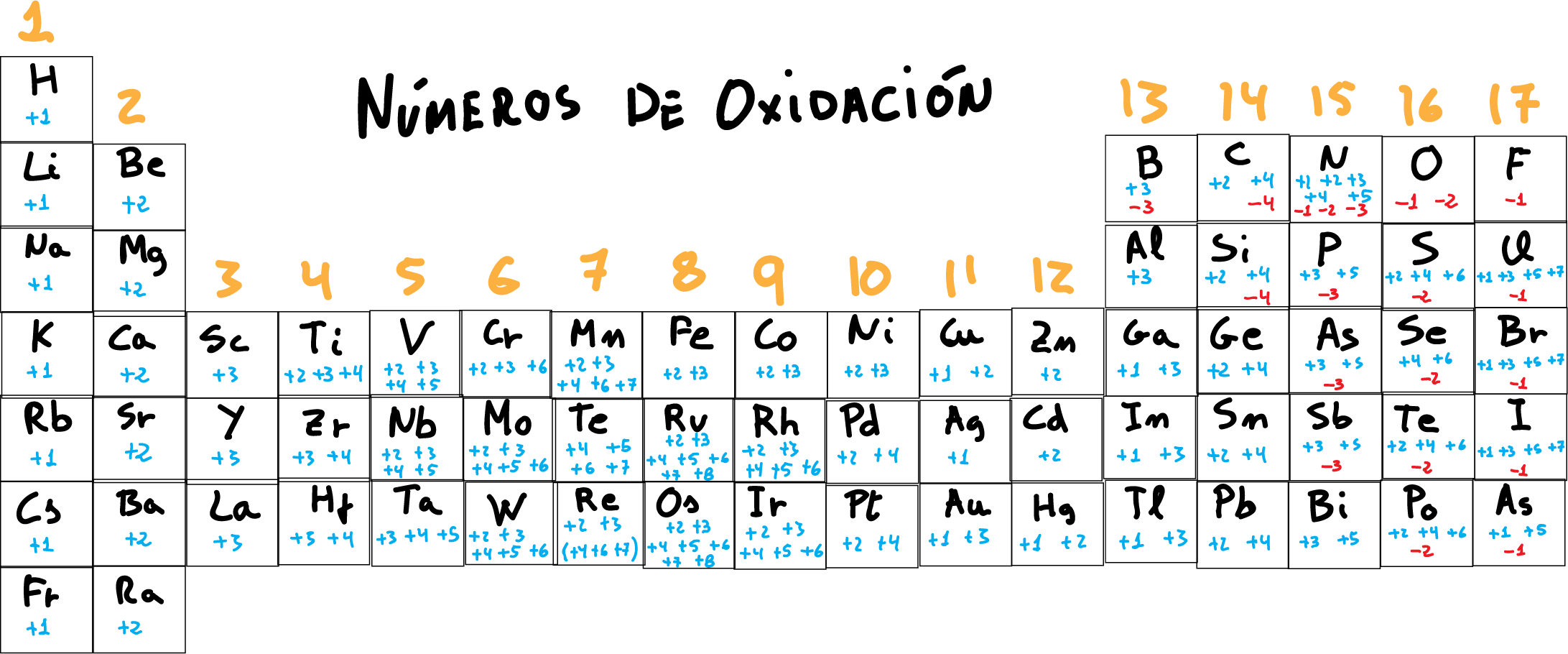
Como característica general, los átomos alcalinos (grupo 1) presentan carga +1, los alcalino-terreos (grupo 2), numero de oxidación +2, y los halógenos cuando tienen número de oxidación negativo de -1.
Cálculo del número de oxidación para un solo átomo de carbono
En compuestos con un solo carbono el número de oxidación se puede calcular a partir de la fórmula molecular.
Se suelen usar como referencia valores de +1 y -2 para los número de oxidación del hidrógeno y oxígeno, respectivamente.
Por tanto, en moléculas como CH4 o CO2 debido a que la carga total es 0, el número de oxidación del carbono en el metano es -4, y en el dióxido de carbono +4.
- La oxidación de un carbono corresponde al aumento del número de enlaces C-O.
- La reducción de un carbono corresponde a la disminución del número de enlaces C-O, o al aumento del número de enlaces carbono-hidrógeno C-H.
Por ejemplo, en la siguiente reacción:
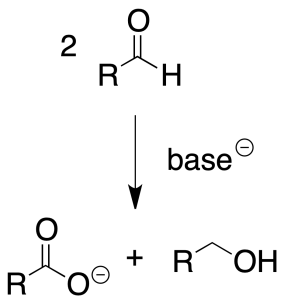
la molécula de RCOH se oxida a RCOOH (aumenta el número de enlaces C-O), mientras que también se reduce hasta RCH2OH (disminuye el número de enlaces C-O, o bien, aumenta el número de enlaces C-H).
Por tanto, en dicho ejemplo el reactivo se oxida y también se reduce; es la llamada reacción de Cannizzaro.
Ejemplos
- ¿Qué número de oxidación tiene cada átomo en la molécula de cloruro de Zinc, ZnCl2 ?
La carga total en la molécula debe de ser cero, 0. Por tanto, si el número de átomos de Cloro es dos y su número de oxidación -1 (al ser ión negativo y pertenecer al grupo 17), el resultado para el cloro es (-1) × 2 = -2.
Es decir, el único átomo de Zinc debe de tener carga opuesta (número de oxidación) +2 para que la suma total sea cero:
Cl = 2 × (-1) = -2
Zn = +2
Carga neta = 0 = (-2) + (+2)
En consecuencia, el número de oxidación del Zn = +2 y el del cloro Cl = -1.
- ¿Qué número de oxidación tiene cada átomo en la molécula de sulfato sódico, Na2SO4 ?
Al igual que en el caso del ZnCl2, La carga total en la molécula debe de ser cero 0. Desdoblamos por un lado el sodio y por otro el sulfato. Por tanto, si el número de átomos de Na es dos y su número de oxidación +1 (al ser ión positivo y pertenecer al grupo 1, alcalinos) el resultado para el Na es 2 ×(+1) = +2. Es decir, la carga +2, la debe de compensar negativamente el ion negativo sulfato por eso se escribe como (SO4=).
El oxígeno presenta número de oxidación de óxido de -2, y por tanto 4 átomos × (-2) de carga cada uno hacen un total de (-8) si le restamos las dos cargas negativas del ión total, el azufre debe tener la misma magnitud pero de signo contrario. Es decir, (-8) – (-2) = -6, y por esto el número de oxidación del azufre debe ser en este compuesto +6.
Para que la suma total sea cero en la molécula se debe de cumplir que:
Na = 2 × (+1) = +2
O = 4 × (-2) = -8
S = 1 × (+6) = +6
Carga neta = 0 = (+2) + (-8) + (+6)
En consecuencia, el número de oxidación del Na = +2 y el del oxígeno O = -2, y el del azufre S = +6.
Resumen
El número de oxidación es necesario para poder formular y nombrar correctamente a un compuesto y se utiliza para indicar la carga neta del mismo y contar el número de electrones. Sólo en el caso de iones elementales éste coincide con la carga eléctrica. En consecuencia, los números de oxidación de los átomos más utilizados se deben de memorizar, y para el resto de elementos, se podrían deducir fácilmente, a partir de sus fórmulas moleculares, como se ha visto en los ejemplos anteriores.
