Índice
Written by J.A. Dobado | Last Updated on 1 año
¿Qué es la extracción líquido-líquido?
La extracción líquido-líquido (denominada abreviadamente como extracción) es una de las operaciones básicas más comunes en el laboratorio de Química Orgánica y permite el aislamiento y la purificación de un producto resultante de una reacción química.
La extracción se puede definir como la transferencia de una sustancia X de una fase líquida A a otra fase líquida B. Ambos fases (o disolventes) deben ser inmiscibles, para que puedan formar de esa manera dos fases distintas y puedan separarse.
El intercambio de la sustancia X entre las dos fases A y B viene dado por la ecuación de Nernst:
![]()
donde CB(X) y CA(X) son las concentraciones de X en B y A, respectivamente, y KD es el coeficiente de reparto, que depende de la temperatura.
Esta operación se realiza típicamente entre una solución acuosa (capa acuosa) y un disolvente orgánico inmiscible en agua (capa orgánica) con la ayuda de un embudo de extracción (embudo de decantación). La posición relativa de las dos capas (superior, inferior) depende de la relación de densidades. Los disolventes clorados como el cloroformo (CH3Cl), cloruro de metileno (CH2Cl2), tetracloruro de carbono (CCl4), etc., permanecen siempre en la capa inferior, ya que son más densos que el agua.
Sin embargo, otros disolventes orgánicos tienen densidades más bajas que el agua (éter dietílico, acetato de etilo, tolueno, hexano, etc.) y por lo tanto, siempre permanecen en la capa superior.
Claramente, los solventes miscibles en agua no son útiles para este proceso, por ejemplo, acetona, MeOH, EtOH, etc.
Embudo de extracción: la extracción de líquido-líquido se realiza a escala de laboratorio con un embudo de separación, un recipiente cónico o en forma de pera con un tapón de vidrio esmerilado en la parte superior y una llave de paso que conecta el recipiente con un tubo de salida que termina en un estrechamiento.
Modo de empleo
Para una extracción exitosa, los siguientes pasos son necesarios:
- El embudo de extracción se acopla en un aro metálico a la rejilla del laboratorio, poniendo debajo un recipiente colector. Generalmente se utiliza un matraz Erlenmeyer.
- La altura del embudo de extracción se ajusta de modo que el tubo de salida quede a unos centímetros del colector.
- Verifique que la llave de paso esté cerrada antes de agregar cualquier líquido.
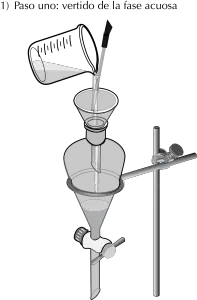
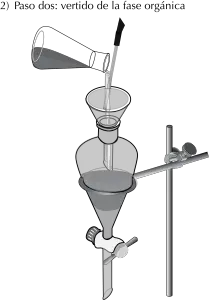
- Con el uso de un embudo conico, se vierten las dos capas inmiscibles en el embudo de extracción (véase Figura: pasos uno y dos).
- Compruebe que el tapon superior esté correctamente ajustado y cierra correctamente sin ninguna fuga.
- Retire el embudo de extracción del aro metálico y sosténgala firmemente con el lado tapón sobre la mano izquierda (para diestros) o derecha (para zurdos). Con la mano libre, sostenga el embudo entre los dedos en la zona de la llave de paso, para que pueda abrirse y cerrarse cómodamente con la punta del dedo índice y el pulgar (véase Figura: paso tres).
- Luego agite el embudo vigorosamente con ambas manos.
- Es importante abrir ocasionalmente la llave de paso para eliminar el exceso de presión que a veces se acumula en el interior (no dirija los gases que salen hacia usted u otra persona).
- Después de agitar, se vuelve el embudo a colocar en el aro metálico y se retira el tapón.
- Deje reposar hasta que las dos capas estén separadas (decantadas).
- La capa que queda en el fondo se vacía abriendo la llave de paso hasta el límite de las dos capas.
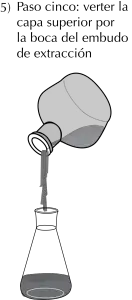
- Finalmente, la capa superior se vierte en otro recipiente tomando el embudo por el cuello (véase Figura: pasos cuatro y cinco).
Esquema general


Consideraciones prácticas
A veces, la separación entre las dos capas en el proceso de extracción presenta una serie de dificultades que ralentizan el proceso, como la formación de interfaces, espumas o emulsiones. No existe un procedimiento estándar para resolver tales problemas. A veces, una simple rotación rápida del embudo es suficiente para romperlos.
En otros casos, es útil agregar algunos cristales de sal (NaCl) o una solución concentrada de salmuera. Pero, en general, esperar es la solución más efectiva.
Cuando se realiza la extracción, las dos capas se saturan con respecto al otro disolvente: agua con disolvente orgánico y la capa orgánica con agua. Por lo tanto, el agua debe eliminarse del solvente orgánico para obtener el producto puro mediante un secado.
Por otro lado, la extracción no siempre se usa simplemente para separar compuestos, distribuyéndolos entre capas orgánicas y acuosas. A veces, es útil forzar la extracción acompañada de una reacción química (más comúnmente a través de una reacción ácido-base o mediante reacciones que forman complejos metálicos), permitiendo la purificación del compuesto si está contaminado con subproductos de diferentes propiedades químicas.
Por ejemplo, en el caso de los aldehídos, tales contaminantes pueden eliminarse de una capa orgánica mediante lavado con una solución acuosa de bisulfito; los alquenos también se pueden purificar con sales de plata o ácidos carboxílicos con soluciones básicas, etc. Este proceso de purificación de líquido se llama «lavado de disoluciones» y se realiza de la misma manera que una extracción líquido-líquido.
Extracción líquido-liquido en continuo
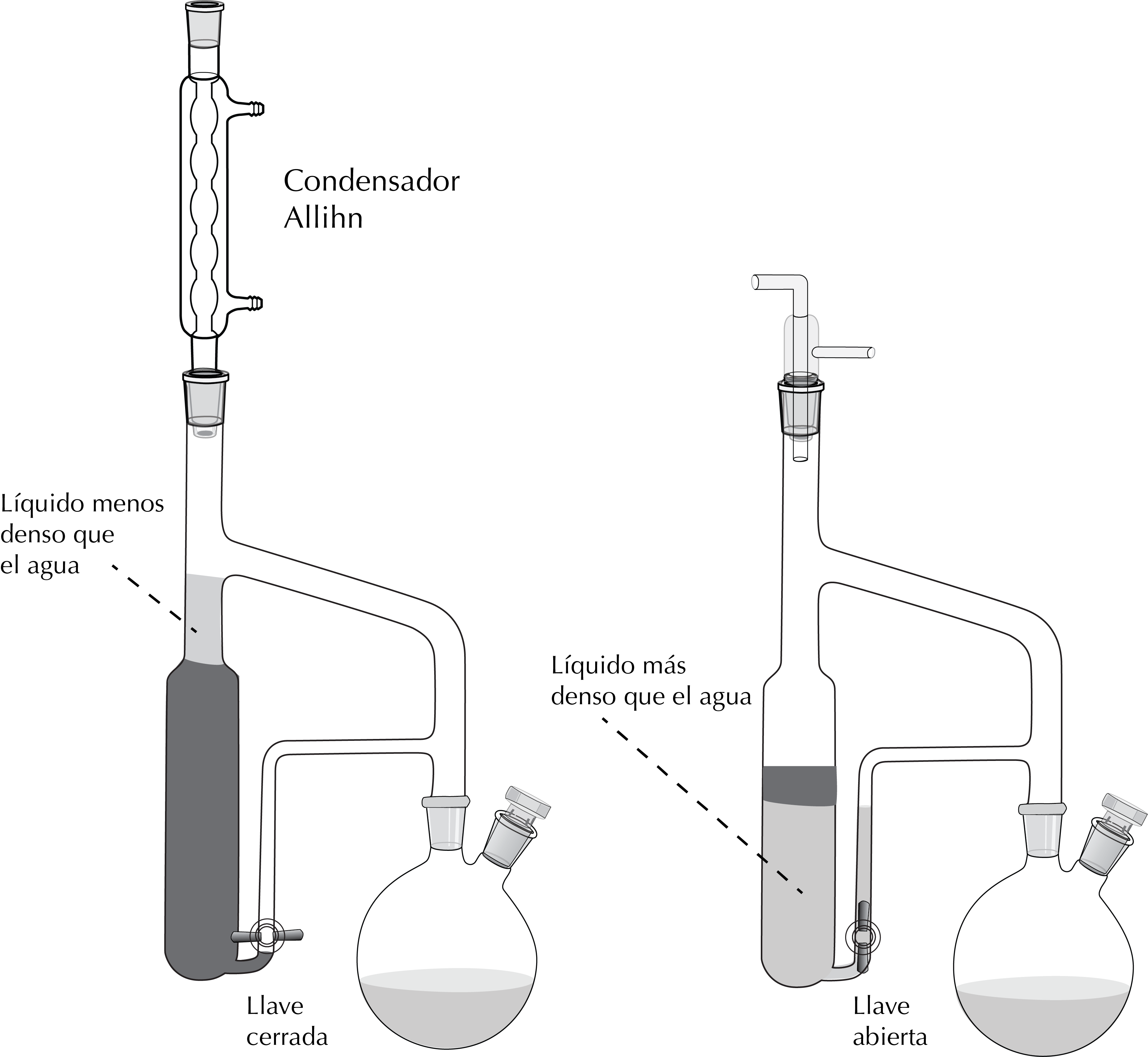
Cuando en una extracción líquido-líquido, no es posible aislar un producto orgánico ni siquiera utilizando las estrategias indicadas anteriormente, debido a que el coeficiente de reparto es muy desfavorable para el producto deseado, la solución sería realizar una gran cantidad de extracciones liquido-líquido, lo que no es operativo desde el punto de vista práctico. En tales casos, se recurre a la extracción liquido-líquido continua, la que se ilustra en la siguiente figura teniendo en cuenta la mayor o menor densidad del disolvente orgánico respecto de la del agua.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
