Written by J.A. Dobado | Last Updated on 1 año
Índice
A continuación, se aborda la estructura y representación de las moléculas orgánicas. Primeramente, se hace un repaso a los grupos funcionales y los tipos de fórmulas estructurales para representarlos. Posteriormente, se abordan conceptos clave en Química Orgánica como electronegatividad, polaridad de enlace e hibridación. Se continua con las representaciones estructurales de Lewis y de estructuras resonantes. Para finalizar, con una descripción de los tipos de representaciones más comunes en compuestos orgánicos cíclicos y acíclicos.
Grupos funcionales y fórmulas estructurales
Están descritos en la literatura química millones de compuestos orgánicos, debido a la capacidad casi ilimitada del carbono de formar enlaces estables consigo mismo y con una amplia gama de elementos.

Los átomos de carbono pueden dar enlaces carbono-carbono mediante uniones carbono-carbono sencillas, dobles o triples, pudiendo formar cadenas y/o ciclos, con la posibilidad de tener también ramificaciones.
Además, el carbono puede unirse otros elementos como H, O, N, S, halógenos, Si, etc. por lo que las posibilidades son prácticamente infinitas.
En la estructura de un compuesto orgánico podemos considerar cuatro niveles:
a) Composición: nos indica los átomos presentes en el compuesto y su proporción relativa.
b) Constitución: nos indica la conectividad de los diferentes átomos en el compuesto. La principal consecuencia es el concepto de grupo funcional, que es un átomo o agrupación de átomos que confieren a una molécula unas determinadas propiedades.
c) Configuración: nos indica cómo se distribuyen los distintos átomos y grupos funcionales en el espacio. Nos mostraría una imagen tridimensional de la molécula.
d) Conformación: como consecuencia del giro, más o menos restringido, en torno a los enlaces sencillos de los compuestos. Nos mostraría la disposición relativa en torno a cada uno de esos enlaces de los distintos sustituyentes.
Tipos de fórmulas de las moléculas orgánicas
- Fórmula empírica: mediante la fórmula empírica se describe la clase de átomos que hay en la molécula y la relación de éstos que hay presentes, por ejemplo, -CH2 para el eteno.
- Fórmula molecular: con la fórmula molecular se describe el número exacto de átomos que forman una molécula. La fórmula molecular puede coincidir con la empírica o ser múltiplo de ésta, por ejemplo, C2H4 para el eteno.
- Fórmula estructural: la fórmula estructural describe el tipo de enlaces que hay en una molécula. La fórmula estructural puede ser:
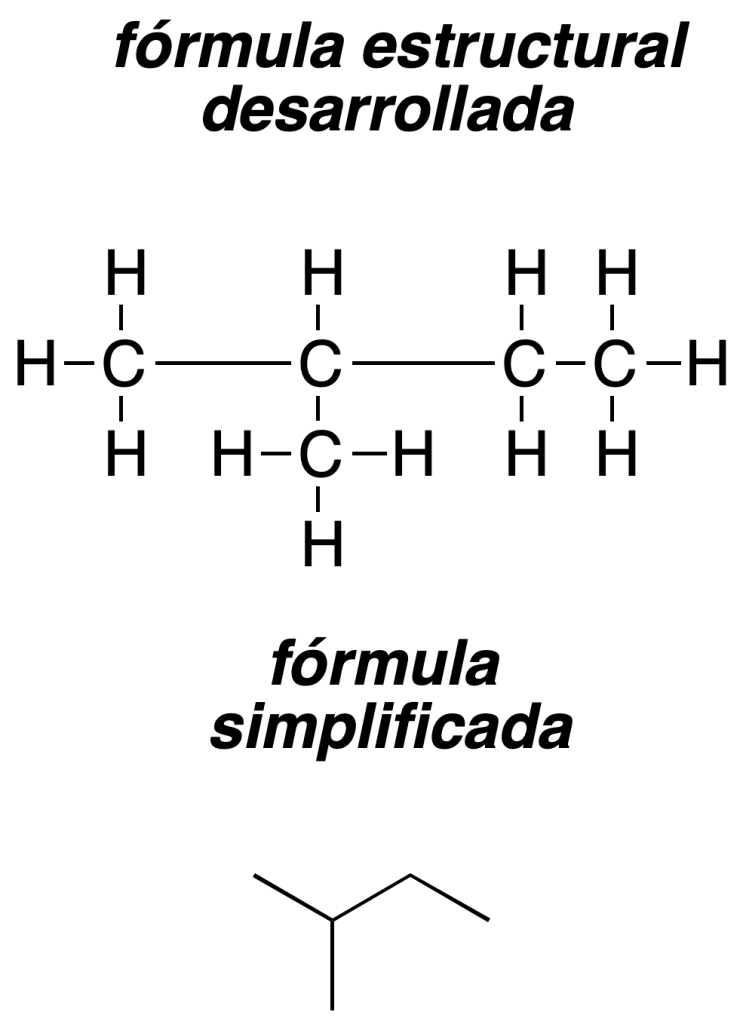
- Fórmula desarrollada: en la fórmula desarrollada se representan todos los enlaces de la molécula. La fórmula estructuraldesarrollada es una representación gráfica que indica la manera de conectarse los átomos de una molécula determinada (los enlaces se muestran mediante líneas).
- Fórmula semidesarrollada: en la fórmula semidesarrollada,se suele simplificar la representación escribiendo los hidrógenos a continuación del átomo al que están unidos. Por ejemplo, CH3-CH2-CH3 para el propano.
Fórmula simplificada: en la fórmula simplificada o esqueletal se representan las cadenas carbonadas y los ciclos mediante líneas, de forma que los átomos de carbono e hidrógeno se indican de una forma implícita. El extremo de una línea corresponde a un -CH3, la conjunción de dos líneas representa un -CH2, de tres un -CH y de cuatro un carbono cuaternario.
- Número de insaturaciones: a partir de la fórmula molecular se puede obtener información sobre la estructura de la molécula, a través del número de insaturaciones. Una insaturación en una molécula puede ser debido a la presencia de:
- Un doble enlace
- Un ciclo
Algunos casos frecuentes son:
- Un triple enlace aporta dos instauraciones.
- El anillo de benceno aporta cuatro insaturaciones (equivale a tres dobles enlaces y un ciclo).
- Un heterociclo aromático pentagonal equivale a tres instauraciones (dos dobles enlaces más un ciclo).
Se calcula mediante la siguiente fórmula:
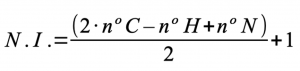
- En la expresión no interviene el número de átomos de oxígeno, ni de otros heteroátomos.
- Si en la fórmula aparece S no se considera, aunque el número de instauraciones puede desvirtuarse. Puede haber más instauraciones pero éstas estarán sobre el átomo de azufre.
- Si hay halógenos se considerarán equivalentes a hidrógenos.
- El átomo de P (fósforo) se considera equivalente a nitrógeno, pero debemos hacer la misma estimación que para el azufre.
- Si hubiera Si, se considera equivalente al carbono.
- No se consideran otros heteroátomos.
Hibridación y enlace
L.C. Pauling, en 1939, introdujo el concepto de hibridación de orbitales para explicar satisfactoriamente la tetravalencia del carbono y a la geometría de las moléculas orgánicas, aunque su configuración electrónica es (1s2 2s2 2p2). Según esta configuración, el carbono debería tener valencia 2, ya que los únicos electrones disponibles serían en principio los dos de los orbitales 2p.[1] Es más, la geometría, por ejemplo, del metano (CH4) es tetrahédrica (109,47º) a pesar de que los orbitales p forman entre ellos ángulos de 90º.
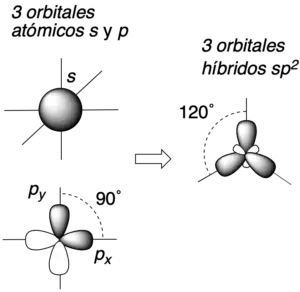
Los 4 orbitales de valencia (s y px, py, pz) del carbono se combinan para dar como resultado 4 nuevos orbitales híbridos sp3 como se indica en la figura. Los 4 nuevos orbitales híbridos adoptarán una disposición geométrica que los separe lo máximo posible entre ellos, esto es, orientados según los vértices de un tetraedro (tetraédricamente).
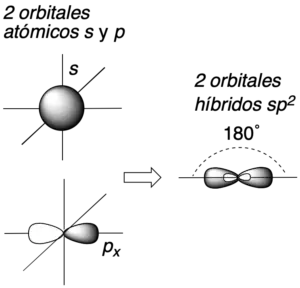
Además, cuando el carbono participa de enlace múltiple o presenta carga, se pueden dar otros tipos de hibridaciones tales como la sp2 o la sp, con geometría trigonal-plana y lineal, respectivamente.
Cuando dos átomos de carbono se unen entre sí pueden dar lugar a la formación de dos tipos de enlaces en función de la hibridación que presenten:
- Enlaces σ obtenidos por solapamiento de dos orbitales híbridos cualesquiera o entre un orbital híbrido con uno atómico.
- Enlaces π obtenidos por solapamiento de dos orbitales p que no participan en el proceso de hibridación.
De esta forma un enlace doble estará constituido por un enlace σ y uno π y un enlace triple lo estará por un σ y dos π.
Es necesario indicar que el fenómeno de la hibridación no se limita al átomo de carbono, ya que otros átomos tales como el O, N, P, y alguno más, poseen tipos de hibridación similares al carbono, aunque prácticamente todos los átomos pueden sufrir hibridación y es debido a la existencia de una gran diversidad de posibles geometrías de los compuestos químicos, y no sólo orgánicos. Así pues, existe una relación directa entre la hibridación de los átomos y la geometría de la molécula.
Polaridad de enlace y electronegatividad
La electronegatividad es un concepto introducido por Linus Pauling en 1932, que describe la capacidad que tiene un átomo para atraer un electrón (véase Tabla de electronegatividad)
| Átomo | Electronegatividad (δEN) |
| H | 2,20 |
| Li | 0,98 |
| Be | 1,57 |
| B | 2,04 |
| C | 2,55 |
| N | 3,04 |
| O | 3,44 |
| F | 3,98 |
| Si | 1,90 |
| P | 2,19 |
| S | 2,58 |
| Cl | 3,16 |
La polaridad de enlace se puede estimar a partir de la diferencia de electronegatividades de los átomos que lo forman. Si dicho valor es bajo, se dice que el enlace es no polar (covalente); si el valor es alto, corresponderá a un enlace polar (iónico), y los electrones se situarán en el enlace cerca del átomo más electronegativo.
El momento dipolar de enlace se define como el vector m cuya magnitud es el resultado de multiplicar la distancia de enlace (d) por la diferencia entre las cargas parciales Δq = (δ+ – δ-), esto es: ( m = Δq · r ).
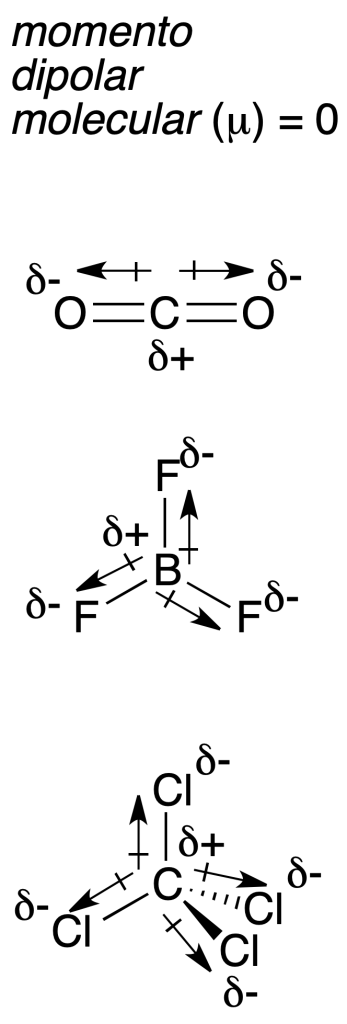
Dicho vector tiene su origen en la carga positiva y termina en la negativa. Se expresa comúnmente en unidades que no son del Sistema Internacional (SI), Debye (1 Debye = 3,33564·10–30 C m). Además, el momento dipolar molecular μ se define cómo la suma vectorial de los momentos dipolares de todos los enlaces presentes en una molécula. Como es un vector, hay que conocer la geometría molecular antes de sumarlos, para saber como están orientados en el espacio los momentos dipolares de enlace.
Por ejemplo, en la siguiente figura se muestran tres moléculas (CO2, BF3 y CCl4)[2] que aunque presentan enlaces polares (el momento dipolar de enlace se indica mediante flechas con origen en el átomo menos electronegativo), en todos los casos el momento dipolar molecular resultante de la suma vectorial es cero debido a la simetría molecular.
Representación estructural de Lewis
Representación de compuestos acíclicos
Con objeto de facilitar la transmisión de información química, se utilizan una serie de normas y convenciones de estructura y representación de las moléculas orgánicas. Asimismo, se muestran los caminos más usuales para pasar de una representación a otra.
Representación de esqueleto o esqueletal
Es un sistema abreviado de representar la estructura molecular. Las representaciones esqueletales están ampliamente difundidas en química orgánica, debido a su sencillez y facilidad de uso incluso para moléculas complejas.
Las cadenas carbonadas formadas por enlaces sencillos se representan por líneas quebradas en donde tanto los átomos de carbono como los de hidrógeno se muestran de forma implícita, es decir que se consideran incluidos sin representarlos como tales, de forma que el extremo de una línea representa un CH3– un vértice en la línea quebrada un -CH2– la unión de tres trazos un CH y la unión de cuatro líneas un carbono cuaternario.
Los enlaces dobles y triples se representan mediante dos o tres líneas paralelas, respectivamente, entre los carbonos que forman dichos enlaces.
Las moléculas cíclicas se representan con figuras geométricas en el plano mientras que los anillos aromáticos se representan con figuras geométricas con dobles enlaces alternados en el ciclo o bien mediante un ciclo con un círculo en su interior. Los átomos diferentes a carbono e hidrógeno se representan mediante su símbolo químico.
A menudo, se utilizan abreviaturas para simplificar la representación y escritura de las moléculas (véase grupos funcionales)
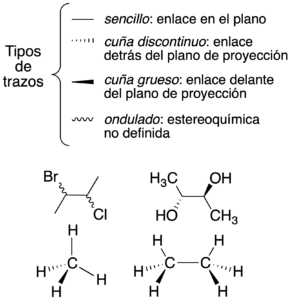
Representación de Cram (trazos en cuña)
Se toma como referencia el plano sobre el que se dibuja, usando diferentes tipos de trazos para obtener una perspectiva tridimensional en el papel.
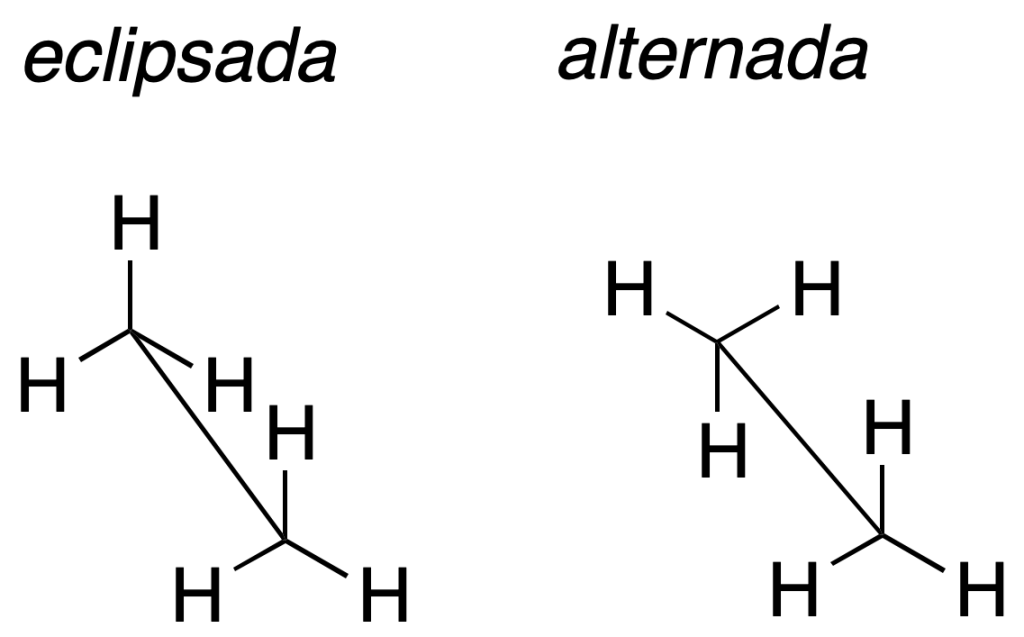
Proyección de caballete
La molécula se representa en torno a un enlace que se dibuja con una línea oblicua simulando cierta perspectiva. Los sustituyentes unidos a los carbonos que definen este enlace se dibujan formando ángulos de 120º. Así la proyección de caballete para etano sería:
| Estructura 3D | |
| Etano (eclipsada) | Etano (alternada) |
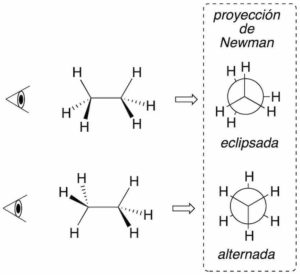
Proyección de Newman
La estructura se representa a lo largo de un enlace entre dos átomos de forma que el carbono más alejado del observador se dibuja con un círculo, mientras que el más próximo aparece como un punto. Los tres enlaces restantes de cada carbono se dibujan sobre el plano formando ángulos de 120º. Es una representación especialmente útil para el análisis conformacional. En conformaciones de tipo eclipsada, para facilitar la visión de los grupos, se giran ligeramente los carbonos evitando así su colapso.
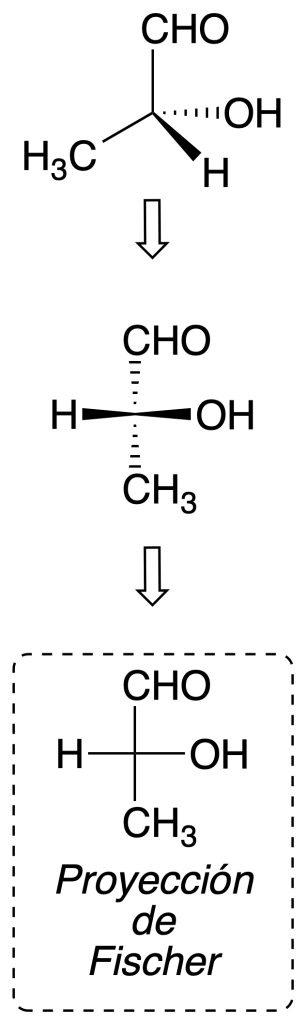
Proyección de Fischer
Este sistema es especialmente útil para la representación de cadenas carbonadas con uno o varios carbonos quirales. Para realizar este método de proyección se sigue una serie de convenciones:
- La cadena carbonada se dibuja verticalmente.
- El átomo con los localizadores de mayor prioridad se dibuja hacia la parte superior.
- Los grupos dibujados en horizontal se colocan de forma que salen hacia afuera del plano en el que se representa la molécula.
La proyección de Fischer permite detectar fácilmente planos de simetría de la molécula, ya que representa a una conformación eclipsada. Por ejemplo:
Representación de compuestos cíclicos
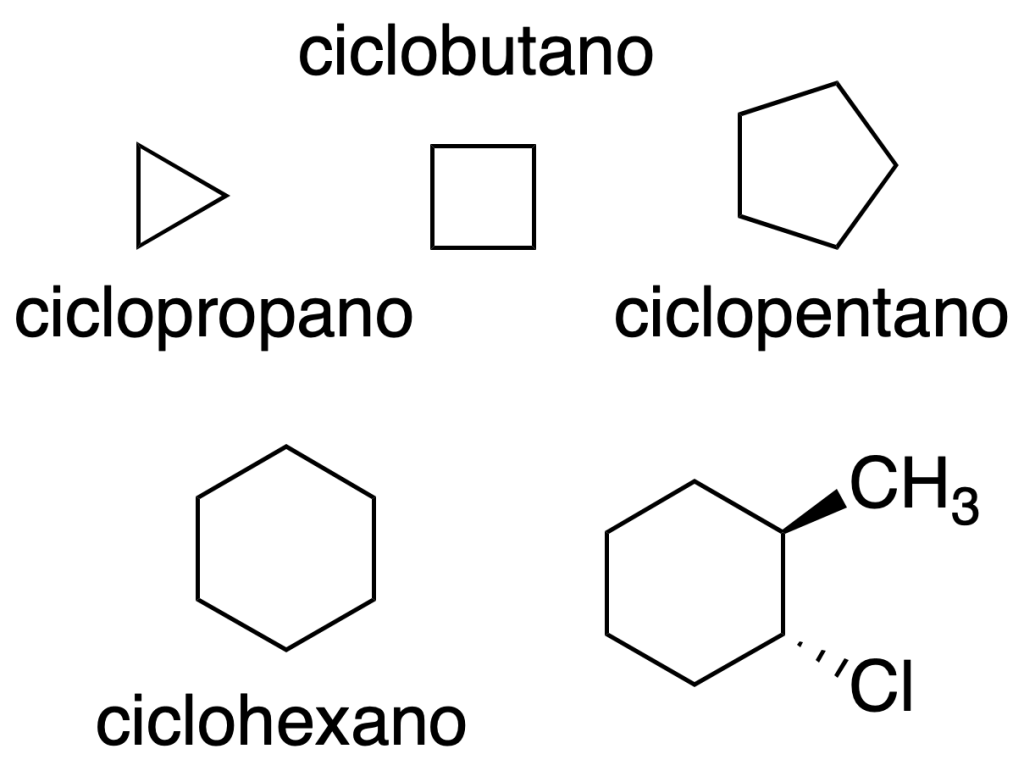
Los compuestos cíclicos con 3, 4, 5 y 6 átomos son los que se estudian con más asiduidad en Química Orgánica. Podemos encontrar diversos métodos de indicar la estructura y representación de las moléculas orgánicas.
Polígonos regulares
Los hidrocarburos cíclicos se representan en el plano como polígonos regulares. Los vértices indican los átomos de carbono. Además, los sustituyentes se representan aplicando los mismos criterios que en la representación de Cram.
Proyección de Haworth
Utilizada frecuentemente en Química de carbohidratos, permite describir la estereoquímica de los compuestos cíclicos con comodidad y comparar estereoisómeros. Se dibuja el ciclo sobre el plano con cierta perspectiva. En la mayoría de las ocasiones se enfatiza dicha perspectiva usando trazos gruesos y en cuña.
Los sustituyentes se dibujan usando líneas verticales. Con este sistema de representación, se detectan fácilmente las formas meso, ya que se localizan intuitivamente los planos de simetría.
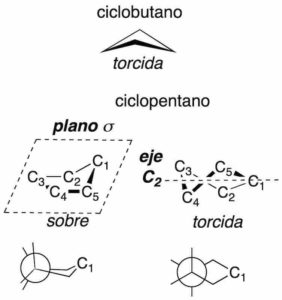
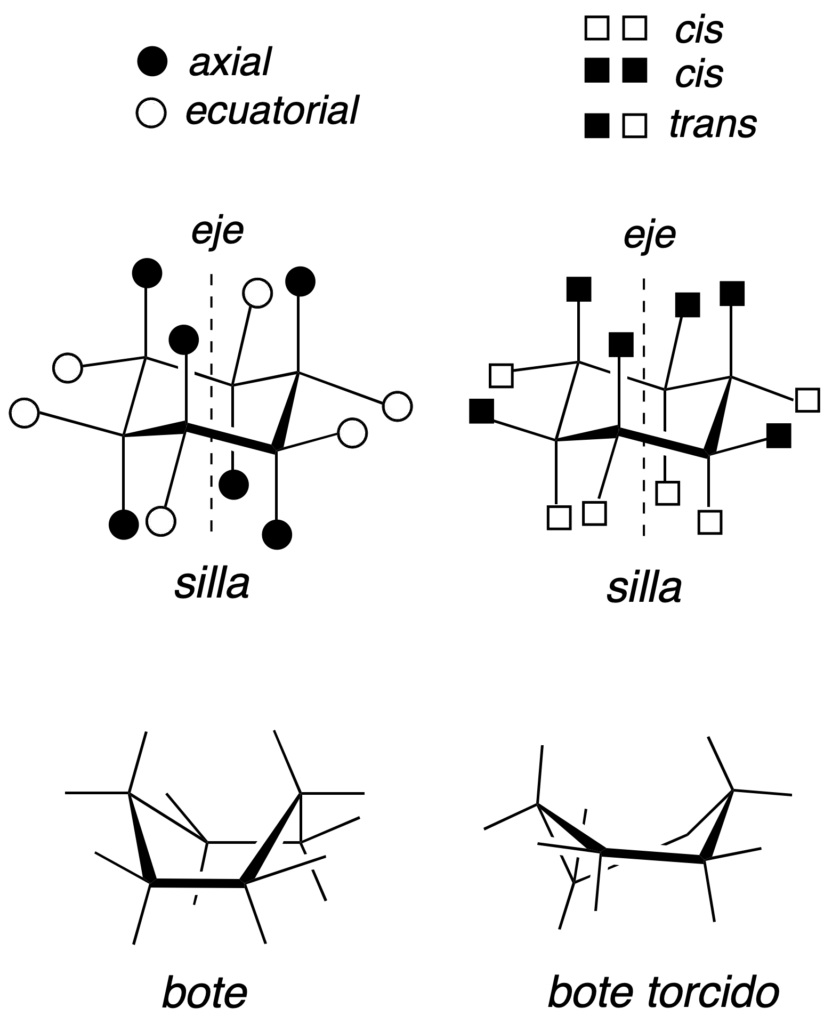
Perspectiva de confórmeros
El ciclopropano es plano, porque los tres carbonos definen sólo un plano, sin embargo, el ciclobutano adopta una conformación torcida, mientras que el ciclopentano puede presentar dos tipos de conformaciones de energía parecida denominadas de sobre y torcida.
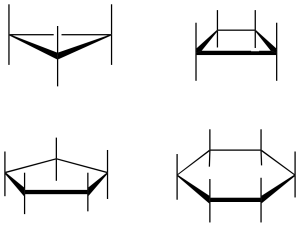
Las tres conformaciones más significativas del ciclohexano son la siguientes: una silla, una bote y otra bote torcido. En la conformación de tipo silla si se traza un eje hipotético perpendicular al ciclo, los sustituyentes paralelos a dicho eje se denominan axiales, mientras que los se encuentran oblicuos se denominan ecuatoriales. Además, dos sustituyentes adyacentes pueden quedar en disposición relativa cis o trans según se describe en la figura (cuadrados negros y blancos).
Proyección de Newman
El anillo más común en cicloalcanos es el ciclohexano, debido a la importancia de dicha estructura. No se suelen representar los hidrógenos de los carbonos 1 y 4, para simplificar el dibujo.
Video de la Representación de Estructuras de Moléculas Orgánicas
Referencias y notas
[1] Le Bel y Van’t Hoff fueron pioneros al proponer en 1874 que la orientación más probable de los enlaces en un carbono con 4 sustituyentes ocurre hacia los vértices de un tetraedro.
[2] Los símbolos δ+ y δ- indican que existe carga parcial positiva y negativa en cada átomo, respectivamente.