Índice
¿Qué es la electronegatividad?
El concepto de electronegatividad se origina de la observación experimental, de que por ejemplo, elementos como cloro y flúor presentan una tendencia muy fuerte a dar iones negativos. Por otro lado, otros elementos del grupo I, como no son electronegativos, y se describen mejor como electropositivos (tendencia a formar iones positivos).
Dicho concepto aparece como uno de los descriptores químicos más antiguos para predecir la reactividad de las moléculas. Berzelius (1779-1848), basándose en los conceptos de electricidad de su época, intenta clasificar las sustancias en electropositivas y electronegativas. Describe todos los compuestos químicos como si contuvieran dos componentes eléctricamente opuestos: el ácido, o electronegativo, y el básico, o electropositivo.
En 1932, Linus Pauling defina la electronegatividad como la capacidad que tiene un átomo para atraer un electrón hacia si mismo.
La escala de coeficientes de electronegatividad es muy útil ya que nos mide la tendencia de un átomo a atraer electrones hacia sí.
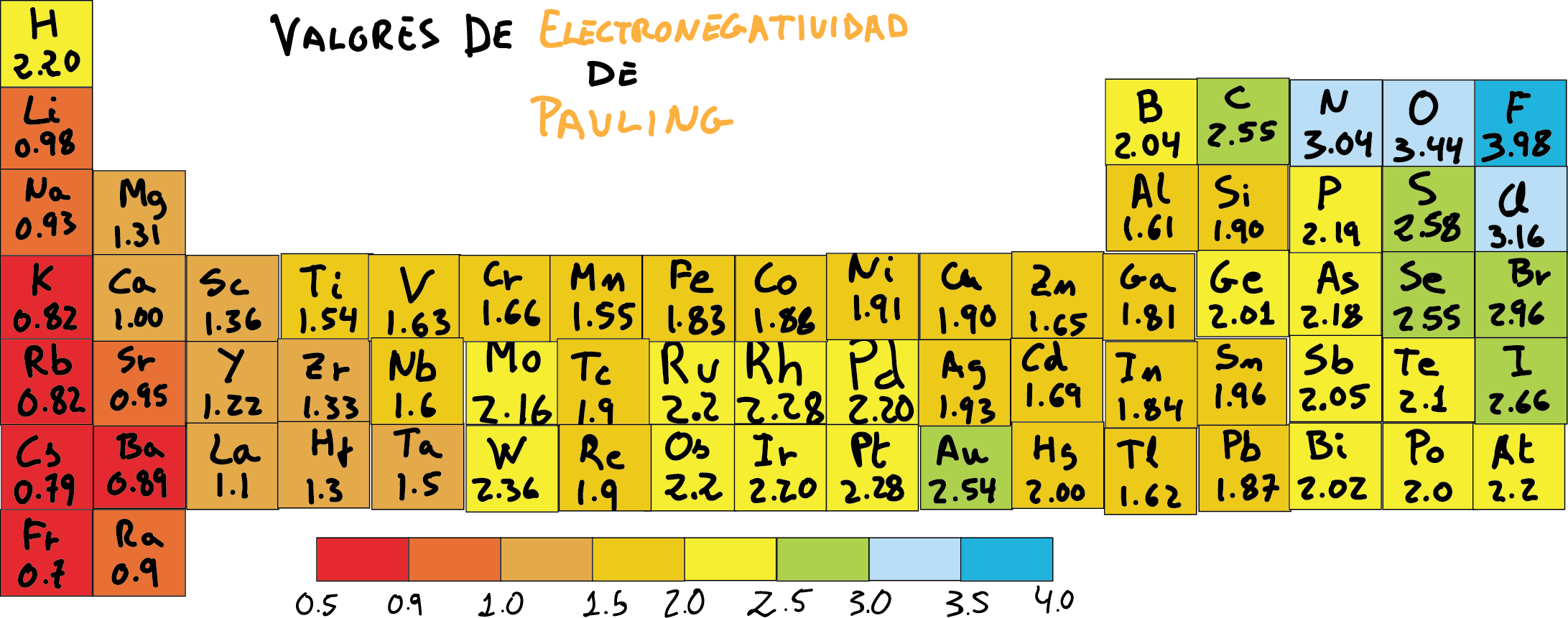
Aunque hay diferentes métodos para estimara la electronegatividad (por ejemplo, escalas de Mulliken o Allred-Rochow), se suele usar comúnmente la escala desarrollada por Pauling, en la que se tabulan valores relativos (sin unidades).
En dicha escala, al elemento más electronegativo (flúor) se le asigna el valor positivo mayor, 3,98, y el valor menor, 0,7, se le asigna al menos electronegativo (francio). En algunos libros de texto se le asigna al flúor un valor para la electronegatividad de 4.0.
Los valores de los demás átomos permanecen en este rango. Además, la electronegatividad del hidrógeno se suele ajustar a un valor de 2.1 o 2.2.
Escala de electronegatividad de Pauling
Escala de electronegatividad de Pauling (átomos ordenador por valores crecientes).
| Nombre (símbolo) | Electro-negatividad (δEN) |
|---|---|
| Francio (Fr) | 0.7 |
| Cesio (Cs) | 0.79 |
| Potasio (K) | 0.82 |
| Rubidio (Rb) | 0.82 |
| Bario (Ba) | 0.89 |
| Radio (Ra) | 0.89 |
| Sodio (Na) | 0.93 |
| Estroncio (Sr) | 0.95 |
| Litio (Li) | 0.98 |
| Calcio (Ca) | 1 |
| Lantano (La) | 1.1 |
| Actinio (Ac) | 1.1 |
| Cerio (Ce) | 1.12 |
| Praseodimio (Pr) | 1.13 |
| Neodimio (Nd) | 1.14 |
| Samario (Sm) | 1.17 |
| Gadolinio (Gd) | 1.2 |
| Itrio (Y) | 1.22 |
| Disprosio (Dy) | 1.22 |
| Holmio (Ho) | 1.23 |
| Erbio (Er) | 1.24 |
| Tulio (Tm) | 1.25 |
| Lutecio (Lu) | 1.27 |
| Plutonio (Pu) | 1.28 |
| Hafnio (Hf) | 1.3 |
| Torio (Th) | 1.3 |
| Americio (Am) | 1.3 |
| Curio (Cm) | 1.3 |
| Berkelio (Bk) | 1.3 |
| Californio (Cf) | 1.3 |
| Einstenio (Es) | 1.3 |
| Fermio (Fm) | 1.3 |
| Mendelevio (Md) | 1.3 |
| Nobelio (No) | 1.3 |
| Laurencio (Lr) | 1.3 |
| Magnesio (Mg) | 1.31 |
| Circonio (Zr) | 1.33 |
| Escandio (Sc) | 1.36 |
| Neptunio (Np) | 1.36 |
| Uranio (U) | 1.38 |
| Tantalio (Ta) | 1.5 |
| Protactinio (Pa) | 1.5 |
| Titanio (Ti) | 1.54 |
| Manganeso (Mn) | 1.55 |
| Berilio (Be) | 1.57 |
| Niobio (Nb) | 1.6 |
| Aluminio (Al) | 1.61 |
| Talio (Tl) | 1.62 |
| Vanadio (V) | 1.63 |
| Zinc (Zn) | 1.65 |
| Cromo (Cr) | 1.66 |
| Cadmio (Cd) | 1.69 |
| Indio (In) | 1.78 |
| Galio (Ga) | 1.81 |
| Hierro (Fe) | 1.83 |
| Cobalto (Co) | 1.88 |
| Silicio (Si) | 1.9 |
| Cobre (Cu) | 1.9 |
| Tecnecio (Tc) | 1.9 |
| Renio (Re) | 1.9 |
| Níquel (Ni) | 1.91 |
| Plata (Ag) | 1.93 |
| Estaño (Sn) | 1.96 |
| Mercurio (Hg) | 2 |
| Polonio (Po) | 2 |
| Germanio (Ge) | 2.01 |
| Bismuto (Bi) | 2.02 |
| Boro (B) | 2.04 |
| Antimonio (Sb) | 2.05 |
| Telurio (Te) | 2.1 |
| Molibdeno (Mo) | 2.16 |
| Arsénico (As) | 2.18 |
| Fósforo (P) | 2.19 |
| Hidrógeno (H) | 2.2 |
| Rutenio (Ru) | 2.2 |
| Paladio (Pd) | 2.2 |
| Osmio (Os) | 2.2 |
| Iridio (Ir) | 2.2 |
| Astato (At) | 2.2 |
| Rodio (Rh) | 2.28 |
| Platino (Pt) | 2.28 |
| Plomo (Pb) | 2.33 |
| Wolframio (W) | 2.36 |
| Oro (Au) | 2.54 |
| Carbono (C) | 2.55 |
| Selenio (Se) | 2.55 |
| Azufre (S) | 2.58 |
| Xenón (Xe) | 2.6 |
| Iodo (I) | 2.66 |
| Bromo (Br) | 2.96 |
| Nitrógeno (N) | 3.04 |
| Cloro (Cl) | 3.16 |
| Oxígeno (O) | 3.44 |
| Fluor (F) | 3.98 |
Escala de electronegatividad Allred-Rochow
A diferencia de las escalas de electronegatividad de Pauling y de Mulliken, la basada en los coeficientes de Allred-Rochow es mucho más precisa y es ampliamente aceptada.
En esta el coeficiente de electronegatividad se define como: la fuerza electrostática de atracción que experimenta un átomo (me masa efectiva nuclear Zef) por un electrón a una distancia del núcleo igual al radio covalente de dicho átomo (electrón de valencia).
Los coeficientes de electronegatividad deAllred-Rochow, χAR, se obtienen a partir de la siguiente fórmula:
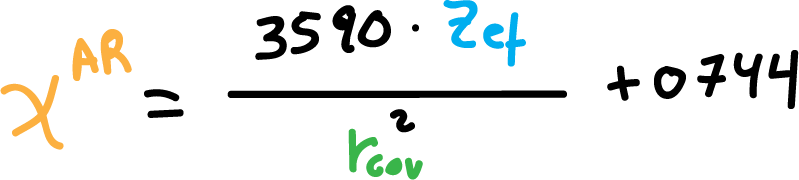
Donde, Zef es la masa efectiva nuclear, y rcov es el radio covalente, del correspondiente átomo.
De manera general, los coeficientes de electronegatividad de Allred-Rochow en la tabla periódica varían de manera que aumentan a medida que nos desplazamos a la derecha y disminuyen a medida que bajamos filas. Esto es, lo opuesto al aumento en el radio covalente, y de la misma forma que las tendencias en la primera energía de ionización.
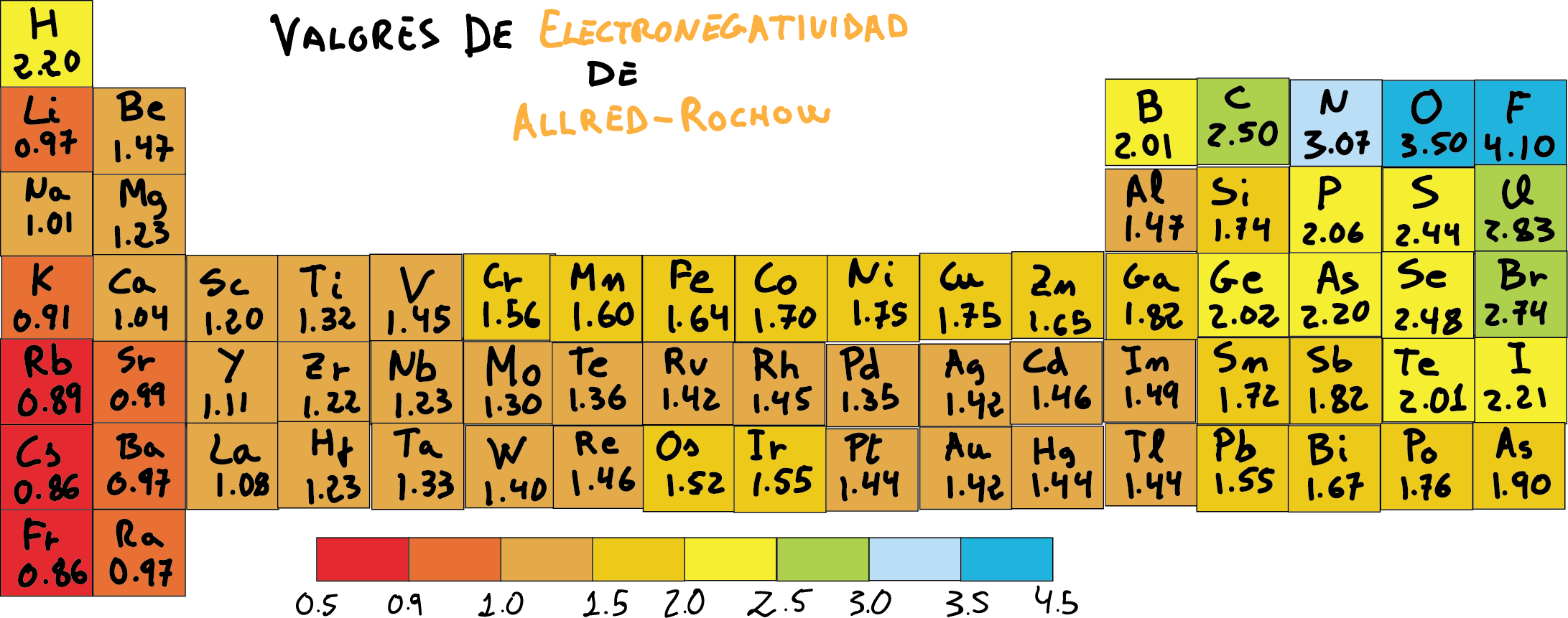
Escala de Electronegatividad de Allred-Rochow
Coeficientes de electronegatividad de Allred-Rochow (átomos ordenador por valores crecientes).
| Nombre (símbolo) | Electro-negatividad (χAR) |
|---|---|
| Francio (Fr) | 0.86 |
| Cesio (Cs) | 0.86 |
| Rubidio (Rb) | 0.89 |
| Potasio (K) | 0.91 |
| Bario (Ba) | 0.97 |
| Radio (Ra) | 0.97 |
| Litio (Li) | 0.97 |
| Estroncio (Sr) | 0.99 |
| Sodio (Na) | 1.01 |
| Boro (B) | 1.01 |
| Calcio (Ca) | 1.04 |
| Lantano (La) | 1.08 |
| Itrio (Y) | 1.11 |
| Escandio (Sc) | 1.20 |
| Circonio (Zr) | 1.22 |
| Hafnio (Hf) | 1.23 |
| Magnesio (Mg) | 1.23 |
| Niobio (Nb) | 1.23 |
| Molibdeno (Mo) | 1.30 |
| Titanio (Ti) | 1.32 |
| Tantalio (Ta) | 1.33 |
| Paladio (Pd) | 1.35 |
| Telurio (Te) | 1.36 |
| Wolframio (W) | 1.40 |
| Plata (Ag) | 1.42 |
| Rutenio (Ru) | 1.42 |
| Oro (Au) | 1.42 |
| Talio (Tl) | 1.44 |
| Mercurio (Hg) | 1.44 |
| Platino (Pt) | 1.44 |
| Vanadio (V) | 1.45 |
| Rodio (Rh) | 1.45 |
| Cadmio (Cd) | 1.46 |
| Renio (Re) | 1.46 |
| Berilio (Be) | 1.47 |
| Aluminio (Al) | 1.47 |
| Indio (In) | 1.49 |
| Osmio (Os) | 1.52 |
| Iridio (Ir) | 1.55 |
| Plomo (Pb) | 1.55 |
| Cromo (Cr) | 1.56 |
| Manganeso (Mn) | 1.60 |
| Hierro (Fe) | 1.64 |
| Zinc (Zn) | 1.65 |
| Bismuto (Bi) | 1.67 |
| Cobalto (Co) | 1.70 |
| Estaño (Sn) | 1.72 |
| Silicio (Si) | 1.74 |
| Cobre (Cu) | 1.75 |
| Níquel (Ni) | 1.75 |
| Polonio (Po) | 1.76 |
| Galio (Ga) | 1.82 |
| Antimonio (Sb) | 1.82 |
| Tecnecio (Tc) | 1.9 |
| Astato (At) | 1.90 |
| Germanio (Ge) | 2.02 |
| Fósforo (P) | 2.06 |
| Arsénico (As) | 2.20 |
| Hidrógeno (H) | 2.20 |
| Iodo (I) | 2.21 |
| Azufre (S) | 2.44 |
| Selenio (Se) | 2.48 |
| Carbono (C) | 2.50 |
| Xenón (Xe) | 2.6 |
| Bromo (Br) | 2.74 |
| Cloro (Cl) | 2.83 |
| Nitrógeno (N) | 3.07 |
| Oxígeno (O) | 3.50 |
| Fluor (F) | 4.10 |
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.