Written by José | Last Updated on 2 meses
¿ Qué es un mol?
En Química, las cantidades de sustancias se suelen medir tradicionalmente en volumen o masa. Así, el concepto de mol es muy importante, ya que permite hacer los cálculos estequiométricos, en las reacciones químicas.
De esta manera, podemos indicar que proporción existe entre reactivos y productos.
Por ejemplo, en la reacción de formación de ácido nítrico, un mol de amoniaco reacciona con dos moles de oxígeno para dar un mol de ácido nítrico y un mol de agua:
- NH3 + 2 O2 → HNO3 + H2O
Por otro lado, desde que se introdujo el concepto de masa relativa (pesos atómicos) por John Dalton, los químicos han podido expresar las medidas de sus experimentos en unas cantidades proporcionales al número de entidades elementales.
Así, en el Sistema internacional (SI), la cantidad de una sustancia se relaciona con la masa del kilogramo.
Definición de la IUPAC de 1971 «La cantidad de sustancia, de fórmula química determinada, que contiene el mismo número de unidades de fórmula (átomos, moléculas, iones, cuantos u otras entidades) que los átomos contenidos exactamente en 12 g de 12C»
Por tanto, mol sería la cantidad de sustancia de un sistema que contiene tantas unidades elementales con átomos hay en 0.012 kg de carbono-12.
Además, cuando empleamos mol, deberemos de especificar a qué tipo de unidades elementales nos estamos refiriendo.
Por ejemplo, si son átomos, moléculas, iones, electrones, otras partículas o grupos de estas. Es decir, si nos estamos refiriendo a un «mol de átomos», «mol de moléculas», «mol de electrones», etc.
La definición de mol de la IUPAC de 1971 recomendaba utilizar como referencia 0.012 kg de carbono-12. Sin embargo, actualmente se puede determinar con gran precisión el número de Avogadro. Por tanto, esto nos lleva a que podamos redefinir mol utilizando dicha constante.
En consecuencia, recientemente (2018), la IUPAC ha redefinido mol, adoptándola como cantidad de substancia utilizada como unidad del SI. Su definición quedaría como:
| Un mol es «la cantidad de sustancia que contiene exactamente 6.022 140 76×1023 entidades elementales.« |
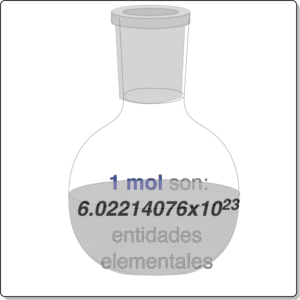
Este número se fija al valor numérico de la constante de Avogadro, NA, cuando se expresa en mol-1, y se denomina número de Avogadro.

