Written by José | Last Updated on 2 meses
¿Qué es una disolución?
Una disolución es una mezcla homogénea de sustancias puras en la cual no hay precipitación. Llamada también dispersión molecular. Las disoluciones constan de un disolvente y uno o más solutos (cuyas proporciones varían de una a otra disolución). En contra, una sustancia pura tiene composición constante. El disolvente es el medio en el cual los solutos se disuelven.
Índice
Una disolución es diferente de una suspensión, dispersión coloidal o una emulsión. La diferencia esencial está en el tamaño de las partículas de soluto. El diámetro de la partícula es inferior a 100 Å. Se caracteriza por ser homogénea y permanentemente estable.
Suspensión
Se denomina también dispersión grosera, se produce cuando el diámetro de partícula es superior a 10.000 Å. Se trata de una mezcla heterogénea y se caracteriza por su falta de estabilidad (ej. Tierra/agua).
Dispersión coloidal
El diámetro de las partículas varía entre 100-10.000 Å. A estas partículas se les llama micelas. Sigue siendo una mezcla heterogénea pero es necesario observar su heterogeneidad al microscopio.
La estabilidad es mucho más elevada, aunque podemos hacer que disminuya por medio de una centrífuga.
Emulsión
Se produce cuando la sustancia disuelta es también un líquido (aceite y agua).
Convenios para indicar el soluto
- cuando en una disolución existe un sólido o gas y un líquido, este último será el disolvente y cualquiera de los dos primeros el soluto.
- cuando la disolución está formada por dos líquidos el soluto será aquel que se encuentre en menor proporción.
- cuando la proporción de los líquidos presentes en una disolución sea la misma, el disolvente será el que se use más habitualmente (metanol/agua, disolvente el agua)
Tipos de disoluciones
Existen tres criterios para clasificar las disoluciones:
- Por el numero de componentes de la disolución: binarios si tienen 2 componentes, ternarios con 3 componentes, etc.
- Por su estado físico: una disolución binaria da lugar a 9 disoluciones posibles, tres en estado gaseoso, tres en líquido y tres en sólido.
| Soluto (disolvente) | Ejemplo |
| Gas (gas) | Aire:O2 en N2 |
| Líquido (gas) | Niebla: gotas de H2O en aire |
| Sólido (gas) | Humo: partículas en aire Iodo sublimado en N2 |
Las dos últimas no son disoluciones verdaderas porque no son homogéneas.
| Soluto (disolvente) | Ejemplo |
| Gas (líquido) | O2 / H2O |
| Líquido (líquido) | Gasolina; EtOH / agua |
| Sólido (líquido) | Glucosa / agua |
Si el O2 reaccionase con el agua ya no seria una disolución.
| Soluto (disolvente) | Ejemplo |
| Gas (sólido) | H2 / Pt |
| Líquido (sólido) | Hg / Cu |
| Sólido (sólido) | Cu / Ni; Au / Cu |
Las disoluciones sólidas son aleaciones y se han obtenido en estado líquido por lo que no son verdaderas disoluciones.
- Atendiendo a la composición y naturaleza química de los componentes.
Si los componentes de una disolución tienen naturaleza semejante no existirán interacciones específicas entre ambos por lo que será una disolución ideal.
Ejemplo: CCl4 /SiCl4 o benceno/tolueno
Si la naturaleza es diferente se pueden producir entre los componentes interacciones de tipo atractivo o repulsivo.
Ej. Interacción atractiva en HNO3 / H2O
Interacción repulsiva Et-O-Et / Me-CO-Me
Propiedades coligativas de las disoluciones
Grado de disociación y constante de disociación de los electrolitos débiles
Se denomina grado de disociación iónica a la fracción de moléculas disociadas o el tanto por uno de disociación (α). La relación entre el factor “i” de van’t Hoff y el grado de disociación “α” de un electrolito en disolución permite calcular este ultimo valor.
i > 1 factor de van’t Hoff aumenta conforme lo hace la disolución:
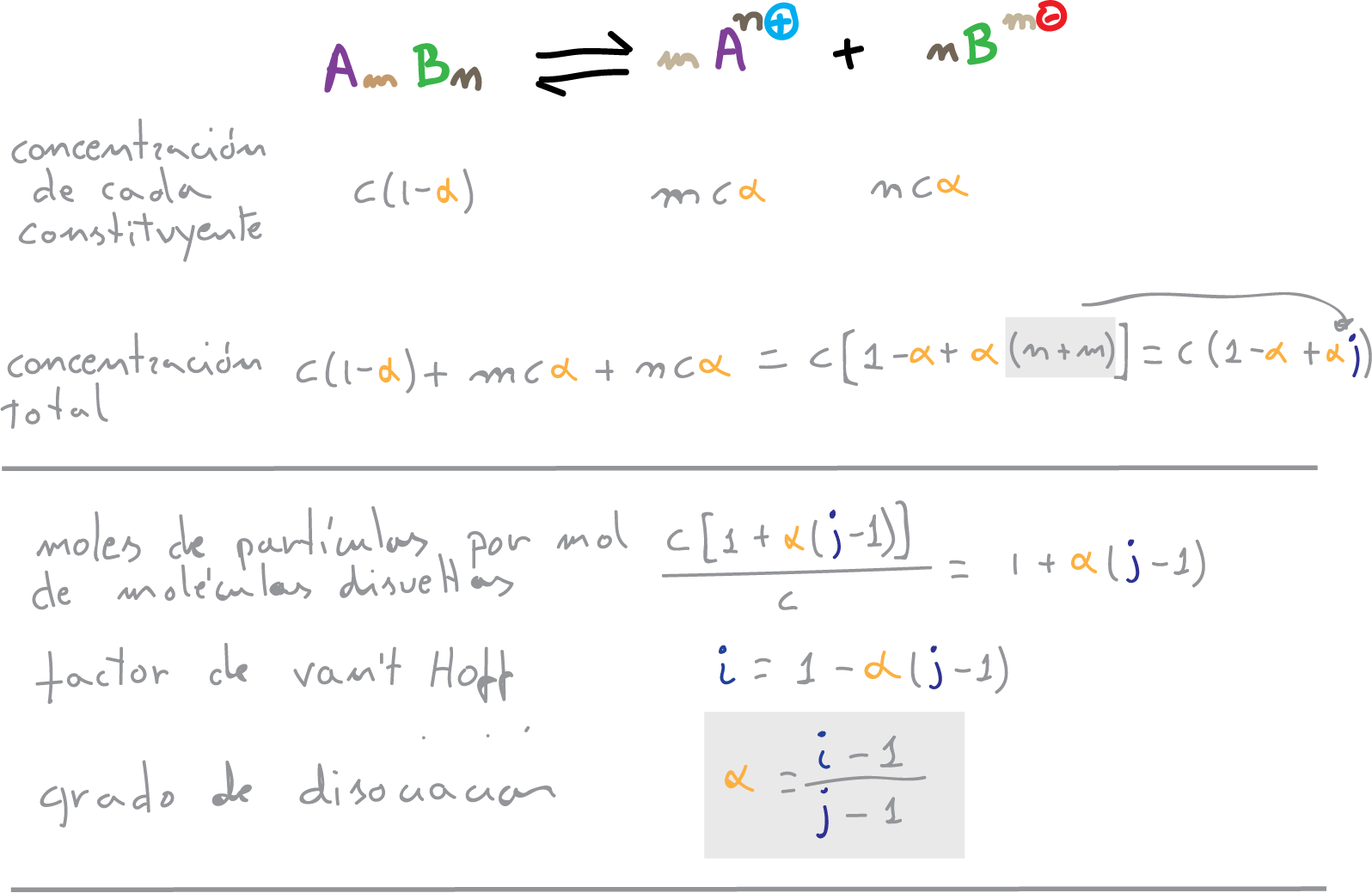
El factor de van’t Hoff será:
i = (c(1-α) + mcα + ncα)/c = 1-α + mα + nα = 1-α + α (m + n)
(dilución infinita i = j)
j = m + n
i = 1 – α + α·j = 1 + α·(j-1)
y el grado de disociación
α = (i-1)/(j-1)
Valores del grado de disociación estándar son los siguientes
α > 0.5 electrolitos fuertes
α < 0.5 electrolitos débiles
por ejemplo para el caso del cloruro potásico:
Actividad y concentración
Si en una disolución tenemos una serie de iones, entre estos se van a producir interacciones de tipo electrostático, bien repulsivas o atractivas. Estas interacciones serán tanto más intensas cuanto mayores sean las concentraciones de los iones en la disolución. Ello va a producir que se modifiquen las concentraciones reales de estos iones, o lo que es lo mismo que disminuya el número de partículas efectivas presentes en la disolución.
En estas disoluciones concentradas el coeficiente o factor de van’t Hoff no va a ser un numero entero. Surge entonces la necesidad de distinguir entre concentración y actividad de una disolución, que no tiene que ser proporcional al número de partículas, sino que dependerá de las interacciones que se produzcan en la disolución. Por tanto, la actividad es igual al coeficiente de actividad multiplicado por la concentración.
a = c·γ ⇒ γ= a/c
(1 > γ > 0)
donde a = actividad, c = concentración y γ = coeficiente de actividad. Sólo cuando la concentración es muy diluida, la concentración será igual a la actividad.
Concentración osmolar
Ley de distribución de Nernst
Iones presentes en los sistemas vivos
Existen una serie de cationes y aniones que se encuentran de forma abundante en los seres vivos:
Cationes: Na+, K+, Mg2+, Ca2+, Fe2+, Fe3+, etc…
Aniones: Cl–, HCO3–, H2PO4–, HPO42-, etc…
Los iones potasio y magnesio se encuentran sobre todo en el liquido celular, mientras que los iones calcio y sodio en el fluido intercelular.
Es necesario también que existan pequeñas cantidades, denominadas trazas, de otros muchos cationes metálicos.
Fe2+ hemoglobina transporte de O2/CO2
Fe2+/Fe3+ citocromos fosforilación oxidativa
Cu2+, Zn2+, Co2+, Mn2+ funcionamiento enzimático
Otros iones no pueden estar en los sistemas vivos ya que provocarían envenenamiento, como el Hg2+ y el Pb2+, ya que reaccionan con los átomos de azufre de las proteínas involucradas en funciones vitales del organismo, perturbándolas e impidiendo que desempeñen sus funciones normales.

