Written by J.A. Dobado | Last Updated on 1 año
Aunque esté incluida entre las técnicas espectroscópicas, la espectrometría de masas (EM) no es una de dichas técnicas pues no utiliza ninguna radiación del espectro electromagnético para irradiar la muestra y observar la absorción de dicha radiación.
Índice
Introducción
En la EM, la muestra es ionizada (y por tanto destruida) usando diversos procedimientos para ello. De todos ellos, el más utilizado es la técnica de Impacto Electrónico (EM-IE) consistente en el bombardeo de la muestra (previamente vaporizada con alto vacío y una fuente de calor) con una corriente de electrones a alta velocidad. Por tanto, la molécula pierde a su vez algunos electrones y se fragmenta dando diferentes iones, radicales y moléculas neutras.
Los iones (moléculas o fragmentos cargados), y solo ellos, son conducidos mediante un acelerador de iones a un tubo analizador curvado con un fuerte campo magnético. De esta manera, son dirigidos a un colector/analizador sobre el que se recogen los sus impactos. Esto se produce en función de la relación carga/masa de los mismos:
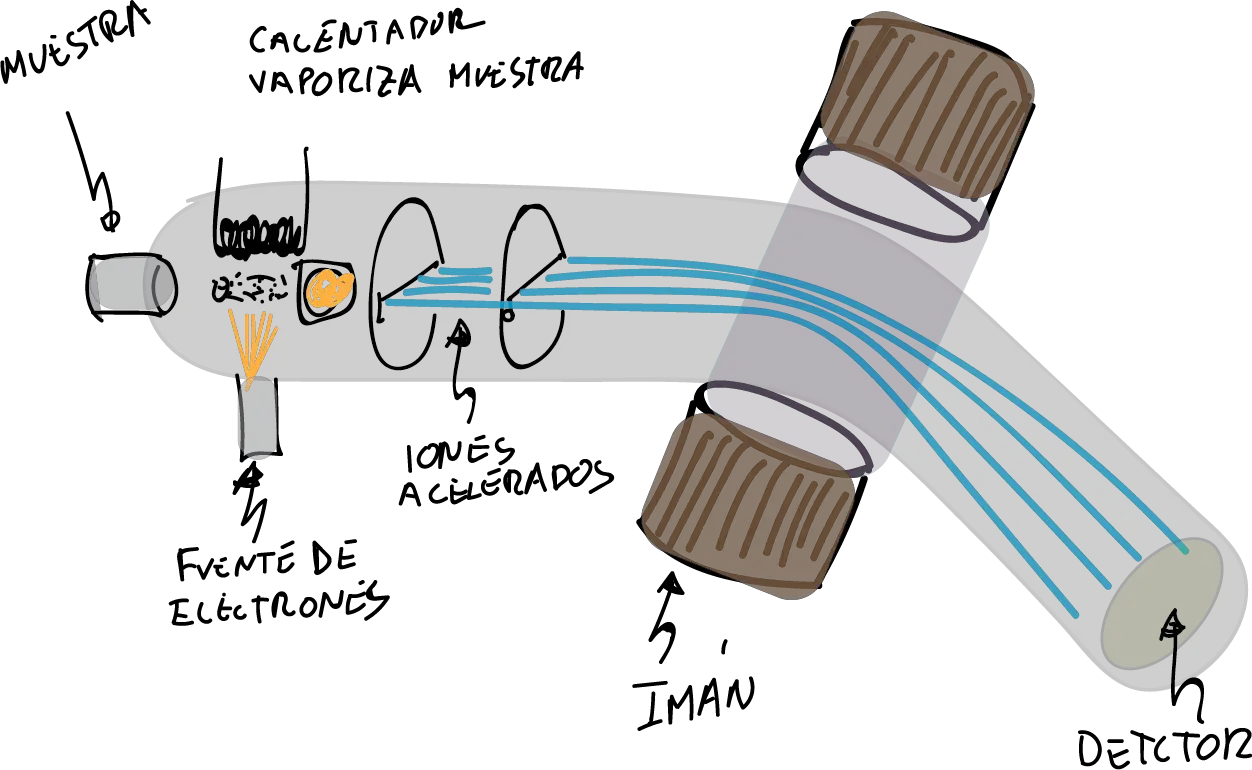
Posteriormente, dichos impactos son transformados en un espectro de masas como el que se muestra a continuación:
En el que la intensidad de los picos, nos indica la cantidad relativa de iones de dicha relación carga/masa. La separación de los diferentes iones se basa en:
Donde H es la intensidad del campo magnético, r el radio de deflexión del tubo analizador y V el potencial de aceleración utilizado.
Dicha expresión puede deducirse de las expresiones que relacionan, de una parte la energía cinética de los iones:
y de otra, el movimiento de una partícula cargada en un campo magnético:
| ¡CURIOSIDADES! «la velocidad de los iones suele ser de unos 100 Km/s, el radio de deflexión (r) de unos 35-50 cm y el tubo analizador suele ser un sector esférico de aproximadamente un metro de longitud.« |
Iones metaestables
La primera cuestión que surge de este planteamiento es que debemos pensar que para que un ion sea observado debe existir al menos durante el tiempo que tarde en recorrer el analizador (iones estables, del orden de 10 microsegundos). Por tanto, todo ion con una vida media inferior a 1 microsegundo no saldrá de la cámara de ionización (iones inestables). Sin embargo, aquellos iones con una vida media entre 1 y 10 microsegundos se descompondrán durante el trayecto y llegaran al colector/detector con una masa distinta a la de partida (iones metaestables).
Supongamos que de la cámara de ionización sale un ion A+ y descompone durante el trayecto dando un nuevo ion E+y perdiendo una molécula neutra N (o un radical sin carga):
Inicialmente:
2·e·V = mA·v2,
pero en el tubo deflector:
e·r·H = mE·v
Igualando obtendremos:
m* = mE2/mA = r2·H2/2V
es decir, aparecerá un ion de una masa aparente:
m* = mE2/mA
Como características especiales de estos iones metaestables destacaremos:
- El hecho de que suelen ser picos anchos (no agudos como los observados en los espectros normales).
- Además, que la masa aparente de los mismos es menor que la de los dos iones que dan lugar a su aparición, menor que mE y que mA.
- Finalmente, que la aparición de uno de tales picos en el espectro nos indica inequívocamente la presencia de un proceso de fragmentación entre los dos iones implicados.
EM-IE de los compuestos orgánicos
Vistos los modos de fragmentación, vamos a revisar las fragmentaciones más usuales de los distintos grupos funcionales.
Hidrocarburos saturados
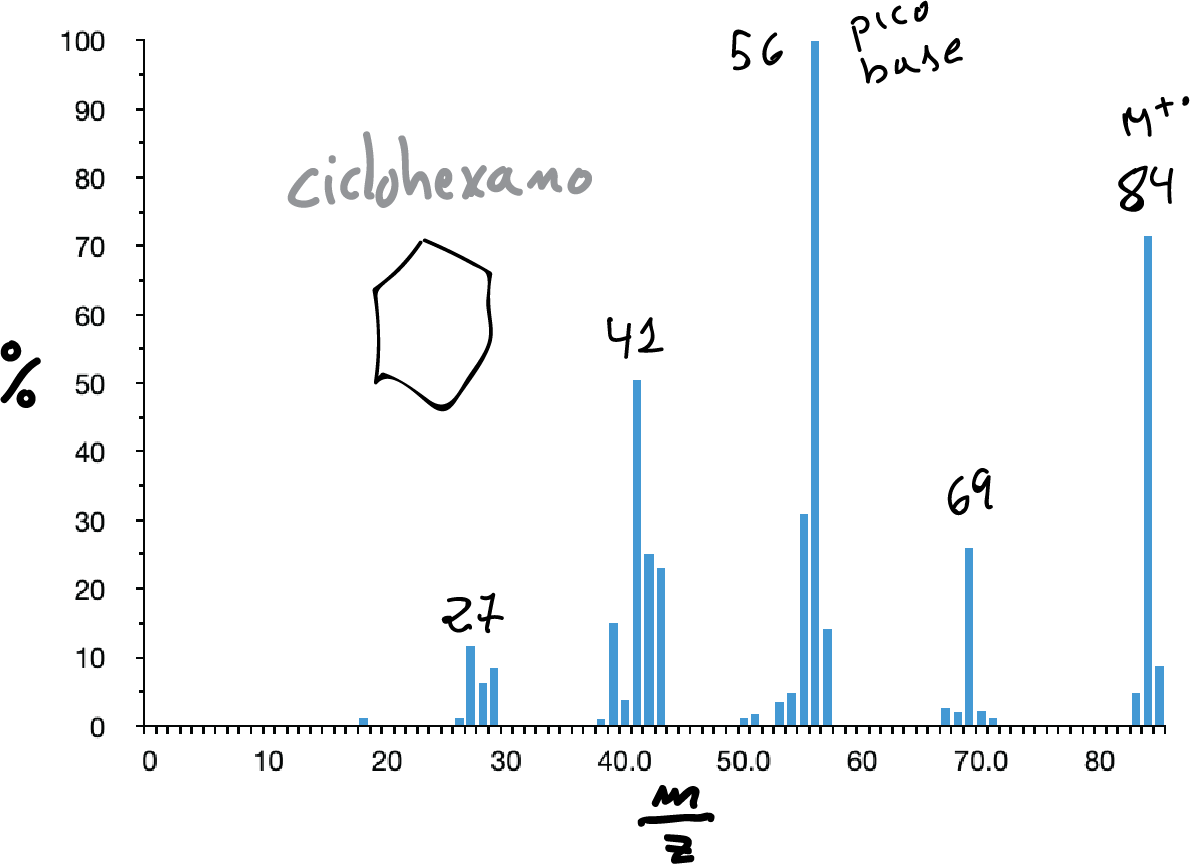
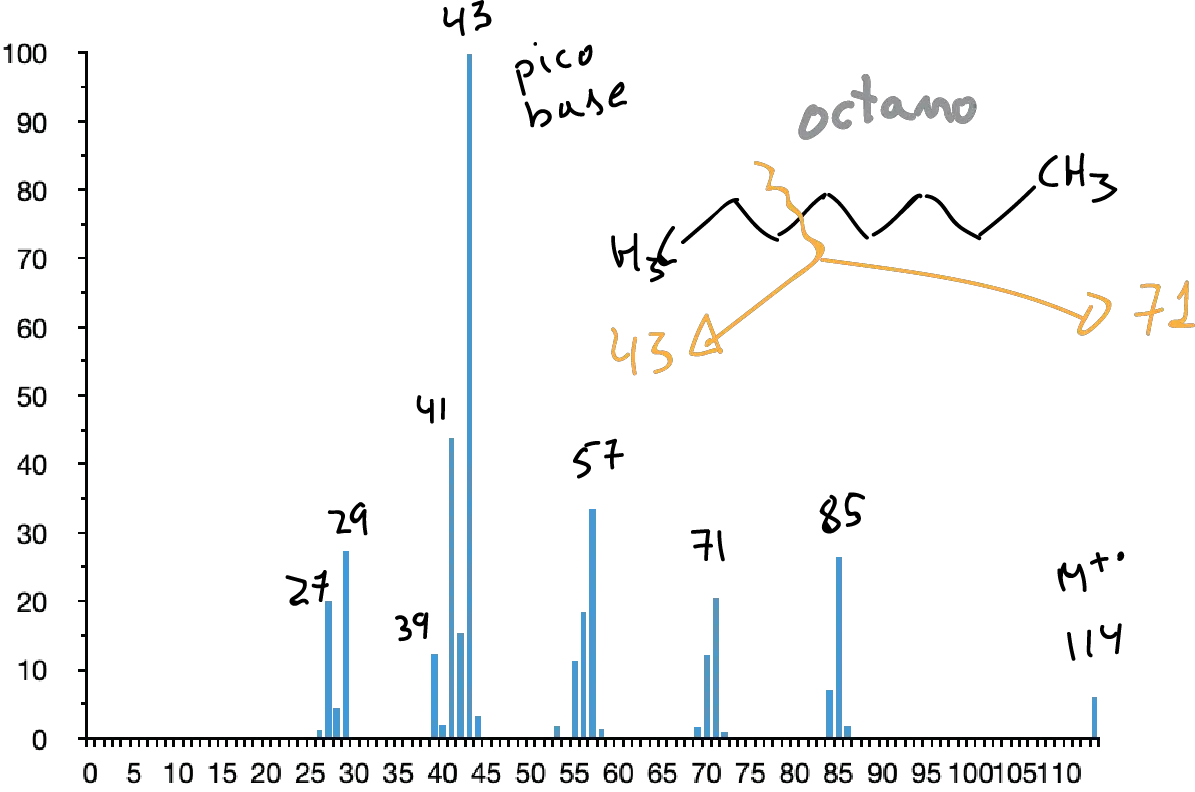
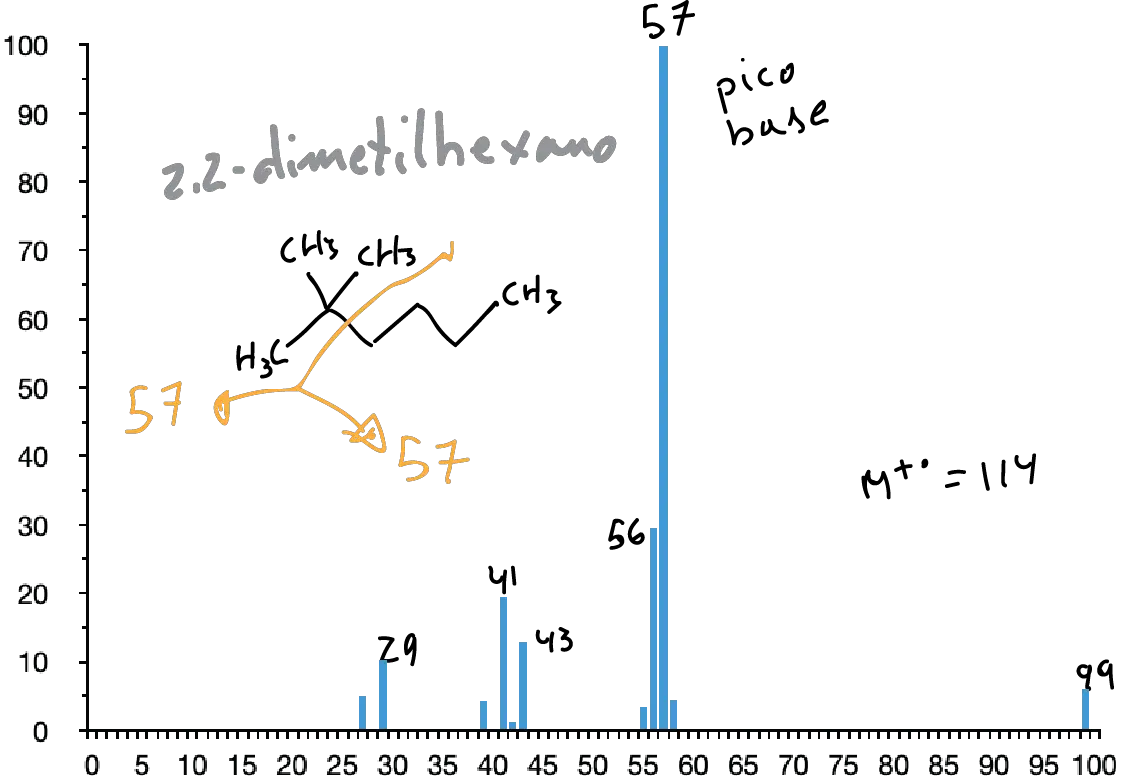
En ellos, el pico molecular suele aparecer aunque a veces con una intensidad baja. Su espectro presenta un conjunto de picos separados en 14 unidades de masa. Siendo normalmente los picos más intensos los correspondientes a C3 y C4 (m/e 43 y 57, respectivamente).
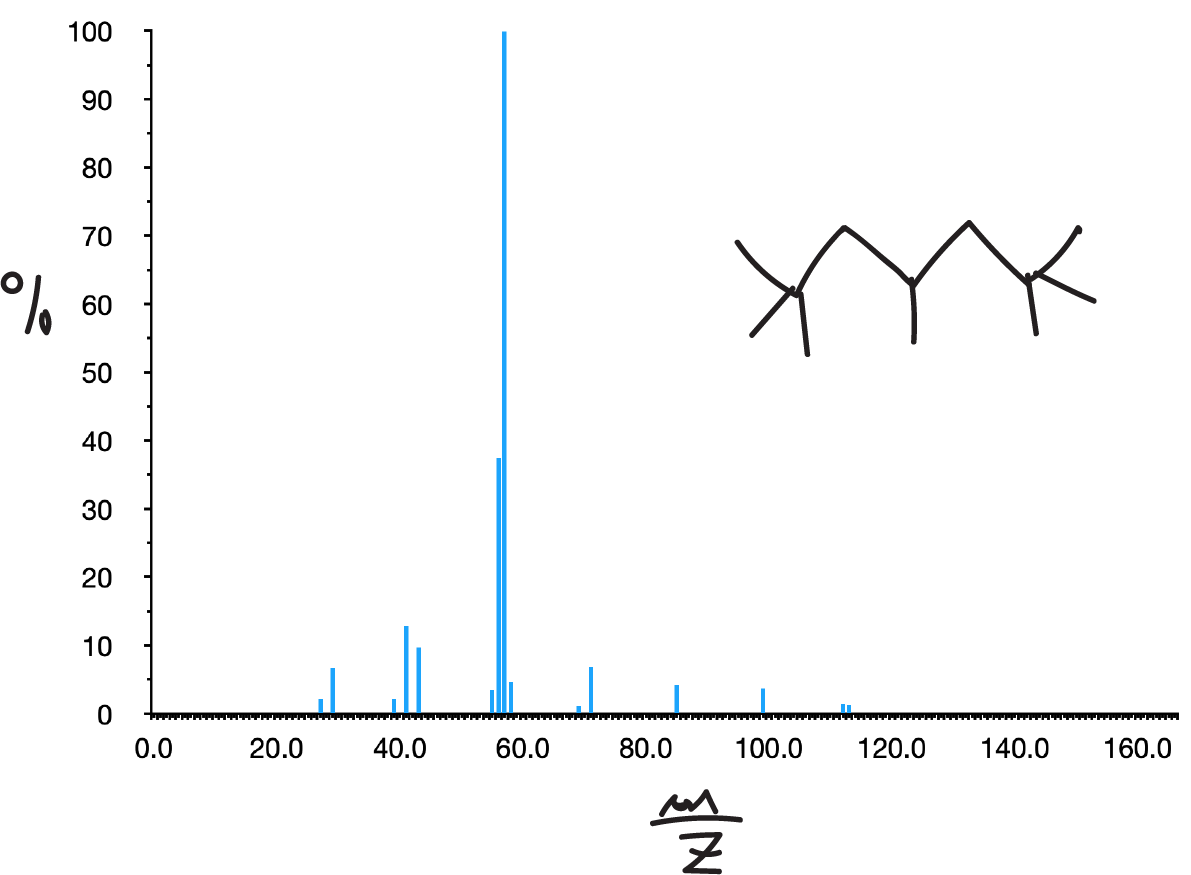
La presencia de ramificaciones da lugar a la rotura por los puntos de ramificación (1ª Regla de la fragmentación simple) aumentando las intensidades de los iones secundarios formados en dichas roturas.
Los hidrocarburos saturados alicíclicos suelen presentar un pico molecular intenso. Suelen ser espectros complejos en los que suelen predominar las perdidas de etileno (M-28) y la perdida de la cadena lateral (caso de existir).
Hidrocarburos insaturados
Suelen presentar el pico del ion molecular, aparentemente formado por la perdida de un electrón π. Los picos más representativos suelen corresponder a la formación de cationes alílicos como consecuencia de la rotura de los enlaces en posición alílica respecto al doble enlace (2ª Regla de la fragmentación).
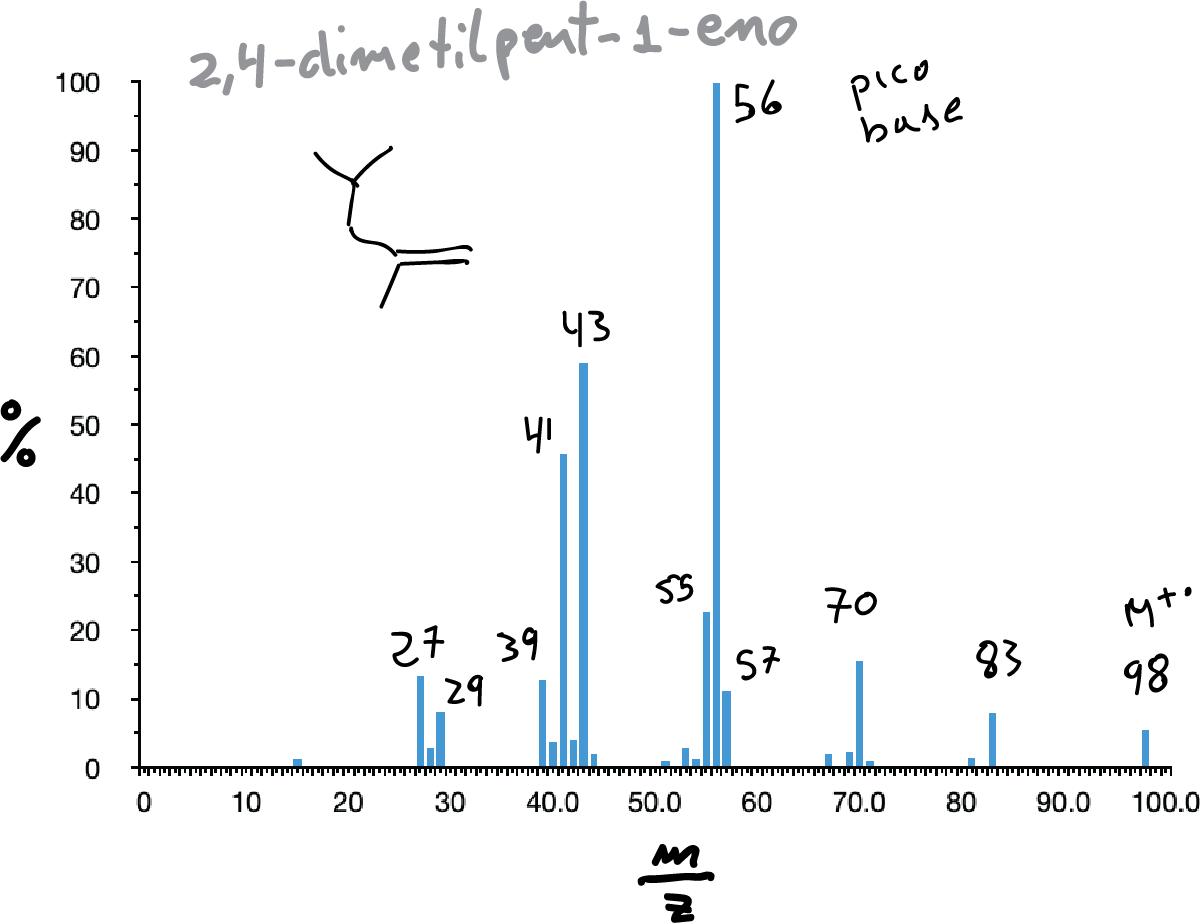
Sin embargo, hay que tener en cuenta la posibilidad de transposiciones o reagrupamientos y también la posibilidad de transposición de McLafferty.
En los hidrocarburos cíclicos suele observarse la formación de los iones correspondientes a la Retro-Diels-Alder.
Hidrocarburos aromáticos
Los hidrocarburos aromáticos suelen presentar un intenso pico del ión molecular. Si son ramificados (alquilbencenos) la rotura mas característica suele corresponder a la formación de ion tropilio (C7H7, m/z = 91) o iones tropilio sustituidos, normalmente acompañados de un pico a m/z = 65 debido a la perdida de acetileno del mismo. Si la cadena es lo suficientemente larga también se observan los picos de la transposición de McLafferty (m/z = 92).
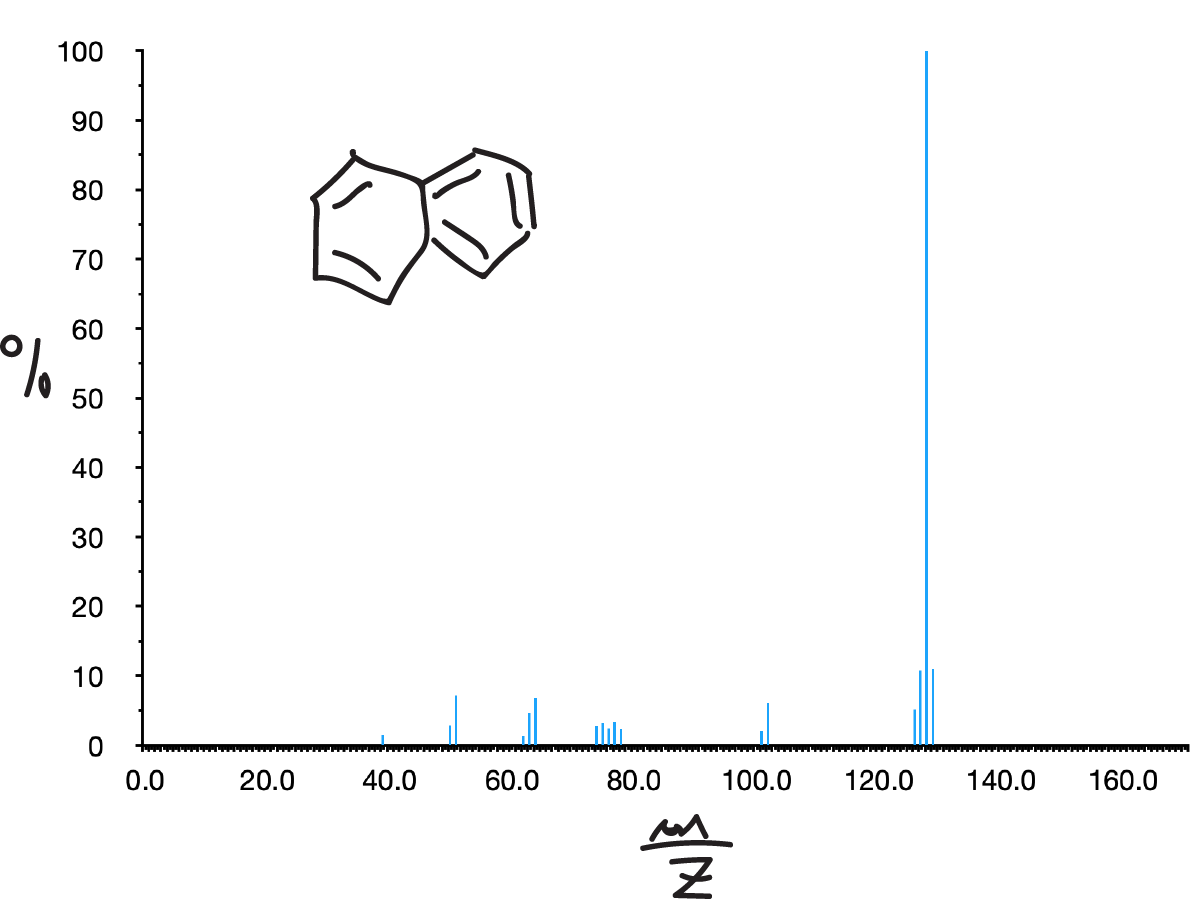
Haluros
Mientras que el fluor y el yodo son monoisotópicos, el cloro y el bromo no lo son con lo cual la presencia de estos se pone de manifiesto por la aparición de dos picos correspondientes al ion molecular de masas M y M+2, en el caso del cloro este último con una intensidad 1/3 de M y en el caso del bromo prácticamente iguales en intensidad.

El fragmento más abundante suele corresponder a la rotura del enlace C-X dando lugar a C+ (3ª Regla de la fragmentación simple). Suele ser frecuente la pérdida de HCl y formación del alqueno.
También, suelen aparecer iones bromonio cíclicos cuando se puede formar un anillo de 5 miembros (véase en la siguiente figura el pico a m/z = 135).
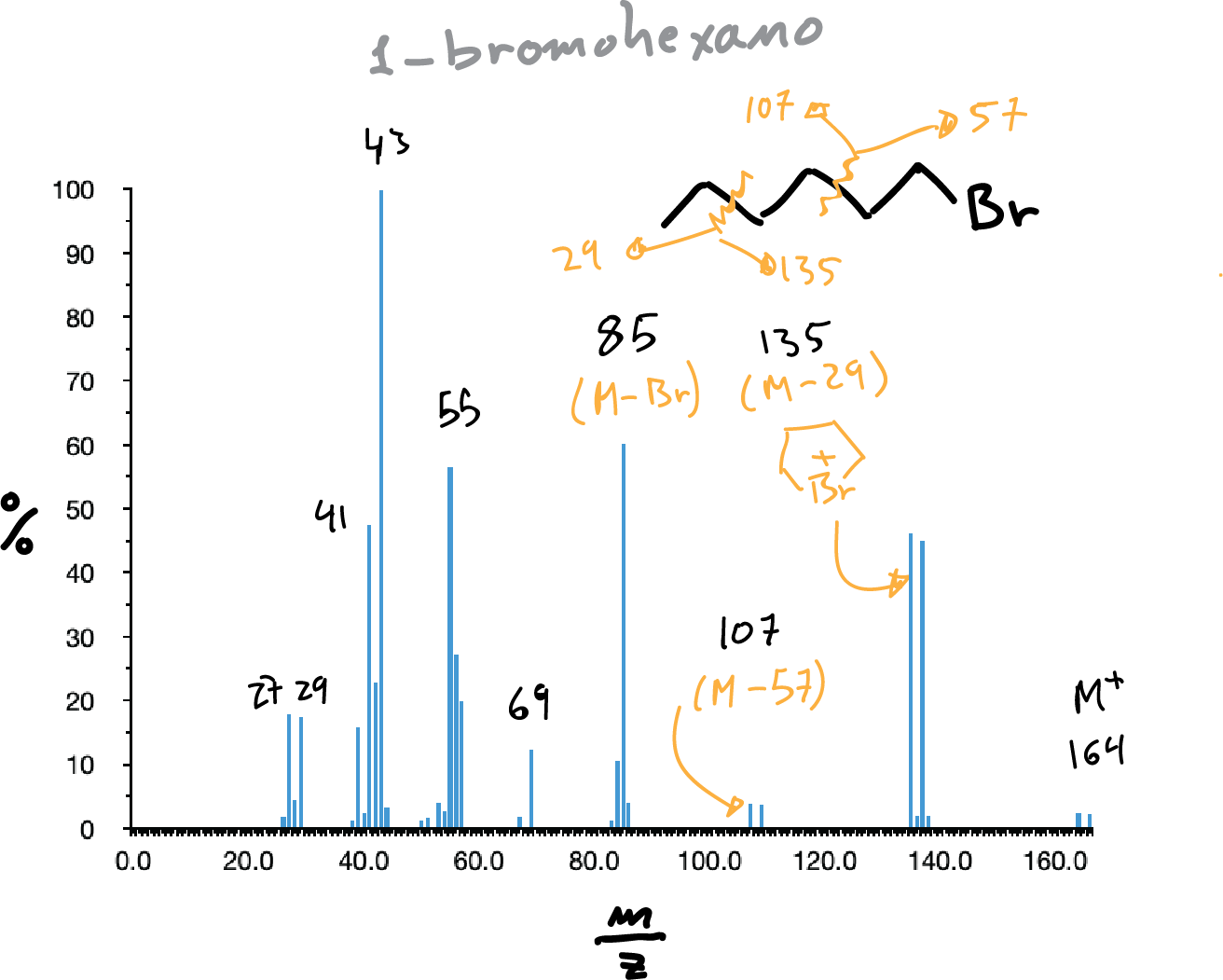
Alcoholes
Los alcoholes primarios y secundarios suelen presentar un débil pico del ion molecular, los terciarios no lo suelen presentar.
En cuanto a los procesos de fragmentación mas frecuentes suelen ser: la deshidratación (M-18) y la rotura de un enlace en el carbono que soporta al grupo -OH.
Esta última, da lugar a iones del tipo: R2C+–OH estabilizados por resonancia por el oxigeno: CH2OH de (m/e 31) en el caso de los alcoholes primarios) (3ª Regla de la fragmentación simple).
Además, los alcoholes bencílicos suelen dan un intenso pico de ion molecular, pudiendo dar el M-1 (hidroxitropilio) y/o el M-18 por efecto orto.
fig-8
Fenoles
Suelen dar un intenso pico de ion molecular y es característico de los mismos el pico a M-28 (perdida de CO).
fig-9
Éteres
Presentan picos parecidos a los de los alcoholes. Los dos procesos de fragmentación mas frecuentes suelen ser:
- Rotura del enlace C-O quedando la carga sobre el radical alquílico (salvo en el caso de los aromáticos en que dicha carga suele quedar tanto sobre el anillo aromático como sobre el fenóxido).
fig-10
- Rotura del enlace C-COH, dando lugar a iones del tipo: R2C+-OR estabilizados por resonancia por el oxígeno: CH2OR (31, 45, 59, …).
Aldehídos
Los aldehídos alifáticos presentan picos débiles de ion molecular. Así, estos suelen dar la rotura del enlace en alfa respecto al grupo carbonilo: picos M-1 (característico de aldehídos) y 29 (CHO).
Si poseen H en posición gamma pueden dar transposición de McLafferty: m/e 44 (CH2=CHOH) y M-44. (3ª y 4ª Reglas de la fragmentación simple).
fig-11
Los aromáticos presentan iones moleculares intensos y también intensos M-1, que suele dar la pérdida de CO para producir iones fenílicos.
Cetonas
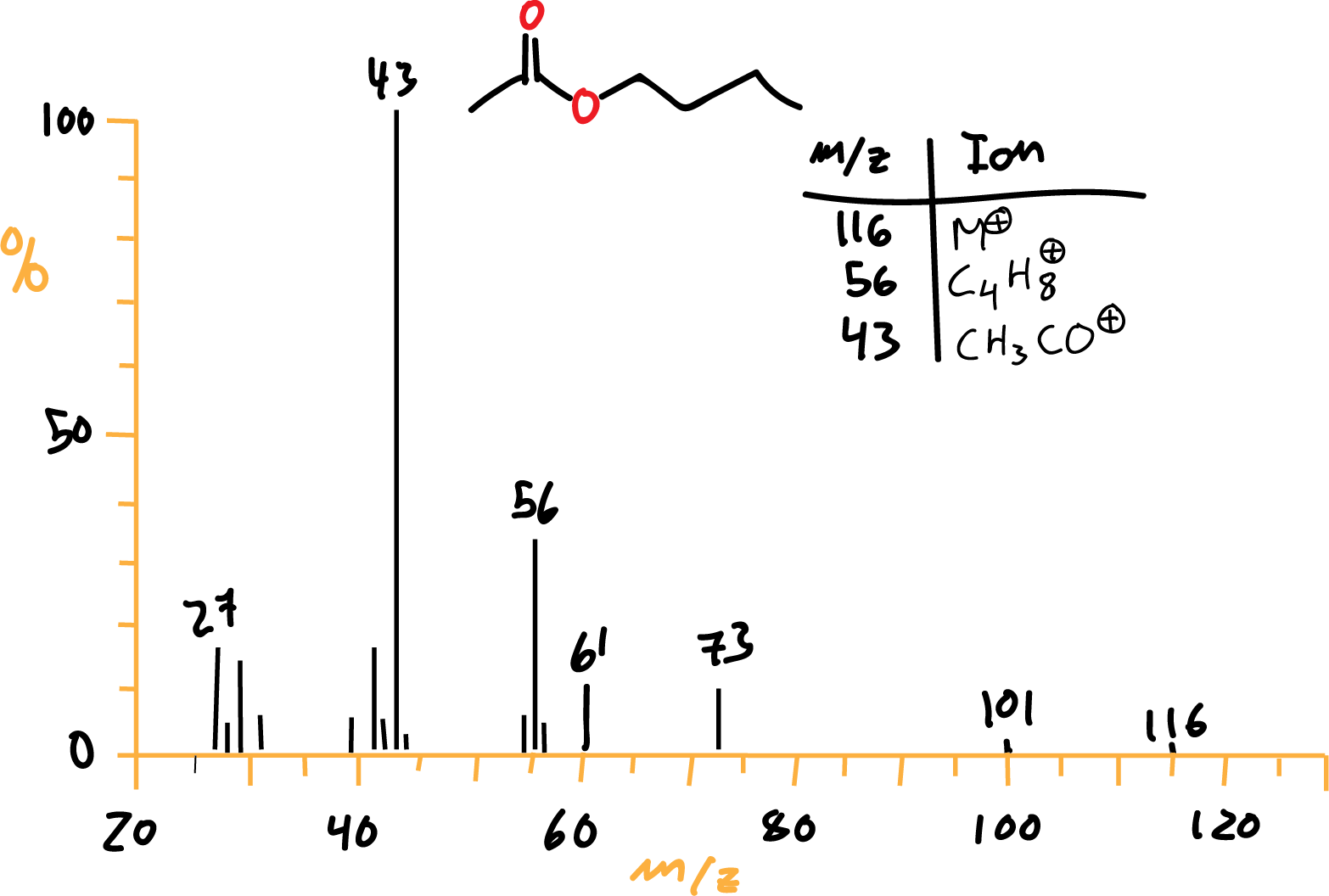
Las cetonas presentan un ion molecular que suele ser intenso. Por tanto, se fragmentan de manera análoga a los aldehídos, predominando generalmente el ion acilo (RCO) resultado de la perdida del resto alquílico más voluminoso. Suelen presentar un pico base a m/e 43 (CH3CO).
Cuando hay hidrógenos en gamma predominan los picos de la transposición de McLafferty pudiendo dar hasta 3 posibles transposiciones acabando con un pico a m/e 58 (CH3COH=CH2).
fig-12
Las aromáticas suelen presentar como pico base el ion benzoilo m/e 105.
fig-13
Ácidos
Si es posible dan transposición de McLafferty, así en los alifáticos el pico base suele ser el de m/e 60 (CH2=C(OH)2). Suelen presentar un pico a m/e 45 correspondiente a COOH.
fig-14
En los aromáticos suele ser muy intenso el pico M-17 correspondiente al ion acilo. Para estudiarlos por MS suelen utilizarse sus esteres metílicos.
Ésteres
Los ésteres metílicos suelen dar como iones fundamentales el ion acilo (RCO) y el carboximetilo (OCOCH3, m/e 59).
fig-15
Si es de cadena larga se obtiene el producto de transposición de McLafferty (m/e 74: CH3COH=CH2). Los esteres de etilo y esteres superiores suelen dar el ion R-COOH debido a dicha transposición.
fig-16
Los de ácidos aromáticos suelen dar importantes iones acilo (ArCO) por perdida del radical alcoxilo y transposiciones de McLafferty. Los bencílicos suelen dar un pico a M-42 por perdida de cetena (CH2=C=O).
fig-17
Aminas
Las aminas alifaticas no suelen presentar ion molecular. El pico más intenso suele corresponder a la perdida de un grupo alquilo en beta respecto al Nitrógeno (R2C=N+R’2), que en el caso de las aminas primarias corresponde a m/e 30 (CH2=NH2).
fig-18
Las aromaticas suelen dar un pico de ion molecular intenso que suele estar acompañado de un moderado M-1.
fig-19
Amidas
Se suele observar el pico molecular. La presencia de un pico a m/e 44 (NH2=C=O) es indicativo de amidas primarias. Las amidas suelen dar transposición de McLafferty.
fig-20
Nitrilos
En los nitrilos, el pico base se debe generalmente a una transposición de McLafferty y corresponde al ion CH2=C=NH (m/e 41).
fig-21
Compuestos nitrados
Los compuestos nitrados suelen dar pérdidas de 30 (NO) y 46 (NO2).
fig-22
Compuestos de azufre
Los tioles y sulfuros se comportan como los alcoholes y éteres, con la salvedad de que presentan iones moleculares más intensos que aquellos. Los disulfuros suelen presentar perdidas de olefinas: pico a m/e 66 correspondiente a HSSH.
fig-23
Factores que influyen en la abundancia de los iones
Los mecanismos más favorables vienen determinados por varias fuerzas:
- Las reacciones que conducen a productos más estables tanto ionicos como neutros. Si existe un heteroátomo (N, S, O), los iones se estabilizan a menudo por formación de un «nuevo enlace» con el heteroátomo.
- Las reactividades en el ion tienen su paralelo en las reacciones conocidas.
- También influyen los factores estéricos.
fig-24
- Efectos de resonancia:
fig-25
- El efecto inductivo: (+I) de los grupos alquilo (hiperconjugación) y (-I) según la serie: Cl > Br, O, S > I >> N
fig-26
fig-27
- La polarizabilidad de los enlaces retransmite a lo largo de los mismos.
Ion molecular
Como se ha indicado anteriormente, cuando se introduce una molécula en la cámara de ionización y se bombardea con una corriente de electrones esta sufre la ionización. Es decir, la molécula pierde un electrón dando lugar a la formación de un ion-radical.
fig-28
Lógicamente, el electrón que se pierde debe ser el que tenga un menor potencial de ionización. Así, se obtendrán unas estructuras como las que se muestran en la figura.
fig-29
Así por ejemplo:
fig-30
Propiedades del ion molecular
Entre otras el ion molecular debe poseer las siguientes características:
- Ser el ion con mayor masa de los que aparecen en el espectro.
- Contener todos los elementos presentes en sus fragmentos.
- Corresponder al ion con el potencial de ionización más bajo.
- Su relación m/e debe ser par cuando no posee nitrógeno o posee un número par de N. Por la misma razón, debe ser impar cuando posee un número impar de átomos de nitrógeno.
- Las diferencias de masa entre dicho ion molecular y los fragmentos que aparecen en el espectro deben ser químicamente lógicas.
- Su abundancia relativa depende en gran medida de la naturaleza química del producto.
Relación entre la intensidad y el grupo principal
Por tanto, existe una serie que relaciona, de una manera cualitativa y aproximada, la intensidad de dicho ion con el grupo principal presente en la molécula.
Ordenadas de mayor a menor sería:
- Compuestos aromáticos > olefinas conjugadas > compuestos alicíclicos > sulfuros > hidrocarburos lineales > mercaptanos > cetonas > aminas > esteres > éteres > ácidos carboxílicos > hidrocarburos ramificados > alcoholes
- Se puede utilizar el ion molecular para la determinación de la fórmula molecular de la sustancia.
- Cuando se obtiene un espectro de masas de alta resolución (HR-EM) es posible distinguir entre fórmulas de igual masa. Esto es debido a que los elementos tienen un peso atómico que permite distinguir entre ellas.
En la Tabla 1, se muestran algunas diferencias de masas de combinaciones atómicas para el pico de valor 43.
| Combinación atómica | Masa exacta |
| CHNO | 43.0058 |
| C2H3O | 43.0184 |
| CH3N2 | 43.0269 |
| C2H5N | 43.0421 |
| C3H7 | 43.0547 |
Distribución isotópica
Además, en la Tabla 2 se indica la causa de tales diferencias, que no es otra que la masa exacta de los elementos debido a la distribución isotópica de los mismos.
| Elemento (Peso Atómico) | Isótopos (abundancia relativa %) | Masa atómica |
| Hidrógeno (1.00794) | 1H (100) 2H (0.015) | 1.00783 2.01410 |
| Carbono (12.01115)
| 12C (100) 13C (1.12) | 12.00000 13.00336 |
| Nitrógeno (14.0067) | 14N (100) 15N (0.366) | 14.0031 15.0001 |
| Oxígeno (15.9994) | 16O (100) 17O (0.037) 18O (0.240) | 15.9949 16.9991 17.9992 |
| Fluor (18.9984) | 19F (100) | 18.9984 |
| Silicio (28.0855) | 28Si (100) 29Si (5.110) 30Si (3.385) | 27.9769 28.97.65 29.9738 |
| Fósforo (30.9738) | 31P (100) | 30.9738 |
| Azufre (32.066) | 32S (100) 33S (0.789) 34S (4.438) 36S (0.018) | 31.9721 32.9715 33.9669 35.9677 |
| Cloro (35.4527) | 35Cl (100) 37Cl (32.399) | 34.9689 36.9659 |
| Bromo (79.9094) | 79Br (100) 81Br (97.940) | 78.9183 80.9163 |
| Iodo (126.9045) | 127I (100) | 126.9045 |
Fragmentaciones y transposiciones del ión molecular
Podemos considerar que existen tres tipos fundamentales de fragmentaciones del ión molecular dependiendo del número de enlaces que se rompen:
Roturas de un enlace sencillo (σ)
Producen siempre un catión y un radical, se conoce como fragmentación simple:

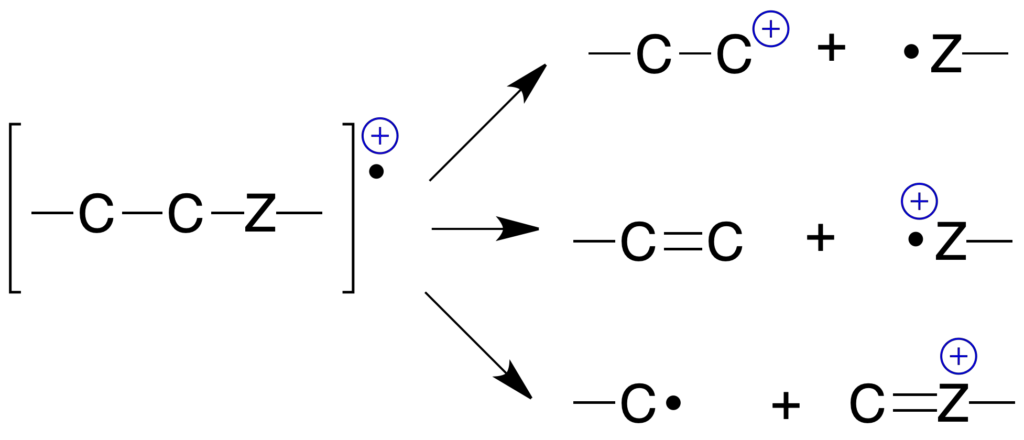
Rotura simultánea de dos enlaces sencillos
Esta rotura, produce normalmente la eliminación de moléculas neutras. En este tipo se engloban también las transposiciones o reagrupamientos a través de estados cíclicos como la retro Diels-Alder y la transposición de McLafferty:

Además, las transposiciones más complejas implican transferencias de radicales hidrógeno y eliminaciones entre átomos no vecinales.
Dependiendo del tipo de rotura del enlace, la fragmentación sencilla puede ser homolítica o heterolítica. En ambos casos, resultando con la formación de un radical (que no es detectado en el espectro de masas) y un catión:
fig-33
Como característica de dicha fragmentación sencilla, cabe indicar que si el ion molecular no contiene nitrógeno (su masa es par) los fragmentos tienen masa impar.
A su vez, los cationes formados en esta fragmentación pueden sufrir nuevas fragmentaciones bien por via homolítica (producirían radicales e iones radicales) o heterolítica (producirían moléculas neutras y otro catión).
fig-34
Fragmentación de moléculas cíclicas
Un caso algo especial es el de las moléculas cíclicas, que cuando se rompe un enlace del anillo se obtiene un nuevo ión radical homólogo del ión molecular, pero lineal.
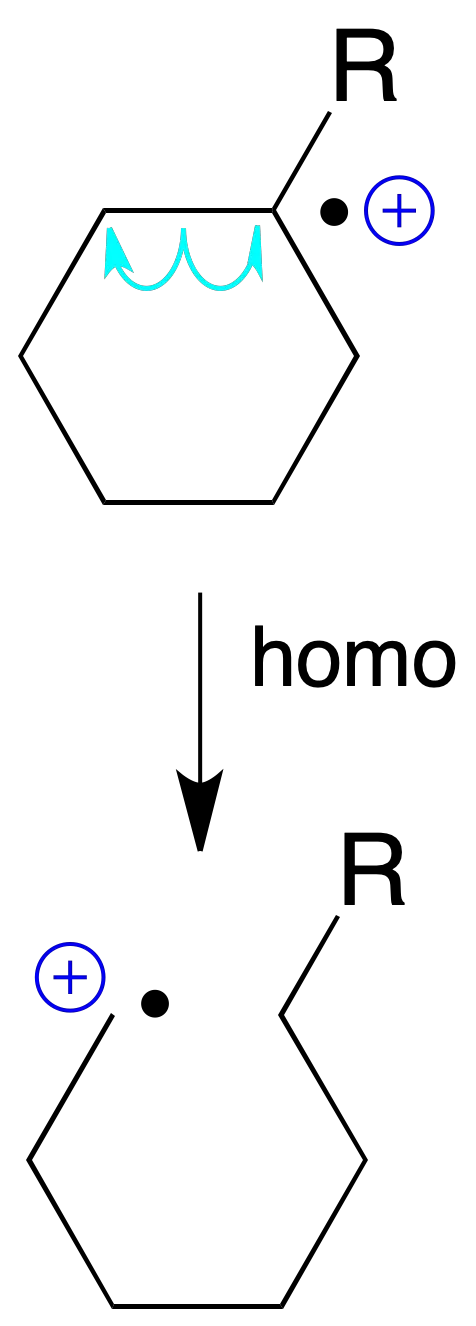
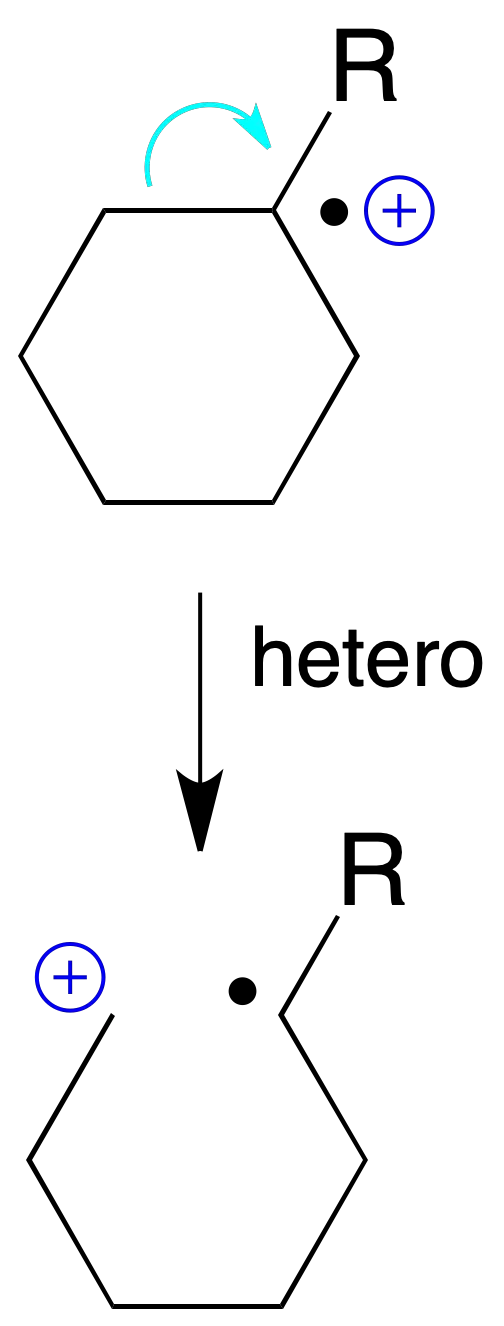
Dichos iones radicales sufren posteriormente nuevas fragmentaciones y/o transposiciones, dando lugar a cationes de masa par o impar, respectivamente.
fig-36
Fragmentaciones más frecuentes
La Tabla 3 incluye las masas de los fragmentos más característicos y frecuentes que aparecen en los espectros de masas. Hay considerar, que dichos fragmentos son característicos de iones pero también de perdidas del ión molecular.
| Masa de ion | Asignación |
| 29 | Etilo (C2H5), formilo (CHO) |
| 30 | Nitroso (NO) |
| 31 | Metoxilo (CH3O), hidroximetilo (CH2OH) |
| 39 | Ciclopropenilo (C3H3) |
| 41 | Alilo (CH2CH=CH2) |
| 43 | Propilo (C3H7), acetilo (CH3CO) |
| 45 | Carboxilo (COOH) |
| 46 | Nitro (NO2) |
| 55 | Butenilo (C4H7) |
| 56 | C4H8 |
| 57 | t-Butilo (C4H9), Propanoilo (CH3CH2CO) |
| 60 | Acido acético |
| 65 | Ciclopentadienilo (C5H5) |
| 77 | Fenilo (C6H5) |
| 91 | Bencilo (tropilio, Ph-CH2) |
| 92 | Metilenpiridina (azatropilio, C5H5N-CH2) |
| 105 | Benzoilo (Ph-CO) |
| 127 | Iodo |
Reglas de fragmentación de los compuestos orgánicos
Con el fin de sistematizar dentro de lo posible todas las indicaciones anteriores, sobre la fragmentación del ión molecular, vamos a considerar que, independientemente del tipo de rotura (homo o heteronuclear), las fragmentaciones responden a alguna de las cuatro reglas siguientes:
Regla 1ª de fragmentación
| ¡Regla 1! «Los enlaces carbono-carbono se escinden con preferencia en los puntos de ramificación.« |

La carga positiva quedará sobre el carbocatión más estable, siendo la estabilidad de estos:
Terciario (3º) > Secundario (2º) > Primario (1º) > Metilo.
Regla 2ª de fragmentación
| ¡Regla 2! «Los enlaces dobles o sistemas de dobles enlaces (entre ellos los aromáticos) favorecen la escisión de los enlaces arílicos y bencílicos.« |
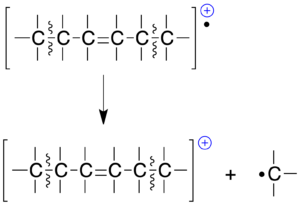
La carga positiva quedará normalmente formando un carbocatión arílico o bencílico. En este ultimo caso, debemos hacer notar que no es un catión bencilo lo que se forma sino que este sufre un reagrupamiento.
En consecuencia, da lugar a la formación del ion tropílio (C7H7+), que es más estable que aquel al ser aromático.

Un caso especial lo constituye el caso de los cicloalquenos, pues poseen dos enlaces en posición alílica. En consecuencia, estos sufren la fragmentación simultánea de ambos enlaces. A esta fragmentación se se la conoce como reacción de retro Diels-Alder.

Regla 3ª de fragmentación
| ¡Regla 3! «Los heteroátomos, como donadores de electrones, favorecen la fragmentación de los enlaces del átomo de carbono que soporta al heteroátomo.« |
Debemos considerar dos casos.
- Que el heteroátomo esté unido al carbono mediante un enlace sencillo. Como consecuencia, se podrían romper bien el enlace C-X bien el enlace C-C-X, quedando la carga sobre el fragmento que la estabilice mejor. Si se rompe el C-X la carga queda preferentemente sobre el átomo de carbono.
fig-39
- Que el heteroátomo esté unido mediante un enlace doble. Por ejemplo, si se trata de un grupo carbonilo (C=O), el ión más estable suele ser el ión acilo (RCO+).
fig-40
Regla 4ª de fragmentación
| ¡Regla 4! «Los dobles enlaces y los heteroátomos favorecen, como aceptores de hidrógeno, la transposición de un hidrógeno a través de un estado cíclico de transición de seis miembros.« |
Se conoce como Transposición específica de hidrógeno o transposición de McLafferty”.

Estas transposicones tienen como principales características:
- Suele ponerse en evidencia por la formación de iones de masa par a partir de iones moleculares pares.
- Para que se produzcan, debe existir un átomo de hidrógeno en posición γ con respecto al doble enlace aceptor de hidrógeno.
fig42