Índice
Written by J.A. Dobado | Last Updated on 5 meses
¿Qué es la destilación por arrastre de vapor?
La destilación por arrastre de vapor es una técnica aplicada en la separación de una sustancia de una mezcla. Aprovecha la propiedad de bajo punto de ebullición de las mezclas inmiscibles. Está especialmente indicado para separar moléculas orgánicas sensibles a la temperatura de un contaminante no volátil en sustancias inmiscibles en agua. Con el inconveniente de presentar puntos de ebullición muy altos, y que descomponen al destilar.
También, suele emplearse esta técnica para purificar sustancias contaminadas por grandes cantidades de impurezas resinosas, para separar disolventes de alto punto de ebullición de sólidos que no se arrastran.
En la destilación por arrastre de vapor, se hace pasar una corriente de vapor (normalmente vapor de agua) que arrastre dicha sustancia.
La mezcla inmiscible se calienta a ebullición, lo que provoca la destilación tanto del agua como de los compuestos orgánicos volátiles. Esto significa que la mezcla gaseosa viaja hacia arriba hasta un condensador, que luego condensa el vapor a líquido para que pueda ser recogido.
A diferencia de la destilación simple, utiliza un depósito para reponer el agua en la mezcla calentada durante todo el proceso. El componente orgánico inmiscible se destila lentamente junto con el agua, mientras que el componente no volátil permanece en la mezcla calentada. Una vez que se destila el componente orgánico, se puede separar del agua mediante extracción líquido-líquido.
Según la forma de generar el vapor se utilizan diferentes dispositivos y se distinguen dos tipos de destilación por arrastre con vapor dependiendo si la fuente de vapor es externa o interna.
Destilación con fuente de vapor externa
Se realiza con un montaje (con la correspondiente sujeción) como el que se indica en la Figura, y que incluye un adaptador Claisen. Es similar al de una reacción con reactivos gaseosos, salvo que en este caso el gas que se hace burbujear sobre la solución del producto es vapor de agua obtenido en un montaje auxiliar.

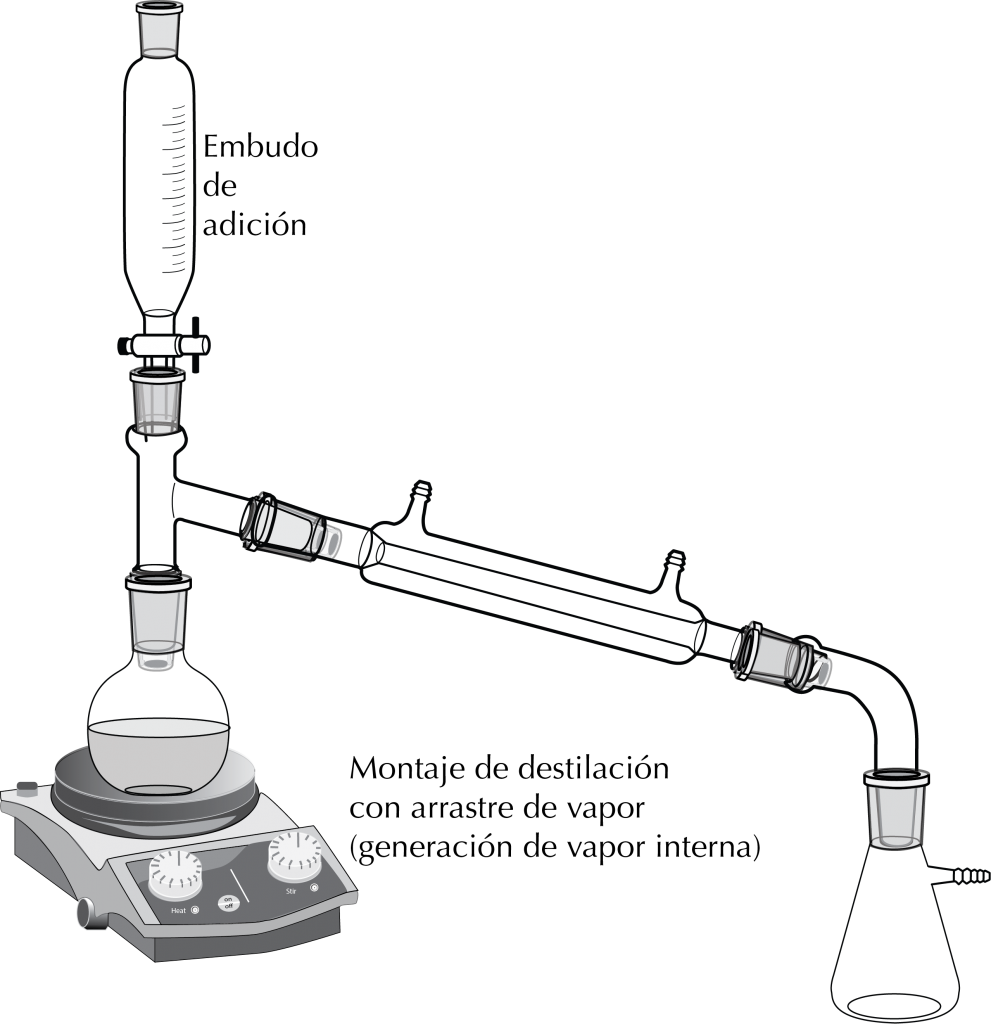
Destilación con fuente de vapor interna
En este caso se trata de destilar una mezcla de un producto disuelto en un disolvente orgánico y agua. Se realiza como una destilación simple y se puede colocar en el montaje un embudo de adición con agua que se va añadiendo gradualmente.
Presión de vapor de una mezcla
Dada una mezcla miscible (solución homogénea), la presión de vapor de cada componente depende de la presión de vapor del componente puro y su fracción molar en la mezcla líquida de acuerdo con la ley de Raoult:
pA = pA* · xA
donde pA es la presión de vapor de un componente líquido en una mezcla líquida miscible, pA* es la presión de vapor del líquido puro y xA es la fracción molar de ese líquido en la mezcla, que es igual a:
nA / nt
Donde nA es el número de moles del líquido individual en la mezcla y nt es el número total de moles de todos los líquidos en la mezcla.
La presión de vapor total por encima de la mezcla líquida miscible es igual a la suma de la presión de vapor parcial de cada componente en ella, lo que se conoce como ley de Dalton de las presiones parciales.
La presión de vapor de un líquido aumenta con la temperatura a medida que más moléculas ganan energía cinética para escapar de la fase líquida a la fase gaseosa. En una mezcla miscible que contiene dos líquidos, la presión viene expresada como:
P = pA + pB
Donde pA y pB son las presiones de vapor del líquido A líquido B, respectivamente, por encima de la mezcla. P es la presión de vapor total de ambos líquidos por encima de la mezcla.
La combinación de las ecuaciones describe la relación entre la presión de vapor total de la solución y la fracción molar de los componentes individuales:
P = pA* ·xA + pB* ·xB
En una mezcla inmiscible, donde los componentes forman una mezcla heterogénea, las presiones de vapor de cada componente contribuyen independientemente a la presión de vapor total.
En consecuencia, la presión de vapor total es igual a la suma de las presiones de vapor puro individuales.
En una mezcla inmiscible compuesta por dos líquidos, la presión total se define como la presión de vapor del primer líquido más la presión de vapor del segundo líquido.
P = pA* + pB *
Punto de ebullición de una mezcla inmiscible
A medida que se calienta un líquido, aumenta la presión de vapor. Cada componente de una mezcla tiene su propio punto de ebullición. En una mezcla de líquidos miscibles, la ebullición se produce a una temperatura entre los puntos de ebullición de los líquidos constituyentes.
Sin embargo, para una mezcla inmiscible, la ebullición se produce a una temperatura mucho más baja que los puntos de ebullición de los componentes individuales. Como cada componente individual contribuye de forma independiente, se requiere menos calor para aumentar la presión de vapor total a la presión atmosférica.
Por ejemplo, en el caso de la mezcla inmiscible de benceno y agua. Los puntos de ebullición (p.e.) del benceno y agua a 1 atm, son respectivamente, 80.1 y 100 ºC. La disolución hierve cuando la presión de vapor total alcanza los 760 mm Hg (presión atmosférica normal). A 69.3 ºC, la presión de vapor del agua es de 227 mm Hg y la presión de vapor del benceno es de 533 mm Hg, que en total equivale a los 760 mm Hg necesarios para hervir. Por tanto, estos valores está muy por debajo del p.e. de cada componente individual.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
