Written by J.A. Dobado | Last Updated on 5 meses
¿Qué es la espectroscopía infrarroja?
La espectroscopía infrarroja (IR) utiliza la radiación del espectro electromagnético cuya longitud de onda (λ) está comprendida entre los 800 y los 400000 nm (0.8 y 400 μ; 1 μ = 10-4 cm).
Índice
Por tanto, su efecto sobre la materia orgánica, es producir deformaciones de los enlaces de la sustancia.
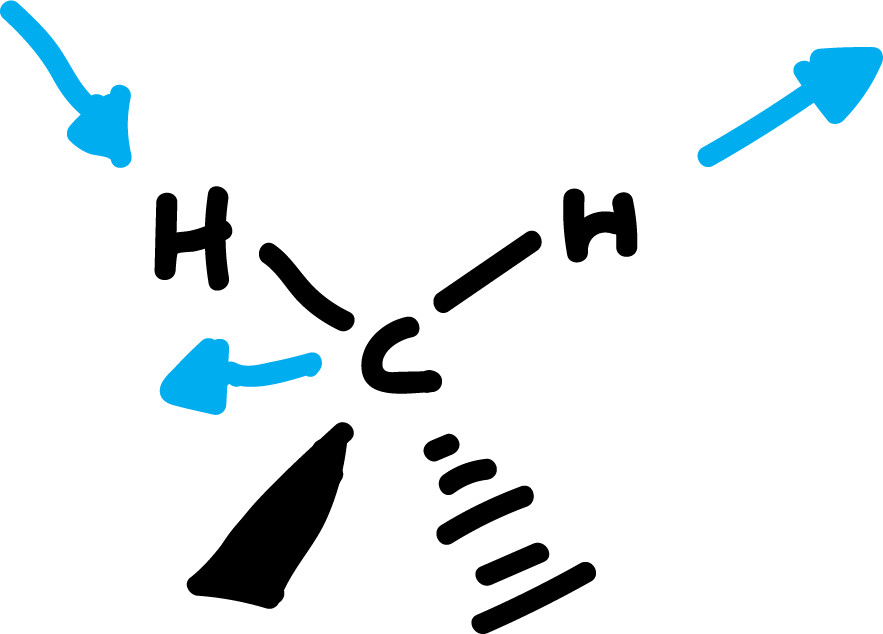
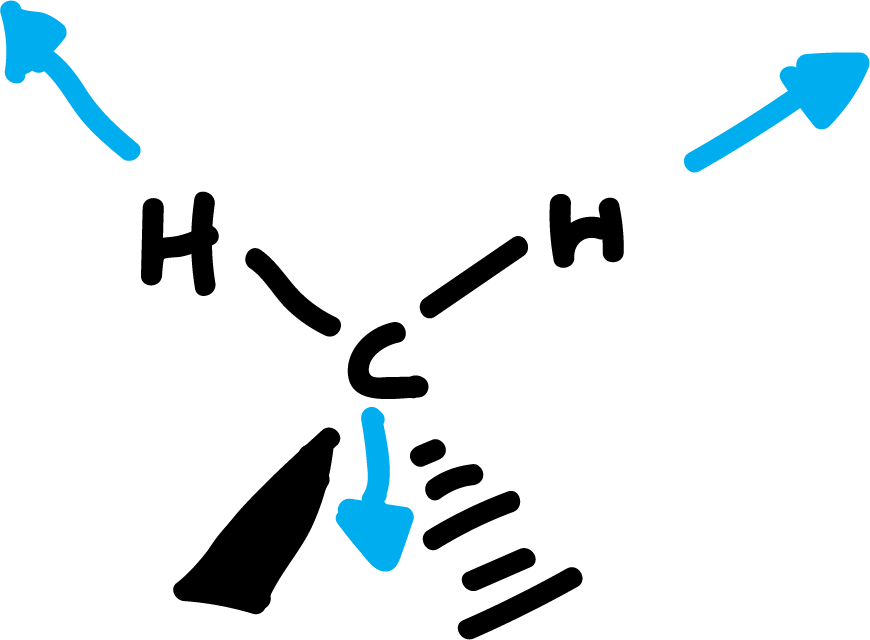
Debido a su gran amplitud se suele dividir en tres zonas:
Siendo el IR medio el normalmente utilizado experimentalmente en determinación estructural (2.5 – 16 μ). Así, debido a consideraciones de tipo histórico, la unidad más usada en IR no es la longitud de onda (λ) sino el número de onda (ṽ = 1/ λ cm-1). Por consiguiente, al IR medio le corresponde la zona comprendida entre 4000 y 625 cm-1.
Por otro lado, el aspecto típico de un espectro IR es el que se muestra en la figura:
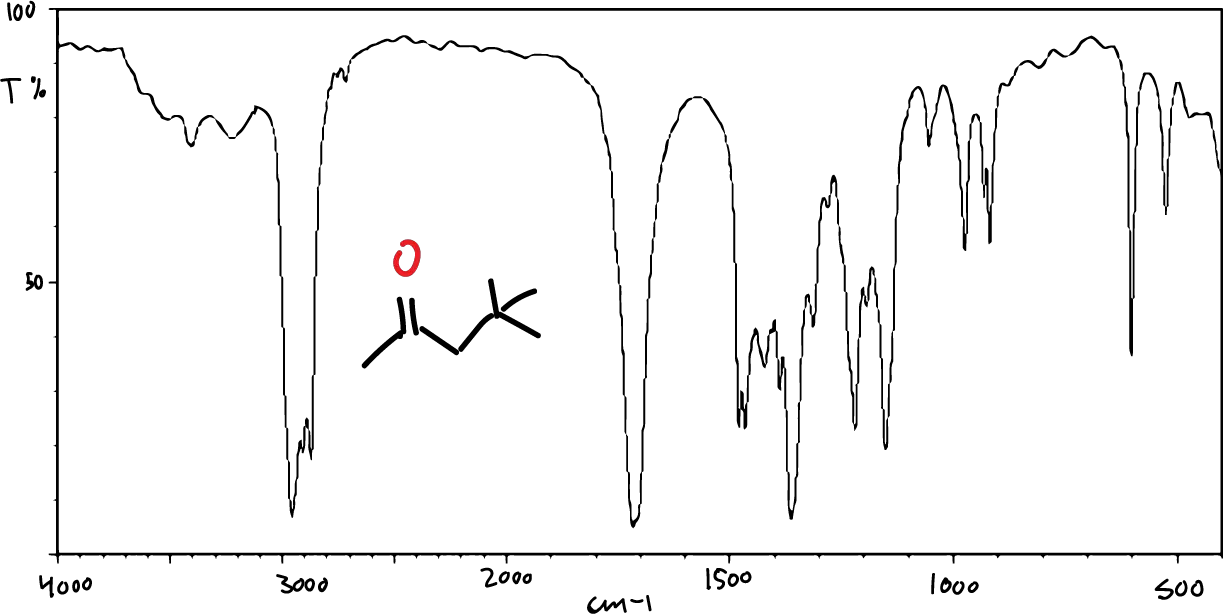
Cada absorción observable en el espectro corresponde a una vibración determinada de algún enlace dentro de la molécula.
Modos de vibración de los enlaces
Hay diferentes modos normales de vibración en las moléculas. Y estos llevan asociado un movimiento característico de los átomos. Los principales son: las deformaciones de enlace, de ángulos de valencia, de ángulos diedros, las deformaciones fuera del plano, etc.

Por ejemplo, los modos normales de vibración del formaldehído. Cada uno de estos tipos de vibración tiene asociada una frecuencia característica, que puede ser calculada mediante la ecuación de Hooke para el movimiento vibratorio:
υ = (1/2π)·√k/mA (ec. 1)
υ = (1/2π)·√k/u (ec. 2)
donde k es la constante de fuerza del enlace y u es la masa reducida del sistema. Según sea la relación entre las masas de los átomos que intervienen en el enlace. Así, usaremos la ecuación (1) cuando mA << mB o la (2) cuando ambas masas sean equiparables.
En una molécula con n átomos deben aparecer 3n-6 bandas de tensión y flexión (3n-5 cuando la molécula es lineal).
Así, de todas ellas solo darán una banda observable en el IR aquellas vibraciones que produzcan un cambio en el momento dipolar (las vibraciones simétricas no aparecen en el IR, pero se podrían observar en la espectroscopía Raman).
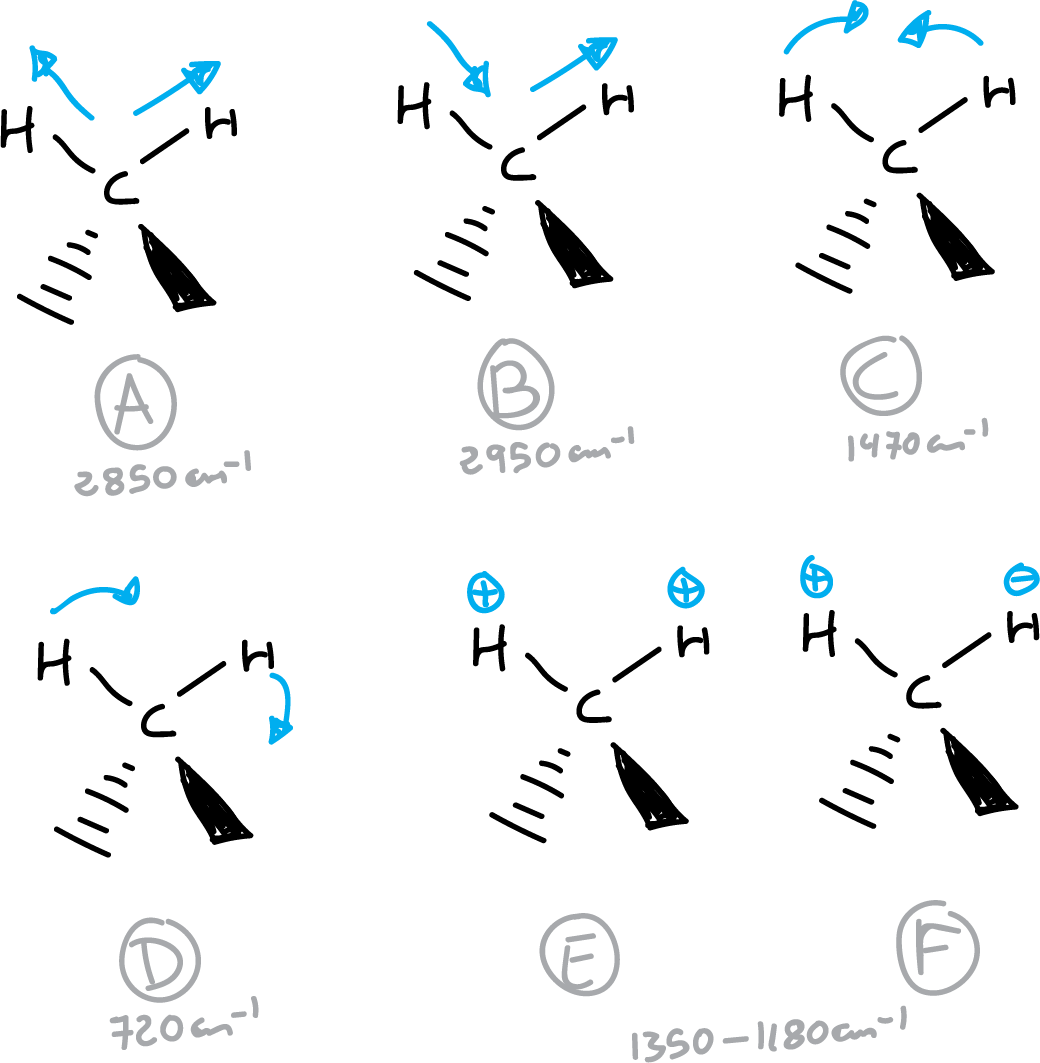
Por ejemplo, los modos de vibración del grupo metileno serán:
Zonas del espectro de IR
A la hora de identificar los grupos funcionales con la espectroscopia IR vamos a considerar el espectro de IR dividido en varias zonas:
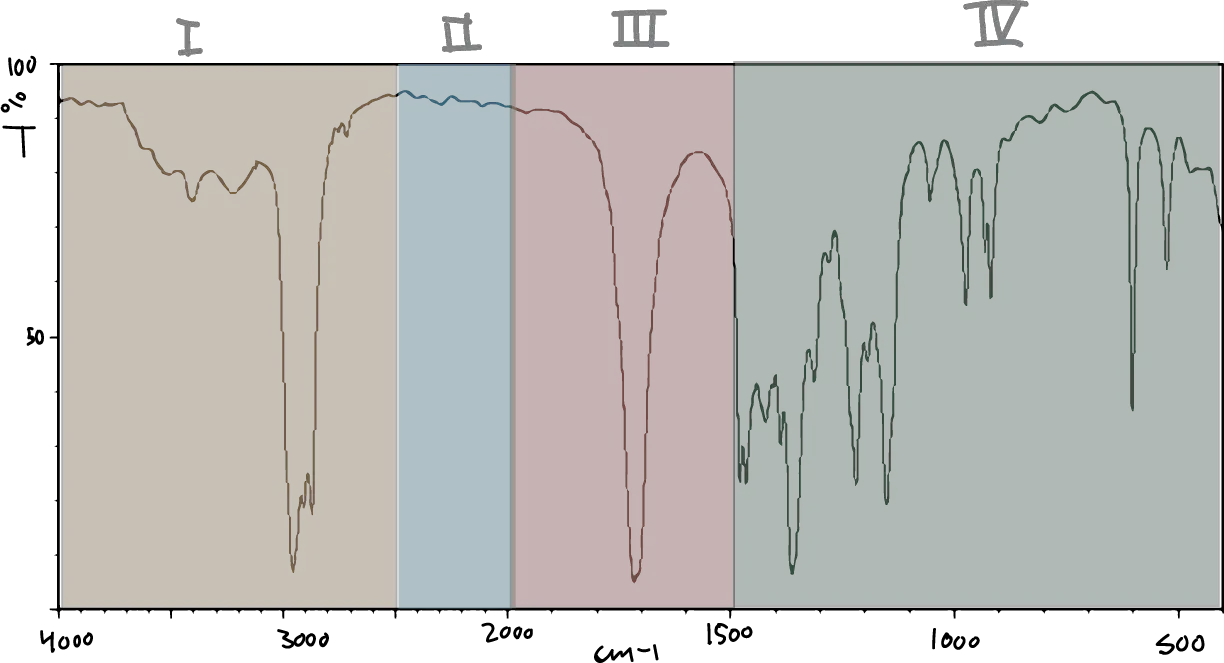
- Zona I de 4000 a 2500 cm-1: Tensión de C-H, O-H y N-H.
- Zona II de 2500 a 2000 cm-1: Tensión de triples enlaces y dobles enlaces acumulados.
- Zona III de 2000 a 1500 cm-1: Tensión de C=O, C=N y C=C.
- Zona IV de 1500 a 600 cm-1: Zona de la huella dactilar (flexión de enlaces CH,CO,CN,CC, etc..)
Identificación de grupos funcionales en el IR
De acuerdo con dicha división se podrán identificar diversos grupos funcionales, tal y como se indica en la Tabla 1.
| Grupo funcional | Nº de onda (cm-1) |
| OH (sin enlace de hidrógeno) | 3600 |
| NH | 3500-3300 |
| OH (enlace de hidrógeno) | 3100-3200 |
| -C ≡ C- | 2300-2100 |
| -N=C=O | ~ 2270 |
| -C ≡ N | ~ 2250 |
| -N=C=S | ~ 2150 |
| C=C=C | ~ 1950 |
| Anhidridos | 1850-1740(2) |
| -COCl | 1815-1785 |
| Ciclobutanonas | 1780-1760 |
| γ-lactonas | 1780-1760 |
| Ciclopentanonas | 1750-1740 |
| Esteres | 1750-1735 |
| Esteres α,β-insaturados | 1750-1715 |
| δ-Lactonas | 1750-1735 |
| Aldehídos | 1740-1720 |
| Cetonas | 1725-1700 |
| Ácidos carboxílicos | 1725-1700 |
| Aldehídos y cetonas α,β-insaturados | 1715-1660 |
| Amidas | 1690-1630 |
| C=N- | 1690-1480 |
| NO2 | 1650-1500 1400-1250 |
| C-F | 1400-1000 |
| Sulfonamidas y sulfonatos | 1370-1300 1180-1140 |
| sulfonas | 1350-1300 1150-1100 |
| S=O | 1070-1010 |
| C-Br | 800-560 |
| C-Cl | 780-580 |
| C-I | 600-500 |
Como podemos observar, la mayor parte de los grupos funcionales más frecuentes en Química Orgánica presentan una absorción característica en el espectro IR.
