Índice
Written by J.A. Dobado | Last Updated on 1 año
¿Qué es la destilación a vacío?
La destilación a vacío, también denominada destilación a presión reducida, es una técnica de la purificación o separación de líquidos o sirupos con un punto de ebullición superior a 150 ºC, o con punto de ebullición menor pero que son térmicamente inestables. Como fuente de vacío se puede usar una trompa de agua o bien bombas de vacío.
Esquema de montaje
Los dispositivos de destilación a vacío pueden presentar diferentes configuraciones y componentes, pero la más popular consiste en un montaje muy parecido a la destilación simple, con la salvedad de presentar una cola de destilación conectada a vacío.

Precauciones
- El material de vidrio que se usa en una destilación a vacío debe ser cuidadosamente examinado para evitar que presente arañazos o grietas ya que supone un riesgo de implosión del montaje. Sobre todo en el caso de usarse presiones muy bajas se puede proteger el montaje envolviéndolo en algún tipo de malla o con cinta adhesiva, para que en caso de que ocurra algún accidente evitar la dispersión de fragmentos de vidrio.
- Hay que engrasar cuidadosamente las uniones esmeriladas para procurar el mejor ajuste y así evitar pérdidas de vacío.
Montaje de destilación a vacío
El montaje para realizar una destilación a vacío es similar al de la destilación simple, pero con algunas diferencias. Por ejemplo, se usa una cola de destilación especial con toma de vacío.
Por otro lado, no se suele emplear plato poroso para que la ebullición sea homogénea, ya que al hacer el vacío, el aire que tiene ocluido el plato poroso puede desprenderse rápidamente, perdiendo el vacío su efectividad. Alternativamente, se emplea agitación magnética.
A veces, como cuando la cantidad de líquido a destilar es pequeña, se puede utilizar un montaje especial (Claisen) para vacío que requiere la utilización de un capilar como sistema de agitación y regulación del vacío.
En el caso de un solo compuesto, se procede según se indica:
- En primer lugar se fija la pinza con la nuez a las barras de la mesa o vitrina.
- Se engrasan las uniones esmeriladas de todos los componentes del montaje con grasa de silicona.
- A continuación, se coloca el matraz de fondo redondo sobre la placa calefactora y se ajusta su embocadura con una pinza.
- Se añade el líquido a destilar (imán para agitación magnética).
- Después, montamos la cabeza de destilación sobre el matraz de fondo redondo.
- Para líquidos con tendencia a formar espumas o salpicaduras, es recomendable intercalar entre el matraz y el refrigerante un adpatador Claisen.
- Posteriormente, se sitúa el termómetro con su adaptador en la parte superior de la cabeza de destilación.
- Fijamos el refrigerante recto con una pinza y nuez al soporte metálico y con un «clip» a la cabeza de destilación.
- Asimismo, conectamos las gomas del refrigerante recto a las tomas de agua (sistema de recirculación o grifo/fregadero).
- Se monta la cola de destilación y se acopla a esta un matraz de ajuste esmerilado.
- En caso de que fuese necesario, se introduce el matraz colector en un baño de hielo, para facilitar la condensación del destilado.
- Conectamos la toma de vacío.
- Abrimos el manómetro de la bomba de vacío.
- En algunos casos resulta adecuado forrar con papel de aluminio el matraz, y la cabeza de destilación (o adaptador Claisen) para evitar pérdidas de calor.
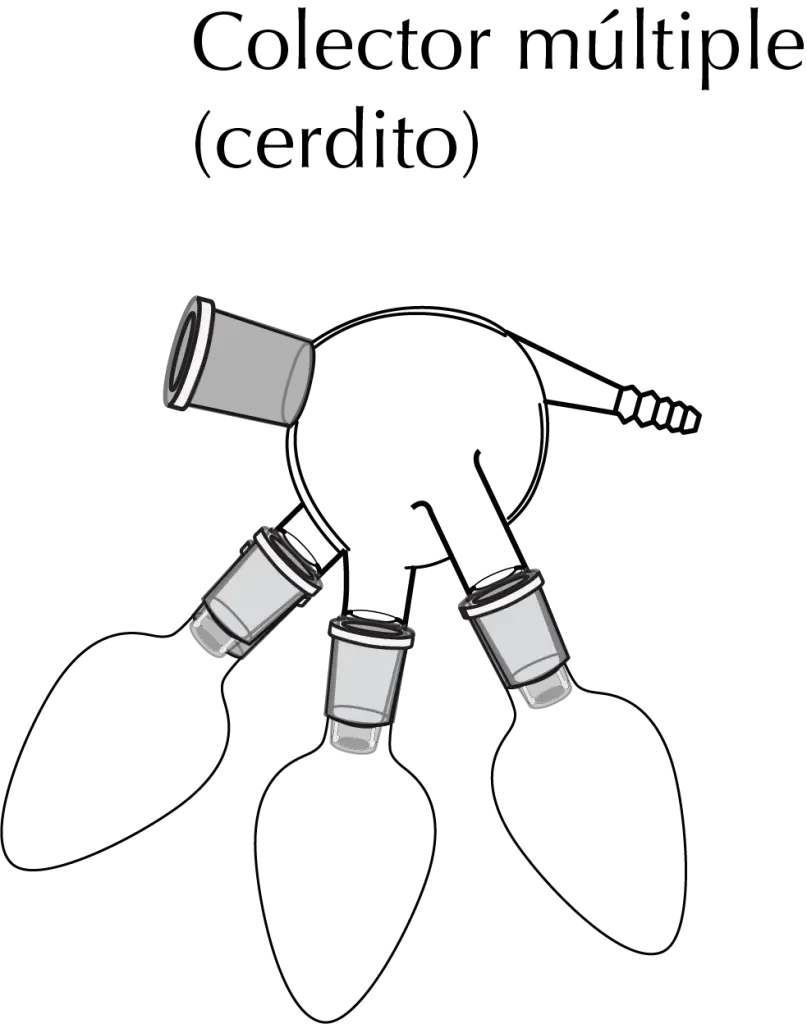
Para destilar una mezcla con dos o más componentes se usa una cola de destilación especial que se denomina cerdito o cola de destilación separador. Presenta por lo general dos o tres ajustes de tipo macho, al que se le conecta a cada uno un matraz redondo de ajuste esmerilado. Girando este adaptador, se van recogiendo las distintas fracciones.
Fundamento de la destilación a vacío
La ebullición de un líquido o disolución comienza cuando su presión de vapor es igual a la presión externa o aplicada (normalmente la presión atmosférica, 760 mmHg). Por lo tanto, si reducimos el valor de la presión externa, el punto de ebullición del líquido también disminuye, como se indica en la Figura.
Esto se debe a que es necesaria una presión de vapor más baja para que el líquido hierva, ya que se lleva a cabo a una temperatura más baja.
Ejemplos
Por ejemplo, el agua produce una presión de vapor de 760 mmHg a 100 ºC, como se muestra en la Figura. Por tanto, el agua hierve al nivel del mar a 100 ºC.
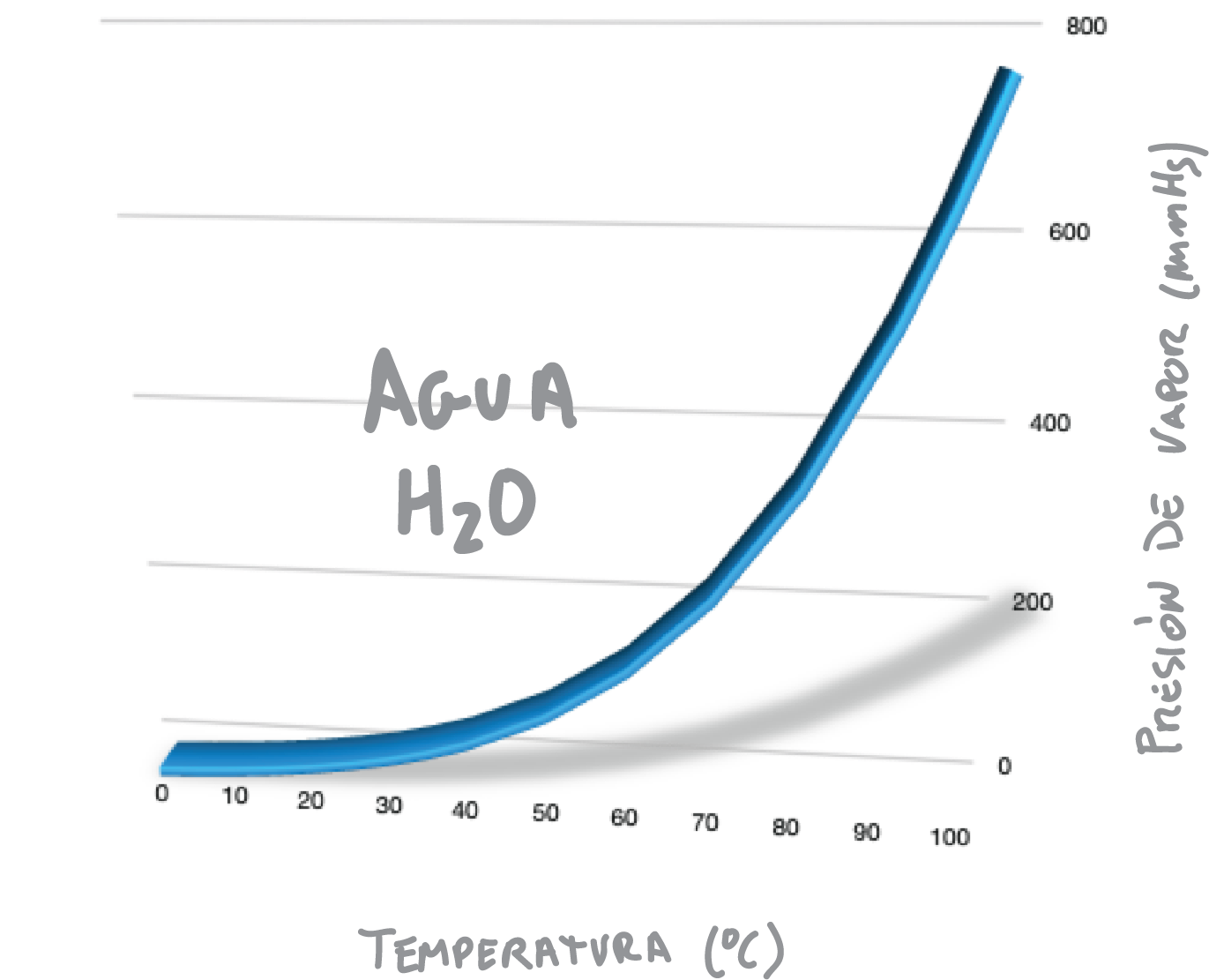
Sin embargo, cuando el agua se somete a un vacío de solo 100 mmHg herviría aproximadamente a 50 ºC, ya que esta es la temperatura que produce una presión de vapor de 100 mmHg (véase Figura). Este comportamiento se explica con la ecuación de Clausius-Clapeyron.
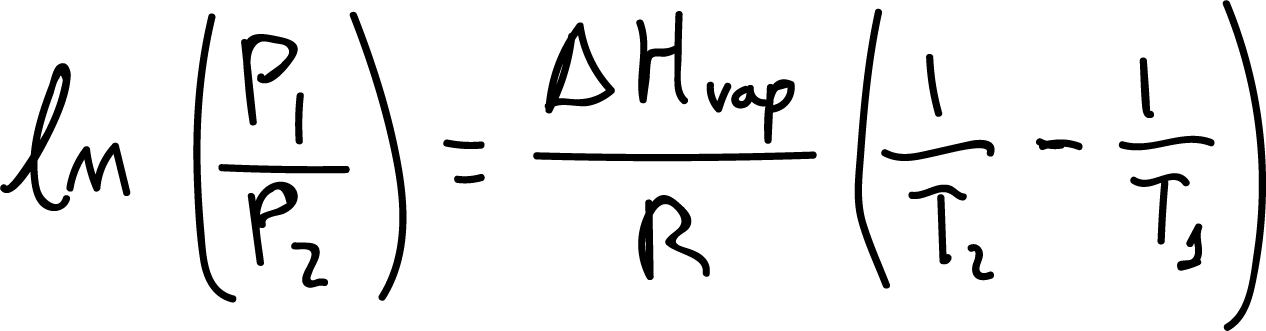
Donde, P1 y P2 son las presiones de vapor a las temperaturas T1 y T2 (en grados Kelvin), respectivamente. ΔHvap es la entalpía de vaporización de la sustancia, y R es una constante igual a 8314 J /mol·K.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
