Índice
Una disolución es una mezcla homogénea en la que el soluto está disperso a escala molecular en un disolvente. No presenta precipitado ni separación de fases a condiciones normales. En una disolución, las proporciones soluto/disolvente pueden variar de un sistema a otro.
Comparación por tamaño de partícula (diámetro efectivo):
- Solución verdadera: < 1 nm (< ~10 Å) → homogénea y estable.
- Dispersión coloidal: 1–1000 nm (~10–10 000 Å) → heterogénea a escala fina; puede requerir microscopía o efecto Tyndall.
- Suspensión: > 1000 nm (> ~10 000 Å) → heterogénea; sedimenta con el tiempo.
Suspensión
Mezcla heterogénea con partículas > 1000 nm; inestable (p. ej., tierra/agua).
Dispersión coloidal
Partículas 1–1000 nm (a menudo llamadas “micelas” o “agregados”). Heterogénea; se observa por efecto Tyndall. Mayor estabilidad; una centrifugación puede acelerar la separación.
Emulsión
Dispersión de líquido en líquido (p. ej., aceite en agua). Si los líquidos son totalmente miscibles (p. ej., etanol/agua), entonces forman una disolución verdadera, no una emulsión.
Convenios para identificar el soluto
- Si hay un líquido con sólido o gas, el líquido suele ser el disolvente.
- Si hay dos líquidos miscibles, el soluto es el que está en menor proporción.
- Si están al 50/50, se considera disolvente el más habitual (p. ej., agua en “metanol/agua”).
Tipos de disoluciones
Existen tres criterios para clasificar las disoluciones:
- Por el numero de componentes de la disolución: binarios si tienen 2 componentes, ternarios con 3 componentes, etc.
- Por su estado físico: una disolución binaria da lugar a 9 disoluciones posibles, tres en estado gaseoso, tres en líquido y tres en sólido.
| Soluto (disolvente) | Ejemplo |
| Gas (gas) | Aire:O2 en N2 |
| Líquido (gas) | Niebla: gotas de H2O en aire |
| Sólido (gas) | Humo: partículas en aire Iodo sublimado en N2 |
Las dos últimas no son disoluciones verdaderas porque no son homogéneas.
| Soluto (disolvente) | Ejemplo |
| Gas (líquido) | O2 / H2O |
| Líquido (líquido) | Gasolina; EtOH / agua |
| Sólido (líquido) | Glucosa / agua |
Si el O2 reaccionase con el agua ya no seria una disolución.
| Soluto (disolvente) | Ejemplo |
| Gas (sólido) | H2 / Pt |
| Líquido (sólido) | Hg / Cu |
| Sólido (sólido) | Cu / Ni; Au / Cu |
Las disoluciones sólidas son aleaciones y se han obtenido en estado líquido por lo que no son verdaderas disoluciones.
- Atendiendo a la composición y naturaleza química de los componentes.
Si los componentes de una disolución tienen naturaleza semejante no existirán interacciones específicas entre ambos por lo que será una disolución ideal.
Ejemplo: CCl4 /SiCl4 o benceno/tolueno
Si la naturaleza es diferente se pueden producir entre los componentes interacciones de tipo atractivo o repulsivo.
Ej. Interacción atractiva en HNO3 / H2O
Interacción repulsiva Et-O-Et / Me-CO-Me
Propiedades coligativas de las disoluciones
Grado de disociación y factor de van’t Hoff
Se denomina grado de disociación iónica a la fracción de moléculas disociadas o el tanto por uno de disociación (α). La relación entre el factor “i” de van’t Hoff y el grado de disociación “α” de un electrolito en disolución permite calcular este ultimo valor.
i > 1 factor de van’t Hoff aumenta conforme lo hace la disolución:
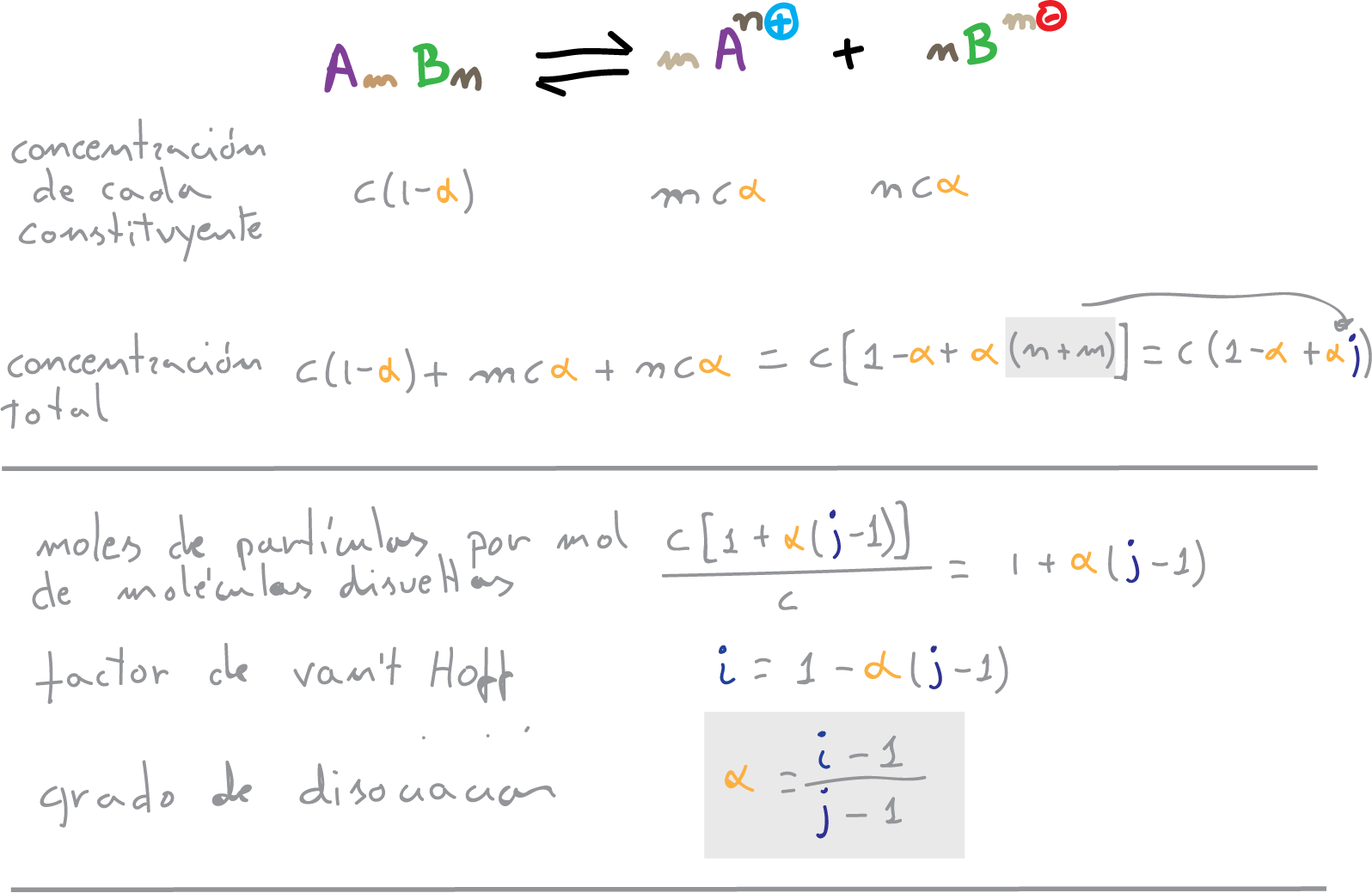
El factor de van’t Hoff será:
i = (c(1-α) + mcα + ncα)/c = 1-α + mα + nα = 1-α + α (m + n)
(dilución infinita i = j)
j = m + n
i = 1 – α + α·j = 1 + α·(j-1)
y el grado de disociación
α = (i-1)/(j-1)
Valores del grado de disociación estándar son los siguientes
α > 0.5 electrolitos fuertes
α < 0.5 electrolitos débiles
por ejemplo para el caso del cloruro potásico:
Actividad vs. concentración (coeficiente γ)
Si en una disolución tenemos una serie de iones, entre estos se van a producir interacciones de tipo electrostático, bien repulsivas o atractivas. Estas interacciones serán tanto más intensas cuanto mayores sean las concentraciones de los iones en la disolución. Ello va a producir que se modifiquen las concentraciones reales de estos iones, o lo que es lo mismo que disminuya el número de partículas efectivas presentes en la disolución.
En estas disoluciones concentradas el coeficiente o factor de van’t Hoff no va a ser un numero entero. Surge entonces la necesidad de distinguir entre concentración y actividad de una disolución, que no tiene que ser proporcional al número de partículas, sino que dependerá de las interacciones que se produzcan en la disolución. Por tanto, la actividad es igual al coeficiente de actividad multiplicado por la concentración.
a = c·γ ⇒ γ= a/c
(1 > γ > 0)
donde a = actividad, c = concentración y γ = coeficiente de actividad. Sólo cuando la concentración es muy diluida, la concentración será igual a la actividad.
Concentración osmolar
La osmolaridad es un concepto relacionado con las disoluciones que indica la concentración osmolar, definida como el número de osmoles por litro de disolución.
Por osmol se entiende el número de partículas en el peso molecular de soluto no disociado.
Ejemplos
- Glucosa (no se disocia) : 1 osmol = 1 mol= 180 gr de glucosa
- KCl (si se disocia): 2 osmoles = 1 mol= 74,5 gr de KCl
Ley de distribución de Nernst
La ley de distribución de Nernst (o ley de reparto de Nernst) fue enunciada por Nernst y explica como se va a distribuir un soluto entre dos disolventes no miscibles. Es un concepto muy utilizado en disoluciones de líquidos inmiscibles.
Si tenemos dos disolventes no miscibles y les añadimos un soluto, este se va a repartir entre ambos de forma que se cumpla que:
“la relación entre concentraciones de soluto (C) en los dos líquidos no miscibles va a ser una constante, independiente de la cantidad de soluto añadido, e igual a la relación entre sus respectivas solubilidades (S)”.
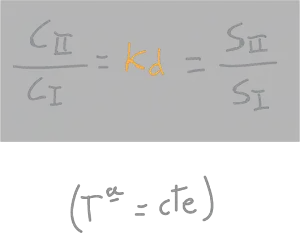
donde Kd es la cte de distribución o de reparto.
Ejemplos
El Iodo es unas 85 veces más soluble en CCl4 que en agua, o lo que es lo mismo podemos tener la misma cantidad de iodo en agua que en un volumen 85 veces menor de CCl4.
Esta propiedad nos permite extraer todo el iodo del agua usando CCl4. A este proceso se le denomina extracción.
¿Cómo se consigue una mayor eficacia en un proceso de extracción?
- Aumentando el número de extracciones.
- Haciendo que los volúmenes utilizados del disolvente extractor (CCl4) sean lo más pequeños posibles.
Iones en sistemas vivos (visión rápida)
Existen una serie de cationes y aniones que se encuentran de forma abundante en los seres vivos:
Cationes: Na+, K+, Mg2+, Ca2+, Fe2+, Fe3+, etc…
Aniones: Cl–, HCO3–, H2PO4–, HPO42-, etc…
Los iones potasio y magnesio se encuentran sobre todo en el liquido celular, mientras que los iones calcio y sodio en el fluido intercelular.
Es necesario también que existan pequeñas cantidades, denominadas trazas, de otros muchos cationes metálicos.
Fe2+ hemoglobina transporte de O2/CO2
Fe2+/Fe3+ citocromos fosforilación oxidativa
Cu2+, Zn2+, Co2+, Mn2+ funcionamiento enzimático
Otros iones no pueden estar en los sistemas vivos ya que provocarían envenenamiento, como el Hg2+ y el Pb2+, ya que reaccionan con los átomos de azufre de las proteínas involucradas en funciones vitales del organismo, perturbándolas e impidiendo que desempeñen sus funciones normales.
Disolución reguladora (pH) ·
Propiedades coligativas ·
Concentración osmolar ·
Ley de distribución de Nernst
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
