Índice
La destilación por arrastre de vapor separa y purifica compuestos orgánicos inmiscibles en agua, sensibles a la temperatura o con p.e. muy altos, aprovechando que la mezcla inmiscible hierve a una temperatura inferior a la de cada componente puro.
Cuándo usar arrastre de vapor
- Compuestos aromáticos, aceites esenciales y volátiles sensibles al calor.
- Muestras con impurezas resinosas o no volátiles.
- Separar disolventes de alto p.e. de sólidos que no se arrastran.
Relacionado:
Destilación simple ·
Destilación fraccionada ·
Destilación a vacío ·
Extracción líquido-líquido
Destilación con fuente de vapor externa
El vapor (habitualmente de agua) se genera aparte y se hace burbujear sobre la mezcla a purificar mediante un adaptador Claisen. Es análogo a un montaje con reactivo gaseoso, pero usando vapor de agua.

Paso a paso (fuente externa)
- Monta matraz con la mezcla, cabeza, condensador y colector; coloca Claisen con tubo de entrada de vapor.
- Genera vapor en un matraz auxiliar y llévalo por tubing resistente al calor hasta el Claisen (burbujeo suave).
- Mantén reposición de agua en el generador y condensación eficiente en el equipo de destilación.
- Recoge el destilado bifásico y separa orgánico/acuoso por extracción L-L.
Destilación con fuente de vapor interna
Se calienta una mezcla de agua + disolvente orgánico inmiscible + soluto. Puede usarse embudo de adición para reponer agua durante el proceso.
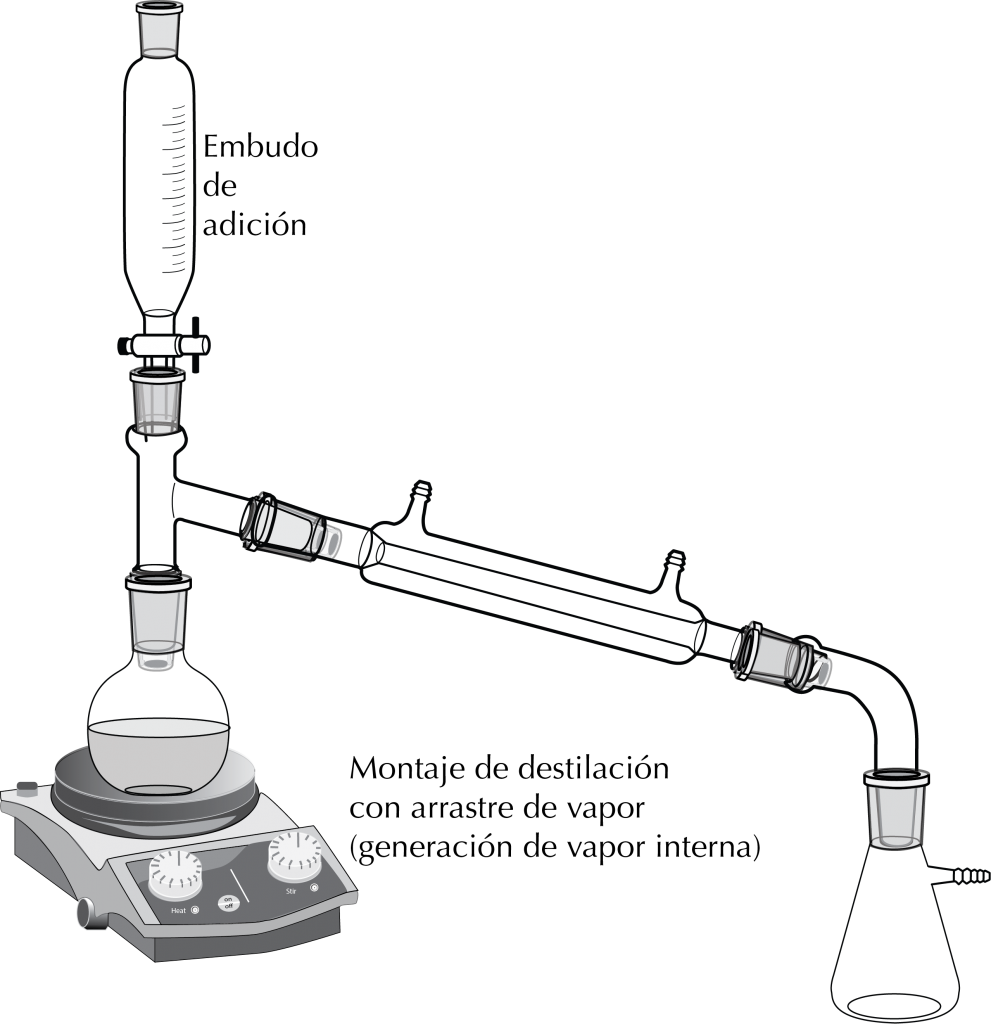
Consejos de operación
- Controla el ritmo de ebullición para evitar arrastres mecánicos.
- Usa trampa si hay riesgo de aspiración hacia vacío.
- Al finalizar, realiza extracción L-L, seca fase orgánica y elimina disolvente.
Fundamento: presión de vapor y ebullición de inmiscibles
En soluciones miscibles rige Ley de Raoult y la Ley de Dalton: P = pA*·xA + pB*·xB. En mezclas inmiscibles, cada componente contribuye con su presión de vapor pura y la presión total es P = pA* + pB*. La ebullición ocurre cuando P alcanza 1 atm, por lo que la T de ebullición conjunta es menor que la de cada componente puro.
A 69,3 °C: p(H2O)=227 mmHg y p(benceno)=533 mmHg ⇒ P=760 mmHg. La mezcla hierve a ~69 °C, muy por debajo de 80,1 °C (benceno) y 100 °C (agua).
Aplicaciones típicas
- Aislamiento de aceites esenciales y terpenos.
- Purgado de resinas y no volátiles de un producto volátil.
- Separación de disolventes de alto p.e. de sólidos no arrastrables.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier. ISBN 978-0-12-803893-2.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
