Índice
¿Qué es un grupo protector?
Un grupo protector es un derivado que bloquea un determinado grupo funcional para que no interfiera en alguna etapa de una reacción química, en el proceso de síntesis de un compuesto. Los grupos protectores que más se utilizan en síntesis orgánica son la protección de grupos alcohol (-OH) y de grupos carbonilo (>C=O).
Ejemplos de grupos protectores
Protección de alcoholes
| Grupo {Tipo} | Protección \ Desprotección | Estable / Incompatible |
Acetato (AcO) CH3COO-R {éster} | CH3COCl / piridina CH3COOH / H3O+ \ hidrólisis ácida o básica | electrófilos, oxidantes, medios ácidos y/o básicos suaves, NaBH4 / ácidos fuertes, bases y nucleófilos organometálicos, LiAlH4 |
Bencilo (BnOR) Ph-CH2-OR {éter} | C6H5-CH2-Br / NaH \ hidrogenación | oxidantes, bases, nucleófilos, reductores / ácido fuerte, H2 /cat, Na/NH3 |
Tritilo (TrO-) (Ph)3C-OR {éter} | (C6H5)3C-Cl / piridina \ medio ácido | bases / ácidos |
TESO- {éter de sililo} | (Et)3Si-Cl / base \ F– o H3O+ | oxidantes, nucleófilos / ácidosa |
TBDMSO- {éter de sililo} | t-Bu(CH3)2Si-Cl / base \ F– o H3O+ | oxidantes, nucleófilos / ácidosa |
TIPSO- {éter de sililo} | (is-Pr)3Si-Cl / base \ F– o H3O+ | oxidantes, nucleófilos / ácidosa |
TMSO- {éter de sililo} | (Me)3Si-Cl / base \ F– o H3O+ | oxidantes, nucleófilos / ácidosa |
Protección de dioles
Los 1,2-dioles y los 1,3-dioles se pueden proteger en forma de acetales (cíclicos o acíclicos). Los más comunes son los isopropiliden derivados (acetónidos) y otra posibilidad son los benciliden derivados.
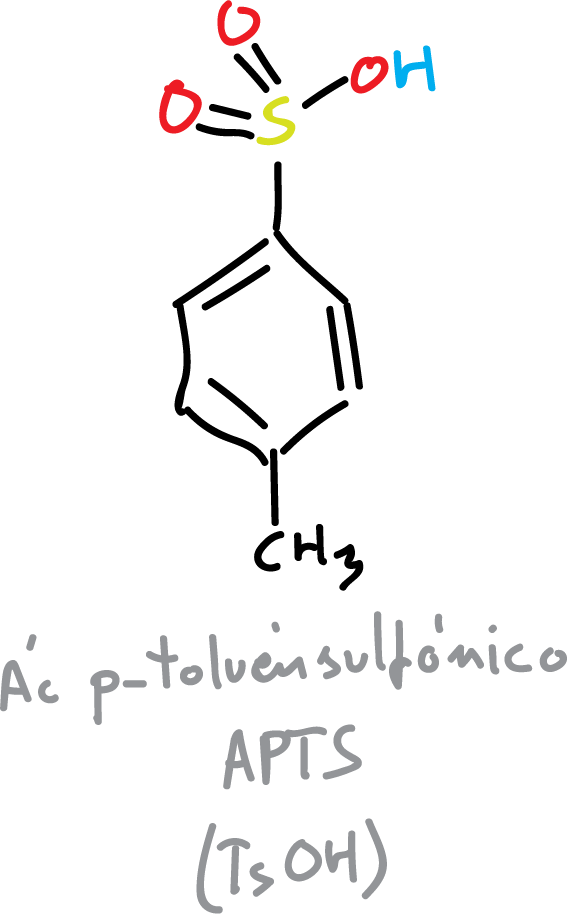
Los acetónidos se van a formar con el diol correspondiente mas la acetona. Se necesita un catalizador ácido para que tenga lugar la reacción, normalmente el ácido para-toluensulfónico (APTS o TsOH).
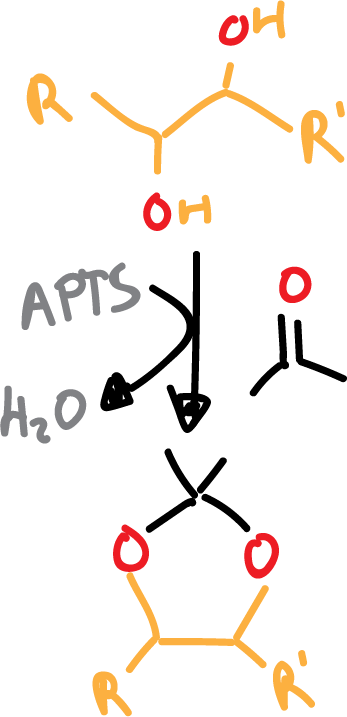
Para que la reacción transcurra correctamente, hay que eliminar el agua del medio.
Otra posibilidad en la que se utiliza benzaldehido en médio ácido (catálisis ácida) en lugar de acetona se indica en el siguiente esquema:
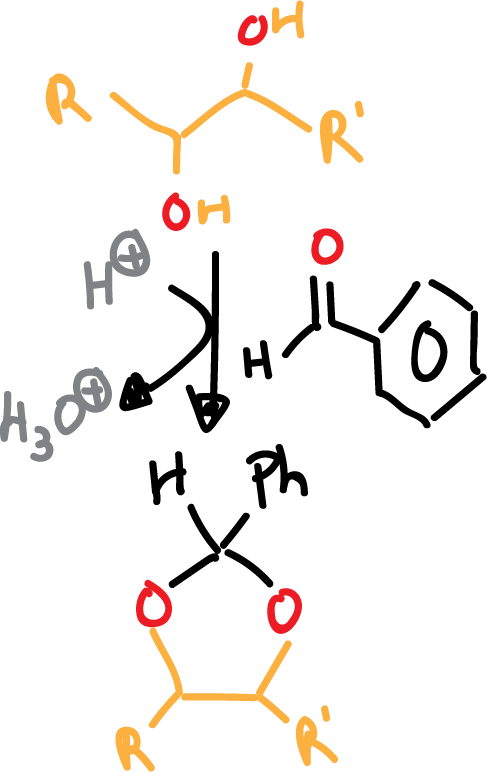
En ambos casos, el paso posterior de desprotección se lleva a cabo en medio ácido acuoso. Los benciliden derivados también se pueden desproteger mediante hidrogenolísis (H2/Pd).
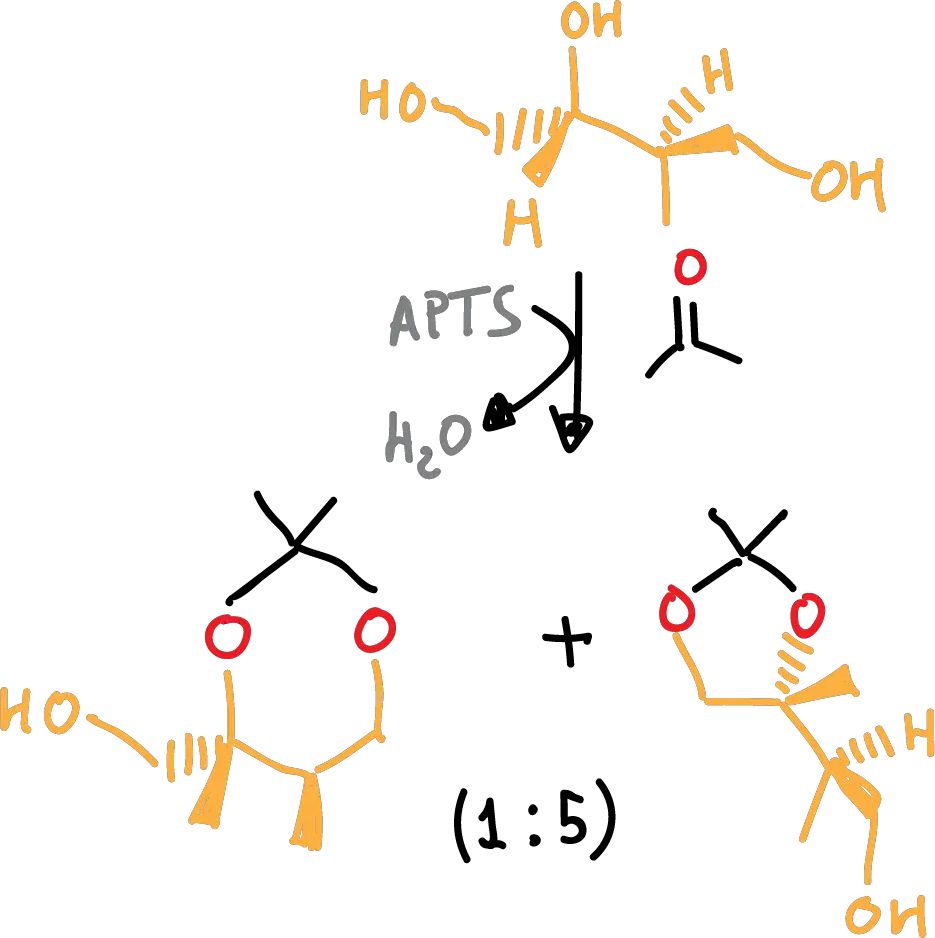
Los acetónidos forman preferentemente anillos de 5 miembros mientras que los benciliden derivados forman preferentemente anillos de 6 miembros.
Por ejemplo, en el siguiente esquema se pone de manifiesto la preferencia de los acetónidos a formar anillos de 5 miembros.
Por otro lado, en este otro ejemplo se ilustra la preferencia de los benciliden derivados a formar anillos de 6 miembros.
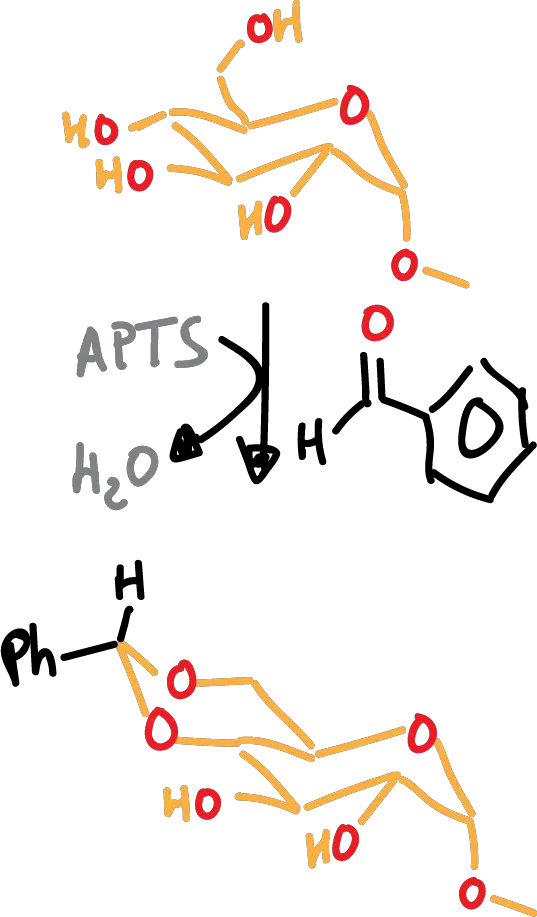
A continuación, se resumen los grupos protectores más frecuentes de 1,2-dioles y 1,3-dioles:
| Grupo {Tipo} | Protección \ Desprotección | Estable / Incompatible |
{acetal} | Benzaldehído / ácido mineral o de Lewis \ hidrogenólisis o hidrólisis ácida, I2 / acetona | Bases, nucleófilos, oxidantes, reductores / medio ácido, halógenos, H2 / cat. |
{acetal} | Acetona / ácido \ hidrólisis ácida I2 / acetona | Bases, nucleófilos, oxidantes, reductores / medio ácido |
Protección de aldehídos y cetonas
Los grupos carbonilo (aldehídos y cetonas) se van a proteger cuando se utilice algún nucleófilo o bien algún agente reductor. De esta manera evitamos que el grupo carbonilo reaccione.
- Formación de cetales o acetales: se suelen formal acetales cíclicos y el reactivo que se utiliza es el etilenglicol en presencia de ácido.
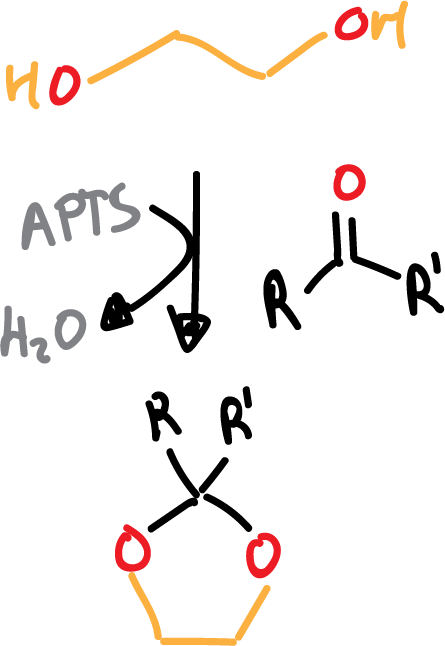
Al igual que en el caso de los glicoles, la desprotección se lleva a cabo en medio ácido acuoso (H2O/H+).
- Formación de 1,3-oxatiolanos: en este caso utilizamos como reactivo 2-hidroxi-1-etanotiol (HS-CH2-CH2–OH) en presencia de trifluoruro de boro, BF3 (ácido de Lewis).
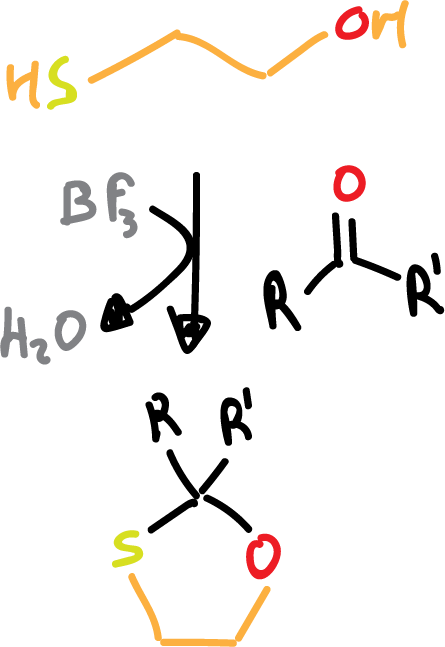
En este caso la desprotección se consigue con Niquel Raney que es un reductor.
- Formación de ditioacetales: en este caso, emplearemos el ditiol HS-CH2-CH2–SH en presencia de un ácido de Lewis.
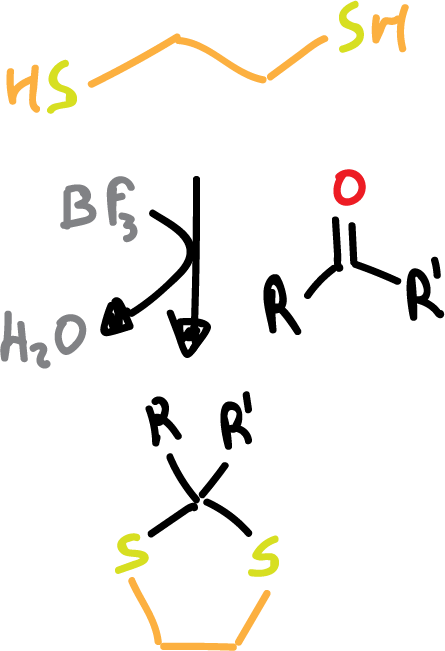
La desprotección se realiza en medio acuoso en presencia de una fuente de Cl+, NO+, o Cu2+ que activa la desprotección. Como se puede observar, la desprotección de estos grupos se puede llevar a cabo selectivamente.
En la Tabla 3, se resumen los grupos protectores más comunes de aldehídos y cetonas.
| Grupo {Tipo} | Protección \ Desprotección | Estable / Incompatible |
RCH(OR’)2 {acetal cíclico o acíclico} | R’OH / H+ \ hidrólisis ácida | bases, nucleófilos, reductores / electrófilos, ácidos |
RCH(SR’)2 {tioacetal cíclico o acíclico} | R’SH / ácido mineral o de Lewis \ sales mercúricas | bases nucleófilos, electrófilos (salvo MeI) / oxidantes, H2/cat, halógenos, perácidos, MeI |
Protección de aminas
Las aminas son nucleófilas y por otro lado el hidrógeno tiene un carácter débilmente ácido y por tanto va a reaccionar con bases.
Si alguno de estas dos características interfieren en la secuencia sintética hay que proteger la amina (secundaria, R2NH, o primaria, RNH2).
Para su protección existen distintas posibilidades:
- Formación de carbamatos o amidas:
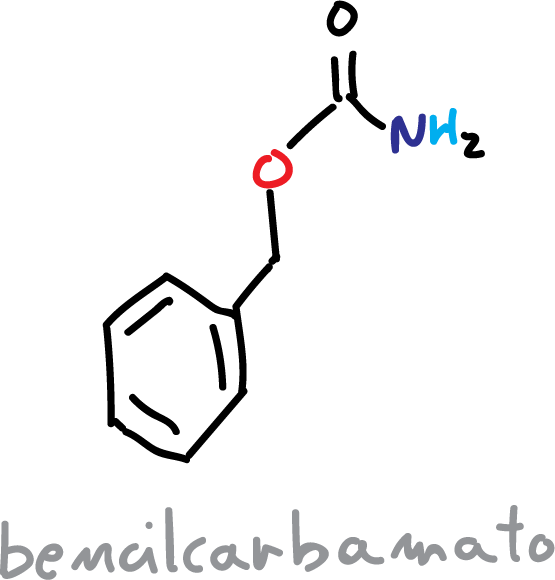
Los carbamatos que se obtienen mas frecuentes son t-butilcarbamato (BOC) o bencilcarbamato (CBz).
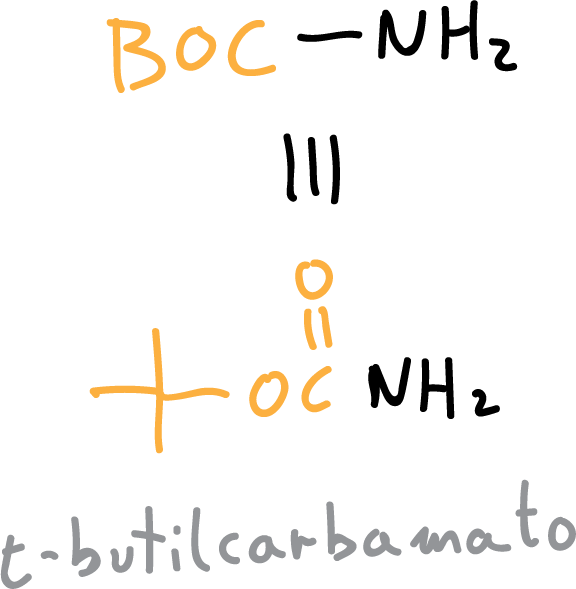
La reacción de protección con BOC procede en medio básico acuoso, se pueden utilizar hidróxido sódico (NaOH) o trietanolamina (Et3N), y transcurre de la siguiente manera:
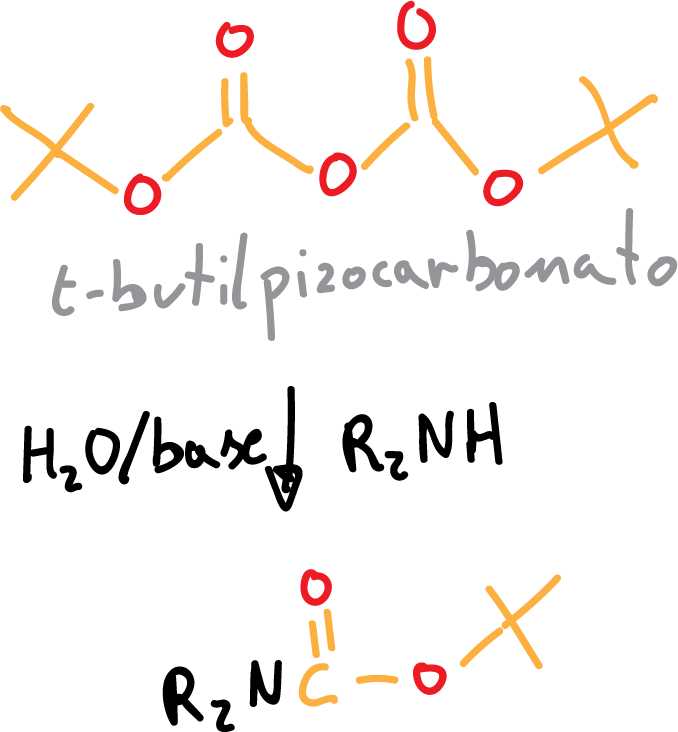
Por otro lado, la desprotección se realiza mediante el empleo de un ácido (APTS, CF3COOH).
Si utilizamos CBz, la reacción de protección se realiza de la siguiente forma:
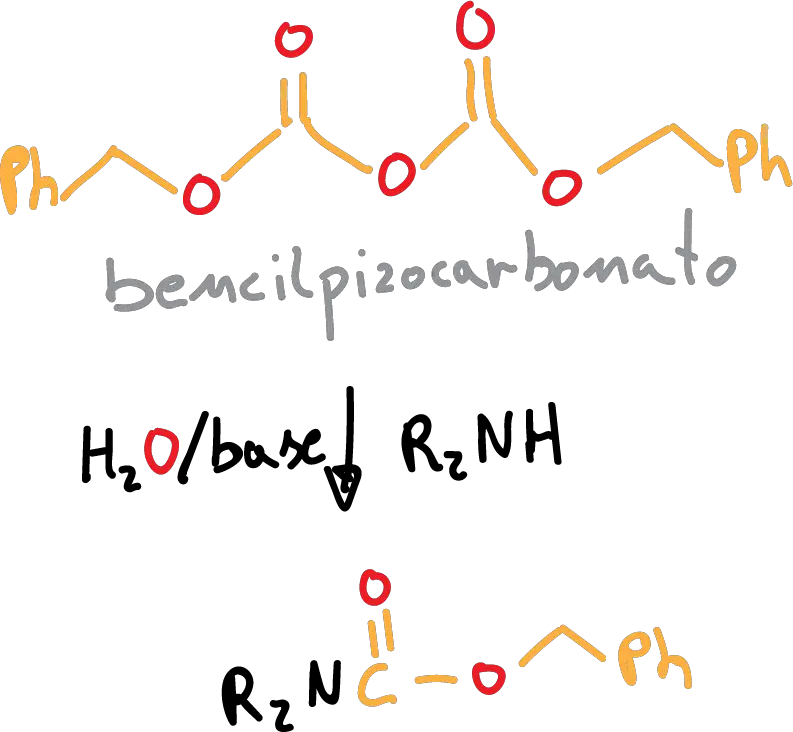
Este grupo se puede desproteger mediante hidrogenolisis (H2/Pd).
- Formación de amidas:
La protección de aminas primarias se puede llevar a cabo en forma de ftalimidas, usando anhídrido ftálico, de la siguiente forma:

La desprotección se realiza con hidracina (H2N-NH2) o bien con borohidruro sódico (NaBH4) en EtOH/agua.
Finalmente, en la Tabla 4 se resumen los grupos protectores más frecuentes de aminas.
| Grupo {Tipo} | Protección \ Desprotección | Estable / Incompatible |
Acetamida AcONHR’ {amidas} | Ac2O CH3COCl / base \ hidrólisis con ácidos fuertes | Electrófilos oxidantes Bases , NaBH4, Hidrogenación / RLi, LiAlH4, LDA |
t-butilcarbamato (BocNHR) RNHOCOt-Bu {carbamato} | Con base \ HCl 3 M o CF3COOH | Bases, oxidantes, reductores nucleófilos salvo RLi, RMgX / ácidos fuertes |
Protección de grupos carboxilo
Se puede realizar la protección de un grupo carbonilo (-COOH) de dos formas: o protegiendo el -OH, o bien protegiendo el carbonilo >C=O.
El hidroxilo (-OH) se protege en forma de ester, mientras que el carbonilo (>C=O) se realiza en forma de oxazolina, a partir del reactivo isobutanol-2-amina.
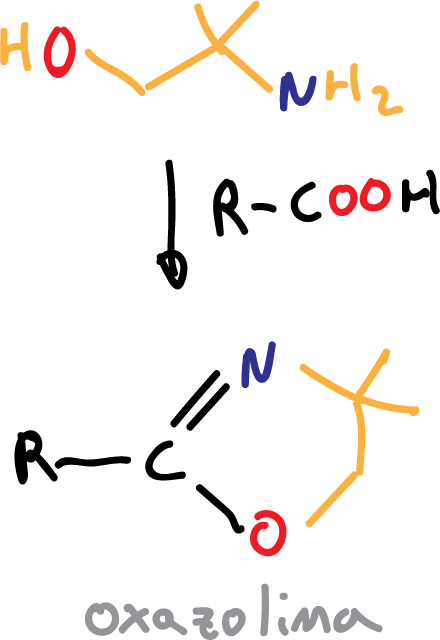
Otro reactivo que se ha utilizado ha sido la 2,2-dimetilaziridina.
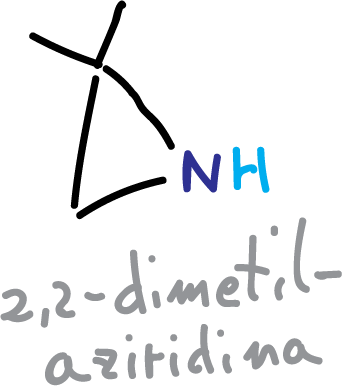
La desprotección se realiza en medio acuoso (H+/H2O).
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
