Índice
¿Que es la reacción de Diels-Alder?
La reacción de Diels-Alder (DA), es la reacción pericíclica por excelencia, también denominada cicloadición [4+2].
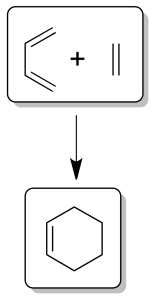
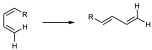
Es una reacción en la que un dieno conjugado se combina con el denominado dienófilo, que puede ser un alqueno o alquino, para dar un aducto cíclico de 6 miembros. El caso más sencillo es la reacción entre el buta-1,3-dieno y el eteno. El dieno aporta 4 electrones π y el dienófilo 2 (π4+π2) como se indica en la figura.
El dieno y dienófilo reacciona por la misma cara de ambos planos moleculares (suprafacialmente) como muestra la figura siguiente:

Veamos un poco su mecanismo de la reacción y a intentar explicar por qué se producen las características más significativas de esa reacción.
Principales características de la reacción de Diels-Alder
Esta reacción presenta una serie de características experimentales que son la siguientes:
La reacción con los reactivos sin substituir, es decir, con el butadieno y el etileno, transcurre a temperaturas moderadas, hay que calentar y poner los reactivos a una cierta presión, pero la reacción transcurre con unas energías de activación que son compatibles con el diagrama de correlación de estados.
- Se observa que si substituimos tanto el dieno como el dienófilo la reacción transcurre más fácilmente sobre todo si estos substituyentes tienen características electrónicas complementarias, es decir, que si ponemos un substituyente electrón donante en uno de los reactivos en el otro a de ser electrón atrayente. Así se conoce reacciones de DA en las que hay substituyentes electrón donantes en el dieno y electrón atrayentes en el dienófilo que son las más normales y se dan muy fácilmente, pero lo contrario también se conoce. Desde un punto de vista mecanístico no existe diferencia entre unas y otras.
- El dieno estará en equilibrio entre la conformación s-cis y la s-trans, siendo la s-trans la más estable. Por tanto, para que la reacción ocurra en dienos acíclicos, éstos deben adoptar mediante rotación del enlace sencillo una conformación denominada s-cis.
![]()
Todo lo que favorezca la conformación s-cis favorecerá también la reacción de DA. Hasta el extremo de que si el dieno no puede adoptar esa conformación, la reacción no se dará.

Y todo lo contrario, si el dieno tiene obligada la conformación s-cis, la reacción se dará muy fácilmente.

El ciclopentadieno es una estructura en la que está obligada ya la conformación s-cis y por lo tanto da reacciones muy fácilmente y por ello es uno de los dienos más utilizados en reacciones de DA.
- Es una reacción pericíclica, ya que la formación del aducto se produce en un solo paso mediante un estado de transición cíclico, en este caso, de seis electrones π.
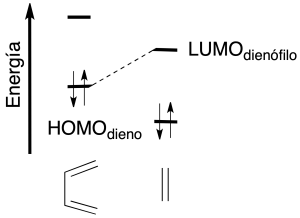
- La reacción tiene lugar por el solapamiento de los orbitales moleculares (OM) más próximos en energía. Esto es, el OM ocupado de mayor energía (HOMO) del dieno y el OM vacío de menor energía (LUMO) del dienófilo.
En dienos y dienófilos convenientemente sustituidos, la aproximación de los reactivos permite dos tipos de aductos: endo y exo, siendo preferente el ataque de tipo endo.
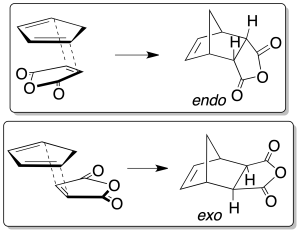
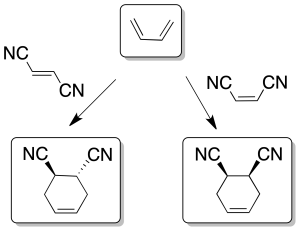
- La reacción es esteroespecífica con respecto a los sustituyentes, tanto en el dieno como en el dienófilo, ya que la estereoquímica relativa cis o trans de los reactivos se mantiene en el aducto.
- La reacción se favorece cuando hay grupos electrón-donante sobre el dieno como -R, -OR, -OSi(R)3, -NH2, etc., (aumentan la energía del HOMO) y electrón-aceptor en el dienófilo como -CHO, -COR, -COOR, -CN, >C=C<, -NO2, -Ph o -X (disminuyen la energía del LUMO). Como resultado, los dos orbitales HOMOdieno y LUMOdienófilo se aproximan más en energía favoreciendo la reacción.
- El impedimento estérico en los átomos directamente implicados en la reacción la ralentiza.
- La reacción de Diels-Alder puede ser intramolecular.
- Los ácidos de Lewis catalizan la reacción.
¿Cómo afectan los sustituyentes a la reacción?
Substituyentes voluminosos en la posición 1 del dieno favorecen la conformación s-trans y por lo tanto retardarán la reacción.
Y todo lo contrario si tenemos un substituyente voluminoso en la posición 2 se puede producir una interacción en la conformación s-trans más fuerte que en la s-cis, y por tanto substituyentes voluminosos en la posición 2 aceleran la reacción.

- En general se observan energías de activación medianas que son compatibles con la pequeña barrera que se observaba en los diagramas de correlación y sobre todo se observan entropías de activación bastante grandes que son compatibles con un ET muy ordenado, lo cual hace pensar que el ET tiene que estar muy ordenado mediante un mecanismo de tipo pericíclico.
- Cuando tanto el dieno como el dienófilo están substituidos se observa una regioquímica característica dependiendo en que posición esté el substituyente. Si el dieno y el dienófilo están substituidos y el dieno lo está en una posición 1 independientemente de las características electrónicas de los substituyentes habrá dos regioquímicas posibles de manera que se obtendrá como producto mayoritario aquel que sitúa los dos substituyentes lo más cerca posible:
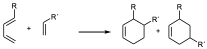
mayoritario
Cuando el substituyente en el dieno está en la posición 2 también se pueden dar dos regioquímicas diferentes pero en este caso el producto mayoritario es aquel que sitúa los dos grupos lo más alejados posibles.
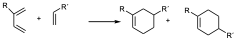
mayoritario
Por esto se habla de que la reacción de DA profiere la orientación orto y para frente a la meta. Asociando la disposiciones 1,2 en los sistemas aromáticos a orto y la 1,4 a para, y 1,3 a meta. Es decir que siempre que puede existir la posibilidad de reactivos substituidos tanto en dieno como en dienófilo se obtendrá preferentemente cuando los dos grupos están lo más cerca posible o lo más lejos posible.
Principales características de la reacción: interacciones HOMO-LUMO
Vamos a tratar de explicar algunas de estas carcterísticas teniendo en cuenta de que se trata de reacciones de tipo pericíclico.
Primero intentaremos explicar el hecho de que se produzca la reacción más fácilmente conforme los substituyentes tengan características electrónicas concretas. Si el dieno y el dienófilo tienen substituyentes con características electrónicas complementarias la reacción se dará más fácilmente. Una de las posibles explicaciones para la reacción es que se produzca la interacción del HOMO de uno de los componentes con el LUMO del otro, y que tanto el HOMO como el LUMO tengan la simetría apropiada, y que esa interacción sea lo más favorable posible. Veamos los orbitales de los reactivos en el etileno y el butadieno sin substituir. Con respecto al elemento de simetría que es el plano que bisecta todos los orbitales tienen esa simetría.

Se puede producir la interacción del HOMO del dieno con el LUMO del dienófilo dando lugar a dos nuevos orbitales de tal manera que los dos electrones se sitúan en el de más baja energía, y por otra parte se puede dar lugar a la interacción del HOMO del dienófilo con el LUMO del dieno que siguen teniendo los dos la misma simetría. Vemos que se producen dos interaciones ambas de igual intensidad, pero teniendo en cuenta que la interacción se está produciendo entre niveles de muy distinta energía.
Supongamos ahora que de las dos posibilidades que hemos dicho, la del dieno con un substituyente electrón donante y el dienófilo con electrón atrayente. Si esto es así, si a un sistema diénico si le estamos dando más electrones, lo que hacemos es poner en exceso el número de electrones del sistema y por lo tanto estamos elevando la energía de cada uno de esos niveles, por ello los niveles energéticos del sistema π del dieno estarán elevados en energía con respecto a los anteriores, tanto los niveles ocupados como los virtuales. Por otro lado si al dienófilo le ponemos un substituyente electrón atrayente, será un sistema π al cual se le están retirando electrones, y por tanto estamos estabilizado el sistema π, lo estamos rebajando en energía. La simetría sigue siendo la misma.
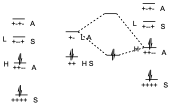
El resultado de este proceso es que el HOMO del dienófilo y el LUMO del dieno se separan mucho en energía, pero por el contrario el HOMO del dieno y el LUMO del dienófilo se acercan mucho de tal manera que antes se podían producir dos interacciones pequeñas porque las diferencias de energía eran muy grandes. Pero aquí como la diferencia de energía es pequeña se producirá sólo una interacción pero muy estabilizante y por tanto se produce la reacción con una energía de activación menor y por eso se da más fácilmente.
Lo mismo podríamos haber hecho cambiando los substiuyentes electrón donantes y electrón aceptor en el dieno y en el dienófilo, de manera que tendríamos que se produciría una interacción entre el HOMO del dienófilo y el LUMO del dieno.
El hecho es que las dos posible interacciones se produce una sola pero esa sola es mucho más estabilizante que las dos que se producían antes.
Vamos a considerar que tenemos el dieno con un substituyente electrón donante en la posición 1 y el dienófilo electrón atrayente.
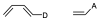
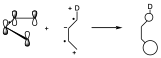
Vamos a ver porqué se favorece la regioquímica que hemos visto. Se va a producir la interacción entre el HOMO del dieno y el LUMO del dienófilo. Vamos a ver la forma cualitativa de esos orbitales moleculares par ver como puede producir la interacción. El HOMO del dieno es un orbital donde hay un nodo en el centro.

Si tenemos un substituyente unido en la posición 1 y que es electrón donante, un sistema diénico con un exceso de carga lo podemos asociar al anión pentadienilo, es decir, el anión pentadienlilo sería el extremo si consideramos ese substituyente electrón donante es una carga negativa neta.

Si tenemos el sistema pentadienilo, anión, el HOMO será el tercero puesto que tendremos tres niveles ocupados. El HOMO nos sitúa las ocntribuciones de cada átomo de esta forma.
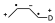
Si hacemos una combinación de esto con lo de antes, obtendremos una contribución pequeña en el primer átomo y otra grande en el cuarto independientemente de lo que ocurra en los átomos 2 y 3 puesto que serán los extremos que interaccionen con el dienófilo.
Por otro lado el sistema de 2 electrones es un doble enlace con un substituyente electrón atrayente, de manera que es el LUMO de este sistema el que interaccionan con el HOMO del dieno. El sistema que podemos equiparar a un doble enlace ocn un substituyente electrón atrayente es el catión alilo en su extremo máximo. El catión alilo tendrá la siguiente forma:
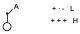
Por tanto vamos a tener que en el orbital LUMO va a haber una contribución nula en un átomo y otra grande en otro.
Por tanto independientemente de los signos, que se pueden cambiar, las formas cualitativas del HOMO del dieno y el LUMO del dienófilo, son esas dos.
Las dos interacciones posibles que se pueden producir son aquellas que hacen que el lóbulo pequeño interacciones con el pequeño y el grande con el grande o bien si obtenemos la otra regioquímica, sería el grande con el pequeño y el pequeño con el grande.

La interacción que se dará preferentemente será aquella en la que se produzca el máximo solapamiento que será la primera. El solapamiento efectivo de esa regioquímica es mejor que la segunda.
¿Cómo sería cuando tengamos un substituyente electrón donante en el dieno en la posición 2, y un substituyente electrón atrayente en el dienófilo?
Hay que considerar la mezcla del HOMO del dieno (que es el que va a actuar) con el sistema anión alilo.
Resumen de interacción HOMO-LUMO
A través del estudio y análisis de los orbitales moleculares HOMOdieno y LUMOdienófilo, es posible predecir la orientación del ataque entre los reactivos y, por tanto, la posición de los sustituyentes en el aducto que se obtiene en mayor proporción.
Para ello se pueden tener en cuenta las siguientes consideraciones:
- Los sustituyentes en dienos y dienófilos modifican el tamaño de los orbitales HOMO y LUMO.
- La gran mayoría de los sustituyentes en posición 1 del buta-1,3-dieno aumentan el tamaño del HOMOdieno en la posición 4.
- La mayoría de los sustituyentes en posición 2 del buta-1,3-dieno, aumentan el tamaño del HOMOdieno en la posición 1.
- Los grupos electrón-atrayente sobre el dienófilo aumentan el tamaño del LUMOdienófilo en la posición 2.
- La orientación del ataque es la que favorece el máximo solapamiento de orbitales (interacción con orbital grande-grande y pequeño-pequeño).
Video sobre la Reacción de Diels-Alder
Referencias
O. Diels, K. Alder, Justus Liebigs Ann. Chem. 460, 98 (1928)
O. Diels, K. Alder, Justus Liebigs Ann. Chem. 470, 62 (1929)
O. Diels, K. Alder, Chem. Ber. 62, 2081 (1929)
O. Diels, K. Alder, Chem. Ber. 62, 2087 (1929)
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.

