Tabla de contenidos
¿Qué son las reacciones electrocíclicas?
Las reacciones electrocíclicas se caracterizan por la apertura o cierre de un anillo dentro de una sola molécula mediante la interconversión de enlaces σ en π o viceversa.
Ejemplos típicos de reacciones electrocíclicas son:

Esto sería un catión alilo deslocalizado entre los tres centros.
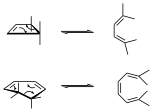
Donde también podemos hacer un símil de las flechas y lógicamente eso son equilibrios de manera que las reacciones se dan en ambas direcciones.
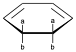
En todos los casos, lo que tenemos en el estado de transición es un bucle cíclico de electrones interaccionantes donde están participando electrones π y σ, pero en el estado de transición los enlaces σ y π van perdiendo su sentido porque lo que nos queda es un intermedio entre ambos:
![]()
Si nos fijamos aquí también podemos tener 2 substituyentes por debajo del plano del anillo y otros 2 por encima, y en el proceso de apertura o cierre, el enlace entre los carbonos que forman el carbono σ se rompe y pasan a ser carbonos sp2.
Esto implica que serán planos, y por lo tanto los substituyentes que originalmente estaban unidos a esos carbonos en el proceso de apertura o cierre, tienen que girar a lo largo de esos enlaces para que esos substituyentes que estaban por debajo o por encima del plano pasen a estar en el plano.
Es decir, que en el proceso de apertura o cierre se tiene que ir produciendo simultáneamente un proceso de giro a lo largo de los enlaces que pasan a ser enlaces π.

Entonces, la estereoquímica de las reacciones electrocíclicas se caracteriza por el sentido de giro de esos enlaces.
Ejemplos
Veámoslo con un ejemplo. Supongamos la siguiente molécula:
Puede producirse la rotura de ese enlace de manera que el giro sobre esos enlaces se de hacia el mismo lado, entonces hablamos de que es una rotación conrotatoria, donde giran ambos enlaces hacia el mismo lado. Por tanto, tendremos una representación del estado de transición donde vemos que los dos van yéndose hacia el mismo lado y entonces uno de los a queda hacia dentro y otro hacia fuera e igualmente para los b.
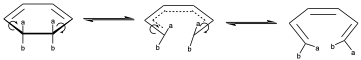
También puede darse otro giro conrotatorio en el sentido contrario que se distinguirá del anterior si los substituyentes son distintos. O bien, producirse un giro disrotatorio, en el cual ambos enlaces giran en sentido contrario.
Y esto va a dar lugar a una representación del ET que evoluciona posteriormente al producto de la reacción con los dos a hacia un lado y los b hacia otro.
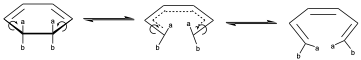
En este caso los productos si pueden ser diferentes cuando se produzca otro movimiento disrotatorio cuando giren los dos en sentidos contrarios.
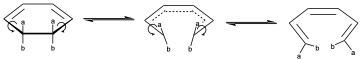
Entonces un movimiento conrotatorio o disrotatorio implica una esteroquímica determinada dependiendo de los substituyentes que pueden tener una configuración determinada sobre los carbonos de los productos de la reacción puesto que si a es más o menos prioritario que b dará lugar al isómero E o Z. Como ya dijimos es útil tratar de ver el que todas la reacciones pericíclicas son casos particulares de cicloadiciones, para lo cual hay que tratar de asociar la estereoquímica antara o suprafacialmente para los distintos tipos de enlaces o de sistemas electrónicos que pueden interaccionar.
Definición de supra antara en sistemas σ
Hemos visto la esteroquímica en sistemas π, cuando era suprafacial o antarafacial, pero en las reacciones electrocíclicas no sólo intervienen sistemas π sino que también intervienen sistemas σ y entonces puede que merezca la pena que seamos capaces de definir una estereoquímica supra o antara para los distintos tipos de sistemas.
Así, cualquier sistema π tenga la longitud que tenga supra es cuando intervienen por arriba o por debajo:
![]()
Y antara cuando intervienen simultáneamente por arriba y por debajo:
![]()
Un enlace σ lo podemos representar como la interacción de dos orbitales híbridos sp3 o sp2 mediante una interacción de este tipo:
![]()
Entonces un enlace σ también puede intervenir supra o antarafacialmente, hay que tener en cuenta que la interacción supra o antara implica mucho sobre la simetría del sistema y de los signos de los lóbulos que intervienen, pero sobre un sistema σ una interacción supra es aquella que se produce sobre lóbulos del mismo signo, mientras que una interacción sobre uno de los lóbulos grandes y otro de los pequeños es un caso de interacción antara. También se puede considerar un único orbital p que puede interaccionar también supra o antara, de manera que para que se produzca una interacción supra tiene que darse dos interacciones por uno de los lóbulos, mientras que en una antara se produce simultáneamente por un lóbulo y por el otro.
![]()
Definición de reacción electrocíclica como una cicloadición
Estamos tratando de ver que las reacciones electrocíclicas se pueden considerar como un caso particular de cicloadiciones. Supongamos una reacción electrocíclica en un sistema de 6 miembros en el que vamos a tener por una parte el orbital σ y tenemos el sistema diénico con sus orbitales π correspondientes.
![]()
Ya vimos que hay 2 posibilidades de estereoquímica, ya que al romperse ese enlace se tiene que producir un giro a lo largo de los otros para que se pueda formar el trieno y que solapen los lóbulos el enlace σ con el sistema π.
Una posibilidad es un movimiento disrotatorio de tal manera que se ve el tipo de interacción que se producirá.

Igualmente, los lóbulos pequeños interaccionaran por la parte de abajo. Por tanto, un movimiento disrotatorio nos obliga a decir que en el sistema σ interaccionan ambos lóbulos del mismo signo y el sistema π interacciona con los 2 lóbulos del mismo lado.
Por lo, tanto esta reacción electrocíclica se puede considerar que es una cicloadición de un sistema σ con dos electrones que interaccionan de forma suprafacial con un sistema π de 4 electrones también suprafacialmente.
Si tenemos substituyentes, tendrán la estereoquímica adecuada de acuerdo con el procedimiento disrotatorio. Si lo que se produce es un movimiento conrotatorio:

Al girar en el sentido de la figura, los lóbulos interaccionan de esa manera, por lo que esta reacción se considera también como σ2s puesto que interaccionan dos lóbulos del mismo signo mas π4a puesto que el sistema π por una parte interacciona por la parte de arria y por otra por la de abajo. También, se puede considerar ese mismo movimiento conrotatorio si nos fijamos que al moverse hacia arriba el lóbulo pequeño de la izquierda puede interaccionar con la parte de arriba y en la derecha el grande lo hace también con la parte de arriba. En este caso tendríamos una interacción σ2a+π4s.

La reacción es la misma ya que el movimiento es conrotatorio sobre el mismo sistema y da los mismos productos, sin embargo, se puede considerar de dos formas distintas.
Esas dos reacciones son totalmente equivalentes. Si nos fijamos las reacciones electrocíclicas se pueden considerar como un ejemplo de reacciones de cicloadición en la que los orbitales que interaccionan no tienen porqué pertenecer a moléculas distintas, sino que pueden pertenecer a la misma molécula y la interacción no está limitada a orbitales de tipo π sino que pueden interaccionar también orbitales de tipo σ. Lo interesante es que en todas estas reacciones se produce un ET con un bucle cerrado de electrones interaccionantes.
Particularidades de las reacciones electrocíclicas
Las reacciones electrocíclicas, al igual que en las cicloadiciones, se observan ciertas preferencias de una esteroquímica de acuerdo con el número de electrones que intervienen en la reacción. De tal forma que cuando el número de electrones es 2 siempre se obtiene estereoquímica disrotatoria, mientras que si el número de electrones es 4 la estereoquímica es conrotatoria.
Cuando el número de electrones es 6 vuelve a darse estereoquímica disrotatoria y así sucesivamente.
Es decir, que al igual que en el caso de las reacciones de cicloadición, cuando cambiamos el número de electrones (aumentando o disminuyendo en dos) la estereoquímica cambia, y esto se invierte cuando las reacciones se realizan fotoquímicamente, es decir, que en el estado excitado la estereoquímica preferida con dos electrones es la conrotatoria y al contrario termicamente. Vamos a ver ahora que las reacciones de transposición sigmatrópica también son un ejemplo particular de cicloadiciones.
Supongamos una transposición [1,5] en la que tenemos un sistema π de 4 miembros y tenemos un enlace σ en el que va a transponer a lo largo de un sistema π.

Por lo tanto podemos tener dos tipos de transposición de acuerdo con la esteroquímica en la que intervenga el grupo que migra, si por ejemplo tenemos una transposición en la que ese grupo migra a la otra posición, lo hace manteniendo la estereoquímica de ese centro.

Entonces esa reacción en realidad es una cicloadición en la que interviene un orbital σ con 2 electrones y un orbital π con 4 electrones.
De tal manera que en el orbital σ intervienen los 2 lóbulos del mismo signo y por tanto será una interacción σ2s+π4s (2 lóbulos del sistema π de abajo). Pero también se podría producir una interacción en la que en lugar de producirse la interacción de ese mismo lóbulo al romperse el enlace se podría ir produciendo la interacción con el lóbulo de debajo de manera que podríamos tener una situación intermedia

Donde ese grupo al ir migrando se iría transformando de un orbital sp3 a un orbital p de manera que en esa situación intermedia tendríamos algo intermedio entre los dos tipos de orbitales que estaría interaccionando con una parte y con otra del sistema π.
Si nos fijamos en ese centro se produce inversión de la configuración, es algo muy similar a un estado de transición de tipo SN2 en el que se tiene que producir inversión de la configuración en el carbono que sufre la substitución.
Esa será una interacción lógicamente σ2a+π4s. En reacciones en el estado fundamental, se observa que hay reacciones sigmatrópicas que se dan y otras que no. Por ejemplo, estas reacciones [1,5] ocurren con retención de la configuración en el carbono que migra, lo cual indica que debe ser una reacción σ2s+π4s.
Sin embargo, en el estado excitado se observa inversión de la configuraciónen el grupo que migra.
Lo que indica que el grupo que migra lo hace con inversión de la configuración, por lo que ese orbital sinteracciona de una manera antarafacial.
Siempre que se produce una interacción antara debe de estar asociada a una inversión de la configuración en algún centro quiral de los que se forman o de los que intervienen en la configuración. Por tanto, vemos que siguen siendo ejemplos particulares de reacciones de cicloadicón y además se sigue cumpliendo lo que habíamos dicho para reacciones de cicloadición y reacciones electrocíclicas.
En general, las reacciones pericíclicas cumplen las condiciones que hemos dicho. Transcurren o no de acuerdo con el número de electrones, y cuando se dan la estereoquímica está también definida por esto. Además, todas estas reglas cambian cuando pasamos del estado fundamental al estado excitado.
Resumen
Se caracterizan por la apertura o cierre de un anillo dentro de una sola molécula. La estereoquímica de estas reacciones fue desarrollada por Woodward y Hoffmann, constituyendo el primer logro de la simetría orbital. Se pueden identificar dos tipos de cierre de anillo.
- Conrotatorio: los orbitales p del sistema de electrones π giran en la misma direación para formar el enlace σ.
fig-41
- Disrotatorio: los orbitales p del sistema de electrones π giran en dirección opuesta.
fig-42
Las reglas de Woodward y Hoffmann establecen cual es el tipo de cierre preferido y predicen la estereoquímica del producto. Esta estereoquímica viene determinada por el número de electrones π del sistema abierto, y si la reacción viene dada en el estado fundamental (térmica), o en el estado excitado del polieno (fotoquímica). Si consideramos el 2,4-hexadieno
fig-43
O sea que la estereoquímica va a depender del tipo de cierre, y esto dependerá de que la reacción se lleve a cabo mediante calor o luz. Si consideramos el estado fundamental de un dieno conjugado, como, por ejemplo, el butadieno, de los dos procesos de cierre térmicos (butadieno en estado fundamental) se daría sólo el proceso conrotatorio del orbital HOMO debido a que acaba en interacción enlazante de los orbitales de los extremos.
fig-44
Si la reacción transcurre fotoquímicamente, al absorber luz el butadieno pasa a su estado excitado y el orbital que reacciona es el LUMO. En este caso el cierre permitido por simetría de orbitales es el proceso disrotatorio donde ocurre interacción enlazante de los orbitales de los extremos.
| nº e– π | reacción | movimiento |
| 4n | térmica | conrotatorio |
| 4n | fotoquímica | disrotatorio |
| 4n+2 | térmica | conrotatorio |
| 4n+2 | fotoquímica | disrotatorio |
Por ejemplo, el hexatrieno presenta 6 electrones π (4n+2=6, para n=1) y el mecanismo permitido térmicamente seria el disrotatorio, mientras que fotoquímicamente se da el conrotatorio.
fig-45
