Índice
Concepto de oxidación-reducción
En un principio estos procesos se entendían de la siguiente forma:
Oxidación: adición de oxígeno a una sustancia.
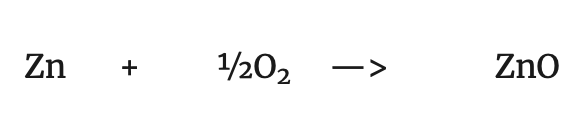
Reducción: Perdida de oxígeno de un compuesto, produciéndose una reducción de masa:
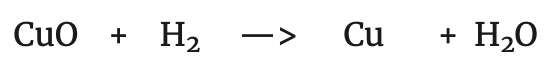
Si se compara la reacción del zinc en el primer proceso con la siguiente:
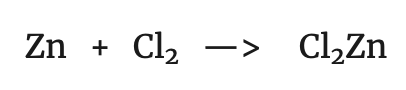
Se observa que en ambas ha tenido lugar la siguiente transformación:
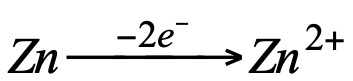
Es decir que el Zn ha perdido dos electrones. Por otra parte, si comparamos la reacción del cobre con la siguiente:
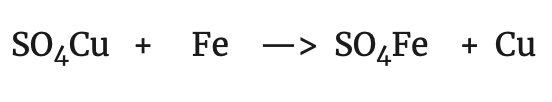
observamos que en ambos casos el cobre ha experimentando el mismo cambio:
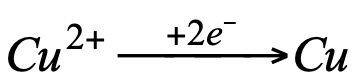
es decir, el cobre ha ganado dos electrones. A la vista de estas observaciones, se estableció un nuevo concepto de oxidación y reducción:
- Oxidación: Proceso en el cual se pierden electrones.
- Reducción: Proceso en el cual se ganan electrones.
Puesto que los electrones no existen libres, para que una sustancia gane electrones ha de existir otra que los pierda, es decir, ambos procesos redox van unidos.
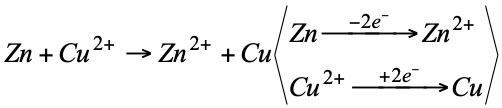
El Zn se oxida (reductor)
El Cu2+ se reduce (oxidante)
- Oxidante: Es una sustancia que se reduce fácilmente, ya que acepta con facilidad electrones de otro, el cual, al perderlos se oxida.
- Reductor: Es una sustancia que se oxida con facilidad, ya que los electrones que pierde se los cede a otro, que al tomarlos, se reduce.
No puede tener lugar una reacción de oxidación sin que exista otra de reducción o viceversa. A estos sistemas de oxidación-reducción se les denomina “sistemas redox”. Para identificar de manera sencilla si una reacción es o no redox deberemos familiarizarnos con el concepto de número de oxidación.
En un sistema redox podemos distinguir dos semireacciones:
a) Reducción del oxidante (X):
b) Oxidación del reductor (M):
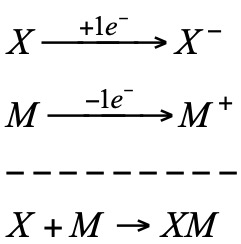
En el proceso redox hay una transferencia electrónica desde el reductor al oxidante. Esta transferencia puede tener lugar sin la necesidad de que los reaccionantes estén en contacto directo bastando una adecuada conexión eléctrica entre los mismos.
En muchos casos, la reacción está casi totalmente desplazada en uno de los sentidos. Si una sustancia se comporta como un oxidante fuerte (1) su forma reducida (1) será un reductor débil; por el contrario un reductor fuerte (2) tendrá una forma oxidada (2) que será un oxidante débil:
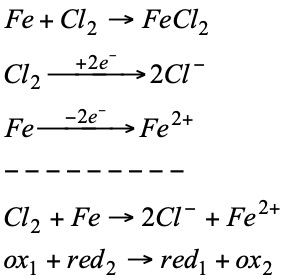
Ajuste de una reacción redox por el método del ión electrón
En primer lugar se procede a separar la ecuación redox en dos ecuaciones parciales:
- Se escribe la fórmula del oxidante (ión o molécula) y a continuación su producto de reducción (iónico o molecular).
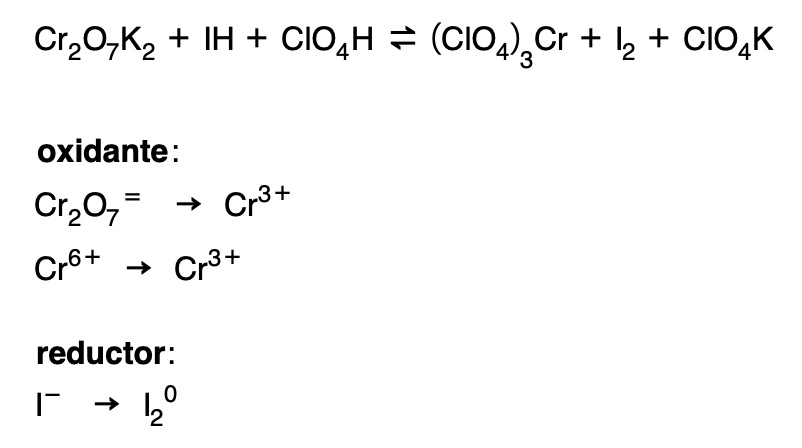
2. Introducimos los coeficientes mínimos necesarios para igualar átomos del elemento característico:

3. Si la forma reducida tiene menos oxígeno, se introduce en forma de agua en el segundo miembro:

Añadiendo los H+ necesarios en el primer miembro:
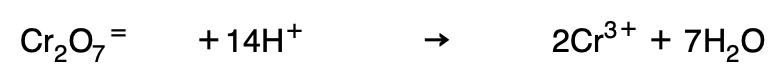
4. Igualar la reacción eléctricamente (se introducen electrones suficientes en el primer miembro), y una vez igualada se sustituye la flecha por el signo igual.
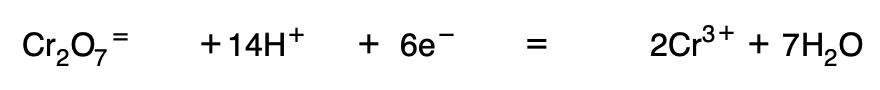
5. Se repite el mismo proceso pero esta vez para el reductor, pero ahora se añadirían H2O si es necesario en el primer término, y en el segúndo termino aparecerían los H+ y los electrones:
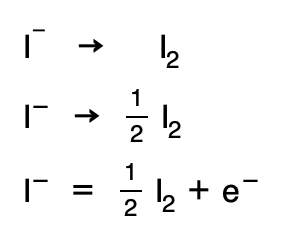
6. Se multiplican por los coeficientes mínimos necesarios para que el número de electrones se iguale:
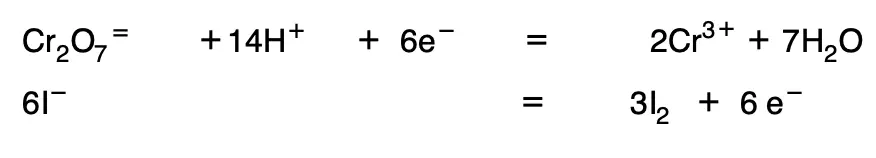
A continuación se suman las dos ecuaciones y se agrupan las moléculas de agua y de H+.
- Si en la ecuación final quedasen en el segundo miembro H+ se añaden ambos miembros un número igual de HO– para que los H+ se conviertan en H2O. En tal caso la reacción tendrá lugar en medio alcalino, por lo que la oxidación del reductor tendrá lugar mediante HO–.
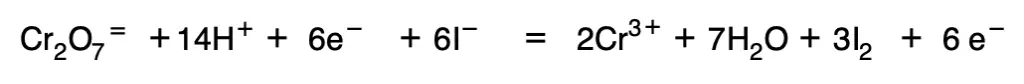
8. Se introducen iones que no sufran cambio en su número de oxidación:
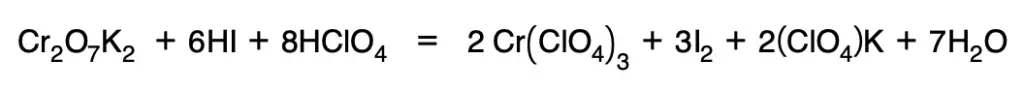
Volumetrías redox. Equivalente de un oxidante o de un reductor
Se llama peso equivalente, masa equivalente o equivalente de un oxidante o de un reductor a la cantidad de una sustancia que gana o cede un electrón. Se calula con la siguiente expresión:
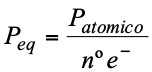
Por ejemplo:
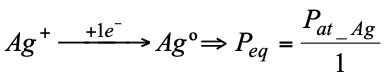
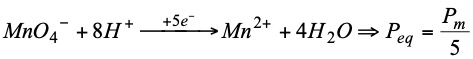
Hay que recordar que:
- El equivalente redox sólo es aplicable cuando la sustancia interviene en procesos de este tipo.
- Las condiciones en que se producen las reacciones influyen en la naturaleza de los productos finales y por tanto en el número de electrones transferidos. Por ello para determinar el equivalente redox es necesario no sólo conocer el producto de partida sino también el que se obtiene:
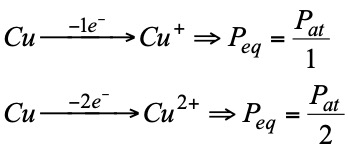
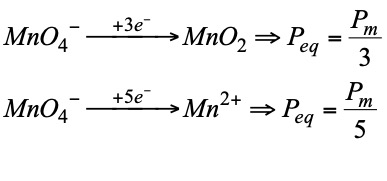
La normalidad de las sustancias oxidantes o reductoras: se obtiene de igual forma que para las demás, pero empleando el concepto de equivalente que acabamos de ver.
Por ejemplo:
Ejercicio: Calcular la cantidad de dicromato potásico que hay que pesar para preparar 1 litro de disolución 0.1 N cuando dicha sustancia se va a reducir a ión Cr3+. ( Cr 52; O 16; K 39)
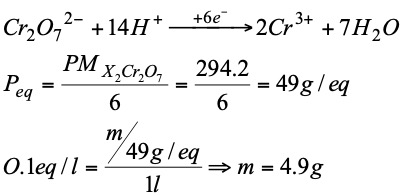
Las volumetrías redox consisten en aprovechar estas reacciones para determinar la concentración de alguna de ellas.
Ejemplo: supongamos que tenemos una muestra de 25 cm3 de una disolución de Fe2+ y queremos saber cual es el contenido en Fe2+ de esa disolución. Se colocan en el Erlenmeyer los 25 cm3 de la disolución de Fe2+ a valorar con unas gotas de H2SO4 y se agrega gota a gota desde la bureta el KMnO4 de concentración conocida (0.1027 N) ( Mn 55; O 16; K 39). Se irá produciendo la siguiente reacción:
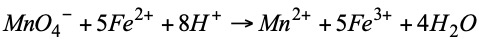
En este caso no se necesitará indicador puesto que el KMnO4 es violeta y el Mn2+ es casi incoloro, por otra parte el Fe2+es algo verdoso y el Fe3+ es amarillento. Al ir agregando KMnO4 el color violeta irá desapareciendo al pasar a Mn2+. Cuando se agote todo el Fe2+ del Erlenmeyer y agreguemos una gota más de KMnO4, el color violeta permanecerá en la disolución, en este momento se anota el volumen de KMnO4 gastado (21.6 cm3).
En la reacción redox se ha producido:
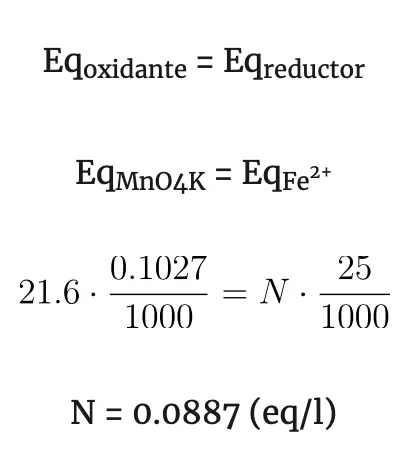
Pilas electroquímicas. Fuerza electromotriz. Potenciales de electrodo
El proceso por el cual se produce corriente eléctrica a partir de reacciones químicas. Supongamos la reacción:
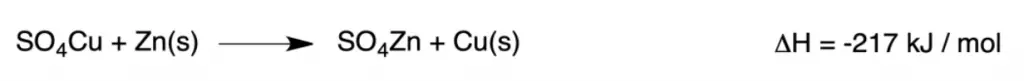
Si la reacción se llevase a cabo directamente en un mismo recipiente se observaría que la disolución, originalmente azul (debido al sulfato de cobre), va perdiendo color a la vez que se eleva su temperatura y se deposita cobre metálico en el fondo. (se forma un depósito pardo rojizo y esponjoso sobre el zinc.)
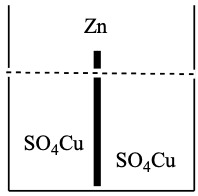
Las semi-reacciones que tienen lugar son:
Hay una transferencia de electrones del Zn al Cu. Si se consigue que esta transferencia no sea directa sino a través de un circuito exterior habremos conseguido una corriente eléctrica. El dispositivo así construido es la pila eléctrica de Daniell o galvánica, capaz de poner en movimiento las cargas a través de un circuito, aprovechando la energía que se libera en una reacción química.
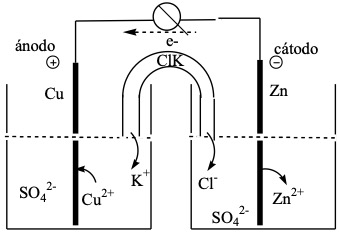
Para que los electrones circulen por el circuito exterior, se separan los reactivos en dos partes que reciben el nombre de semipilas o semielementos. En esta pila ambos semielementos van unidos mediante un tubo en U relleno de un compuesto iónico (KCl) denominado puente salino y cuya misión es anular el exceso de cargas positivas y negativas que se originan en los semielementos dejando pasar los iones Cl– y K+ a través de la membrana porosa que lo cierra.
Pila de Daniell:
Para construir una pila es necesario disponer de dos semielementos en los que exista una diferente capacidad de oxidarse o reducirse, de modo que los electrones circulen de uno a otro semielemento. En esta reacción se ha desprendido una energía que dependerá de la naturaleza de los productos que reaccionan y de los estados inicial y final del sistema.

se llama Faraday a la carga de un mol de electrones.
(Voltio = Julio / Culombio)
Cada generador o pila desarrolla una determinada cantidad de energía por cada Culombio que hace circular, tal energía por unidad de carga se llama fuerza electromotriz del generador (fem).
Como ya sabemos, una pila está formada por dos semielementos o semipilas llamadas electrodos.
Por ejemplo, la pila de Daniell está formada por un electrodo de cobre (cobre metálico en una disolución de sus iones) y un electrodo de Zn (zinc metálico en una disolución de sus iones). De acuerdo con la naturaleza de estos electrodos la pila presentará un determinado valor de su fem. Depende de la Temperatura, concentración y naturaleza química de la substancia.
Para determinar las fem de las distintas pilas se elige un electrodo determinado como referencia y se refieren a él estas fem. El electrodo elegido como electrodo de referencia es el de hidrógeno, que se denomina electrodo patrón.
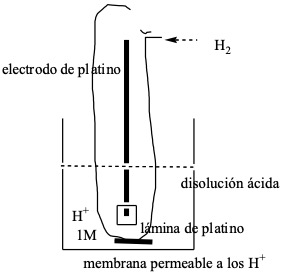
Este electrodo se consigue utilizando una lámina de platino, sobre la que se burbujea hidrógeno puro a P = 1 atm, y que se va introduciendo en una solución ácida a la que la concentración de protones es de [H+] = 1 M.
La reacción que tiene lugar en este electrodo es:
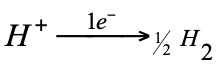
Cuando se desea determinar el potencial normal de cualquier electrodo [disolución 1M, 1 atm presión (gas) y sólidos puros (formas mas estables a 15ºC).], se monta la pila con el correspondiente semielemento y el normal de hidrógeno (potencial cero voltios).
Para la notación de una pila se escribe cada elemento separado por una línea, de los iones de la disolución y dos rayas, separando las dos disoluciones, situando a la izquierda el electrodo en el que se produce la oxidación del reductor (ánodo) y a la derecha el electrodo en el que se produce la reducción del oxidante (cátodo). Según este convenio, la notación de la pila de Daniell es:
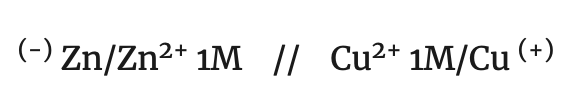
ánodo/electrolito anódico // electrolito catódico/cátodo
Esta pila en condiciones standard da una fem de 1.10 v.
Según que el electrodo normal de hidrógeno actúe como polo negativo o positivo de una pila, la reacción que va a tener lugar será el siguiente.
Polo negativo (ánodo) la oxidación:
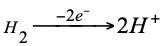
Polo positivo (cátodo) la reducción:
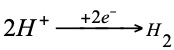
Para medir el potencial relativo de cualquier electrodo aislado han de recogerse dos datos:
- la fem de la pila formada por dicho electrodo y el electrodo normal de hidrógeno.
- Si el electrodo objeto de nuestra medida hace de polo positivo o negativo de la pila.
Del primer dato se deduce el valor numérico y del segundo el signo del potencial del electrodo.
Por ejemplo: Si deseamos determinar los potenciales de los electrodos normales de zinc y de cobre, hay que formar las respectivas pilas con el electrodo normal de hidrógeno.
Midiendo la fem de estas pilas se obtiene para la primera un valor de 0.76 V y para la segunda de 0.34 V. Pero en el primer caso, el electrodo de zinc es el polo negativo y , en el segundo el de cobre es el polo positivo.
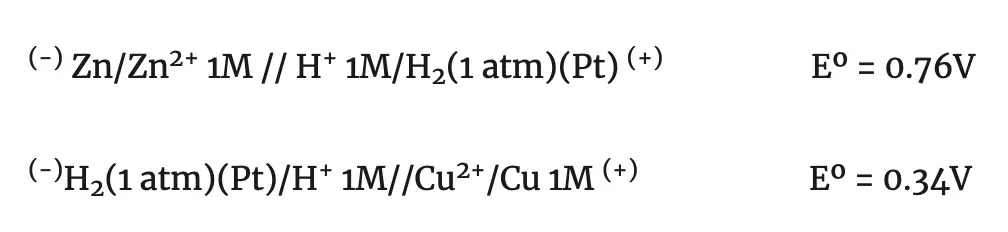
por tanto, los potenciales normales de reducción de los electrodos de zinc y de cobre son:
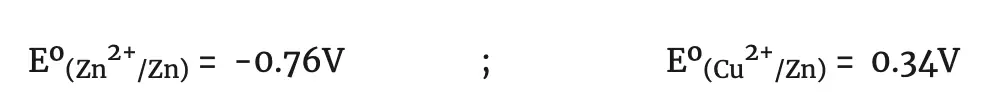
Pila de Daniell 1.10V Eº(Cu2+/Cu) = 1.10-0.76 =0.34 V
Las reacciones redox que tienen lugar en ambas pilas son:
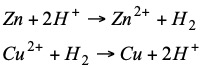
Todo electrodo sumergido en una disolución 1M de sus iones de denomina electrodo normal y su potencial (frente al electrodo normal de hidrógeno) con sus correspondiente signo se llama potencial normal o estándar y se encuentra tabulado. Los potenciales normales de reducción se encuentran tabulados y cuando su signo es negativo significa que la reacción indicada no es espontanea.
Cuanto mayor sea el potencial de reducción, más acentuada será la tendencia del electrodo a reducirse, es decir, mayor su poder oxidante.
Conocidos los potenciales normales de reducción de los semielementos se puede calcular la fem de una pila, formada por cualquier pareja de ellos, y predecir la polaridad de los mismos. Para ello basta escribir las reacciones de electrodo y sus respectivos potenciales, con los signos adecuados.
El polo negativo será el electrodo de menor potencial, esto es, el más negativo, que tenderá a ceder electrones mientras que el polo positivo será el de mayor potencial que tenderá a captar electrones.
La fem será la suma de ambos potenciales y la reacción global de la pila la suma de las correspondientes reacciones.
Procesos redox en células electrolíticas
En el apartado de pilas electroquímicas se ha descrito como se puede producir corriente eléctrica aprovechando las reacciones químicas. En este apartado se detalla el proceso electrolítico inverso, es decir, cómo se puede producir una reacción química no espontánea mediante una corriente eléctrica.
La corriente eléctrica es el movimiento de cargas eléctricas. En un circuito eléctrico (alambre metálico) los electrones no alteran los cables conductores (aunque se llega a producir algo de calentamiento). Esto se debe a los tipos de enlace que están presentes en los metales (enlace metálico que origina la conducción metálica o electrónica).
Sin embargo, al paso de electricidad a través de disoluciones de algunas sales (o sales fundidas) provoca cambios químicos en el electrolito disuelto, en los electrodos o en ambos ya que se producen reacciones químicas.
Por ejemplo, el NaCl sólido no conduce la corriente eléctrica porque los iones Cl– y Na+ están fijos en la red cristalina y no pueden moverse. Sin embargo, el sólido fundido de NaCl si conduce la corriente eléctrica porque ahora los iones.
En la electrólisis, la conducción de la corriente eléctrica se debe a la migración de los iones (en lugar del movimiento de electrones), y se le denomina conducción iónica o electrolítica.
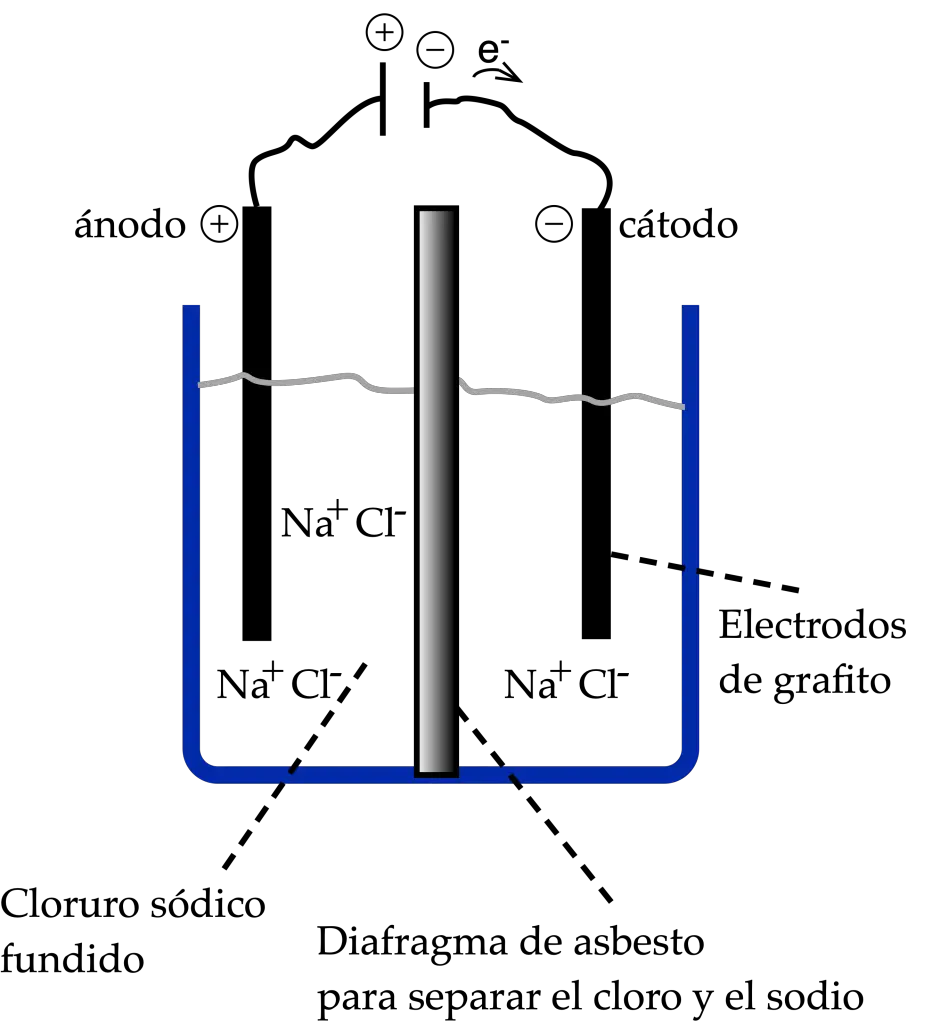
El NaCl, si aumentamos la temperatura por encima de los 800 ºC que es el punto de fusión del NaCl, e introducimos dos electrodos inertes de grafito conectados a los polos de un generador de corriente continua, en el caso de que el voltaje sea lo suficiente.
En ese caso los iones Na+ tomarán electrones del cátodo y se depositará Na en forma de sodio metálico. Al mismo tiempo, los iones negativos de Cl– cederán electrones al ánodo liberándose Cl2 en forma de gas. Las reacciones que se producen se resumen a continuación:
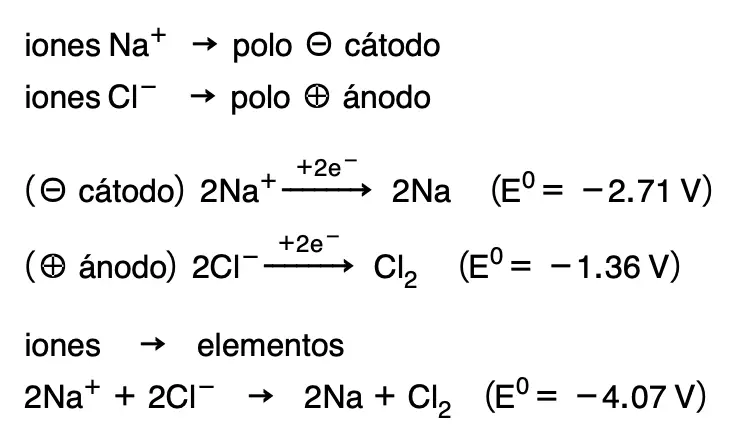
El potencial teórico mínimo de dicha reacción sería -4.07 V, y se produciría la reacción inversa a la que se da en la naturaleza, es decir a partir de iones obtendríamos con corriente eléctrica los elementos Na y Cl2. Tanto en las pilas galvánicas como en las cubas electrolíticas, el ánodo es el electrodo donde ocurre la oxidación, y el cátodo es donde ocurre la reducción.
Las reacciones que tienen lugar en las células o cubas electrolíticas son procesos redox. Por ejemplo: electrólisis del cloruro de cobre(II). Si se introducen dos electrodos inertes de Pt que se conectan a los terminales de un generador de corriente y se observa lo siguiente:
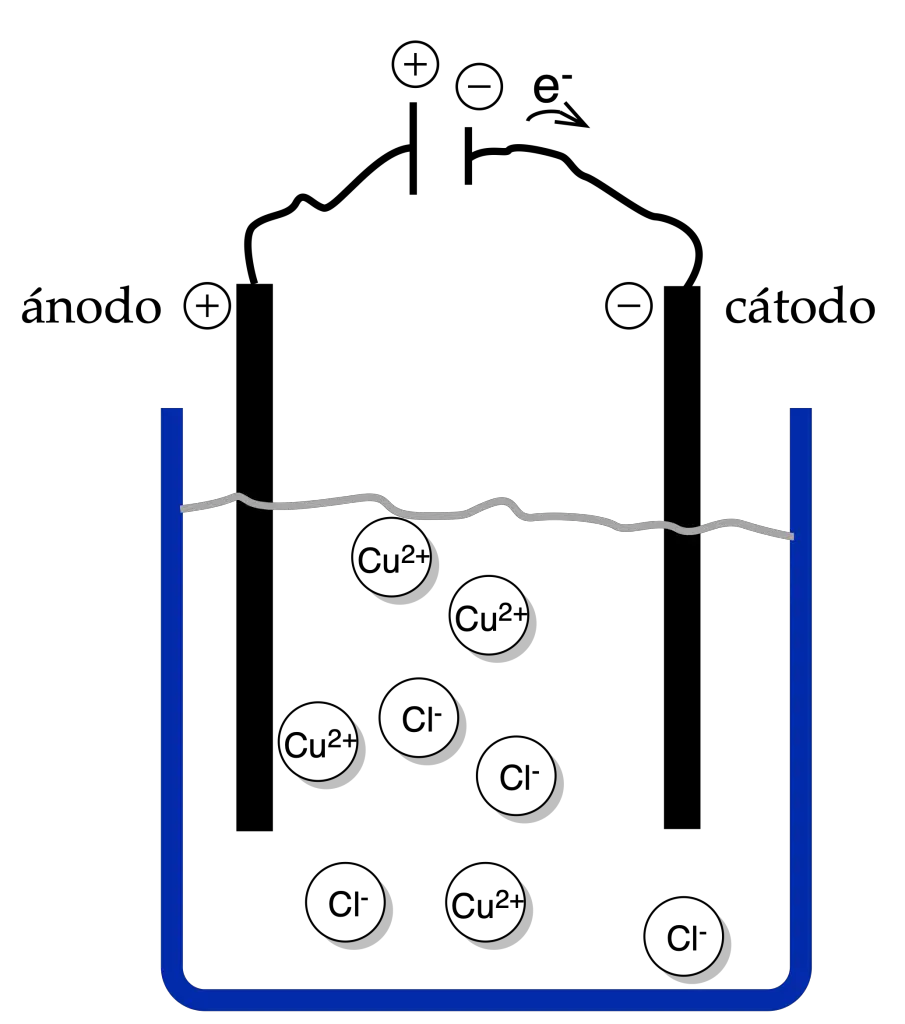
Cada electrodo se carga con el signo del borne al que está unido. El electrodo ⊕ es el ánodo y el ⊖ el cátodo.
Los iones de la disolución por las fuerzas eléctricas, se dirigen hacia los electrodos: los aniones ⊖ van al ánodo ⊕ y los cationes ⊕ al cátodo ⊖.
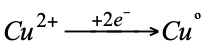
ánodo ⊕: aceptor de electrones (reducción del oxidante)
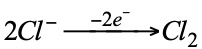
cátodo ⊖: donor de electrones (oxidación del reductor)
Cuanto mayor es la fuerza electromotriz (fem) del generador, el proceso se dará en mayor extensión.
Las reacciones que tienen lugar en la cuba electrolítica como consecuencia de la energía eléctrica suministrada, consisten en la descomposición de las sustancias y el proceso se denomina electrólisis.
Sin embargo el proceso de electrólisis no es espontáneo, es decir, la descomposición no se produciría si no se hubiese aportado energía eléctrica. Se define el FARADAY como una cantidad de carga igual a 96496 C capaz de descomponer un equivalente de cualquier electrolito.
Ecuación de Nerst: relación entre el potencial y la constante de equilibrio de una reacción redox
Si los reactivos o los productos de la correspondiente reacción redox se encuentran en condiciones distintas (temperatura, presión, concentración, etc) la fem será diferente.
Vamos a ver la relación que existe entre el potencial de una reacción redox y la concentración de las especies que participan, es decir, entre la constante de equilibrio.
Como consecuencia de una reacción espontánea obtenemos una corriente en una reacción redox. Esta relación hizo pensar a Thomson y Helmholtz que el origen de la energía eléctrica provenía de la energía química del proceso (calor de reacción)
Como en ambos casos la reacción se lleva a presión constante (p atmosférica):
Energía eléctrica = calor de reacción
n·F·E = Qp
de donde E = Qp/n·F regla Thomson-Helmholtz (1851) [1]
Qp es el calor de reacción expresado en julios (1cal =4.1840 J)
E es la diferencia de potencial en voltios
F es Faraday 96496 C/eq-gr
n es el nº de equivalentes formados
Esta energía eléctrica se puede cuantificar por medio del trabajo eléctrico:
W = I·E·t = (Q/t)·E·t
I = intensidad; E potencial; t tiempo
W=Q·E
W= z·E·F = Qp = -ΔH
Q = z·F; z = nº electrones; F carga de un mol 96496 C
E =-ΔH/z·F
Esta es la relación del potencial de una reacción con su calor de reacción. Es una expresión aproximada, ya que la energía eléctrica de una reacción espontánea, está relacionada mas bien con ΔG que con ΔH.
E=-ΔG/z·F
Por otra parte sabemos que:
-ΔG = RTln(K/J)
K= cte equilibrio; J = cte en la que los reactivos y los productos aparecen en el momento actual y no en el de equilibrio.
E = (R·T/z·F)ln (K/J)
E = (R·T/z·F)ln K-(R·T/z·F)ln K F = 96496
Si la temperatura permanece constante, tendremos que:
E = (R·T·2.303/z·F)log K-(R·T·2.303/z·F)log K R·T·2.3/F = 0.06
Factores que afectan al potencial de un sistema redox
Si consideramos la siguiente reacción:

Una variación en las concentraciones a va producir una variación en el potencial. Por tanto, los factores que afectan a la concentración afectarán al potencial. Por ejemplo:
pH
1) En aquellos sistemas en los que varía el oxígeno en el proceso de reducción:
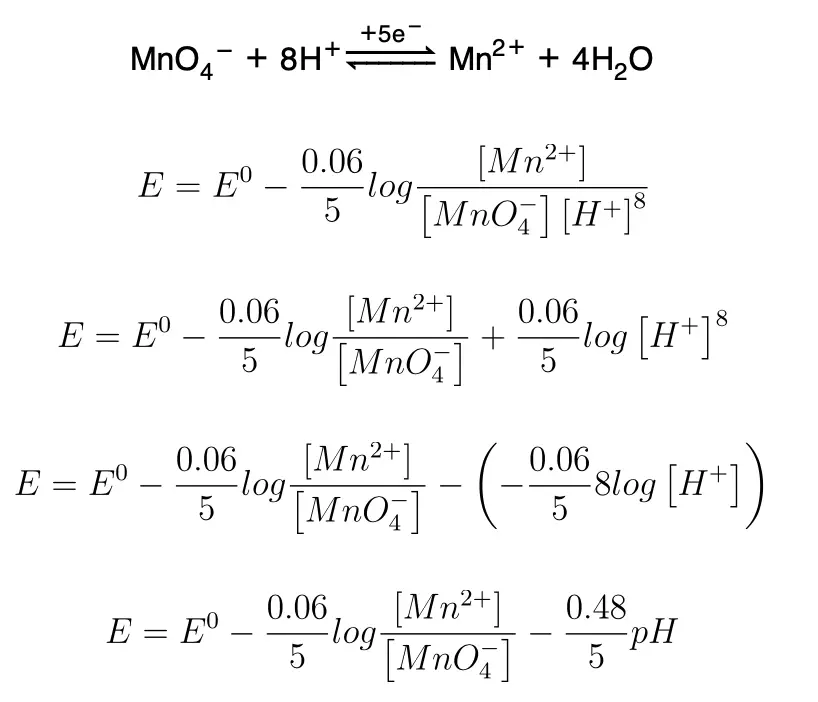
La siguiente gráfica nos muestra que el potencial E será máximo cuando el pH sea cero.

2) En aquellos sistemas en los que el oxígeno no varía en el proceso de reducción:
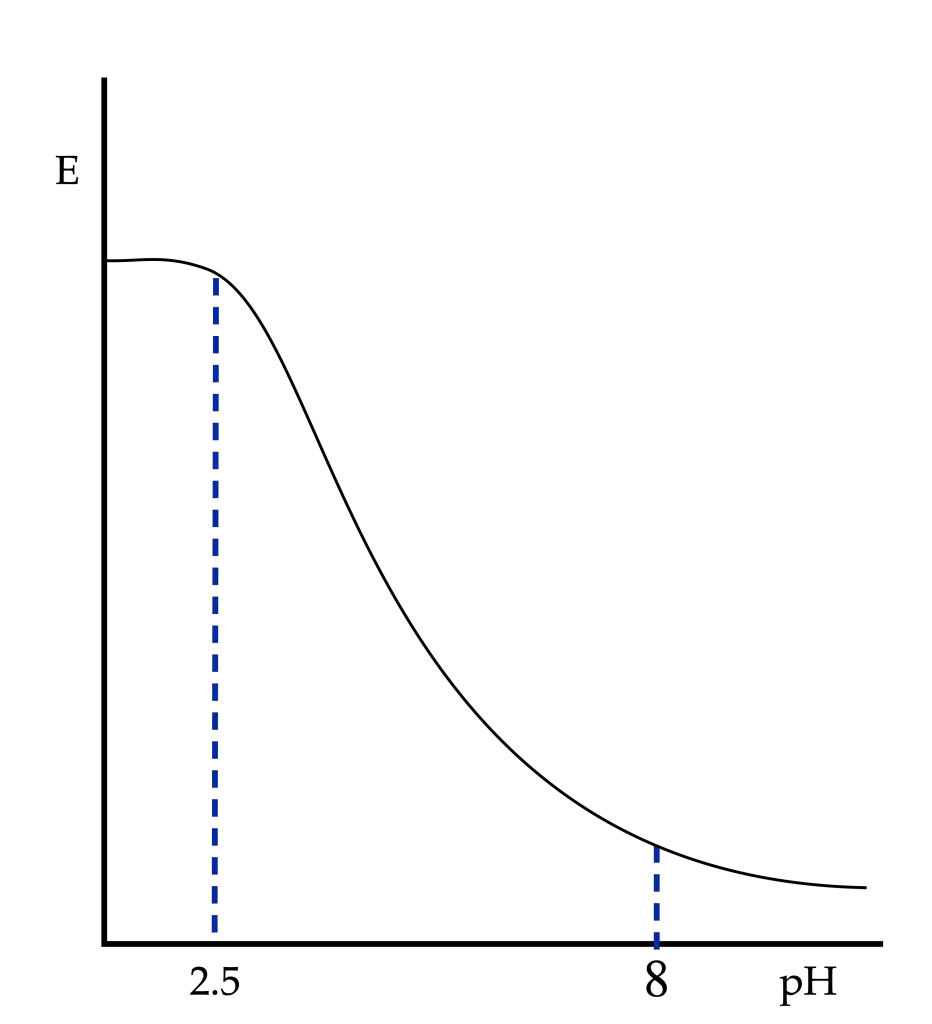
- En el rango de valores de pH comprendido entre 0 y 2.5, la concentración de HO– es muy pequeña como para que precipite el Fe(OH)3 o el Fe(OH)2, por lo que el pH no influye en el potencial.
- En el rango de valores de pH comprendido entre 2.5 y 8, precipita el Fe3+ en forma de Fe(OH)3.
- En el rango de valores de pH comprendido entre 8 y 14, precipita el Fe2+ en forma de Fe(OH)2.
Presencia en el medio de iones formadores de precipitados
Precipita alguna de las sustancias presentes en el equilibrio redox, variará constante de dicho equilibrio y por tanto el potencial de la reacción:
Video de las Reacciones Redox
Aplicaciones de los potenciales normales de electrodo
[1] No es rigurosamente exacta pero se cumple con bastante aproximación, en algunos casos es muy errónea.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
