Índice
Objetivo
Sintetizar un colorante, en este caso el amarillo Martius (o amarillo ácido 24) mediante nitración indirecta del α-naftol (1-naftol), para obtener el compuesto dinitrado. Esto es reacciones sucesivas de sulfonación y nitración. Además, formar la sal del compuesto dinitrado con hidróxido de amonio para obtener el mencionado colorante.
Antecedentes
El colorante amarillo Martius fue descubierto en 1868 por Karen Alexander Von Martius. Y su estructura químcia consiste en la sal de amonio del 2,4-dinitro-1-naftol. Su uso más frecuente es como colorante antipolilla para la lana. Con un 1 g de colorante amarillo Martius se pueden teñir 200 g de lana.
Las sales de diazonio son relativamente estables, y se pueden formar con aminas primarias aromáticas por reacción con ácido nitroso. Estas sales a su vez, pueden actuar como electrófilos débiles y reaccionar con anillos aromáticos activados, produciendo reacciones de sustitución electrofílica aromática (SEAr). Los fenoles y las aminas aromáticas tienen activado el anillo aromático, y esto les permite reaccionar con las sales de diazonio. Así, se producen una serie de compuestos que se utilizan como colorantes.
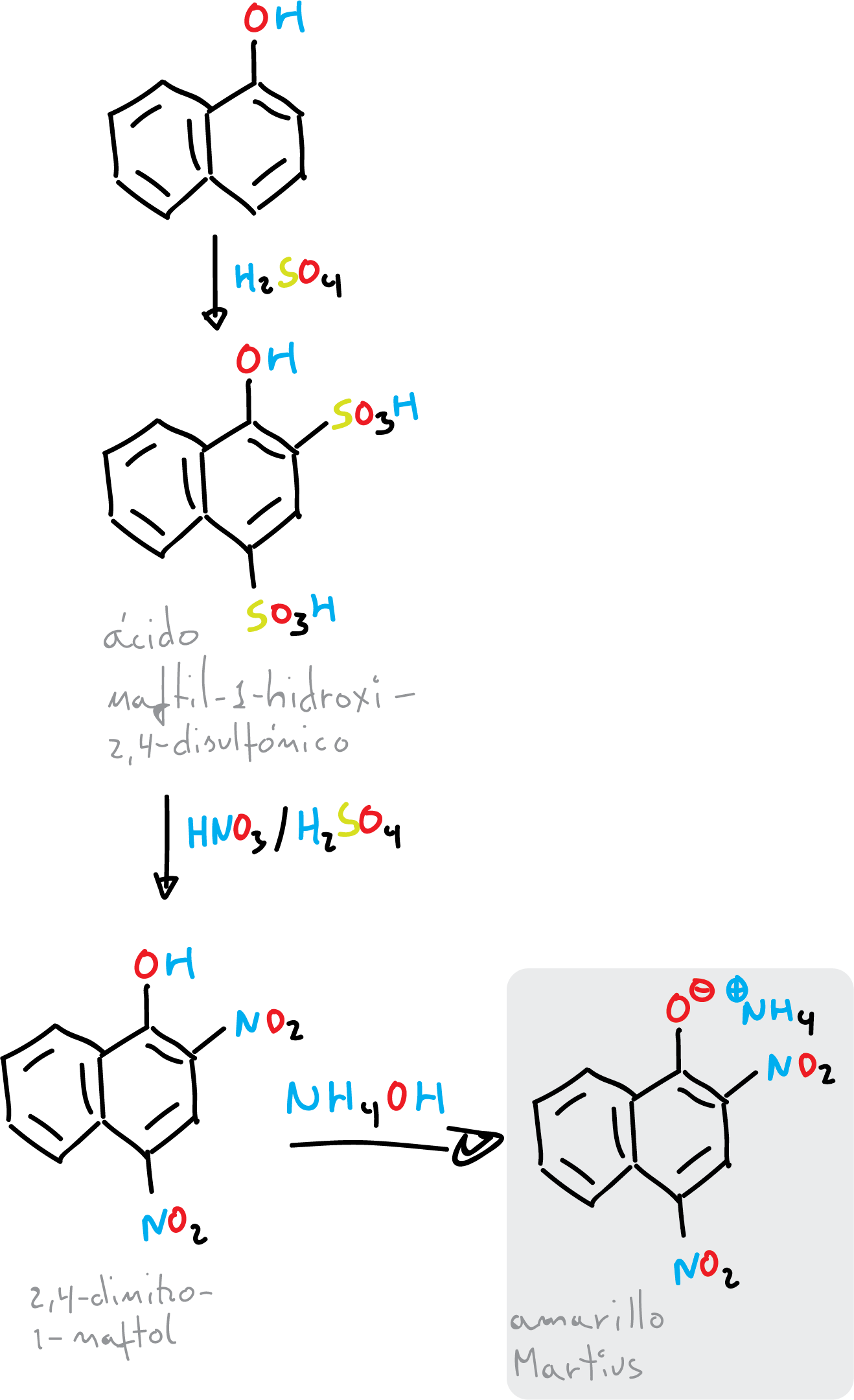
La síntesis se lleva a cabo mediante de la sulfonación aromática del α-naftol (1-naftol) con ácido sulfúrico concentrado. Posteriormente, se realiza una nitración en ipso del ácido disulfónico, previamente obtenido, con una mezcla de ácido nítrico y ácido sulfúrico en medio acuoso. De esta manera, el intercambio de grupos funcionales ocurre con facilidad.
Procedimiento experimental
a) Síntesis del 2,4-dinitro-1-naftol
Se colocan 2.5 g de 1-naftol en un Erlenmeyer de 100 ml y se le añaden 5 ml de ácido sulfúrico concentrado (H2SO4). Se prepara un baño María. La mezcla se calienta (a una temperatura de 37-40 ºC) durante, aproximadamente, 10 min, y se agita en una placa calefactora con agitación magnética hasta disolución y desaparición del color rojo.
Una vez finalizado el proceso, se deja enfriar en un baño de hielo, y se adicionan, por las paredes del Erlenmeyer, 15 ml de agua helada y se deja reposar durante 2 min.
Se prepara otro vaso de precipitado con 4 ml de ácido nítrico concentrado (HNO3), en un baño de hielo. Y se adicionan al crudo de reacción de la etapa anterior gota a gota. Dejamos reposar la mezcla durante 2 min. Seguidamente, el crudo de reacción se calienta en baño maría (a 37 ºC) durante 5 min.
Una vez finalizado el proceso, el producto se separa como una pasta amarilla, que se vierte sobre otro vaso de precipitados con, aproximadamente, 30 ml agua/ 10 g hielo picado, para romper la pasta formada.
Se recoge el producto por filtración a vacío, y se lava con agua fría.
b) Obtención de la sal de amonio del 2,4-dinitro-1-naftol
La tercera reacción se lleva a cabo en otro vaso de precipitados. Agregue 75 mL de agua caliente y 2.5 mL de hidróxido de amonio concentrado, y caliente hasta el punto de ebullición, y se agíta (agitación magnética) para disolver el sólido. Agregue 5 g de cloruro de amonio (NH4Cl) al crudo de reacción para obtener la sal de amonio (Martius Yellow). Finalmente, se enfría en un baño de hielo, y se filtra a vacío el colorante amarillo Martius y se lava con agua que contenga 1-2 % de cloruro de amonio, y se recoge el producto obtenido (p.f. 144-145 ºC). Se deja secar y se calcula el rendimiento.
International Chemical Identifier
Se aportan los identificadores InChI key de la IUPAC para, los compuestos principales utilizados en la práctica a fin de facilitar la nomenclatura y formulación de compuestos químicos y la búsqueda de información en internet de dichos compuestos.
| 1-naftol | KJCVRFUGPWSIIH-UHFFFAOYSA-N |
| 2,4-dinitro-1-naftol | FFRBMBIXVSCUFS-UHFFFAOYSA-N |
| ácido naftil-1-hidroxi-2,4-disulfónico | GMSFXHLBYYCMAT-UHFFFAOYSA-N |
| ácido nítrico | GRYLNZFGIOXLOG-UHFFFAOYSA-N |
| ácido sulfúrico | QAOWNCQODCNURD-UHFFFAOYSA-N |
| amarillo Martius | XTWUZSGBAZWJJK-UHFFFAOYSA-N |
| cloruro amónico | NLXLAEXVIDQMFP-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- Nitration of naphthol: A laboratory experiment
Dwight F. Mowery
Journal of Chemical Education 1982 59 (8), 689
DOI: 10.1021/ed059p689
Volver a la página de prácticas de Síntesis Orgánica.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
