Índice
¿Qué es el sulfuro de hidrógeno?
El sulfuro de hidrógeno es un compuesto inorgánico de fórmula H2S que está compuesto por un átomo de azufre y dos de hidrógeno. Es el análogo al agua pero cambiando oxígeno por azufre.
El H2S es un gas de olor característico a huevos podridos, y presente en la naturaleza en muchas emanaciones volcánicas. Sin embargo, esta molécula desempeña en el organismo humano funciones esenciales. Se encuentra en el petróleo, gas natural, o gases emitidos en volcanes y manantiales de aguas termales.
Estructura química
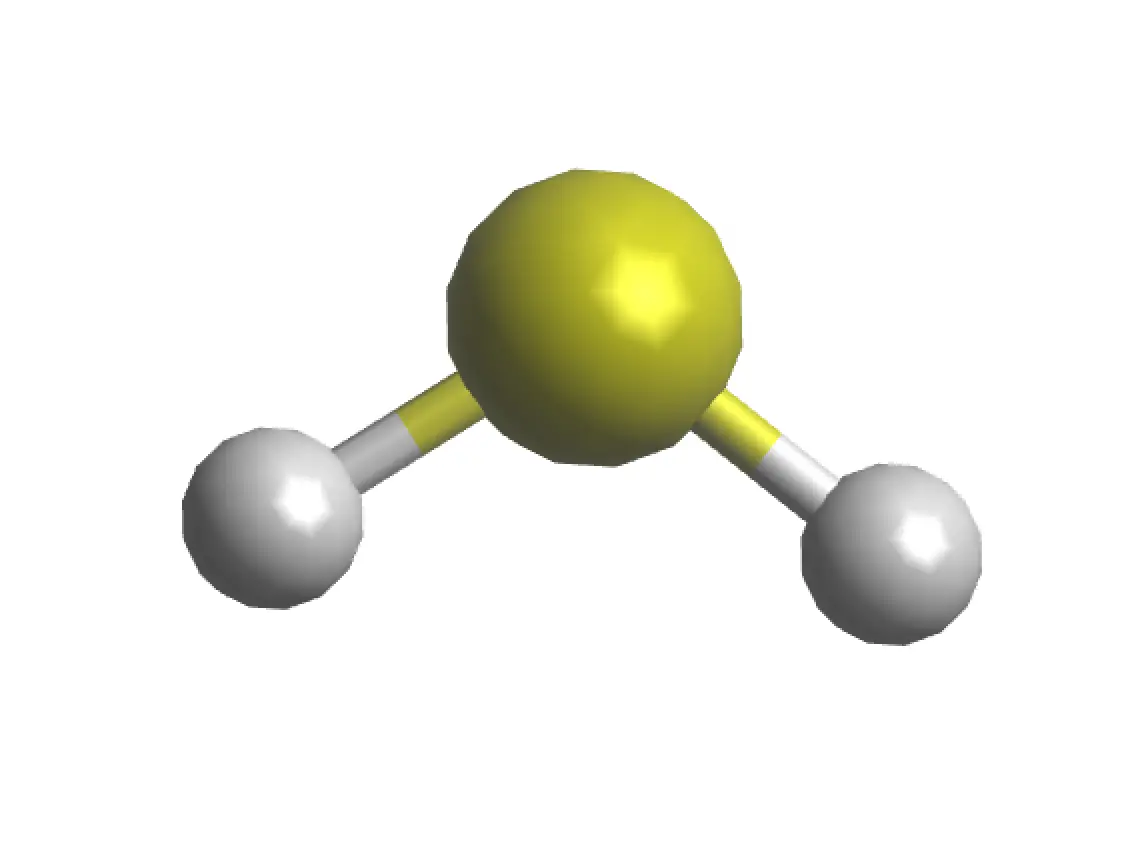 |
| Estructura 3D |
La molécula de sulfuro de hidrógeno presenta una geometría angular (similar al agua), con una distancia de enlace S-H de 1.336 Å y un ángulo de enlace ∠HSH de 92.1º. En cuanto a su simetría molecular, pertenece al grupo puntual C2v. Además, presenta un momento dipolar de 0.97 Debye.
Se puede representar con la estructura de Lewis siguiente:
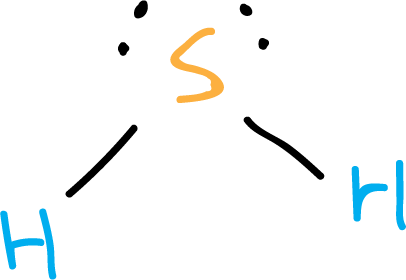
Propiedades fisicoquímicas
Es un gas más pesado que el aire. Además, es inflamable, incoloro, tóxico, odorífero (a materia orgánica en descomposición).
Se le denomina ácido sulfhídrico cuando esta en disolución acuosa (H2S(aq)), presenta una solubilidad en agua de 4 g dm−3 (at 20 °C), y también es soluble en alcohol. El H2S tiene una masa molar de 34.08 g/mol. Es de carácter básico (pKa de 6.89), por lo que en presencia de bases fuertes forma sales denominadas sulfuros.
Presenta un punto de ebullición de -60.29 ºC y un punto de fusión de -86 ºC y densidad 1.363 g dm−3. Arde con una llama azul en oxígeno para formar óxido de azufre (IV) y agua.
El H2S es muy nocivo para la salud. Concentraciones de solo 20-50 partes por millón (ppm) en el aire provocan un malestar agudo que conlleva a la asfixia y a la muerte por sobreexposición.
Su toxicidad es comparable a la del ácido cianhídrico (HCN). Este último usados usado en cámaras de gas y campos de concentración de la Segunda Guerra Mundial.
Se puede detectar la presencia de H2S en una muestra mediante un ensayo impregnando un papel húmedo con acetato de plomo, Pb(CH3COO)2, también se puede emplear nitrato de plomo. El resultado positivo dará lugar a una mancha negra debido al sulfuro de plomo que se forma mediante la siguiente reacción:
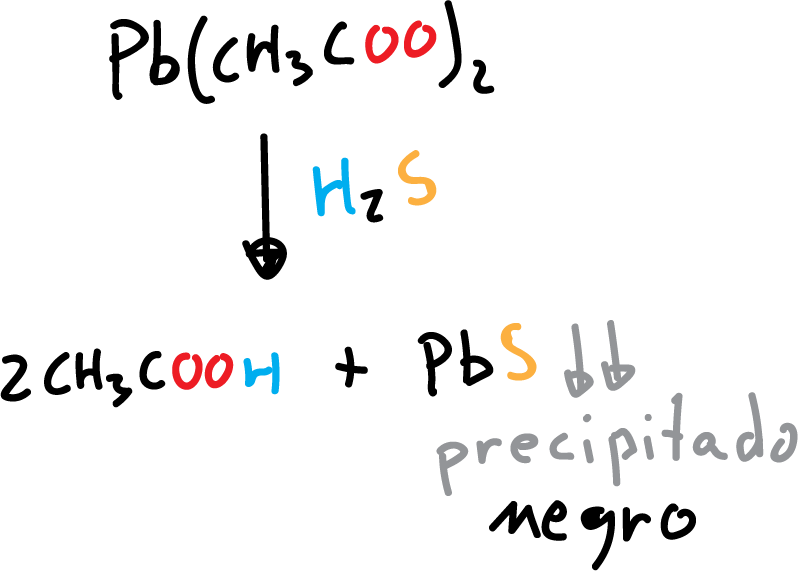
Obtención
Se puede obtener por descomposición de la materia orgánica en condiciones anaerobias. El H2S tiene su origen en proteínas con aminoácidos de azufre (cistina, cisteína y metionina). Estos aminoácidos con azufre son más abundantes en pelo, uñas y cuernos.
Otro método obtención por acción de bacterias anaeróbicas, se consigue mediante la reducción de los sulfatos (SO4=) presentes en el agua, por contacto de un sulfuro o un sulfhídrato con un ácido, con agua ácida o incluso neutra, o por combustión de un hidrocarburo o hidrógeno en contacto con azufre.
En el laboratorio, se obtiene por reacción de ácido clorhídrico (HCl) con sulfuro de hierro (II) (FeS), utilizando un generador de kipp.
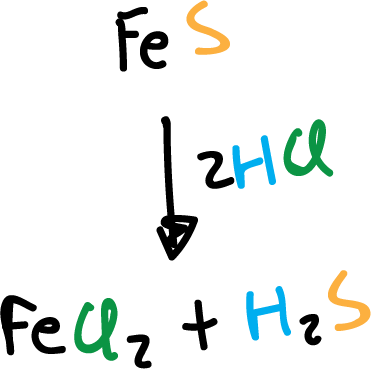
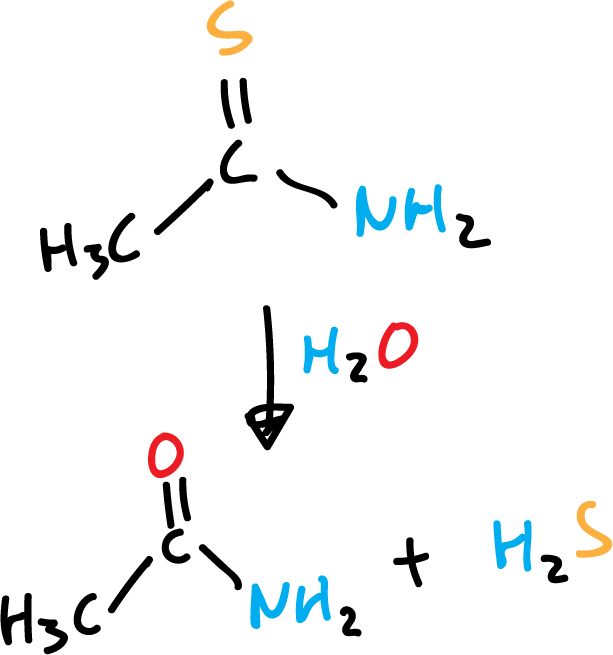
También, se utiliza tioacetamida como producto de partida para obtenerlo para uso en Análisis Cualitativo Inorgánico.
Muchos sulfuros de metales y no-metales (sulfuro de aluminio, pentasulfuro de fósforo, disulfuro de silicio) liberan sulfuro de hidrógeno cuando se mezclan con agua.
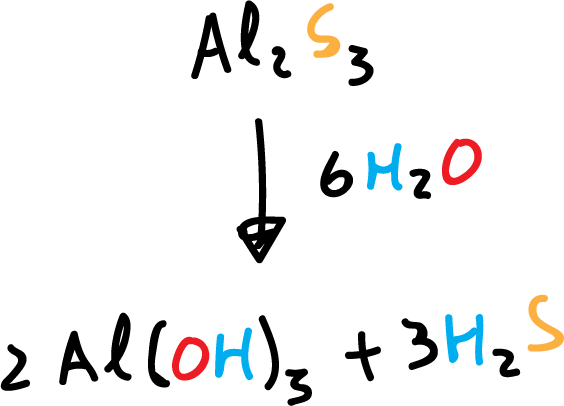
Otro método de laboratorio consiste en calentar una mezcla azufre (S) elemental y parafina.
A escala industrial, el ácido sulfhídrico se obtiene como subproducto de la limpieza del gas natural, en el que se encuentra en concentraciones de hasta un 10 %.
Usos y aplicaciones
Antiguamente se usaba en Química Analítica cualitativa, en la marcha catiónica (marcha analítica) para precipitar los cationes de metales pesados del grupo II. Se obtienen unos precipitados en su mayoría negros o tambien blancos.
La sal sulfuro de sodio (Na2S), se usa para envejecer (simulación de antigüedad) bronces (orfebrería). También se emplea en curtiduría para la preparación de cuero.
El ácido sulfhídrico es responsable del ennegrecimiento de algunas pinturas basadas en carbonato de plomo, por formación de sulfuro plumboso (sulfuro de plomo II), (PbS), de color negro.
El sulfuro de hidrógeno es un compuesto de partida de algunas Síntesis Orgánicas.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
