Índice
A continuación, se describen las técnicas de laboratorio (calentamiento y enfriamiento) más usadas para llevar a cabo reacciones químicas en distintas condiciones.
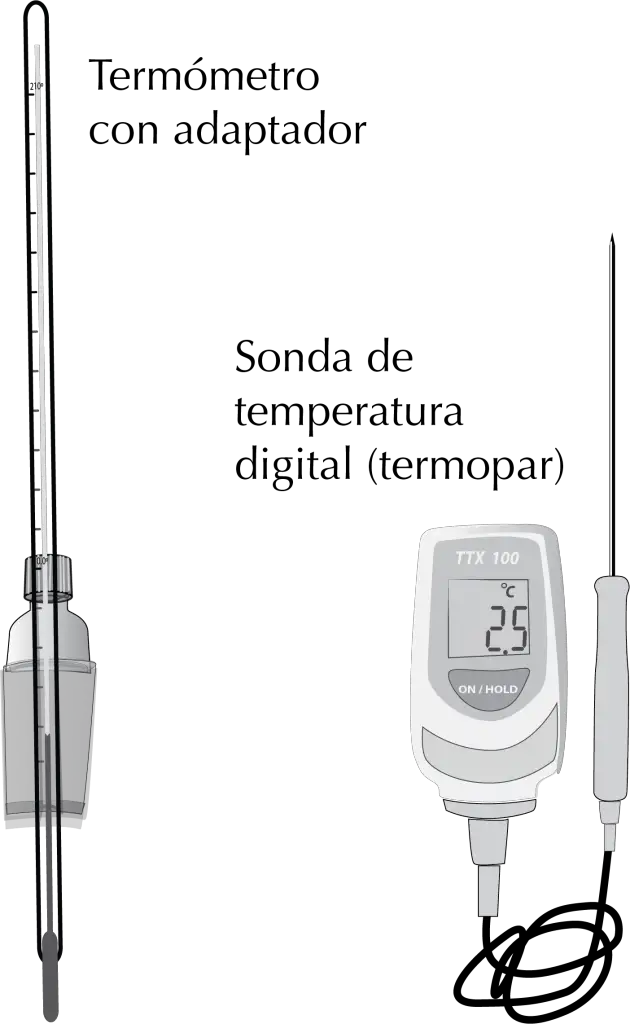
Medida de la temperatura (termómetros)
En muchos procesos de laboratorio es preciso medir la temperatura, por ejemplo en reacciones tanto en frío como en caliente. Existen distintos tipos de termómetros adaptados a cada necesidad y con distintos intervalos de utilización. Los más usuales consisten en un tubo de vidrio graduado con un líquido en su interior. Debido al carácter nocivo del mercurio este ha sido reemplazado en la actualidad por un líquido coloreado.
En algunos casos los termómetros vienen provistos de una pieza esmerilada para ajustar a las cabezas de destilación, de no ser así se ajustaran a dicha cabeza de destilación mediante un adaptador adecuado (normalmente un tapón de rosca con un aro de goma).
Es preciso tener en cuenta que el líquido en los termómetros no presente discontinuidades. Estas se suelen producir cuando el termómetro alcanza temperaturas superiores a su límite de utilización. Hay que asegurarse de que el rango de temperatura que se va a medir se encuentre siempre comprendido en la escala del termómetro. Estos modelos de termómetro no son de uso clínico por lo que no hay que agitarlos (sacudir) para bajar la temperatura.
Hoy día, es cada vez más común utilizar dispositivos electrónicos de medida de temperatura o termopar. Estos pueden conectarse a los agitadores magnéticos permitiendo regular la temperatura de la placa con más fiabilidad que el propio regulador.
Técnicas de calentamiento
La gran mayoría de las sustancias orgánicas son inflamables y muchas de ellas, además, volátiles por lo que el calentar una reacción química o disolución suponen un riesgo si no se toman las precauciones adecuadas.
Por ello, hoy en día prácticamente no se utilizan técnicas de calentamiento que supongan una exposición directa a una llama (por el peligro al manipular disolventes orgánicos volátiles o inflamables), como son los típicos mecheros Bunsen. Actualmente, se han sustituido por dispositivos eléctricos con resistencias termostáticas.
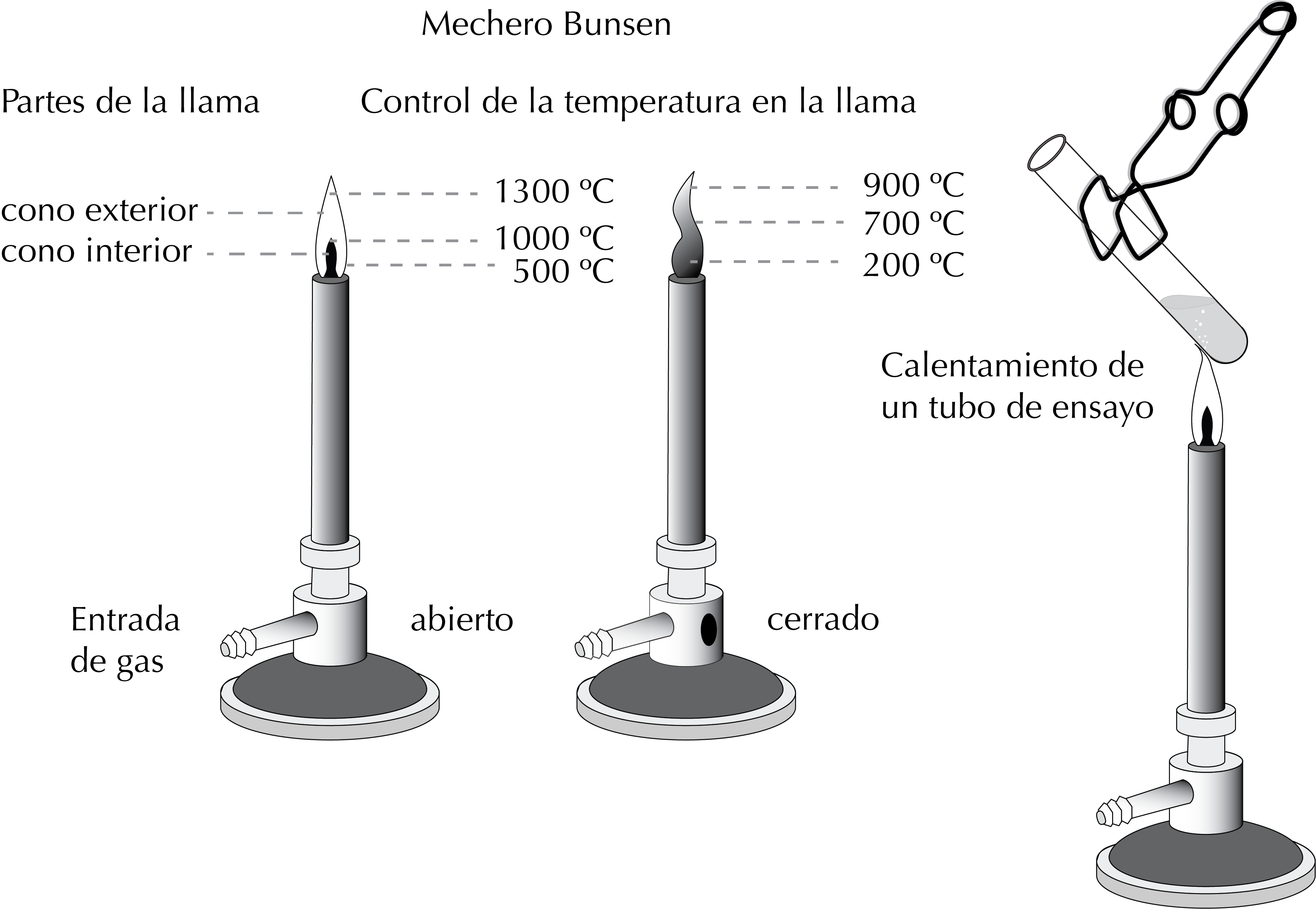
Mechero Bunsen
Inventado en 1854 por Robert Bunsen, se usa para calentar tubos de ensayo o esterilizar distintos tipos de muestras o instrumental. En Química Orgánica se utiliza también para moldear varillas de vidrio y en la fabricación de capilares.
Se genera una llama en el extremo de un tubo metálico, mediante una corriente continua de un gas (butano, propano o similar) que se mezcla con el aire que entra por un orificio. La entrada de aire se puede regular con una llave o manipulando una rendija, con lo que se modifica la composición de la mezcla gas/aire, y el tipo de llama que se genera.
El color de la llama indica la temperatura que esta puede llegar a alcanzar. Un color amarillo (llama sucia) indica baja temperatura aprox. 300 ºC. Al aumentar la proporción de aire/gas la llama se vuelve azul, hasta hacerse prácticamente invisible, alcanzándose las temperaturas más altas (aproximadamente 700 ºC).
Aunque están desaconsejados debido a su peligrosidad, se sigue usando, por ejemplo para calentar tubos de ensayo en pruebas analíticas.
Los tubos de ensayo se sostienen con una pinza, y se acercan a la llama ligeramente inclinados (45º) y orientados hacia una dirección segura, con agitación ocasional. De manera que en caso de que pudieran producirse salpicaduras los daños sean mínimos.
Placa calefactora
El método más empleado para calentar una reacción es el uso de una placa calefactora con regulador de temperatura interno. Ciertos modelos de placa permiten la conexión de un termopar externo para una mayor precisión en la regulación de la temperatura.
La gran mayoría de las placas actuales incluyen además agitación magnética, con lo que se puede calentar y agitar simultáneamente.
El recipiente o el montaje utilizado se sitúa directamente sobre la fuente de calor de la placa, o bien se puede intercalar un baño que puede ser de agua (baño María), aceite, arena o un bloque de aluminio. En todos los caso se debe controlar la temperatura con un termómetro que se introduce en el baño o bloque de aluminio.
| ¡PELIGRO! «No calentar nunca un recipiente abierto con un disolvente inflamable sobre una placa calefactora. Los vapores pueden provocar un incendio al entrar en contacto con la zona caliente o los componentes eléctricos de la placa.« |
Baño de agua (baño María)
El baño más sencillo y que todavía se utiliza es el de agua o «baño María» ya que resulta muy efectivo cuando se requieren temperaturas por debajo de 80 ºC. Con él se alcanzan en el interior de la reacción temperaturas entre 70 y 80 ºC.
El agua se introduce en un cristalizador y dentro del baño se introduce el recipiente con la reacción. El término «baño María» procede de María la Judía, hermana de Moisés, que fue considerada como la primera alquimista.
 Presenta el problema de la evaporación con relativa rapidez. Se evita una rápida evaporación adaptando un trozo de papel de aluminio para cubrir la superficie del baño que queda libre.
Presenta el problema de la evaporación con relativa rapidez. Se evita una rápida evaporación adaptando un trozo de papel de aluminio para cubrir la superficie del baño que queda libre.
Baño de aceite
Los fluidos transmiten el calor de forma eficiente y homogénea por lo que se han utilizado habitualmente para calentar reacciones. Estos fluidos deben ser térmicamente estables y no inflamables en el rango de temperatura a utilizar. Otro dato importante es conocer el punto de inflamación o «flashpoint«. La temperatura mínima a la cual se produce una mezcla inflamable constituida por lo vapores del fluido y el aire en las proximidades de la superficie de éste.
El fluido se introduce en un recipiente, generalmente un cristalizador de vidrio que se coloca sobre una fuente de calor (la misma placa calefactora). El cristalizador presenta la ventaja de tener una pared no muy alta que permite visualizar la reacción. Como fluidos se usan aceites minerales o de silicona.
| ¡PELIGRO! «El aceite mineral es inflamable. Se debe tener especial precaución para que no se derrame ninguna gota sobre la placa caliente. Además, si el agua se mezcla con el aceite, hay riesgo de salpicaduras si la temperatura es mayor de 100 ºC. El peligro reside en que al ser el agua más densa que el aceite cae al fondo produciendo y a esa temperatura producirá salpicaduras con proyección de aceite a elevada temperatura.« |
Baño de arena
En lugar de un fluido se puede llenar un cristalizador con arena. Permite calentar recipientes pequeños a temperaturas que no excedan los 200 ºC. Se preparan añadiendo arena al cristalizador hasta una altura de unos 3 cm.
Bloque de aluminio
Es un accesorio que se coloca sobre la placa calefactora, produciendo una eficaz transmisión del calor entre esta y el recipiente con la reacción.
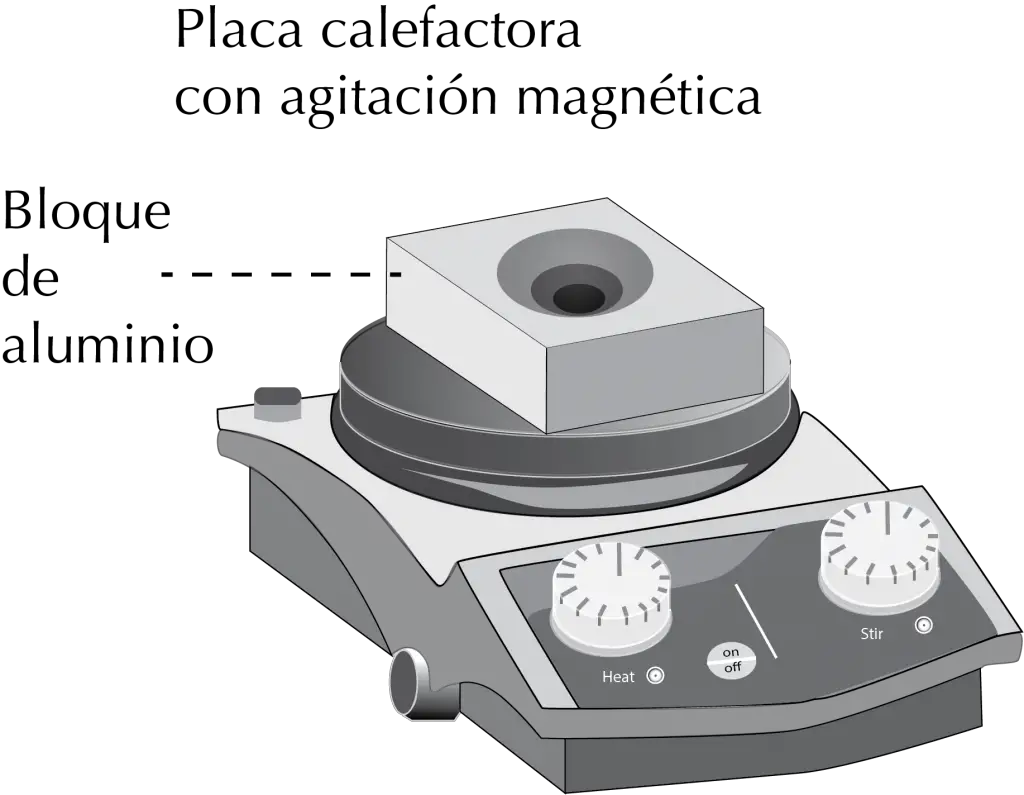
Existen diversos diseños que van desde los semiesféricos que se adaptan a los matraces de fondo redondo, mejorando además la estabilidad de los mismos, como otros que presentan diferentes orificios en el bloque para distintos tipos de recipientes.
En este caso, se posible calentar varios matraces o viales a un tiempo. Los bloques de aluminio tienen una serie de ventajas:
- El aluminio se calienta muy rápido.
- Puede alcanzar temperaturas altas.
- Los bloques se pueden enfriar rápidamente si se toman con una pinza y se sumergen en agua.
En la Tabla 1 se recogen algunos materiales empleados para los baños, así como el rango de temperatura comúnmente utilizado y su punto de inflamación.
| Material | Pto de inflamación (ºC) | Tª de trabajo (ºC) | Observaciones |
| Agua | – | 30-70 | Barato; no es inflamable ni tóxico; no genera residuos; evapora con rapidez |
| Aceite mineral | 113 | 30-90 | Barato; se oscurece y polimeriza con el tiempo; peligrosoa; bajo punto de inflamación |
| Parafina | –b | 55-180 | Barato; no se degrada con el tiempo; peligrosoa |
| Aceite de silicona | 150-350 | 30-230 | Amplio rango de temperatura; relativamente estable con el uso; peligrosoa |
| Arena | – | 30-500 | Barato; no es inflamable; a efectos prácticos no tiene límite de uso |
| aPuede producir proyecciones, si se vierte agua accidentalmente. bVariable según la procedencia. | |||
| ¡PELIGRO! «Jamás se debe calentar un baño de un fluido a una temperatura superior a 20 ºC por debajo de su punto de inflamación.« |
Baño termostatado
Son equipos autónomos formados por un recipiente para agua o aceite que se calienta mediante una resistencia, pudiendo mantenerse la temperatura estable durante largos periodos de tiempo.
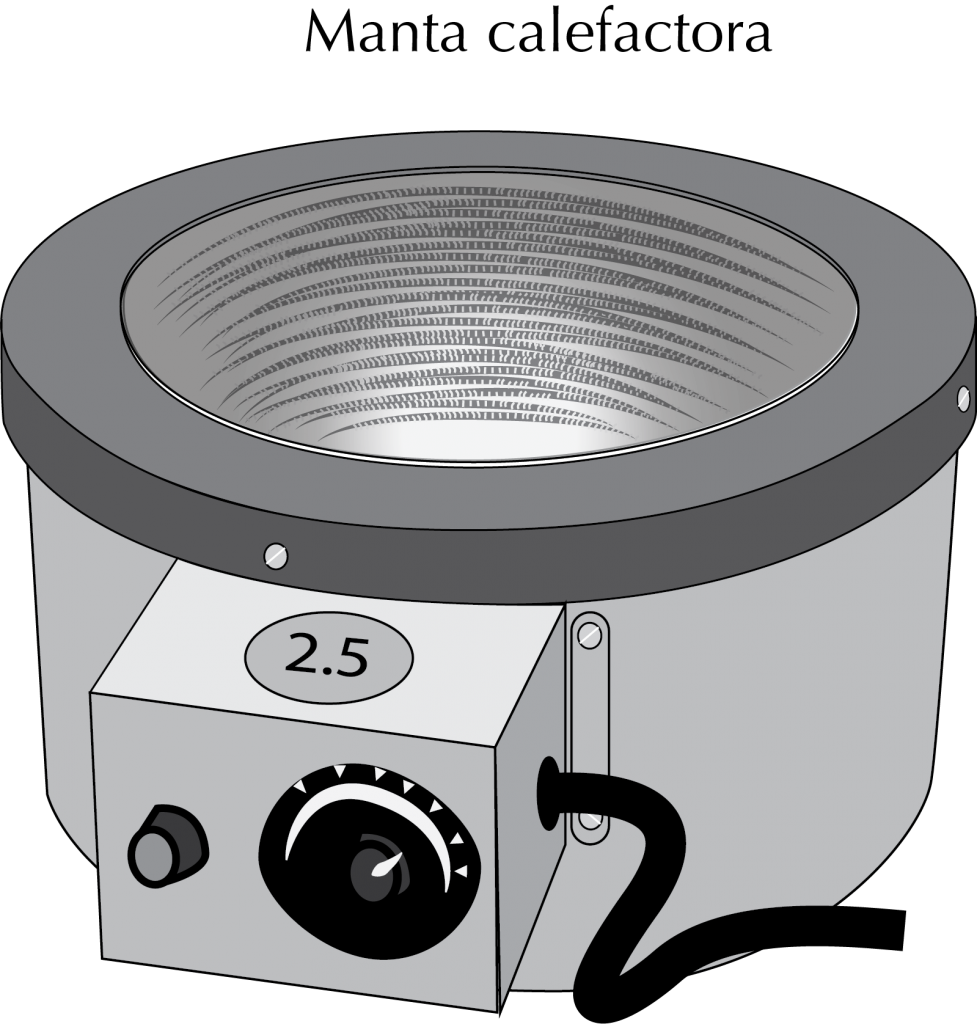
Manta calefactora
Presenta una carcasa metálica con una oquedad en la que hay un lecho de fibra de vidrio o material cerámico que se adapta a la forma del recipiente, el cual se puede mantener en contacto directo con el vidrio del recipiente. Dispone de una resistencia eléctrica que permite controlar la temperatura mediante un regulador de potencia conectado a un termostato.
Existen mantas calefactoras provistas de sistema de agitación magnético por lo que se puede calentar y agitar al mismo tiempo. Las más usuales son las que están diseñadas especialmente para el calentamiento de matraces de fondo redondo desde 50 ml a 5 l e incluso mayores.
El uso de este sistema de calefacción es muy conveniente para matraces con capacidades superiores a los 500 ml, sobre todo para la destilación de disolventes en grandes cantidades y donde las temperaturas requeridas sean relativamente altas y en cierto modo estables. Para los matraces de menor tamaño se emplean con más asiduidad las placas calefactoras.
La forma más rápida de modificar el ritmo de calentamiento de una manta calefactora es cambiando la distancia entre la oquedad y el matraz, en lugar de manipular el termostato. Esta separación se puede modificar, subiendo y bajando el matraz por medio de un soporte adecuado montado fuera de la manta que permita hacerlo con rapidez.
Aunque las mantas calefactoras son muy fáciles de utilizar seguras, hay que extremar la precaución y evitar a toda costa que caiga sobre ellas cualquier producto químico incluyendo disolventes, por dos motivos:
- La temperatura que alcanza la resistencia es tal que produce la descomposición térmica de las sustancias generando vapores tóxicos o peligro de incendio.
- Se deteriora el dispositivo pudiendo producirse un mal funcionamiento e incluso cortocircuitos.
 Menos comunes en un laboratorio de Química Orgánica son las mantas calefactoras diseñadas para calentar vasos de precipitados, a diferencia de las anteriores tienen forma cilíndrica en lugar de semiesférica.
Menos comunes en un laboratorio de Química Orgánica son las mantas calefactoras diseñadas para calentar vasos de precipitados, a diferencia de las anteriores tienen forma cilíndrica en lugar de semiesférica.
Equipo de microondas
Una alternativa al uso de los dispositivos anteriormente mencionados son los equipos de microondas. Estos pueden proporcionar energía térmica a una reacción con la ventaja adicional del ahorro de tiempo y energía.
Esta forma de calentamiento utiliza la propiedad de algunas moléculas de transformar la energía electromagnética (cercana a 900 MHz) en calor, la cual provoca la rotación de los dipolos dentro del líquido lo que causa que las moléculas polares se alineen y luego relajen en el campo oscilante de la radiación electromagnética.
Cuando la energía de la rotación de esos dipolos se disipa, se produce el calentamiento del líquido. Debido a esto, al producirse el calentamiento en el interior del líquido y no transferirse desde el vaso a éste, el líquido estará a mayor temperatura que el recipiente.
Sin embargo, tienen como inconveniente que para reproducir adecuadamente los resultados, se necesitan equipos sofisticados, con precios que no suelen ser asequibles a la mayoría de los laboratorios de prácticas.
Horno de fundición
Se usan fundamentalmente para fundir metales y síntesis de materiales cerámicos. También se emplean para activar tamices moleculares y para obtener sales anhidras.
Técnicas de enfriamiento
A veces es necesario enfriar una reacción por debajo de la temperatura ambiente, por ejemplo, en reacciones muy exotérmicas donde se requiera eliminar o paliar el calor desprendido, o bien porque los reactivos o los productos sean térmicamente inestables.
En otros casos, se necesita enfriar una disolución sencillamente para propiciar la cristalización de un determinado compuesto o incluso para facilitar la condensación de un líquido. A continuación, se describen algunos procedimientos utilizados en el laboratorio para enfriar.
Baño de hielo
Es la opción más sencilla. Se llena un cristalizador con hielo, que debe estar picado y mezclado con agua para facilitar el contacto con el matraz que se quiere enfriar.
Mezcla frigorífica
Suelen ser mezclas binarias que adquieren una temperatura inferior a la de los componentes por separado. La más sencilla de todas es la mezcla compuesta por hielo y sal común.
En este caso, es algo difícil fijar la temperatura, puesto que depende de la relación entre las cantidades de hielo y sal. En la Tabla 2, se listan las diferentes mezclas frigoríficas clasificadas por temperatura.
| Temperatura (ºC) | Composicióna,b |
| 13 | p-Xileno/CO2(s) |
| 12 | Dioxano/CO2(s) |
| 6 | Ciclohexano/CO2(s) |
| 5 | Benceno/CO2(s) |
| 2 | Formamida/CO2(s) |
| 0 | Hielo |
| -5 a -20 | Hielo/NaCl |
| -10.5 | Etilen glicol/CO2(s) |
| -12 | Cicloheptano/CO2(s) |
| -15 | Alcohol bencílico/CO2(s) |
| -22 | Tetracloroetileno/CO2(s) |
| -22.8 | Tetracloruro de carbono/CO2(s) |
| -25 | 1,3-Diclorobeneceno/CO2(s) |
| -29 | o-Xileno/CO2(s) |
| -32 | m-Toluidina/CO2(s) |
| -38 | Heptan-3-ona/CO2(s) |
| -41 | Acetonitrilo/CO2(s) |
| -42 | Piridina/CO2(s) |
| -47 | m-Xileno/CO2(s) |
| -56 | n-Octano/CO2(s) |
| -60 | Éter isopropílico/CO2(s) |
| -61 | Cloroformo/CO2(s) |
| -72 | EtOH/CO2(s) |
| -77 | Acetato de butilo/CO2(s) |
| -78 | Acetona/CO2(s) |
| -83 | Propil amina/CO2(s) |
| -83.6 | Acetato de etilo/N2(l) |
| -89 | n-Butanol/N2(l) |
| -94 | Hexano/N2(l) |
| -94.6 | Acetona/N2(l) |
| -95.1 | Tolueno/N2(l) |
| -98 | MeOH/N2(l) |
| -100 | Éter dietílico/CO2(s) |
| -104 | Ciclohexano/N2(l) |
| -116 | EtOH/N2(l) |
| -116 | Eter dietílico/N2(l) |
| -131 | n-Pentano/N2(l) |
| -160 | Isopentano/N2(l) |
| -196 | N2(l) |
| aCO2(s) = nieve carbónica. bN2(l) = nitrógeno líquido. | |
Si el valor de la temperatura de reacción no resulta crítico, los baños se pueden sustituir por otros que den una temperatura parecida y que los disolventes empleados sean menos tóxicos, o más baratos.
Para las reacciones que suelen realizarse en un laboratorio de prácticas los baños con temperatura por encima de los 0 ºC se pueden sustituir por mezclas de agua/hielo controlando la temperatura con un termómetro. Para temperaturas entre 0 y -20 ºC la solución ideal debido a su bajo precio y disponibilidad es emplear hielo o bien mezclas hielo/sal.
En caso de que se necesite mantener la temperatura durante largos periodos de tiempo, es conveniente aislar el recipiente en el que se tiene la mezcla frigorífica y el matraz en el que se realiza la reacción.
Las mezclas frigoríficas, sobre todo las que conllevan el uso de disolventes más o menos tóxicos o peligrosos se están sustituyendo por enfriadores.
Baño termostático de refrigeración
El procedimiento ideal para mantener una reacción a baja temperatura es usar un baño termostático de refrigeración, constituido generalmente por una cubeta metálica rellena de un líquido que no congele a la temperatura de trabajo, donde se sumerge el recipiente con la reacción.
Enfriador de inmersión
Disponen de una unidad refrigeradora para producir frío, pero con un accesorio exterior (serpentín de enfriamiento, similar a un dedo frío) que se puede utilizar para generar frío localizado en otros tipos de cubetas de reacción.
Enfriador de circuito cerrado («Chiller»)
Los denominados enfriadores de circuito cerrado, son utilizados ampliamente para circular líquidos a baja temperatura en los condensadores habituales de agua. Su uso más común, es en rotavapores y reflujos de disolventes de bajo punto de ebullición, se suelen rellenar con una mezcla frigorífica similar a los anticongelantes que se utilizan en automoción.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
