Tabla de contenidos
Ir a la página con el listado de problemas.
Haloalcanos – Haluros de Alquilo – soluciones a los problemas
Solución 1:
a) es un bromuro terciario, b) es un cloruro secundario, c) es un bromuro secundario y alílico, d) es un cloruro primario y alílico, e) es un bromuro primario, f) un bromuro secundario y bencílico, g) es un bromuro secundario y h) un yoduro secundario y alílico. Los carbocationes obtenidos para cada uno de ellos se indican a continuación. Además, para d), f) y h) se obtienen más de un carbocatión por resonancia.
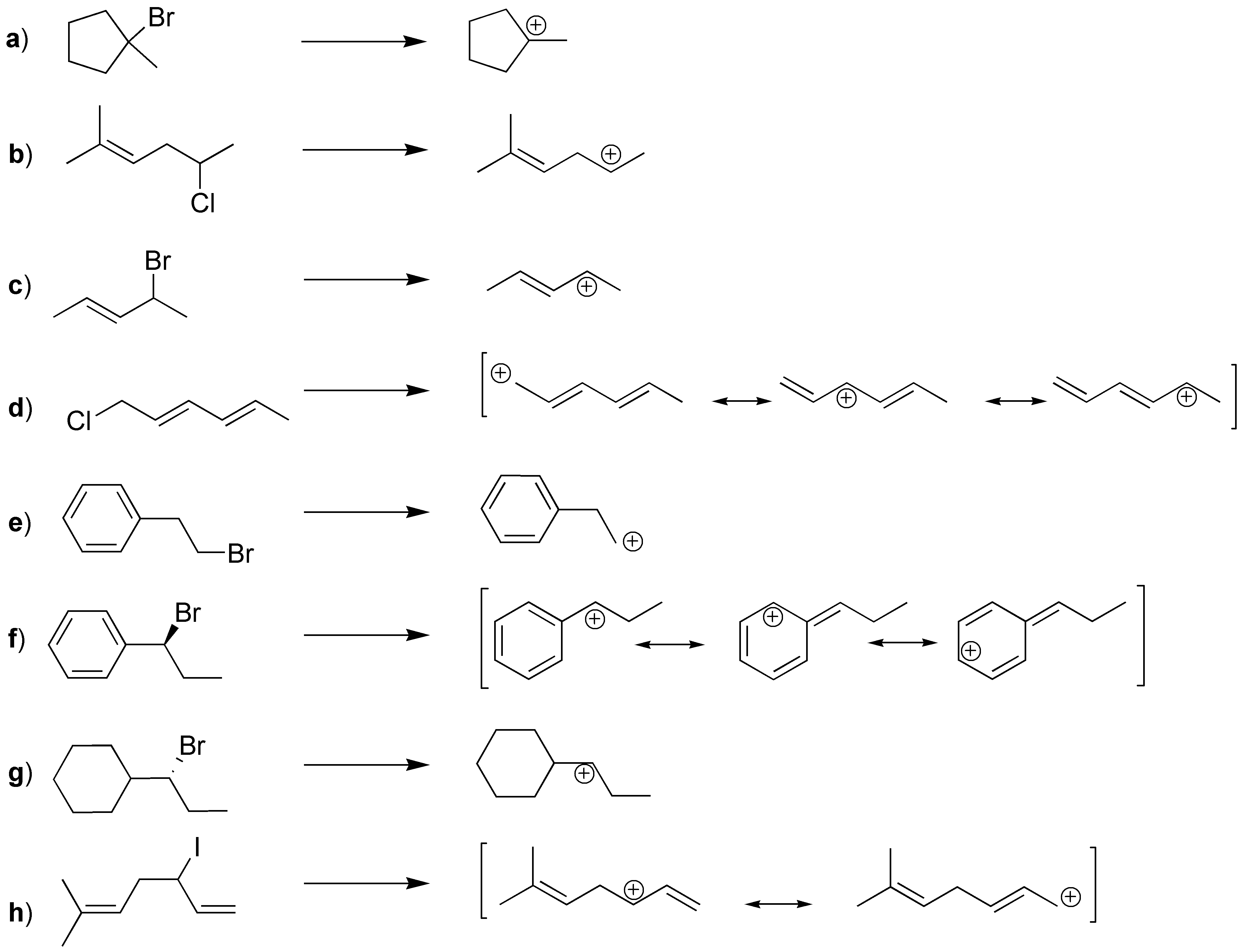
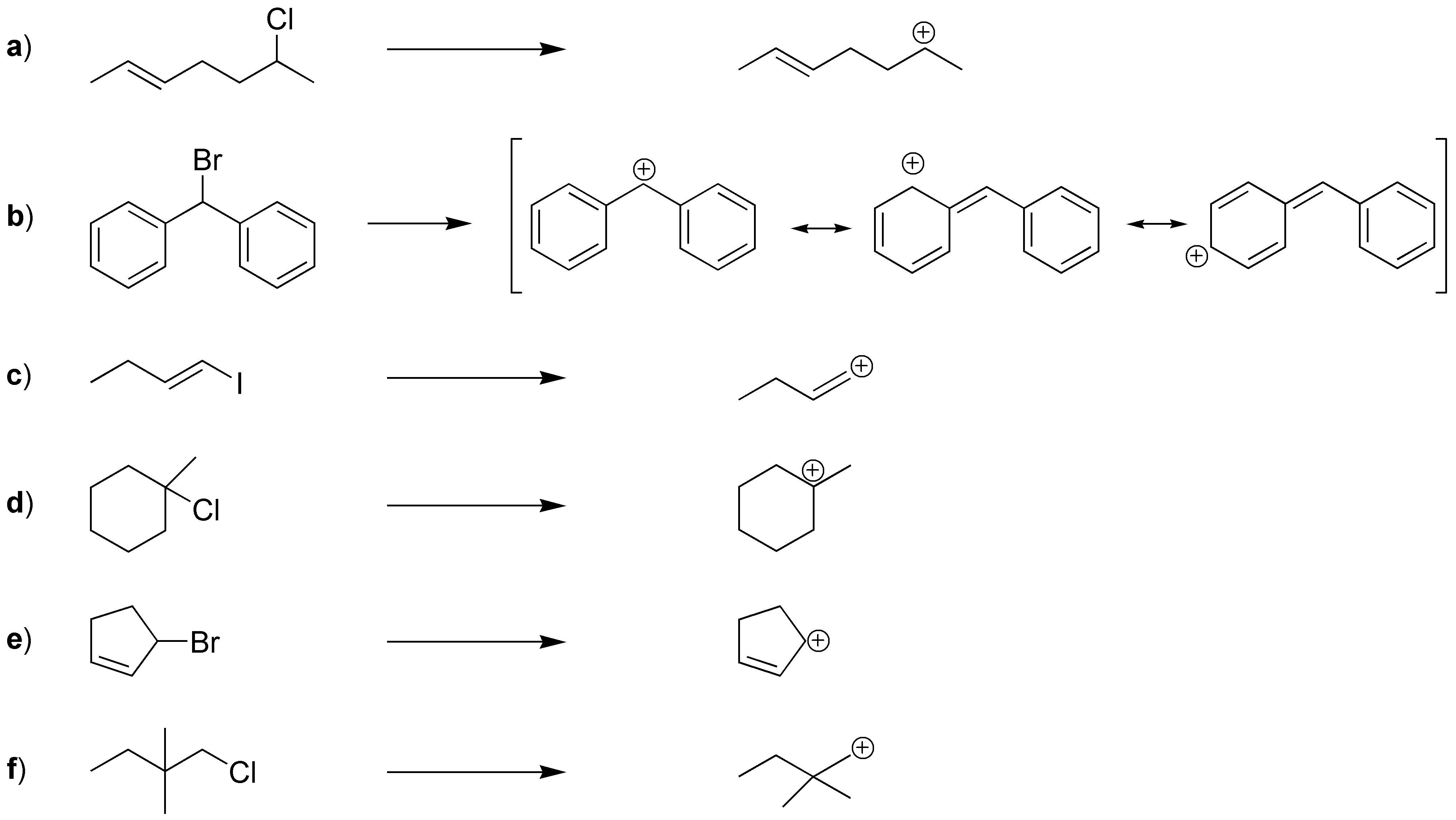
Solución 2
a) secundario; b) bencílico; c) vinílico; d) terciario; e) alílico; f) primario
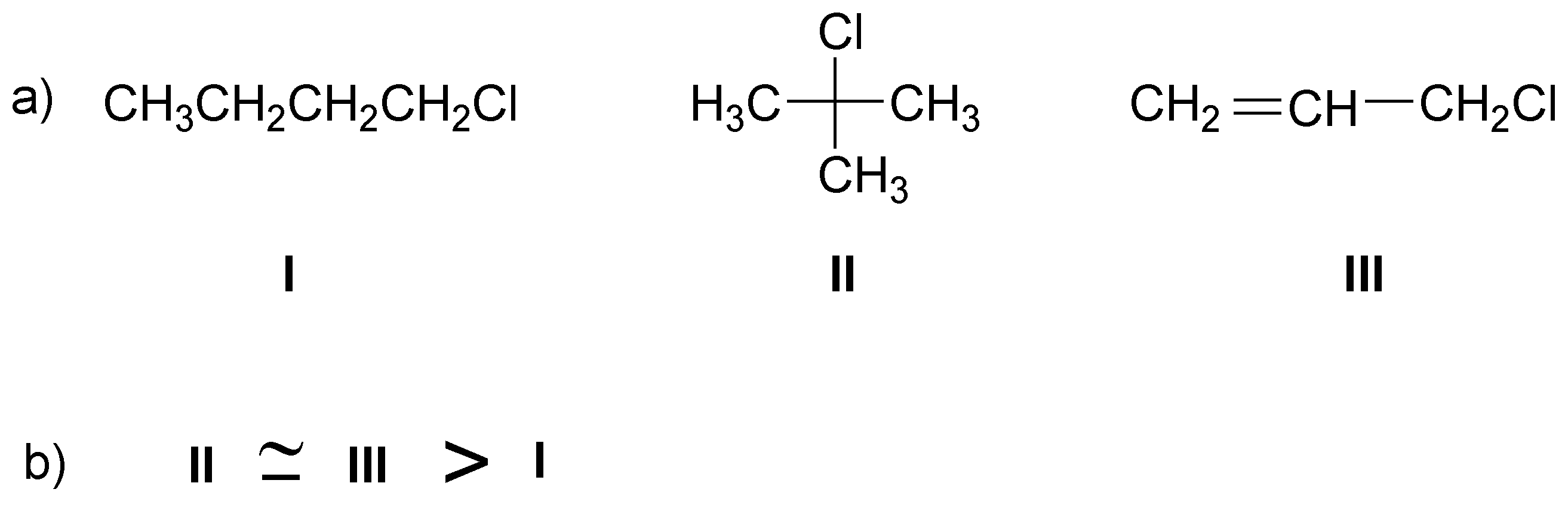
Solución 3:
La SN1 implica la formación de un carbocatión por lo que como II y III dan lugar a carbocationes muy estables (alílico y terciario) con respecto a I (primario) ambos reaccionaran más rápidamente. Las estructuras serán:
Solución 4:
La reactividad en la SN2 viene dada por el impedimento estérico por lo que el orden será: metilo, primario, secundario y terciario.
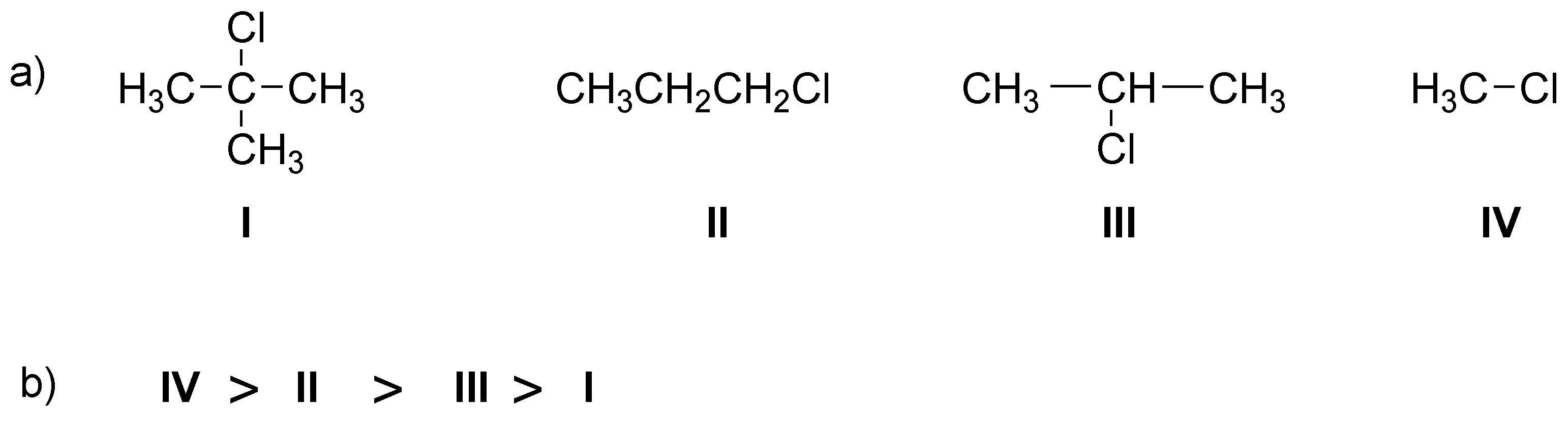
Solución 5:
Al tratarse de un cloroalcano terciario la etapa inicial será la formación de un carbocatión (pérdida de ión cloruro). Dicho carbocatión es atacado por el metanol (nucleófilo) generando un ión alquiloxonio que por pérdida de un protón genera el terc-butilmetiléter correspondiente:
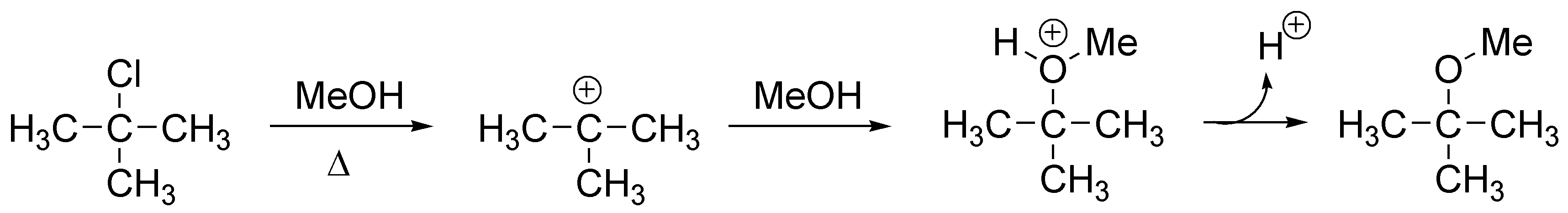
Solución 6:
Al ser un haluro de metilo se trataría de reacciones de sustitución nucleofílica bimolecular:
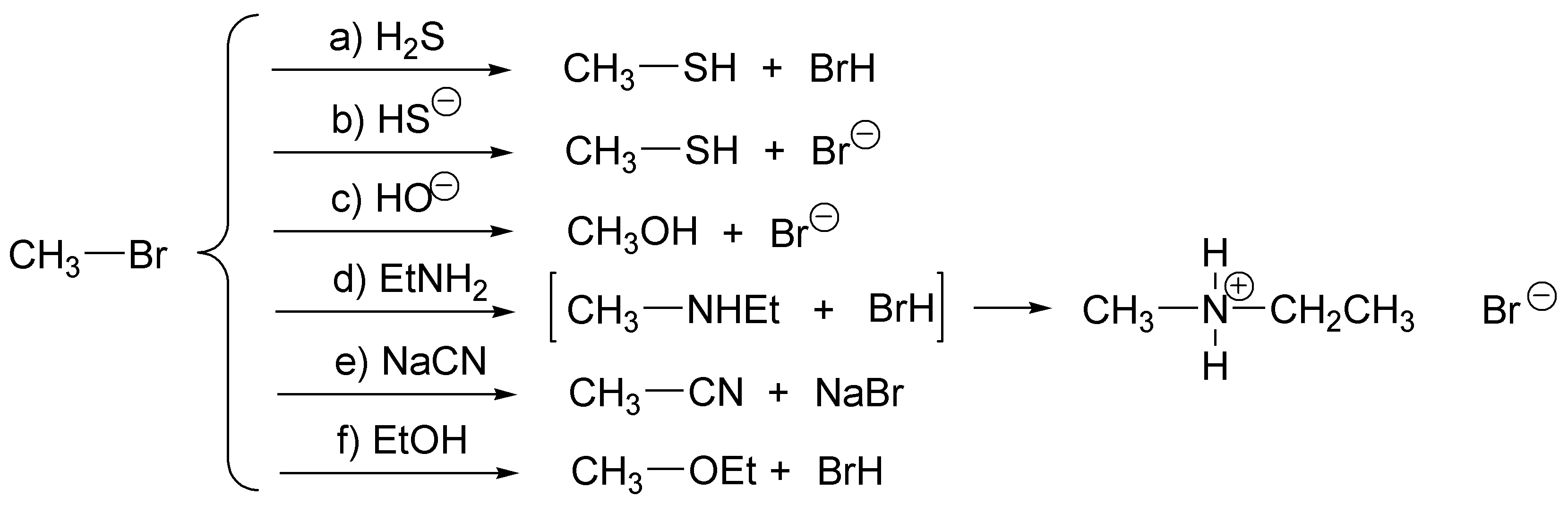
Solución 7:
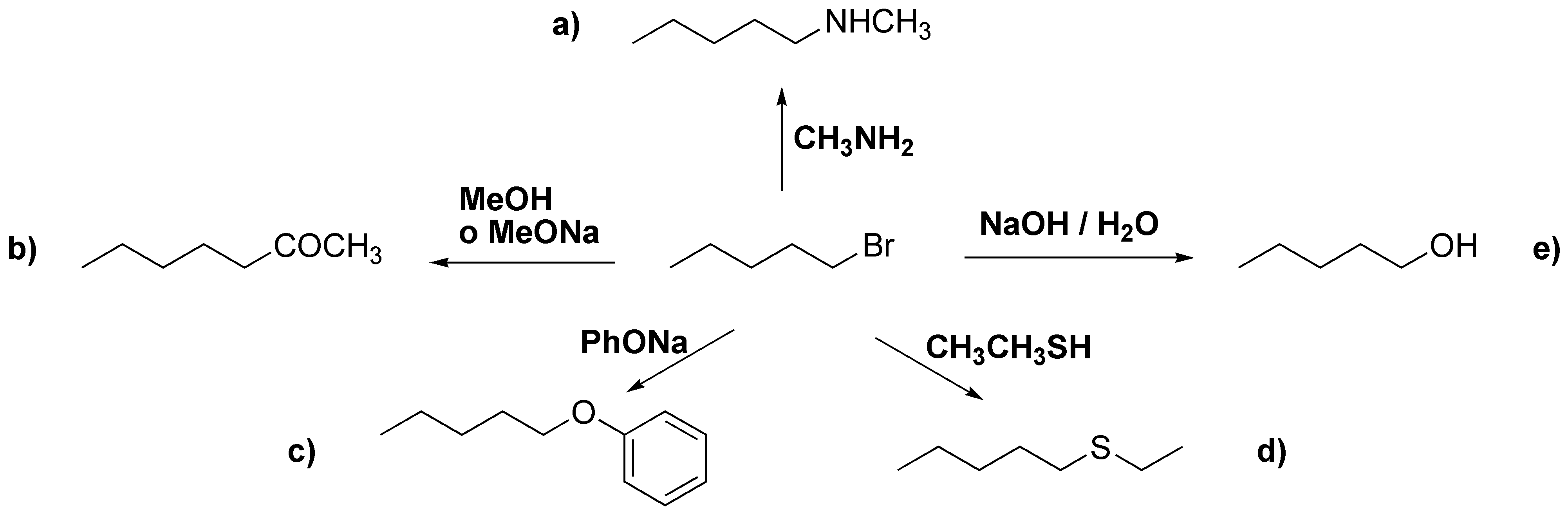
Al ser un haluro primario se trataría de reacciones de sustitución nucleofílica bimolecular y los reactivos necesarios serían los siguiente nucleófilos:
a) metilamina; b) metanol o metóxido sódico; c) fenolato sódico; d) etilmercaptano (etanotiol); e) hidróxido sódico en agua
Solución 8:
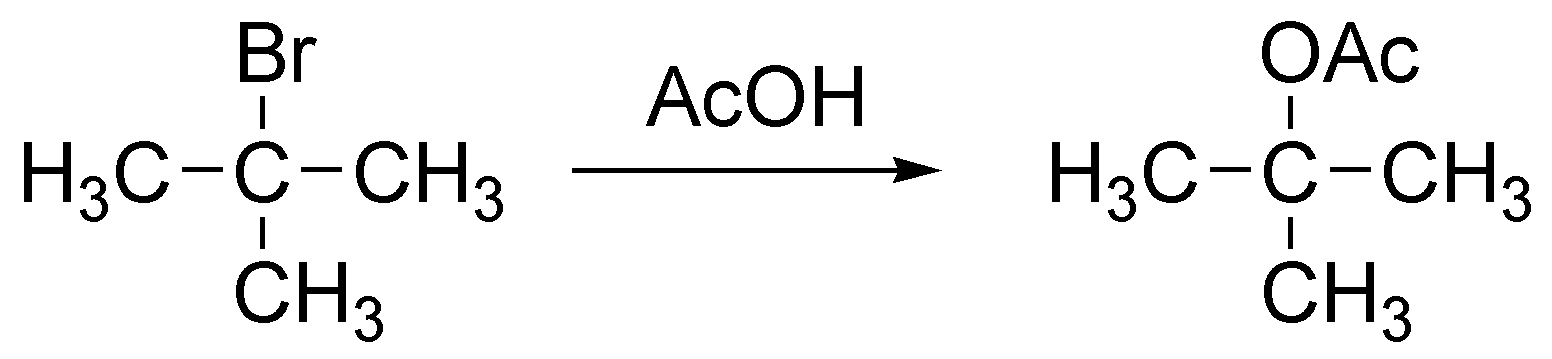
a) Es una reacción SN1 por tratarse de un haloalcano terciario.
b) La etapa determinante de la velocidad es la formación del carbocatión terciario.
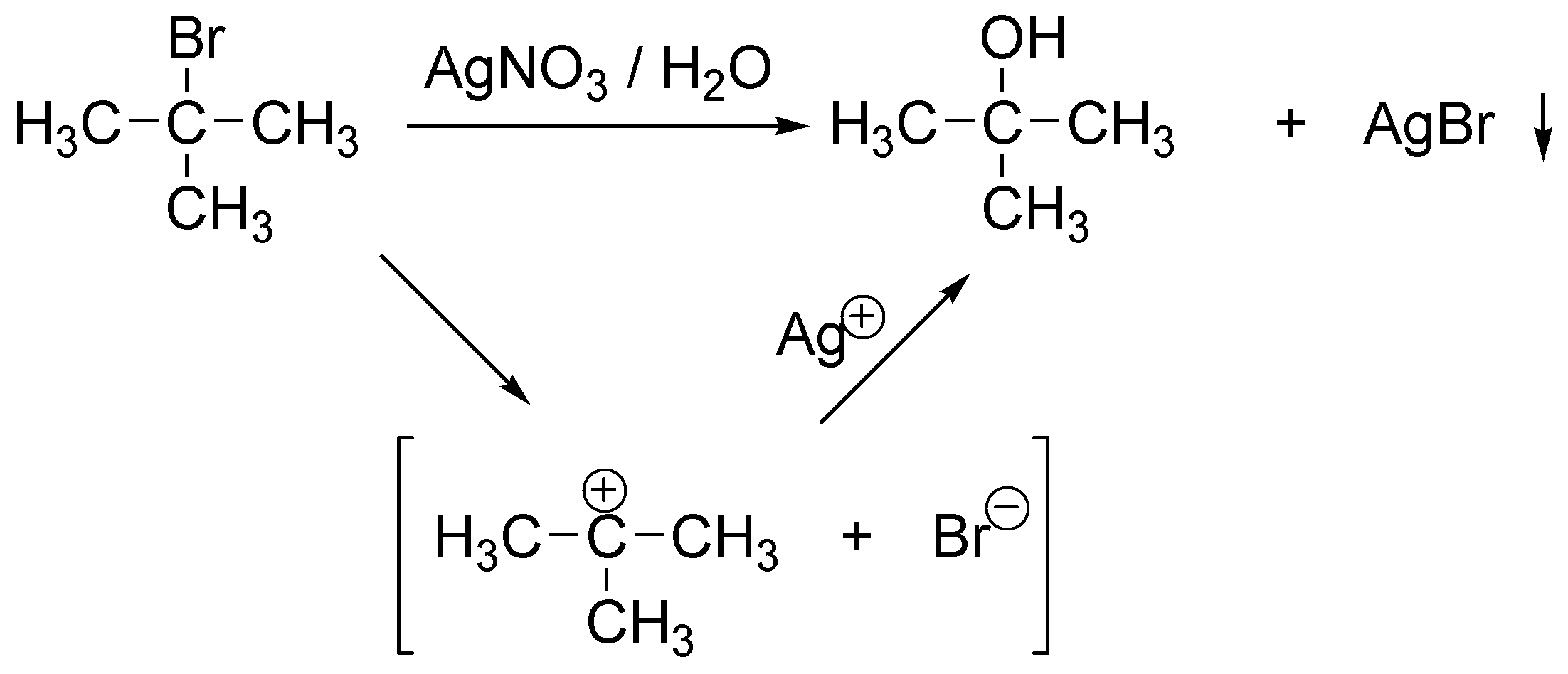
Solución 9:
Se trata de una SN1
Solución 10:
Se trata de una reacción SN2 y por tanto las reactividades relativas dependerán del grado de sustitución del sustrato: en el primer y tercer caso se tratan se bromuros primarios frente a secundarios y en el segundo caso se trata de quien es mejor grupo saliente (bromuro frente a cloruro).
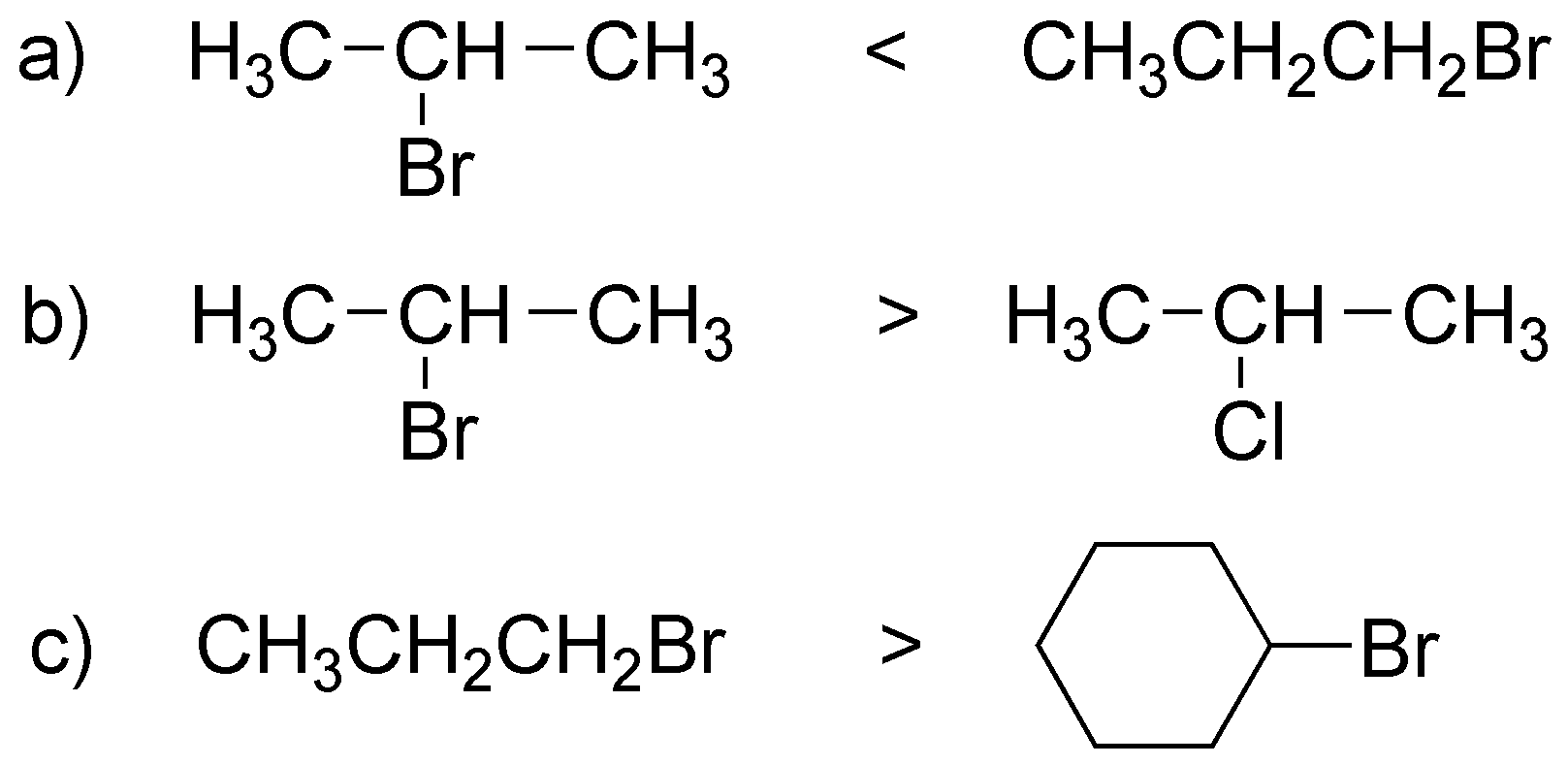
Solución 11:
Se trata de una reacción SN2 y por tanto las reactividades relativas dependerán del grado de sustitución del sustrato; aunque ambos son haluro primarios el segundo posee más impedimento estérico y por tanto reaccionará más lento y con peor rendimiento (dará más eliminación E2).
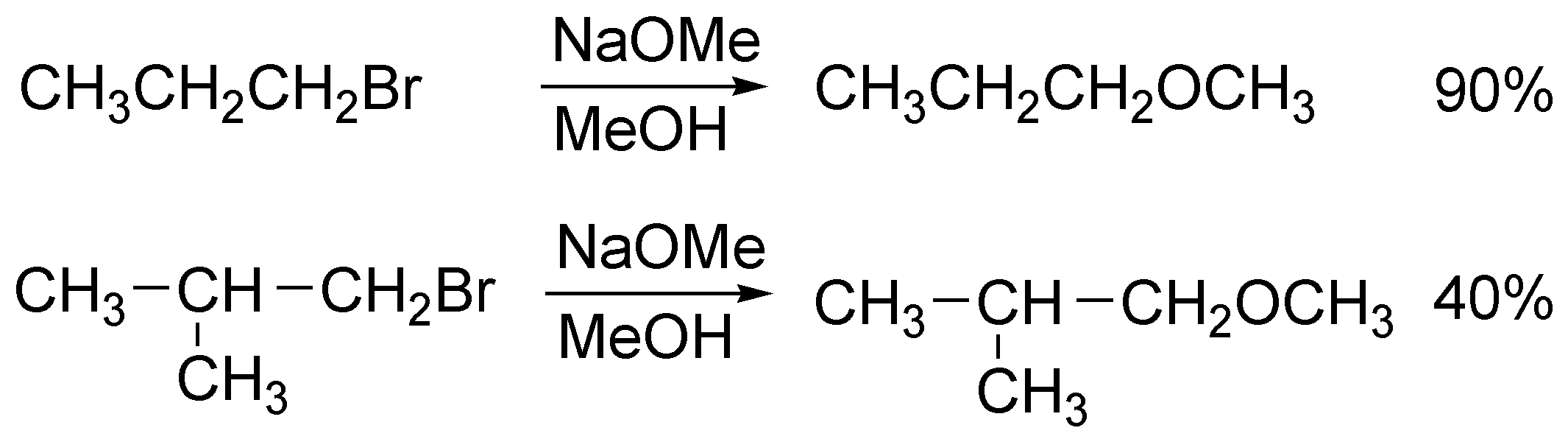
Solución 12:
Es un proceso de segundo orden por lo que la velocidad de reacción dependerá de las concentraciones de 1-yodopropano de cianuro, v = k [R-I]·[CN–]. En el estado de transición se produce la rotura y formación simultánea de los enlaces del grupo saliente y del nucleófilo en el carbono primario de forma simultánea. En este tipo de reacciones no hay intermedios de reacción, por lo que el perfil de la reacción se caracteriza por un máximo energético (estado de transición) según avanzamos en la coordenada de reacción desde los reactivos a los productos. Si se disminuye la concentración de cianuro y se mantiene la de yoduro, la velocidad de reacción se reduce a la mitad.
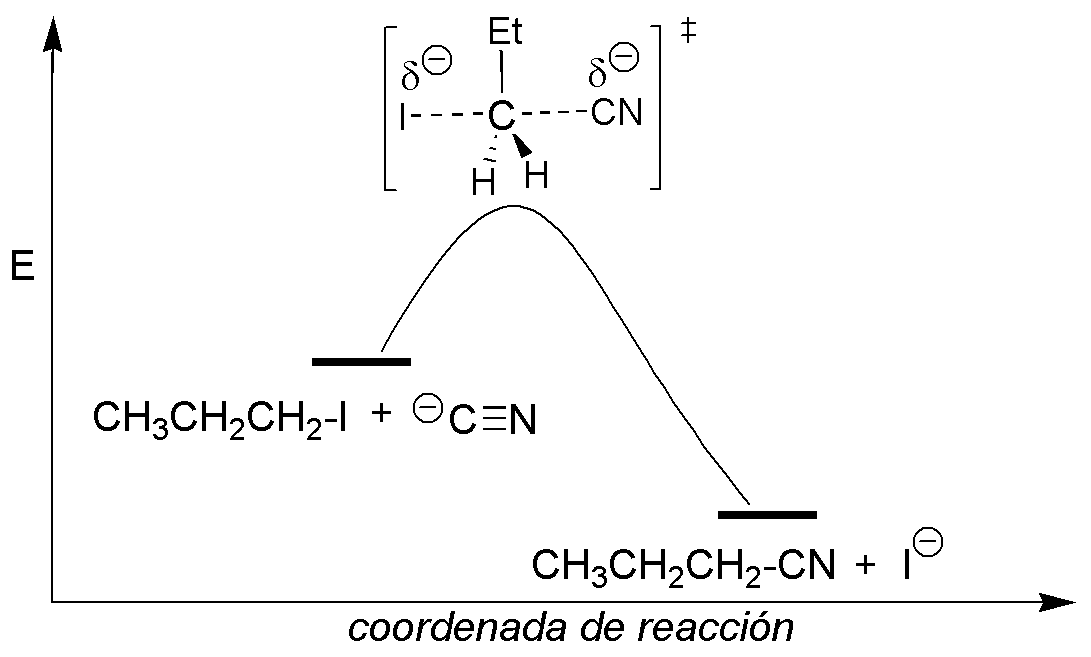
Solución 13:
a) El ión I– es más nucleófilo que el Cl–. La nucleofilia aumenta cuando se desciende en un grupo de la tabla periódica.
b) El azufre es más nucleófilo que el oxígeno por la misma razón que en el apartado anterior.
c) El agua es un nucleófilo relativamente débil comparado con el ión hidroxilo debido que la densidad electrónica es mayor en el átomo de oxígeno para el hidroxilo que para el agua.
d) El metóxido es más nucleófilo que el fluoruro. A igualdad de otras condiciones, la nucleofilia de dos átomos en una misma fila de la tabla periódica aumenta hacia la izquierda. Además, los valores de pKa para los ácidos conjugados son 5 para el HF y 16 para el CH3OH. Cuanto más bajo sea el valor del pKa indica que el ácido es más fuerte y por tanto, su base conjugada será más débil.
Solución 14:
a) Las reacciones I (NaOH/MeOH), II (NaOH/DMSO), y V (H2O)conducen a la formación de 2-metilbutan-1-ol. Las reacciones III (NaSH/MeOH) y IV (NaSH/DMSO) producen 2-metil-butanotiol. En todos los casos el mecanismo de las reacciones es de tipo SN2.
![]()
b) La reacción más rápida será aquella en la que se utiliza el nucleófilo más fuerte con un disolvente aprótico. Estas condiciones se dan en el caso de las reacciones IV y II.
Solución 15:
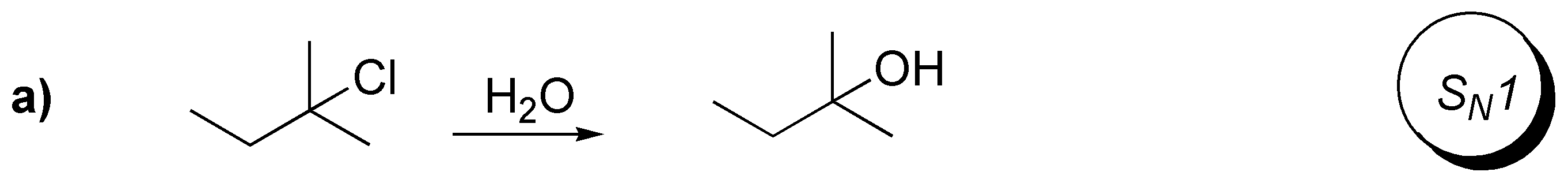
a) Dada la naturaleza del sustrato, que es un haluro terciario, y del reactivo, que es un nucleófilo débil, polar y prótico, el mecanismo más probable es una reacción de tipo SN1, y en este caso se trata de una reacción de solvólisis.
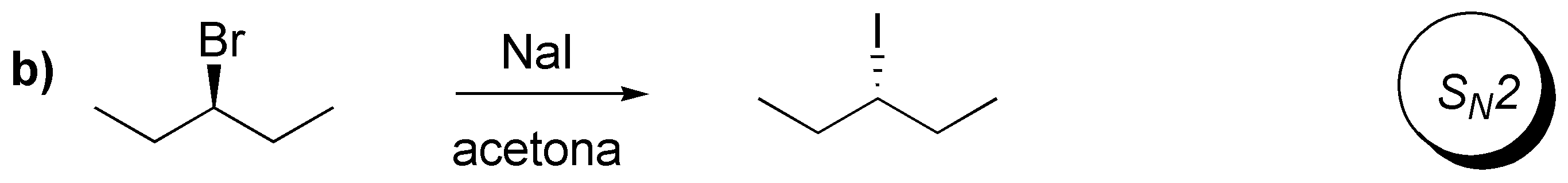
b) La reacción es de tipo SN2, ya que transcurre en un sustrato secundario con inversión de la configuración y usando un buen nucleófilo y un disolvente polar aprótico como la acetona.
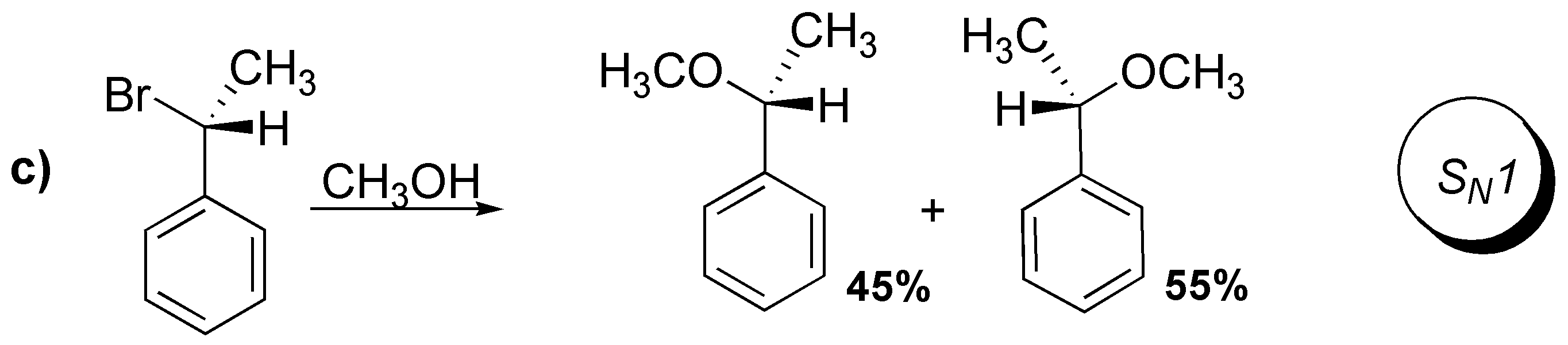
c) Se parte de un sustrato quiral y como resultado se obtiene una mezcla de dos enantiómeros en proporciones parecidas. El haluro de partida es secundario, y el carbocatión que se genera secundario y bencílico. El nucleófilo (metanol) ataca por las dos caras del carbocatión sin preferencia marcada, con lo cual el tipo de reacción es SN1.
d) El tipo de reacción es SN2 por las condiciones de la reacción. Es un sustrato similar al del caso anterior y la reacción se lleva a cabo en presencia de un buen nucleófilo como el cianuro y con un disolvente polar aprótico como el DMSO. Por tanto, se produce inversión de la configuración.
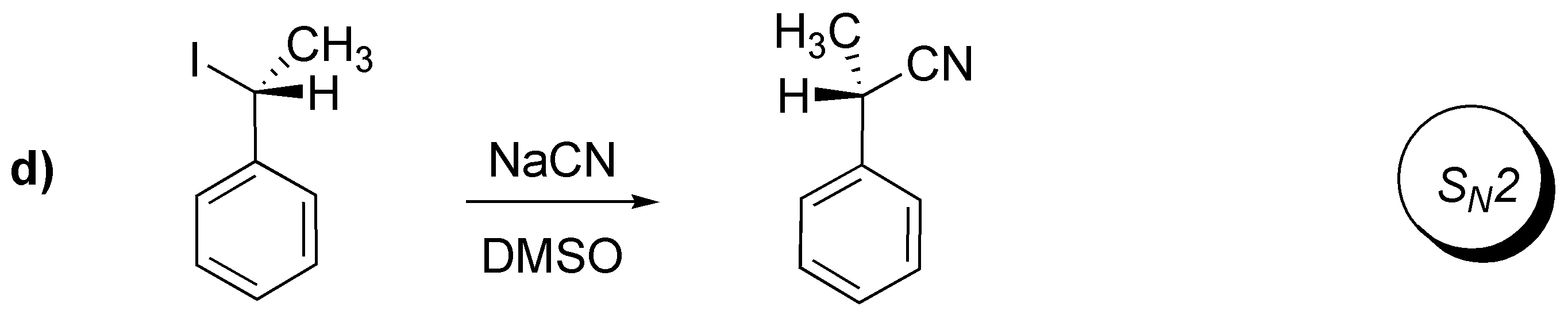
Solución 16:
A.- Se sustituye un átomo de bromo por un grupo OH con inversión de la configuración. Para realizar esta transformación el reactivo adecuado es NaOH.
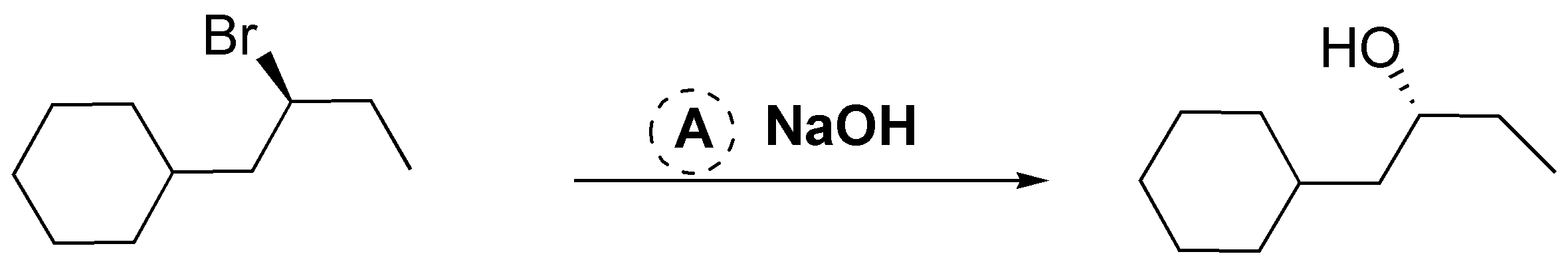
B.- En este caso no habrá reacción, ya que el bromo se encuentra en una posición primaria, por lo que una reacción de solvólisis es muy improbable, y el agua no es lo suficientemente nucleófila como para dar la reacción SN2. Por otro lado el cloro sobre el anillo de benceno es inerte en estas condiciones.
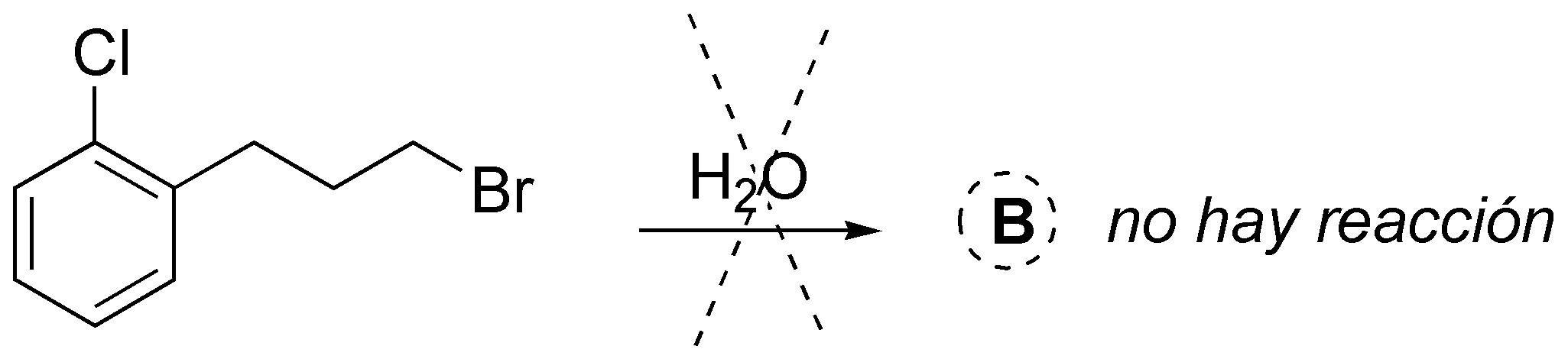
C.- Los haluros de alilo primarios y secundarios reaccionan rápidamente con nucleófilos mediante un mecanismo SN2. Los tioles forman fácilmente con bases los correspondiente tiolatos, que son unos excelentes nucleófilos por lo que se obtendrá el siguiente producto con inversión de la configuración:
D.- Se trata de una solvólisis con metanol. El intermedio de reacción es un carbocatión secundario y alílico que se encuentra estabilizado por resonancia, por lo que el nucleófilo puede atacar en las dos posiciones donde hay mayor densidad de carga positiva. En una de las posiciones se obtendría la mezcla racémica de productos.
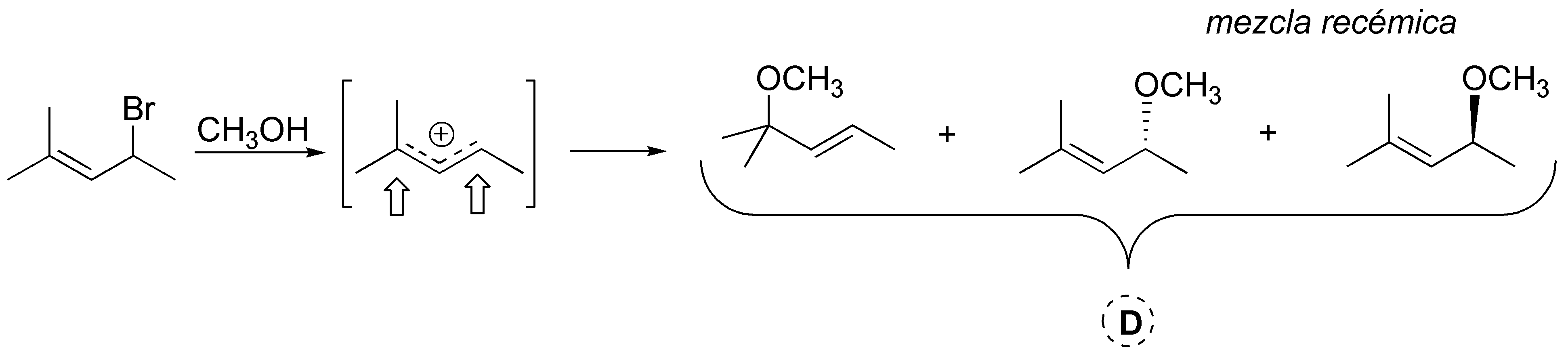
Solución 17:
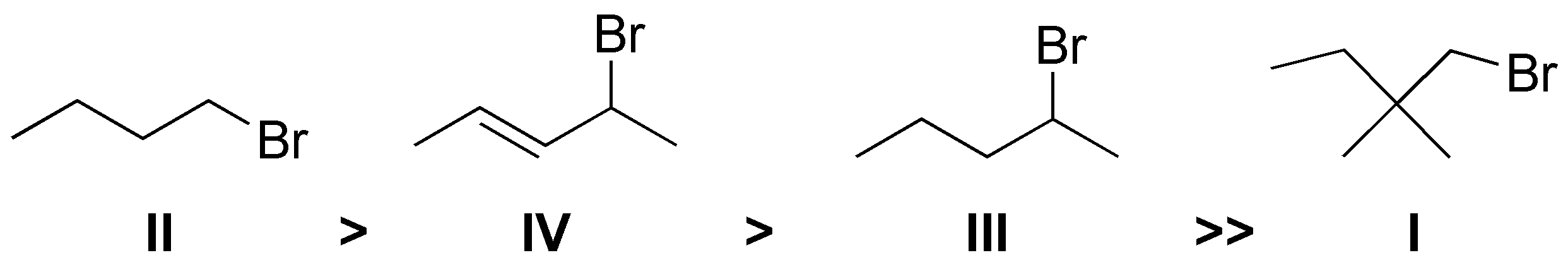
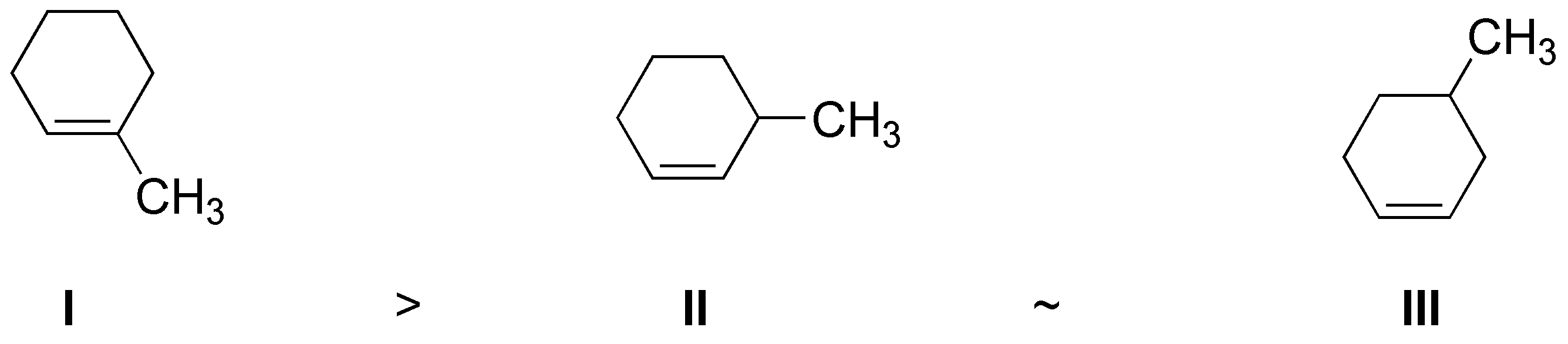
El orden de reactividad es II > IV > III >> I. El sustrato que presenta mayor facilidad para la SN2 es II, ya que es un bromuro primario con bajo impedimento estérico para el acercamiento de un nucleófilo. En orden decreciente de velocidad de reacción le sigue el sustrato IV ya que es secundario y además alílico. A continuación estaría III, ya que es secundario y por último I que sería prácticamente inerte, ya que los sustituyentes en posición β impiden el acercamiento del nucleófilo.
Solución 18:
La velocidad de solvólisis de un sustrato viene dada por su capacidad para formar carbocationes estables, ya que la reacción transcurre a través de un mecanismo SN1. II genera un carbocatión terciario, I uno secundario mientras que III es una estructura rígida que impide la formación de un carbocatión convencional. El orden de reactividad es II > I >> III.
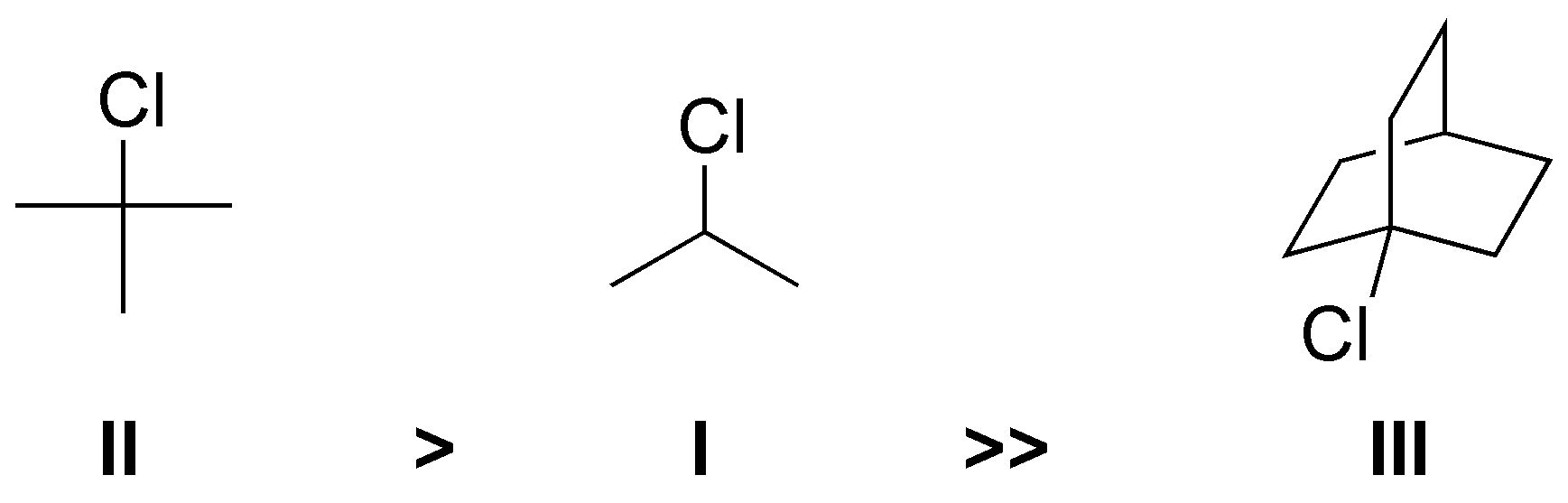
Solución 19:
La reacción que se describe es una solvólisis, que en el caso de utilizar agua como disolvente, recibe el nombre específico de hidrólisis. La reacción transcurre mediante un mecanismo SN1, a través de un carbocatión. El carbocatión que se forma en primera instancia es secundario. Sin embargo, el producto obtenido sugiere el ataque de la molécula de disolvente en una posición terciaria. Para justificar este hecho se debe producir una transposición de un átomo de hidrógeno como hidruro según el siguiente esquema:
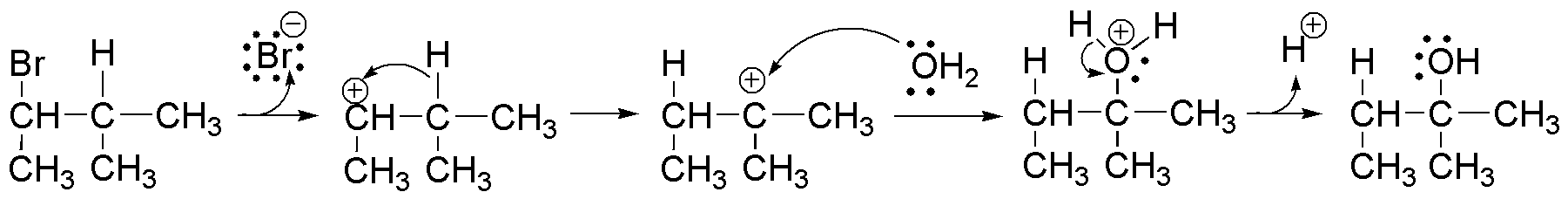
La fuerza impulsora de la transformación es la formación de un carbocatión terciario, mucho más estable que el secundario.
Solución 20:
La reacción es de tipo SN2 intramolecular, ya que la base genera un alcóxido que actúa como nucleófilo y desplaza al cloro que se encuentra en la propia molécula dando como resultado la formación de un ciclo de cinco miembros
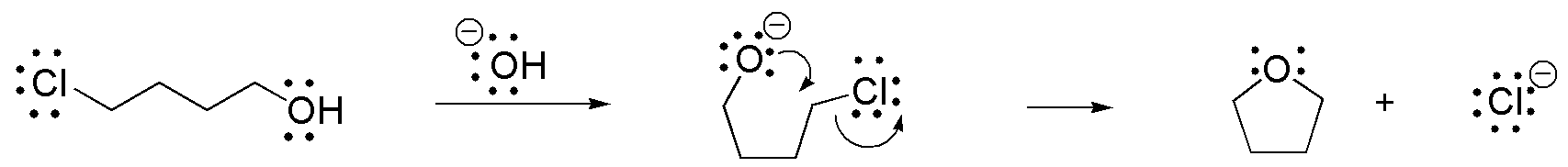
Solución 21:
a) En la siguiente figura, los hidrógenos en posición α se indican con un círculo discontinuo:
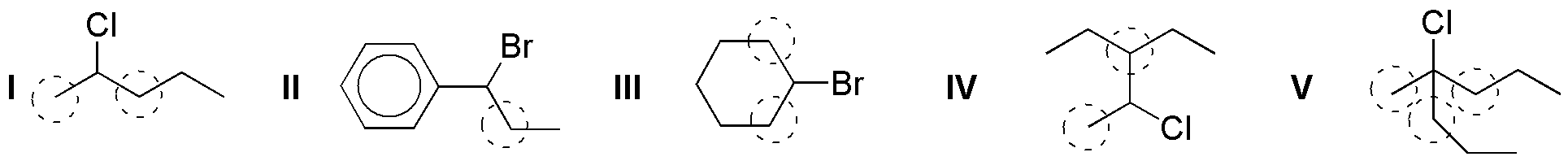
b) En las condiciones adecuadas las reacciones de eliminación se darán en estos sustratos por pérdida del grupo saliente Cl y Br y de un hidrógeno situado en las posiciones α.
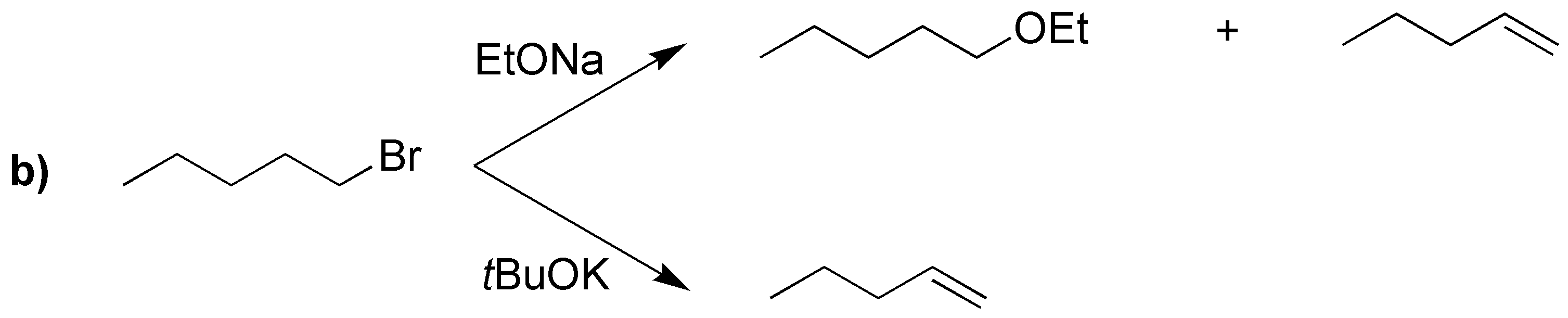
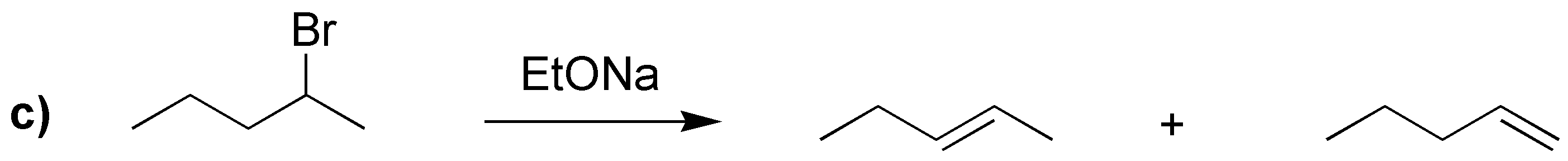
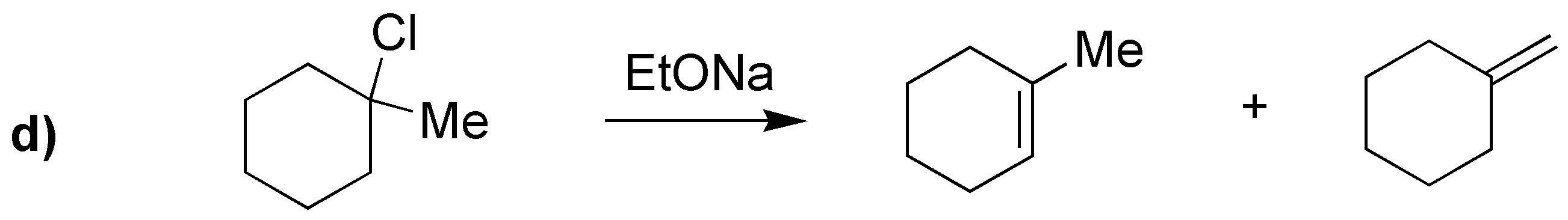
Si se da la posibilidad de formación de varios alquenos, debido a que pueda haber varios hidrógenos a que se encuentran en la posición adecuada para que se produzca la reacción de eliminación, en las condiciones habituales en las que se realiza este tipo de procesos (bases no voluminosas como KOH o NaOEt), se sigue la regla de Zaitsev basada en observaciones experimentales nos dice que “el producto mayoritario será el alqueno más sustituido, y cuando exista la posibilidad, predomina la formación del alqueno de configuración relativa E (trans) sobre el Z (cis), por ser termodinámicamente más estable”. De acuerdo con estas consideraciones, el resultado de las reacciones propuestas es el siguiente:
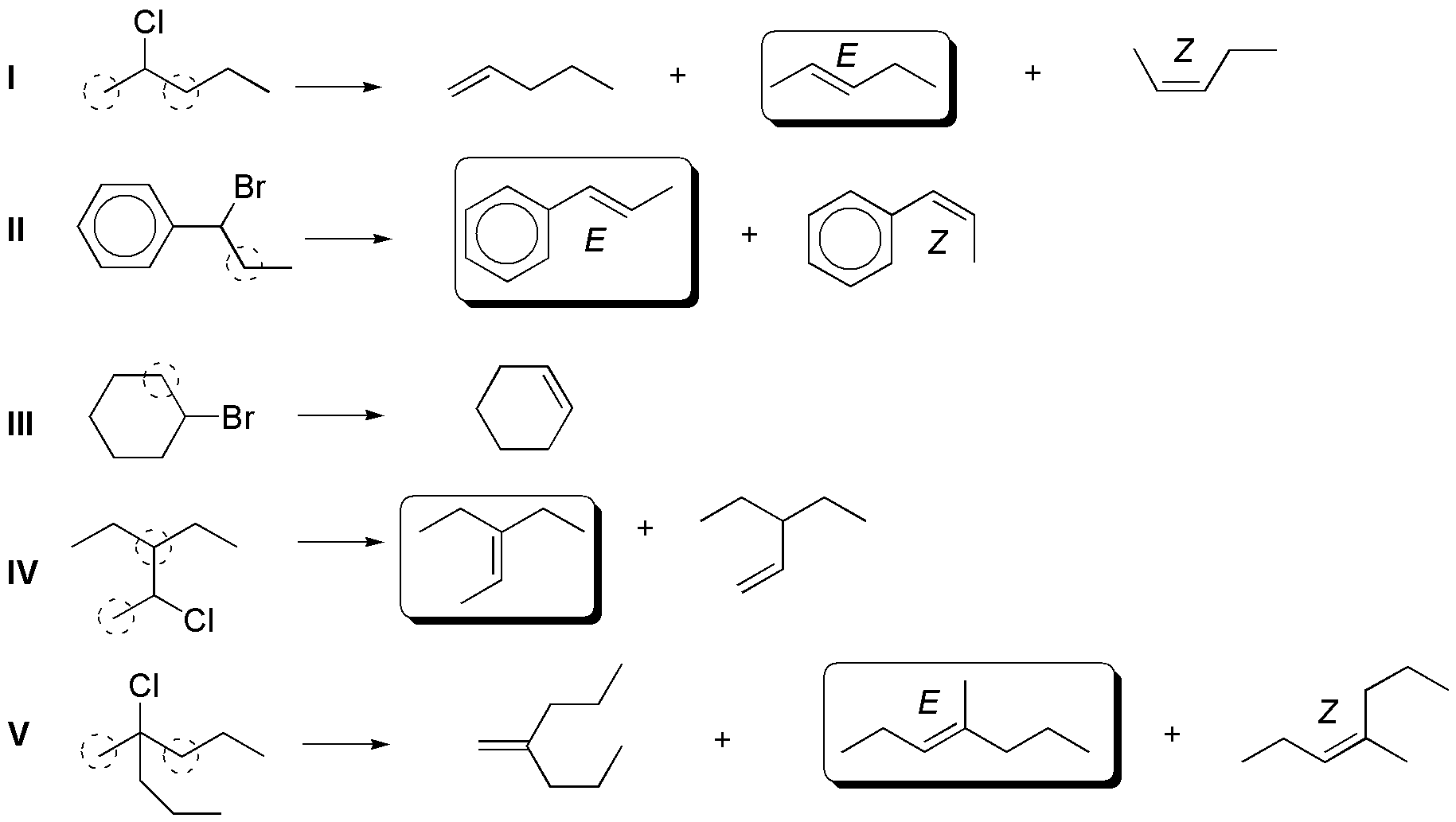
Los alquenos que se obtienen en mayor proporción en I, II, IV y V son los que aparecen con un recuadro. Para el compuesto IIIse obtiene un único producto, ya que las posiciones marcadas conducen hacia la formación del mismo producto.
Solución 22:
Al tratarse de haloalcanos primarios, las reacciones a) y c) serán dos SN2. Mientras que la b) al tratarse de un haloalcano bencílico será una SN1.



Solución 23:
La diferencia entre realizar la reacción en metanol o en acetona estriba en la naturaleza del disolvente (prótico en el primer caso y aprótico en el segundo). Los disolventes próticos favorecen la SN1 mientras que los apróticos la SN2, por lo que en metanol suelen predominar las racemizaciones mientras que en acetona predominan las inversiones de configuración.
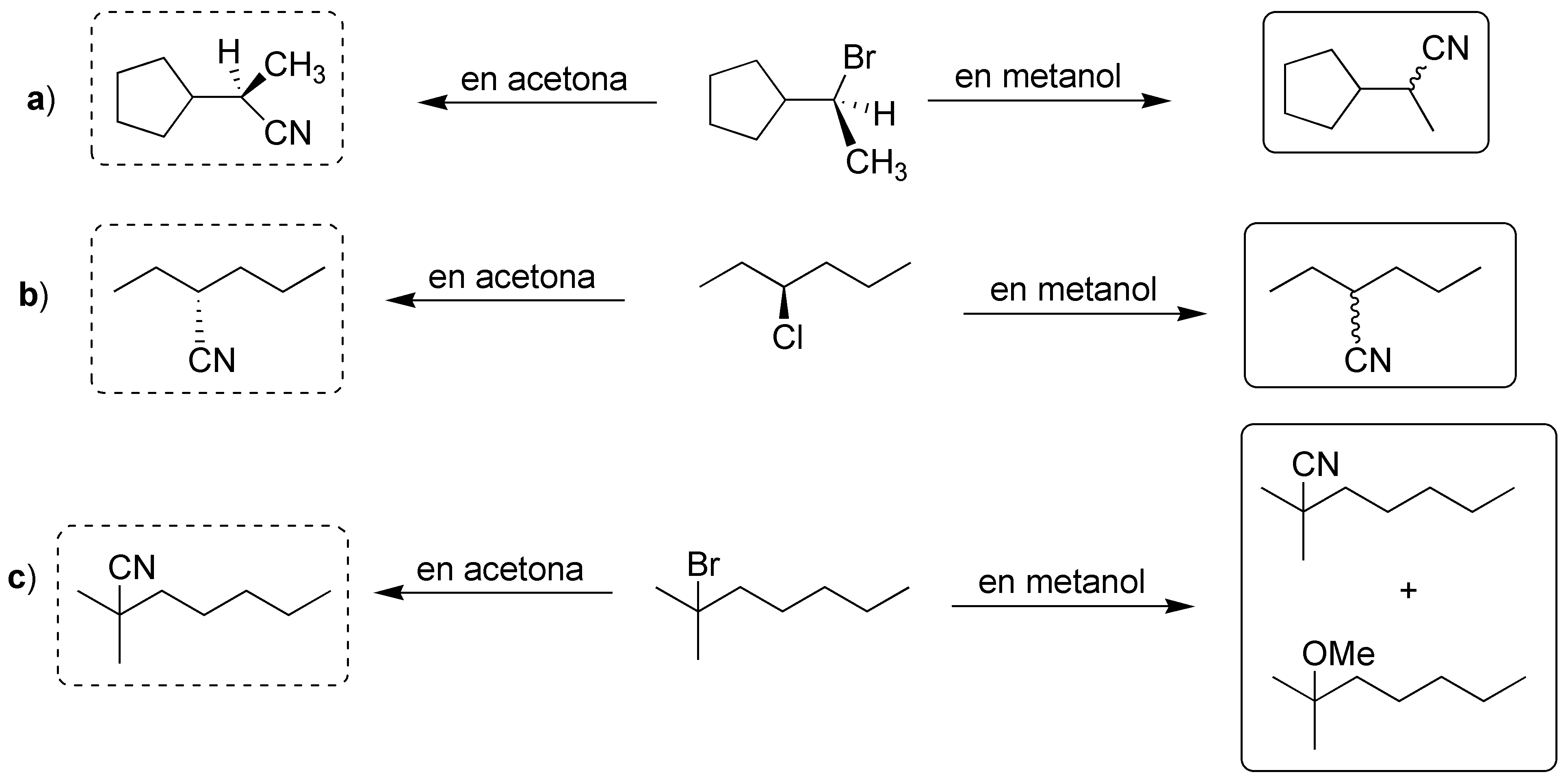
Solución 24:
a) Al ser una reacción tipo SN1, la concentración de metanol, que actúa como disolvente y nucleófilo, no influye en la velocidad del proceso.
![]()
Solución 25:
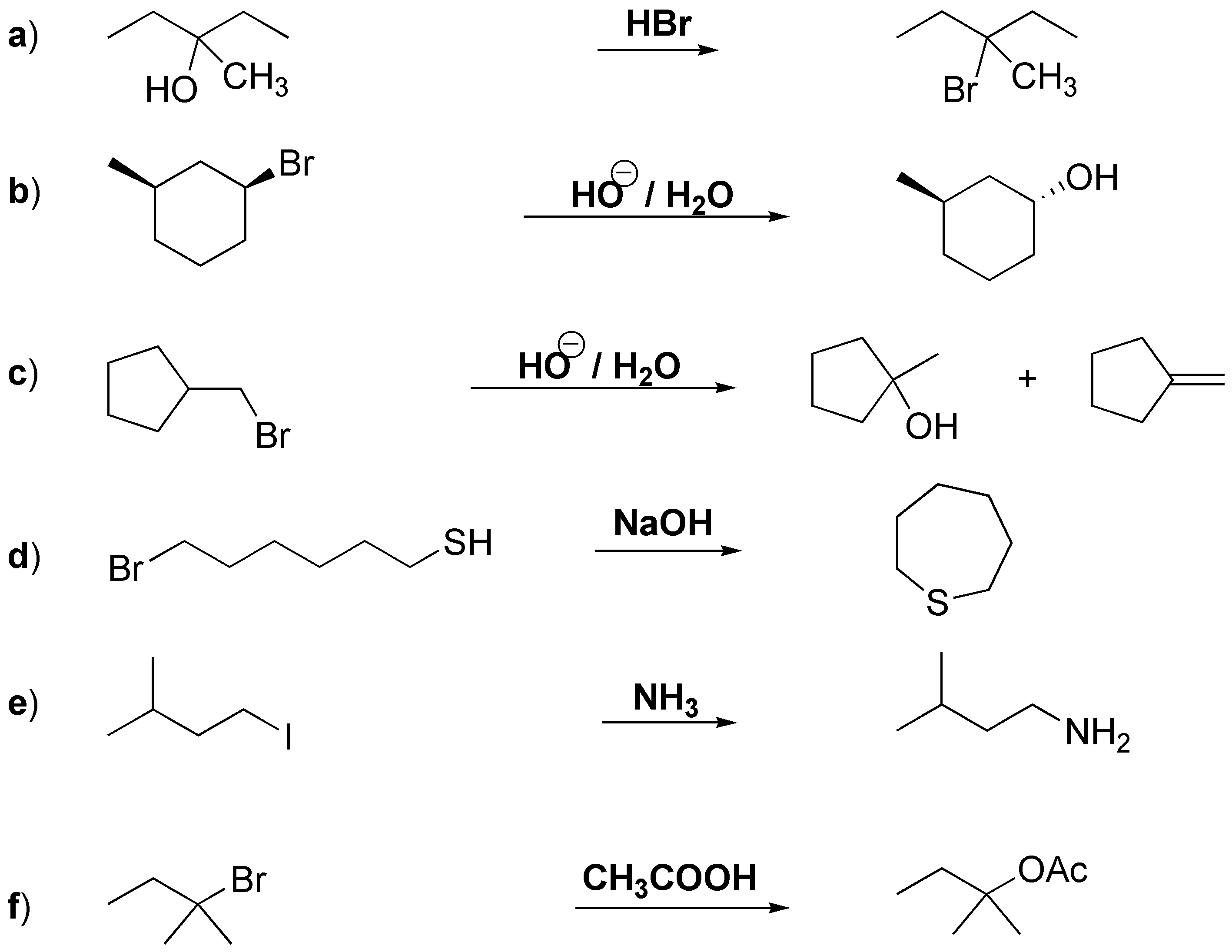
a) Se trata de una sustitución nucleófila, el grupo hidroxi se transforma en un buen grupo saliente por tratamiento con ácido fuerte, convirtiéndose en un ión hidronio que es sustituido por el ión bromuro. b) La solvólisis de un bromo alcano secundario aunque lenta es posible. c) En la sustitución del haluro primario se puede producir una transposición dando lugar al alcohol terciario; sin embargo predominaría la eliminación. d) se trata de una SN2 intramolecular el tiol en medio básico formará el tiolato que sustituye al bromo primario. e) Otra SN2 el ión yoduro es buen grupo saliente, se encontraría el producto final como sal de amonio. f) Es una SN1, aunque el ión acetato es mal nucleófilo es el único ión presente.
Solución 26:
a) Es una SN2 pues el ión yoduro es un buen nucleófilo y una base muy débil; b) SN2 la eliminación no es posible; c) E2, pues el ión metóxido es una base muy fuerte; d) SN1, es un haloalcano terciario y el agua es un disolvente muy polar y prótico; e) SN2 el ión cianuro es buen nucleófilo; f) Aunque el ión cianuro es buen nucleófilo el haloalcano está muy impedido y no se producirá reacción; g) SN2, pues es un alcohol primario, posiblemente se producirán transposiciones.
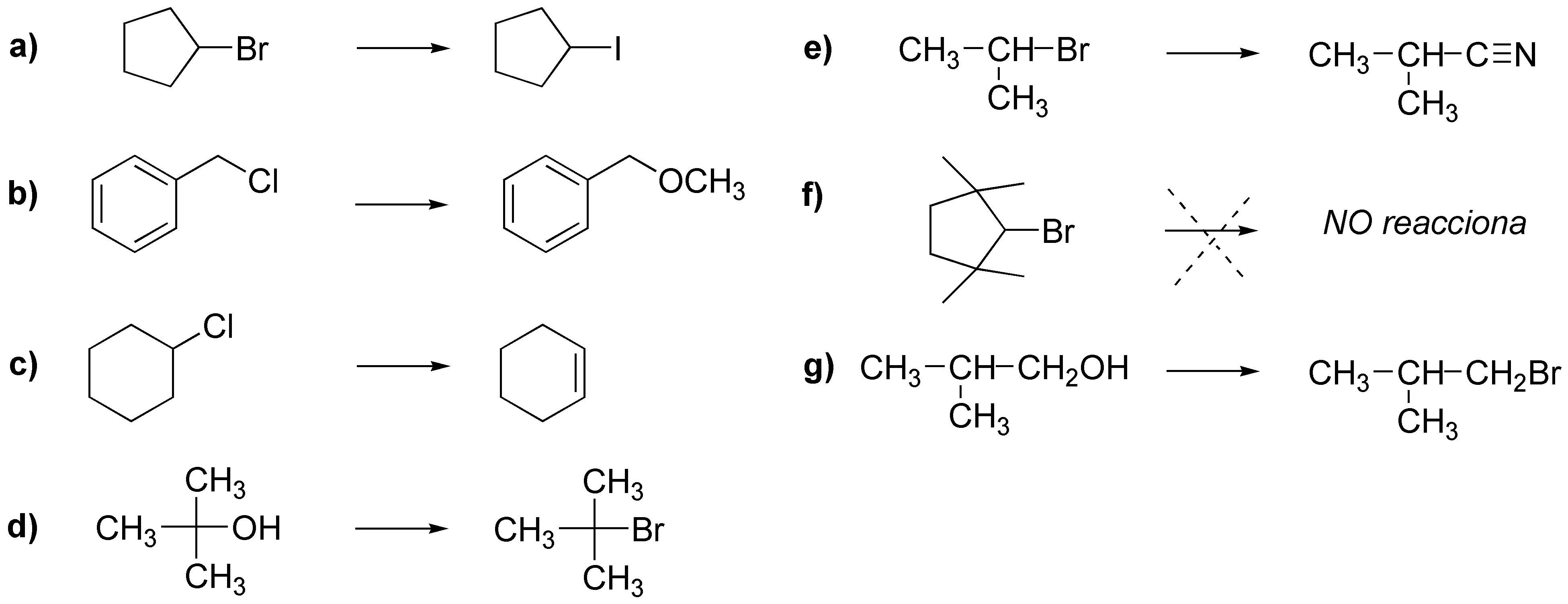
Solución 27:
Los productos de partida son:

En las reacciones de eliminación el grupo saliente y el átomo de hidrógeno que se eliminan deben situarse en una disposición antiperiplanar, que en el caso de anillos de ciclohexano significa que ambos grupos se encuentran trans-diaxiales.
Para apreciar la situación usamos un método de proyección que permita saber qué grupos se encuentran en disposición axial y ecuatorial, por lo que usamos la representación en silla.
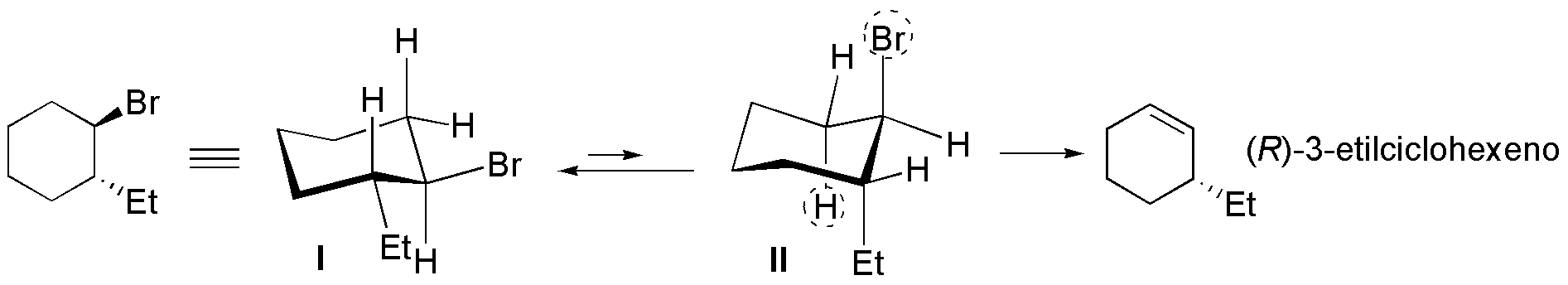
En el confórmero más estable (I) los grupos más voluminosos, Br y etilo, se encuentran en una disposición ecuatorial por lo que no es posible que se dé la reacción de eliminación. El compuesto debe evolucionar hacia el confórmero II, menos estable, pero con el grupo saliente en axial y el hidrógeno marcado con el círculo discontinuo antiperiplanar con respecto a éste. Como resultado de la reacción se obtiene el (R)-3-etilciclohexeno. En cuanto al (1S,2R)-1-bromo-2-etilciclohexano la eliminación se produce a partir del confórmero que presenta el átomo de bromo en disposición axial (III). Hay dos hidrógenos que se sitúan antiperiplanares con respecto al grupo saliente, y que aparecen marcados con círculo discontinuo, y que pueden dar dos alquenos diferentes. El producto mayoritario será el 1-etilciclohexeno, ya que es el alqueno más sustituido.
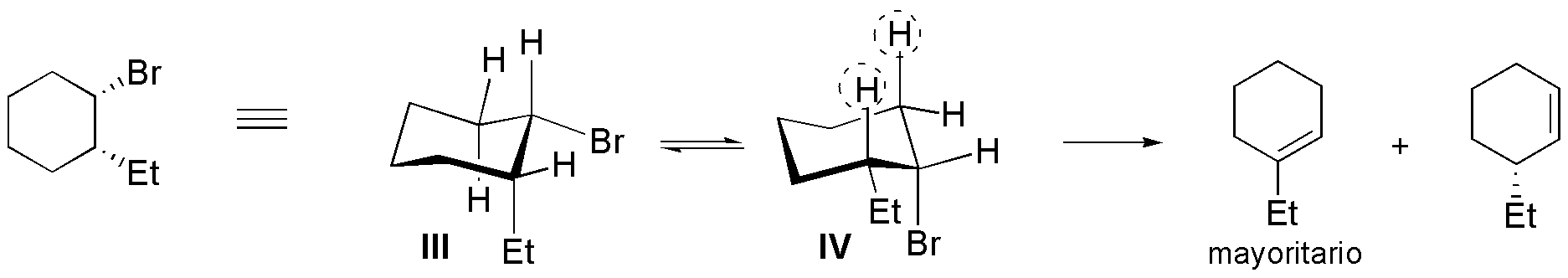
Solución 28:
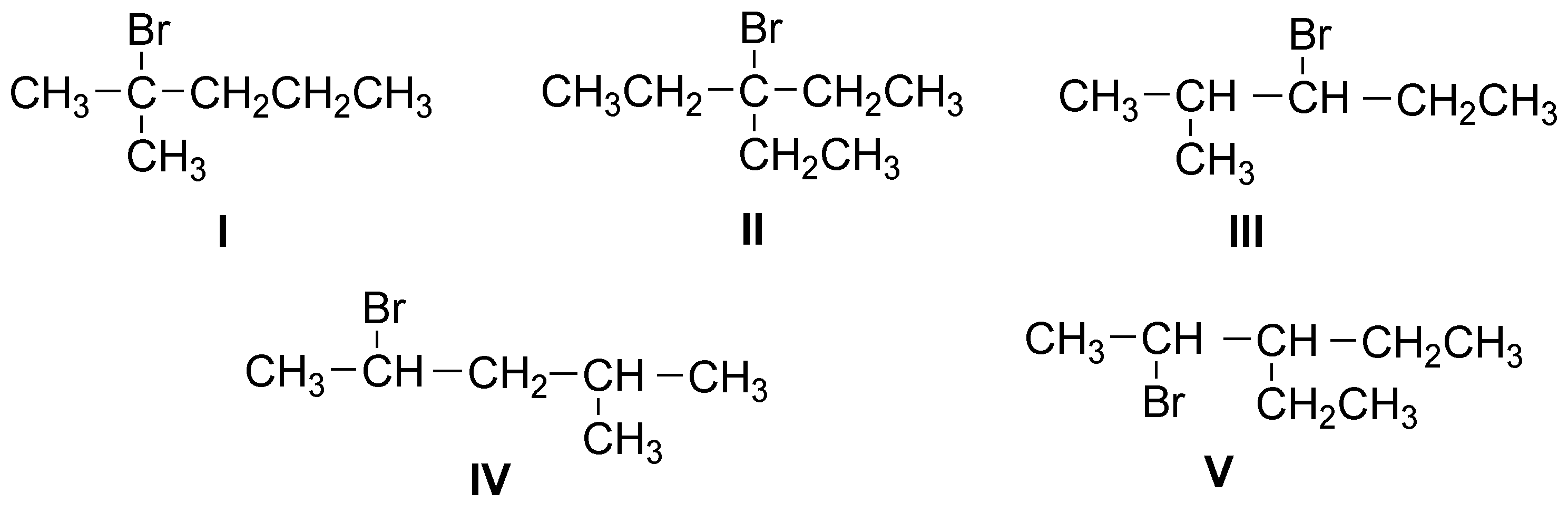
Sólo la estructura II al ser simétrica dará un solo alqueno, las demás darán mezclas más o menos enriquecidas en el alqueno más estable (más sustituido, Zaitsev).
Solución 29:
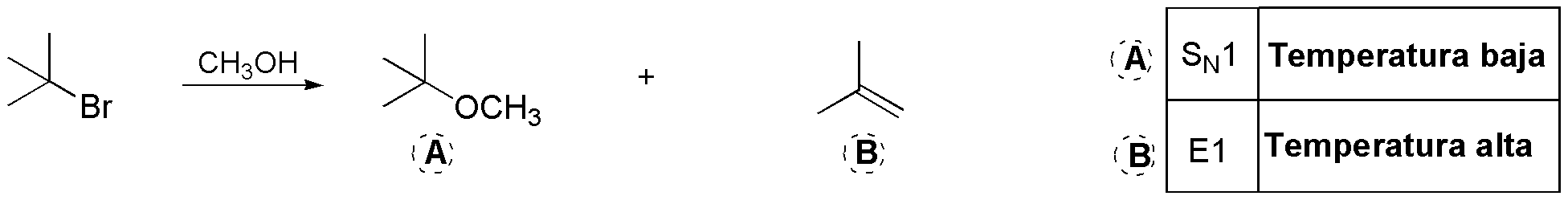
a y b): La estructura terciaria del haluro sugiere un mecanismo monomolecular, ya que el carbocatión intermedio es terciario. La diferencia entre ambas reacciones radica en la temperatura usada para cada una de ellas. En este tipo de sustratos, la reacción de sustitución predomina a temperaturas bajas o moderadas, mientras que la proporción del producto de eliminación se ve incrementada a temperaturas más altas.
c) El sustrato es de tipo terciario, por lo que se deben descartar los mecanismos de tipo bimoleculares, SN2 o E2. El resultado de la reacción es una mezcla de tres productos:
![]()
El producto mayoritario debe ser el de solvólisis, ya que hay una elevada proporción de moléculas de disolvente, que pueden atacar al carbocatión que se forma como intermedio de la reacción.
d) El sustrato es secundario, por lo que el mecanismo de la reacción debe ser bimolecular. El metóxido es básico y su nucleofilia es de carácter moderado. El factor determinante, en este caso es la baja temperatura, hace que predomine la reacción de sustitución SN2 frente a la eliminación E2.
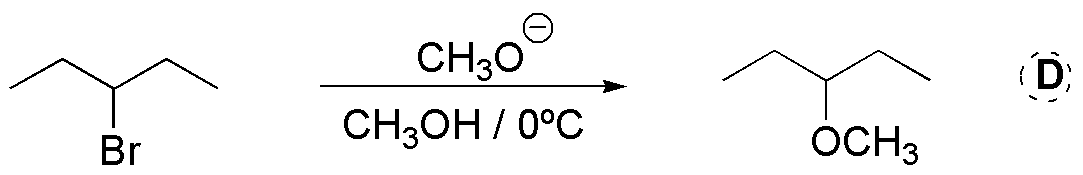
e) Como reactivo, se utiliza una base no nucleófila como es el terc-butóxido potásico. La reacción es de tipo E2, y se obtiene un único producto, el ciclopenteno.
![]()
f) Las condiciones de reacción son las típicas de un proceso de eliminación bimolecular, ya que se utiliza una base fuerte no nucleófila. El sustrato presenta dos tipos de hidrógenos en posición b, con respecto al grupo saliente, susceptibles de situarse en la disposición anti adecuada (CH2 y CH3), marcados con un círculo discontinuo.
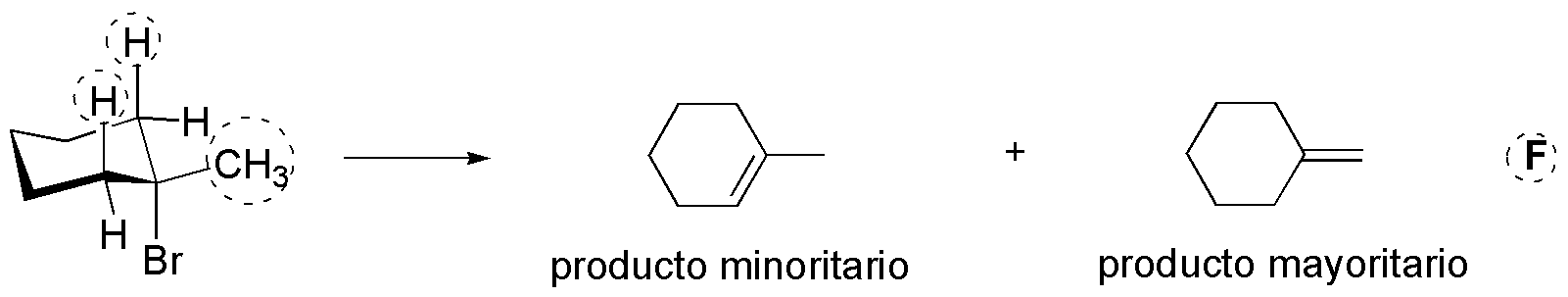
En el primer caso, se obtendría un único producto, ya que los dos hidrógenos axiales son equivalentes por simetría. La eliminación del átomo de bromo con un hidrógeno del metilo conduce a la formación de un doble enlace exocíclico. El terc-butóxido potásico es una base voluminosa, por lo que predominan los factores estéricos sobre los termodinámicos. El producto de reacción es el alqueno menos sustituido, ya que la base se acerca con mayor facilidad a los hidrógenos primarios que a los secundarios porque son más accesibles.
Solución 30:
a) La reacción más rápida es la segunda. El sustrato y el nucleófilo son los mismos, pero en el segundo caso el DMSO, un disolvente polar y aprótico facilita la reacción.
![]()
b) La reacción más rápida será la segunda ya que el bromo es mejor grupo saliente que el cloro, y a igualdad del resto de las condiciones de reacción será el factor determinante.
![]()
c) La primera reacción es más lenta que la segunda. Las condiciones de reacción y el grupo saliente son los mismos, pero en el sustrato hay una ramificación en posición α con respecto al grupo saliente que hace que el nucleófilo se acerque con más dificultad al carbono unido al bromo.
![]()
d) La reacción más rápida es la primera, ya que el NaSH es mejor nucleófilo que NaOH, dado que la nucleofilia aumenta conforme se desciende en un grupo de la tabla periódica.
![]()
Solución 31:
El sustrato empleado en la reacción es un bromuro de alquilo quiral terciario y los reactivos usados tienen una baja nucleofilia. Todo ello sugiere una reacción de solvólisis. El intermedio de reacción es un carbocatión terciario que puede ser atacado indistintamente por el agua y el metanol por lo que los productos obtenidos serán los siguientes:
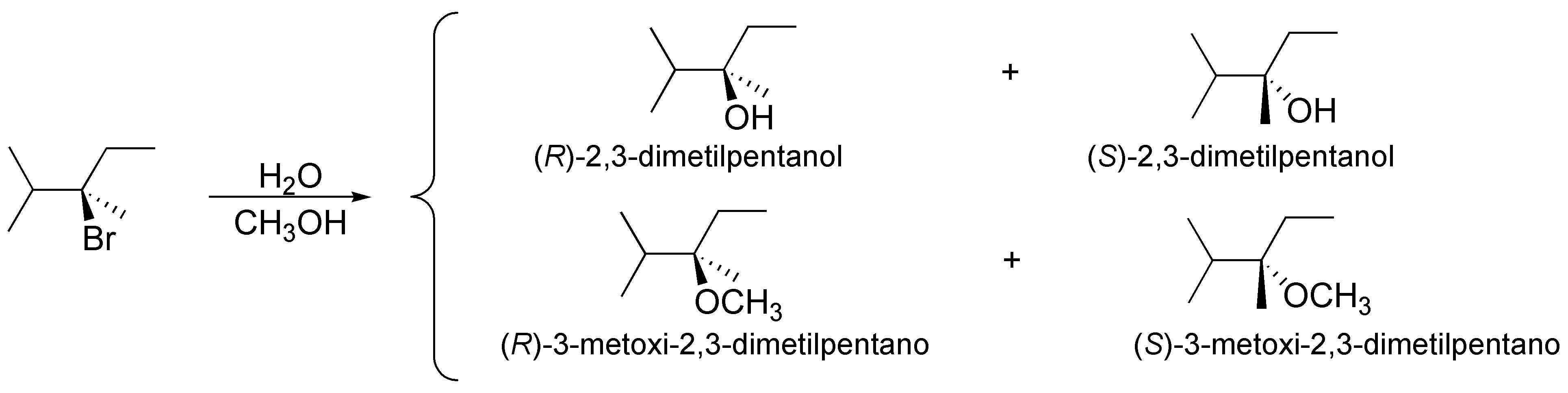
Solución 32:
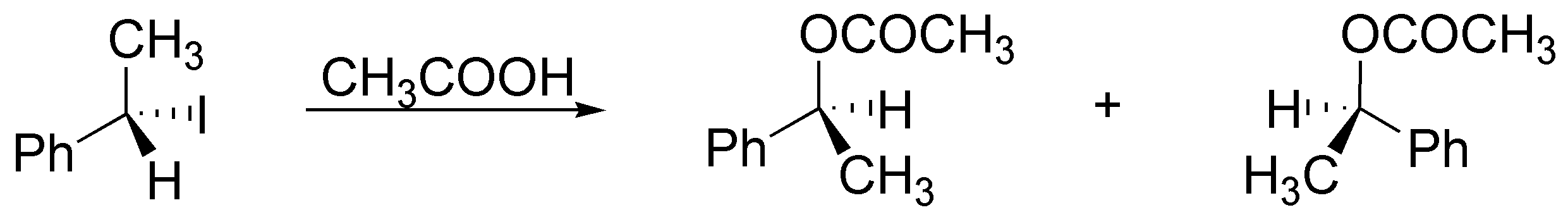
a) El reactivo necesario para obtener el resultado es ácido acético, ya que se trata de una reacción de solvólisis (acetólisis) que transcurre mediante un mecanismo SN1. Se produce una racemización si se parte, como en este caso, de un sustrato quiral.
b) La reacción que tiene lugar es una eliminación. Puesto que se obtiene como producto de la reacción el alqueno menos sustituido, el reactivo necesario es una base poco nucleófila y voluminosa como el terc-butóxido potásico. El disolvente habitual en estos caso es terc-butanol.
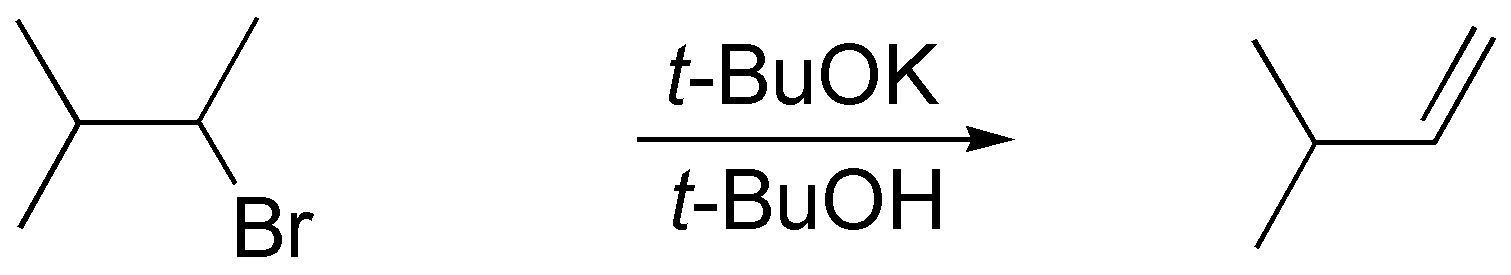
c) El intercambio de halógeno se puede realizar mediante una reacción de sustitución. Dado que el sustrato es primario, el proceso será SN2. Como reactivo se puede utilizar yoduro sódico o potásico y como disolvente es recomendable uno polar y aprótico como acetona o DMF.
![]()
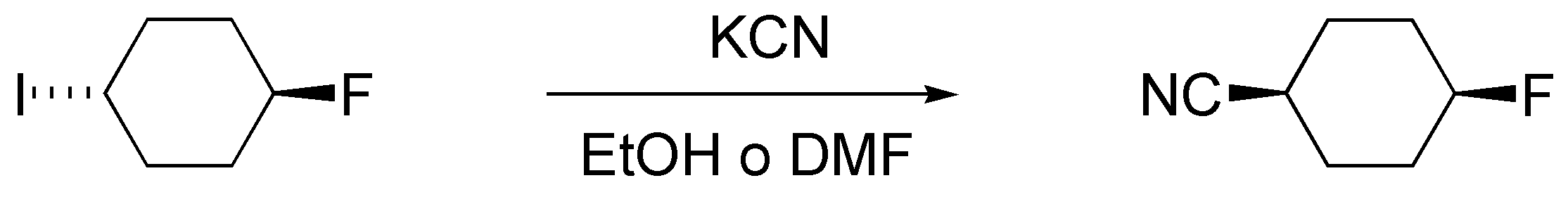
d) Se produce la sustitución de I por CN, mientras el F, que es un mal grupo saliente permanece inalterado. Las condiciones habituales para esta reacción son el empleo de la sal potásica del cianuro en un disolvente polar como el etanol o DMF.
e) La sustitución del Br por la agrupación C≡CH se realiza usando el acetiluro, generado a partir de acetileno y NaNH2. Se tiene que emplear como disolvente NH3 líquido que es el ácido conjugado de la base (amiduro) o bien THF, un disolvente polar y aprótico que evita la destrucción de la base.
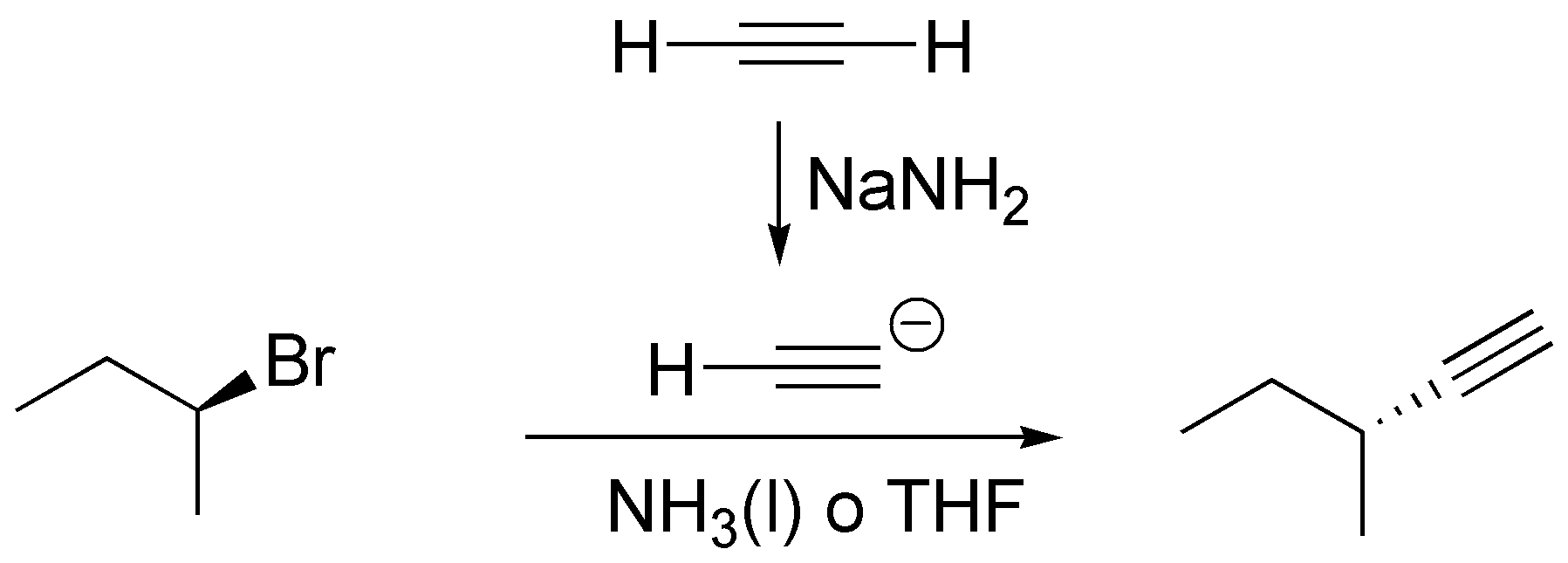
f) Para producir el alqueno menos sustituido de los posibles se requiere el empleo de una base voluminosa como el terc-butóxido potásico en terc-butanol.
![]()
Solución 33:
El alqueno más estable es el más sustituido en este caso I.
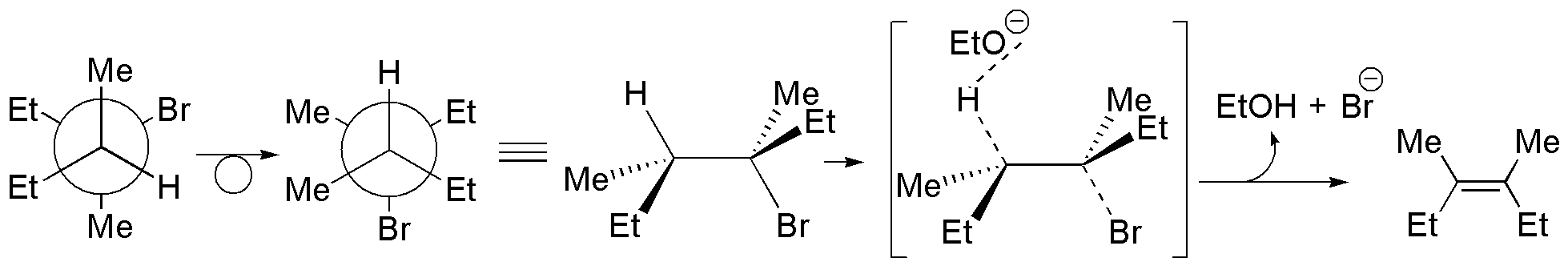
Solución 34:
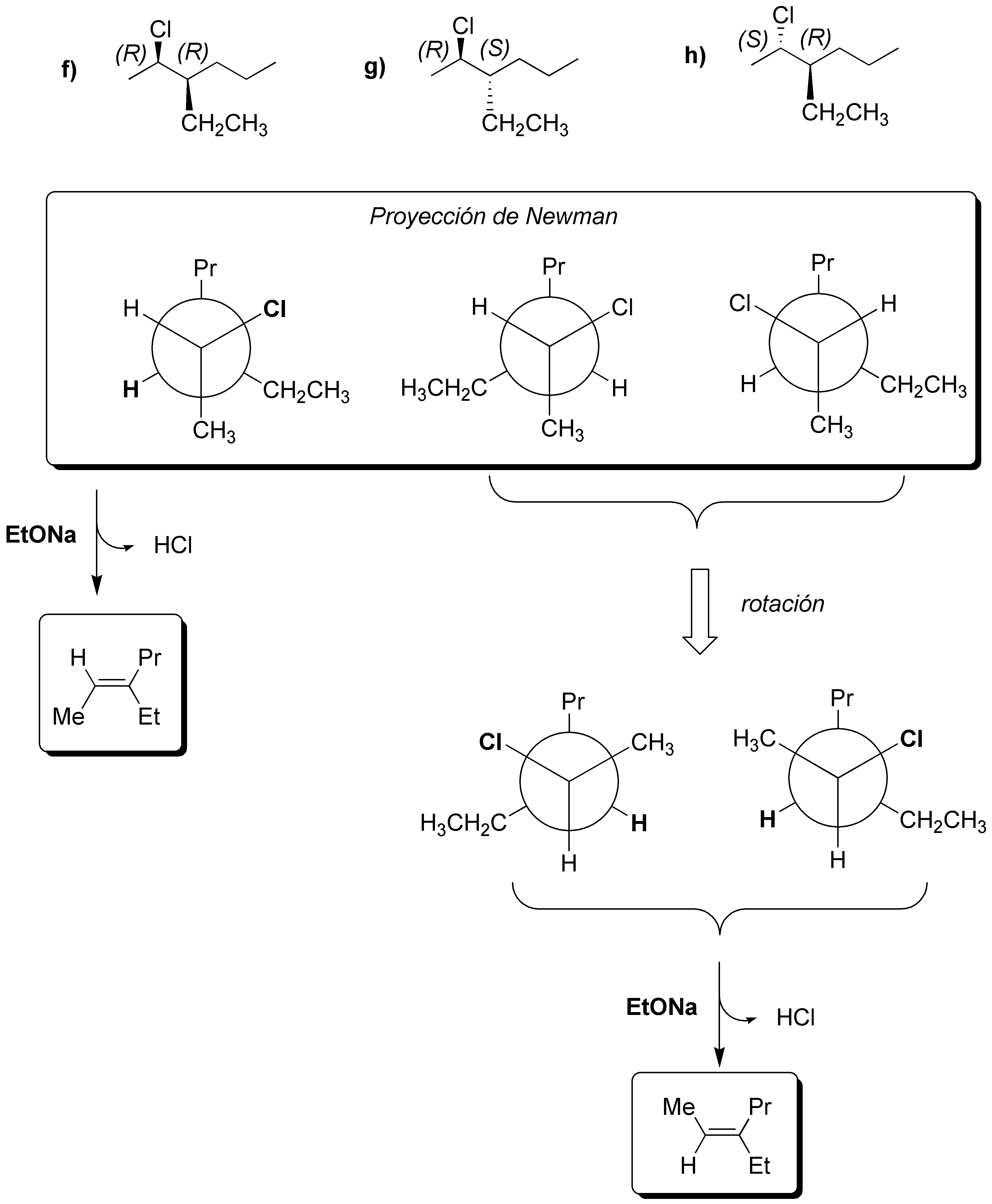
a) La proyección de Newman representa al (3R,4S)-3-bromo-3,4-dimetilhexano. Para que se dé la reacción de eliminación el bromo en C3 y el H en C4 deben situarse antiperiplanares para lo cual se procede a representar la conformación apropiada. Como resultado se obtiene el (Z)-3,4-dimetilhex-3-eno.
b) Sólo hay un hidrógeno β con respecto al grupo saliente, que se sitúa en un carbono primario. El alqueno que se forma es:
c) No hay reacción E2 ya que no presenta hidrógenos en disposición adecuada.
d) La conformación que se representa no tiene los grupos que se van a eliminar en la disposición adecuada, por lo que hay que rotar la molécula en torno al enlace sencillo hasta que el bromo y el hidrógeno del carbono contiguo estén antiperiplanares.
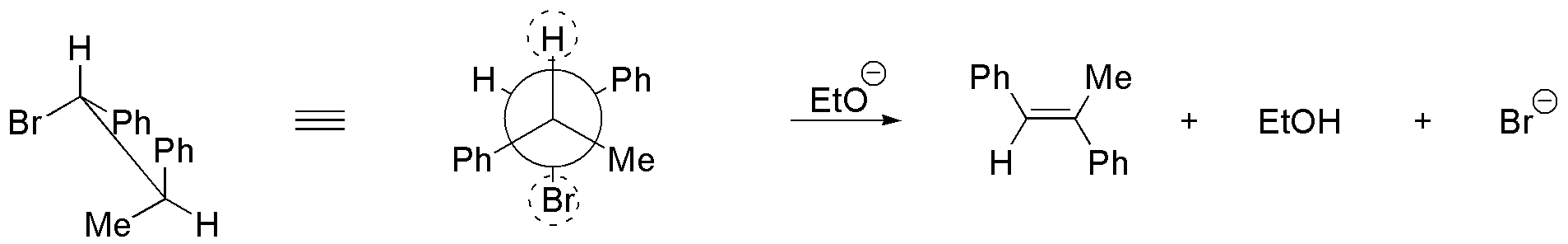
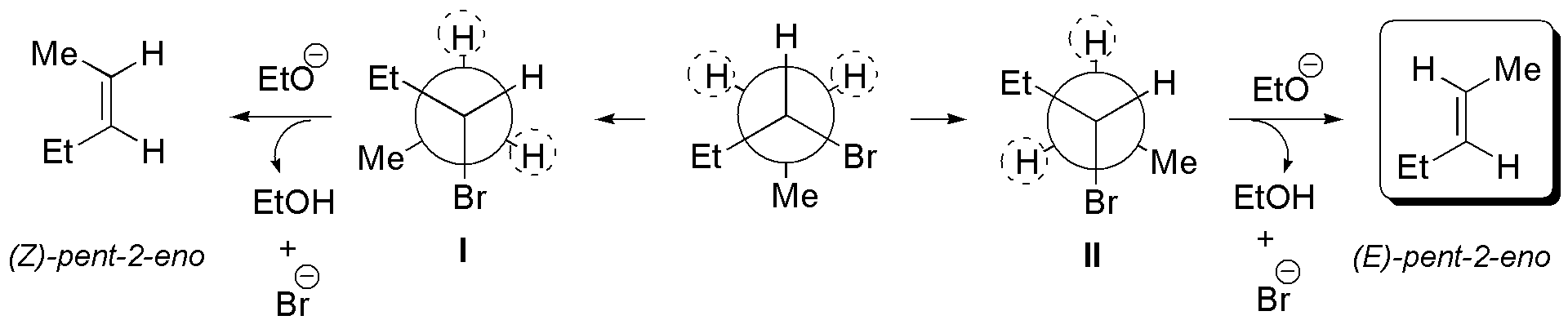
e) El compuesto tiene dos hidrógenos susceptibles de situarse en posición antiperiplanares con respecto al grupo saliente. Se procede a dibujar los confórmeros en los que se da esta situación, a partir de los cuales se obtienen los correspondientes alquenos. II es más estable que I, ya que los grupos Et- y Me-, que son los más voluminosos se sitúan lo más alejados posible, por lo que el producto mayoritario será el (E)-pent-2-eno.
Solución 35:
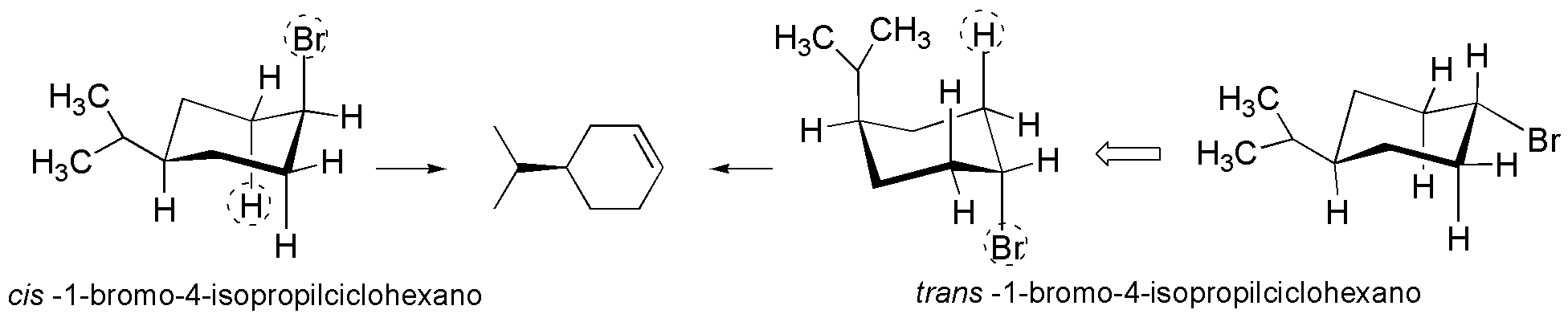
Los confórmeros más estables de I y II son aquellos en los que el grupo isopropilo, que es el más voluminoso presenta una disposición ecuatorial. Además, para que se elimine el BrH y se forme el doble enlace, el Br y H deben estar en posición antiperiplanar. Para el isómero cis el bromo se encuentra antiperiplanar con respecto a dos hidrógenos, por lo que a partir de esta conformación se puede dar la reacción de eliminación, mientras que para el isómero trans se requiere un cambio conformacional, justamente hacia un confórmero especialmente desfavorecido. De ahí la diferencia en la velocidad de la reacción.
Solución 36:
El esquema de la reacción es el siguiente:
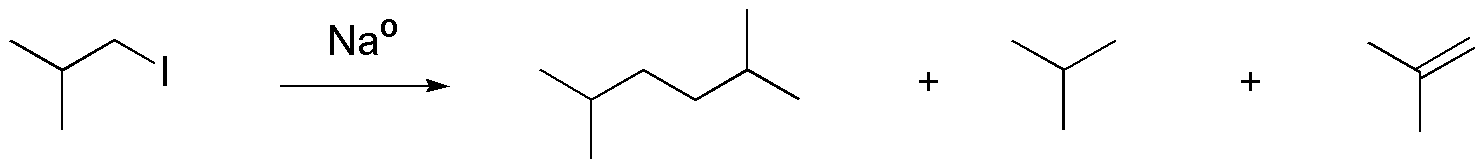
y corresponde a un ejemplo de la síntesis de Wurtz.
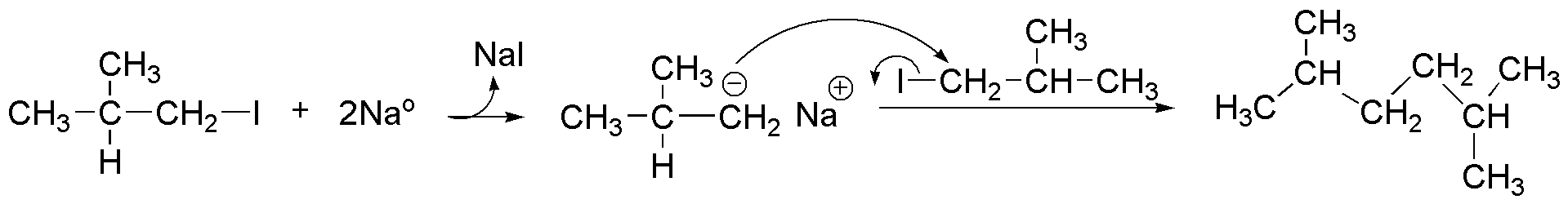
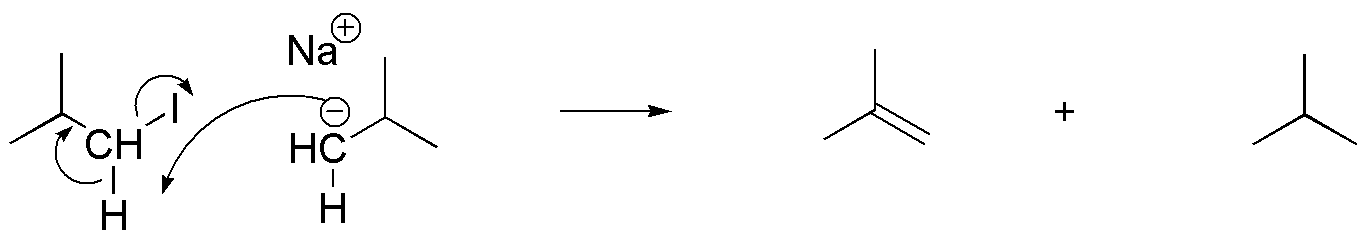
La formación de los subproductos se puede justificar considerando el carácter básico que presenta el anión intermedio, capaz de abstraer un protón del yoduro de alquilo de partida, transformándose en un alcano. Simultáneamente a la pérdida del protón, se produce la salida del yoduro, con lo que se forma un doble enlace.
Solución 37:
a) El resultado de la reacción será la formación de ciclopentano. La deshalogenación se lleva a cabo radicalariamente con (n-Bu)3SnH y requiere la presencia de un iniciador (AIBN) para que comience el proceso.
![]()
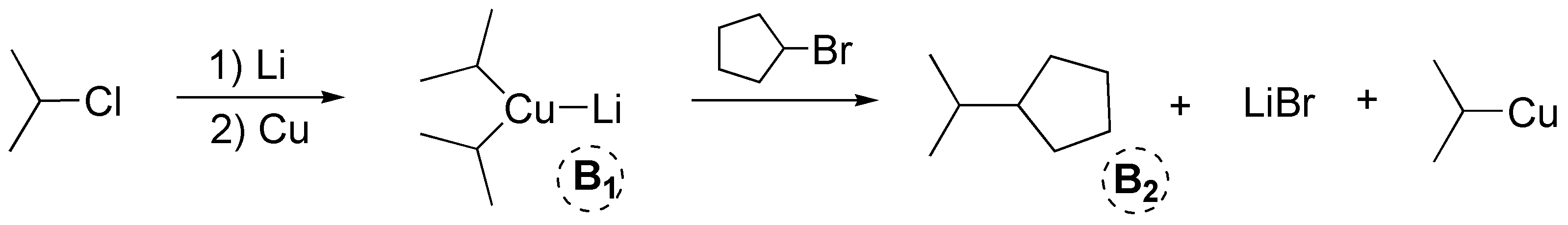
b) La secuencia de reacciones que se describe corresponde a un ejemplo de síntesis de Corey-House. En el primer paso de la reacción se produce un organolítico, que tratado con cobre genera un dialquilcuprato de litio, B1, (reactivo de Gilman). En este primer paso el haluro de partida puede ser primario, secundario o terciario. Posteriormente, este dialquilcuprato de litio se puede tratar con un haluro de alquilo primario o secundario, que puede ser cíclico o acíclico. En este caso corresponde a bromuro de ciclopentilo. Como resultado se produce un alcano de la unión entre los fragmentos empleados.
c) y d) Ambas son reacciones de Wurtz intramoleculares. En este caso se minimiza la formación de subproductos cuando se emplean dos haluros de alquilo diferentes. El resultado de ambas reacciones es el siguiente:

Solución 38:
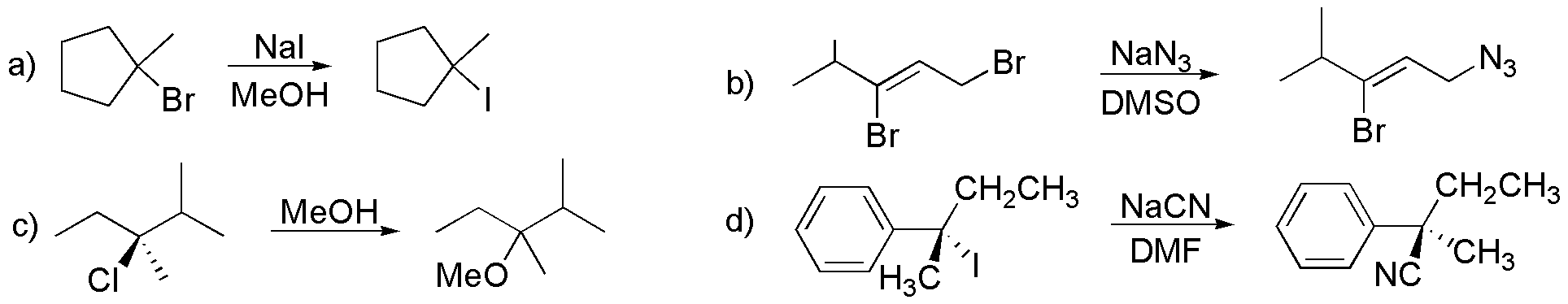
a) y c) se tratan de dos SN1, en la primera el ión yoduro es un excelente nucleófilo (además de buen grupo saliente) y en la tercera el disolvente actúa como tal. b) Es una SN2, el bromo sustituido es el primario, el vinílico es muy poco reactivo. d) es otra SN2con inversión de la configuración.
Solución 39:
En la SN2 reaccionan mejor los haluros primarios, que los secundarios y estos mucho mejor que los terciarios. En cuanto a los primarios a) y c) reaciona mejor el que mejor grupo saliente posee: Yoduro mejor que bromuro y cloruro. Por lo que el orden será:
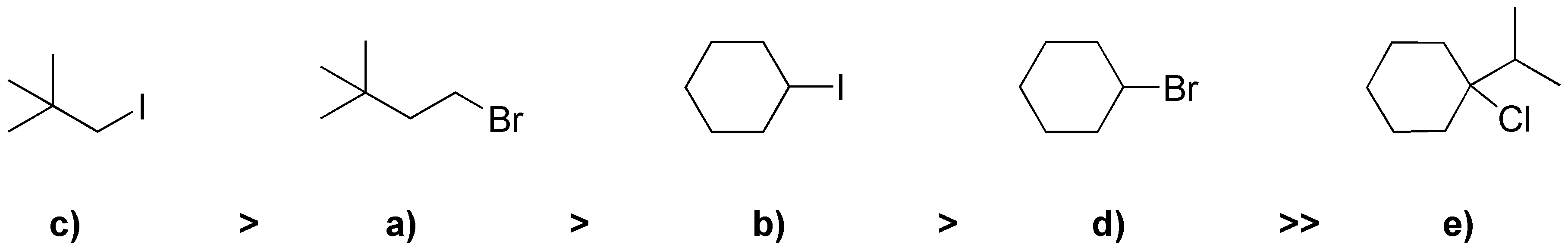
Solución 40:
a) NaBr / MeOH, pues se trata de una racemización de un haloalcano terciario.

b) EtONa / EtOH (baja temperatura) pues se trata de una SN2.
![]()
c) NH3; se trata de una doble SN2.
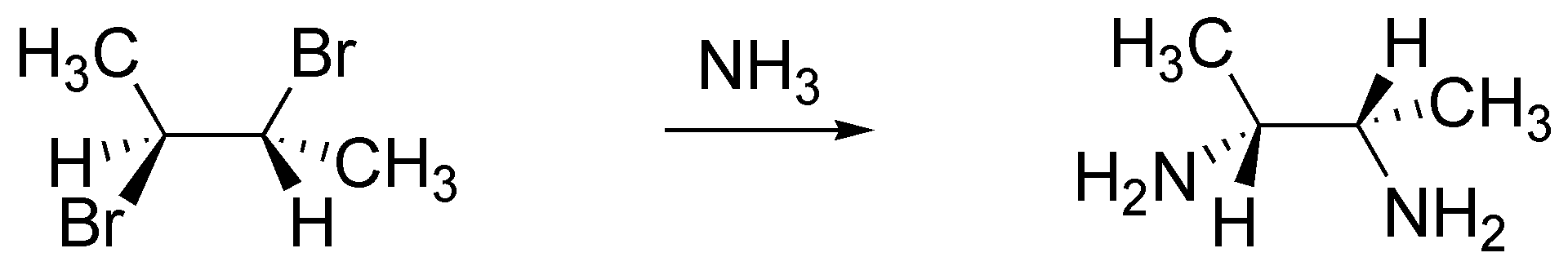
d) NaOH. Se trata de una doble SN2 la primera intermolecular y la segunda intramolecular en la que el nucleófilo es el alcóxido o alcoholato generado por la sosa.
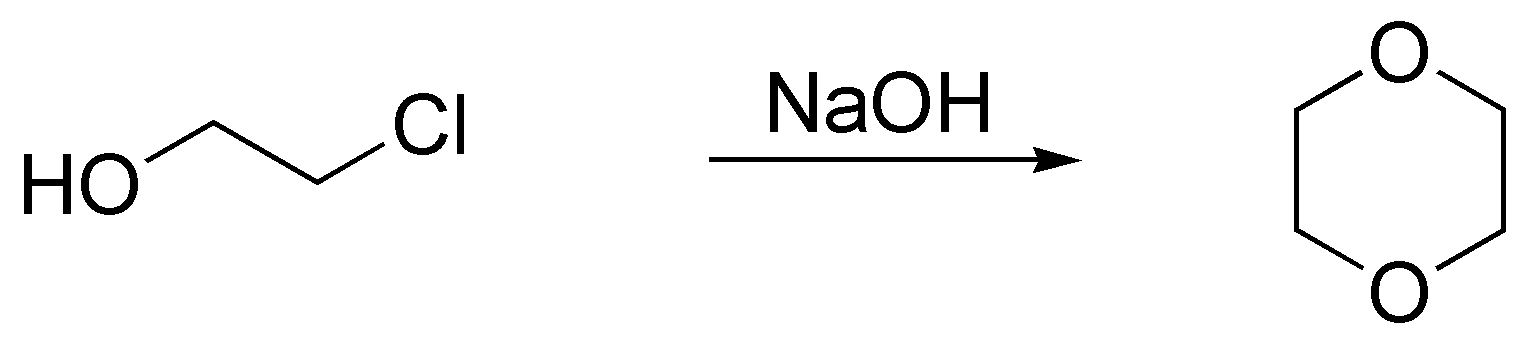
Solución 41:
La velocidad de solvólisis es mayor para haloalcanos terciarios que para secundarios y también se ve favorecida por la naturaleza del grupo saliente (yoduro mejor que bromuro). Por lo que el orden de velocidad de solvólisis será:
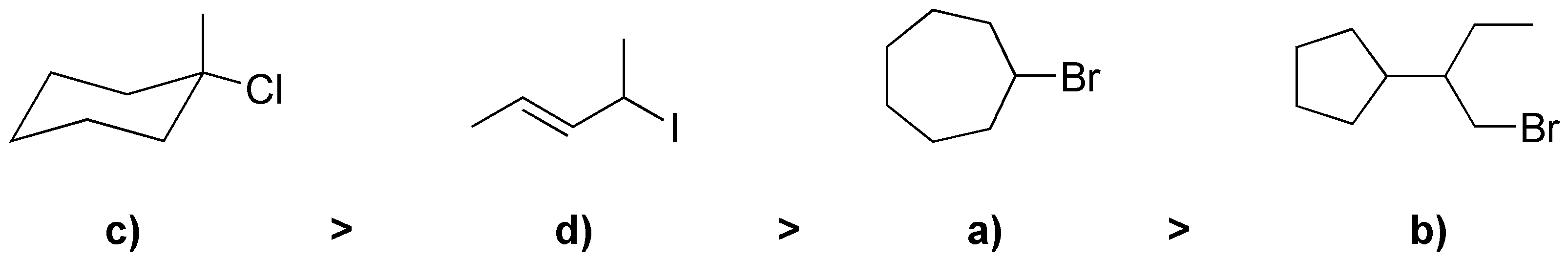
Solución 42:
a) Se producirá una E2, pues se trata con una base fuerte, no se producirá SN1. b) Al no utilizar una base se producirá la SN1. c)De los dos halógenos el bromo es mucho mejor grupo saliente; como el nucleófilo es además una base fuerte se producirá una mezcla de E2 y SN2. d) Al utilizar una base fuerte y además muy voluminosa se producirá una E2 dando el alqueno menos sustituido. e) La eliminación E2 producirá una mezcla de alquenos. f) Se producirá una E2 aunque se utilize una base voluminosa.
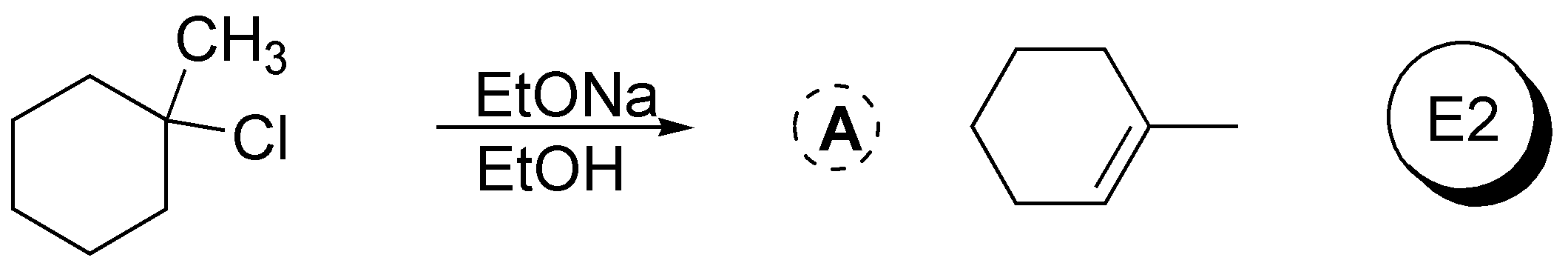
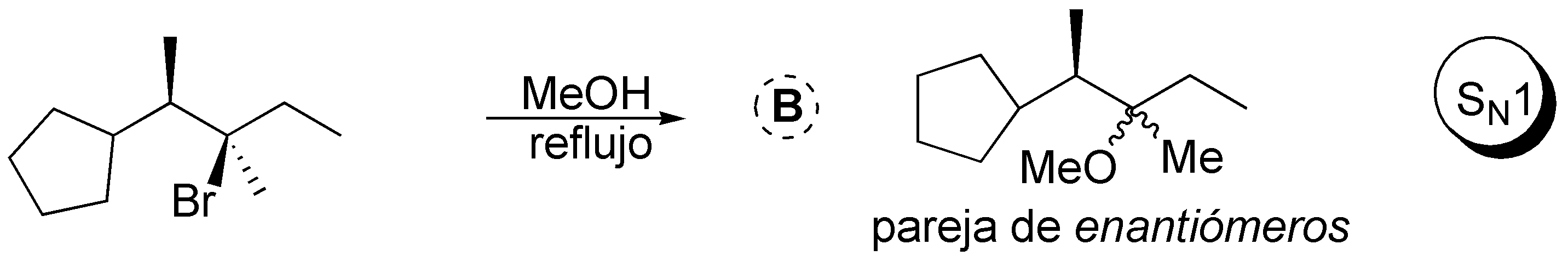
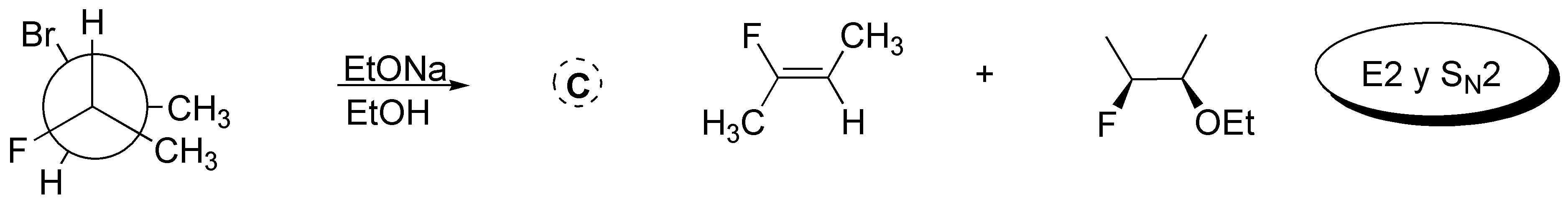


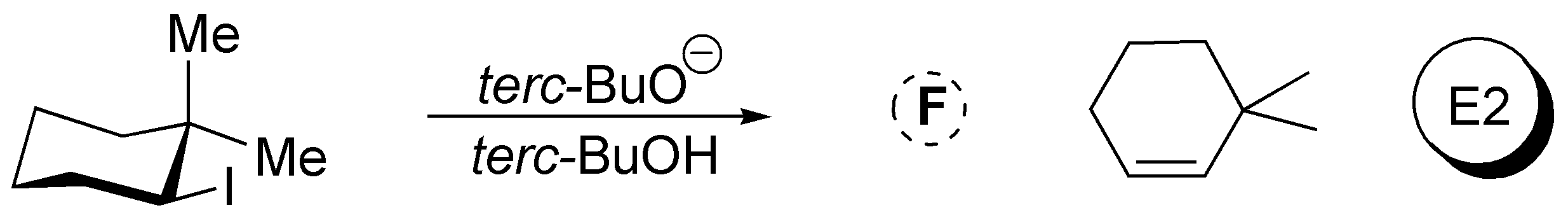
Solución 43:
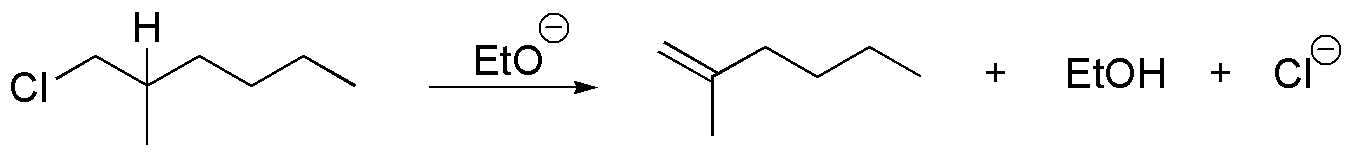
El 3-bromopentano presenta una mayor velocidad de reacción de sustitución nucleofílica que el 1-bromo-2,2-dimetilpentano pues los grupos metilo en posición 2 de este dificultan el acercamiento de los nucleófilos en reacciones de tipo SN2.
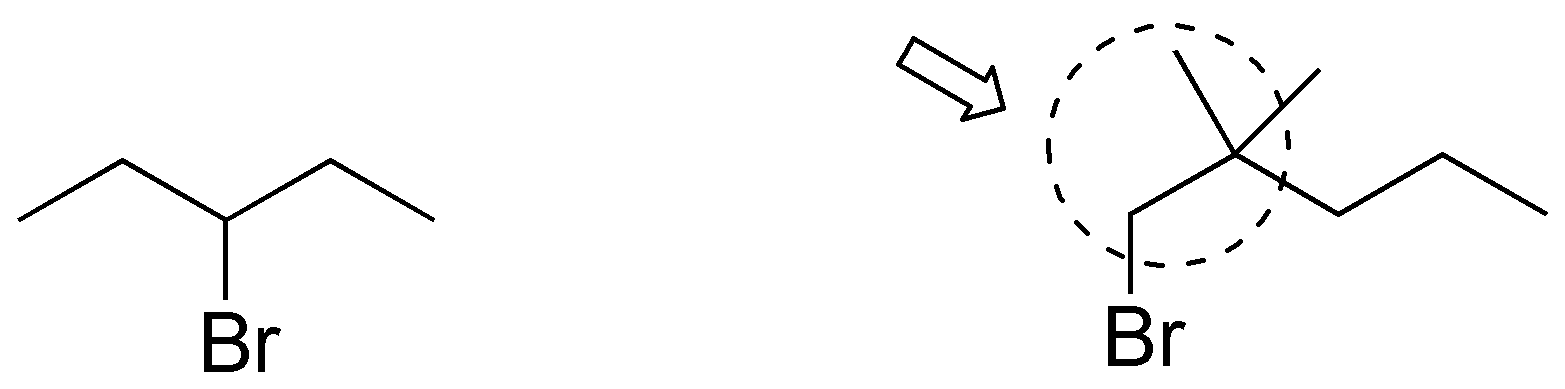
Solución 44:
En el caso del isómero cis se produce el alqueno más sustituido, tal y como predice la regla de Zaitsev, pero en el isómero transno porque es necesario que los grupos que se eliminen (Br e H) tengan una disposición antiperiplanar y en este isómero sólo tiene hidrógeno adecuado en la posición 6 del anillo.
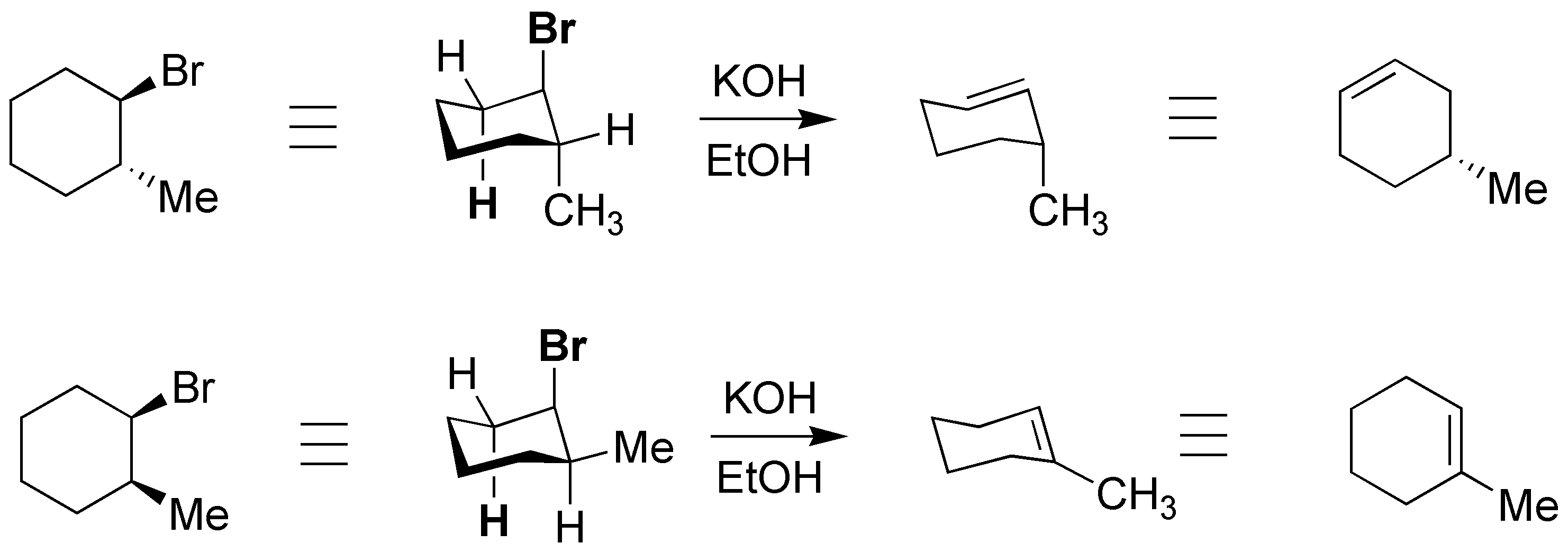
Solución 45:
La causa de la mayor velicidad de un isómero sobre el otro es la distinta estabilidad de las conformaciones que han de adoptar los productos para que se produzca la eliminación. Bromo e hidrógeno en disposición antiperiplanar, tal y como se muestra en la figura:
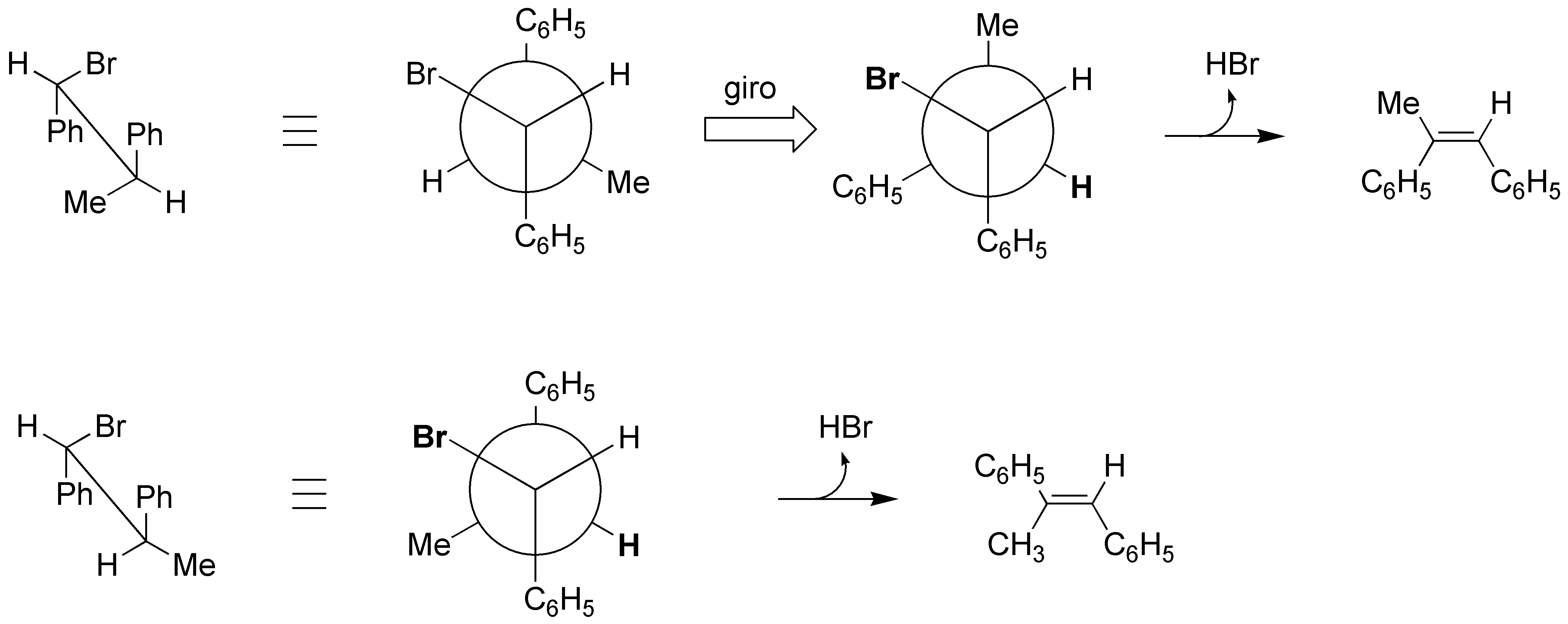
Solución 46:
La diferencia entre la utilización de una base u otra se va a traducir principalmente en la naturaleza del alqueno mayoritariamente producido: el terc-butóxido al ser más voluminoso suele producir el ataque sobre el carbono menos impedido dando mayoritariamente el alqueno menos sustituido. No así en el caso del etóxido en que predomina el más sustituido (termodinámicamente más estable) e incluso puede dar sustitución.
En el caso a) no se puede producir eliminación luego se producirán las correspondientes sustituciones nucleofílicas:

Con terc-butóxido sódico se obtienen los correspondientes alquenos con el doble enlace terminal.
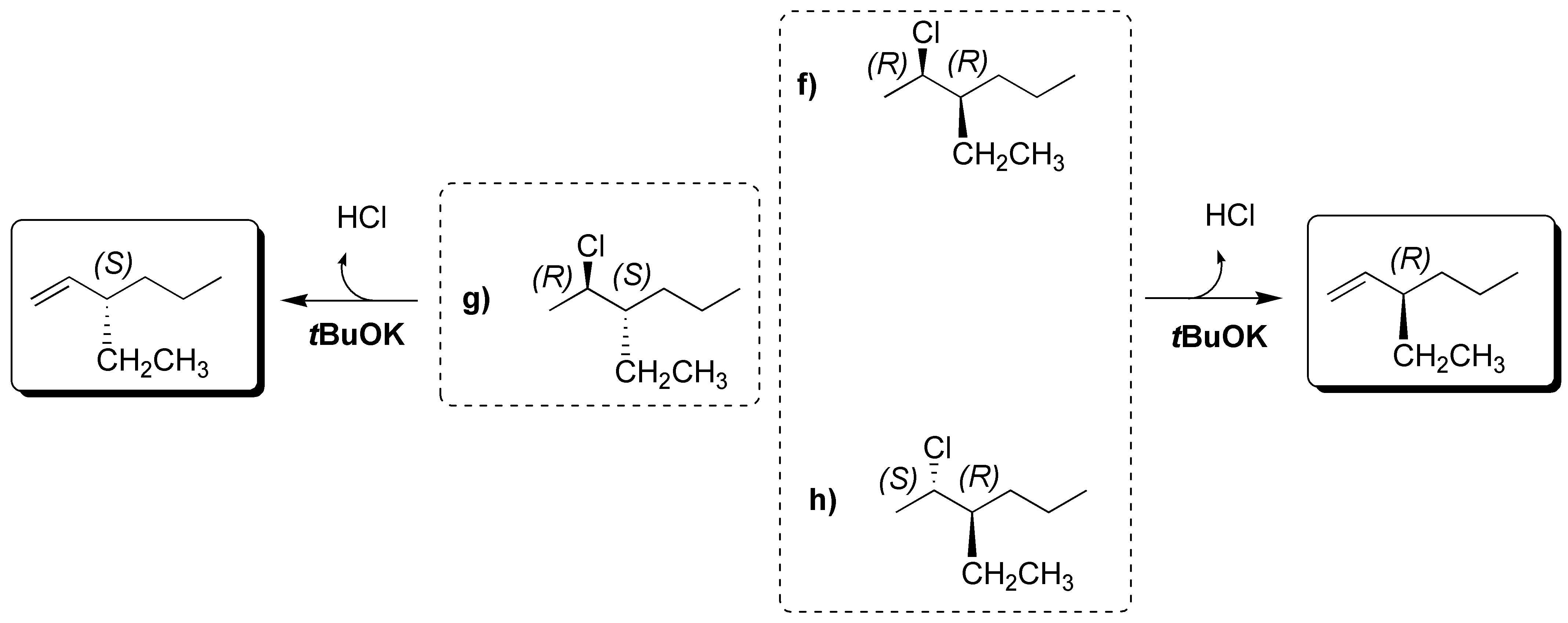
Solución 47:
Para que se produzca la eliminación bimolecular el cloro y el hidrógeno deben encontrarse en una disposición antiperiplanar. Como puede observarse en el esquema en el primer caso sólo existe un hidrógeno en la disposición adecuada por lo que sólo se produce un producto. No así en el segundo, en el que existen dos:
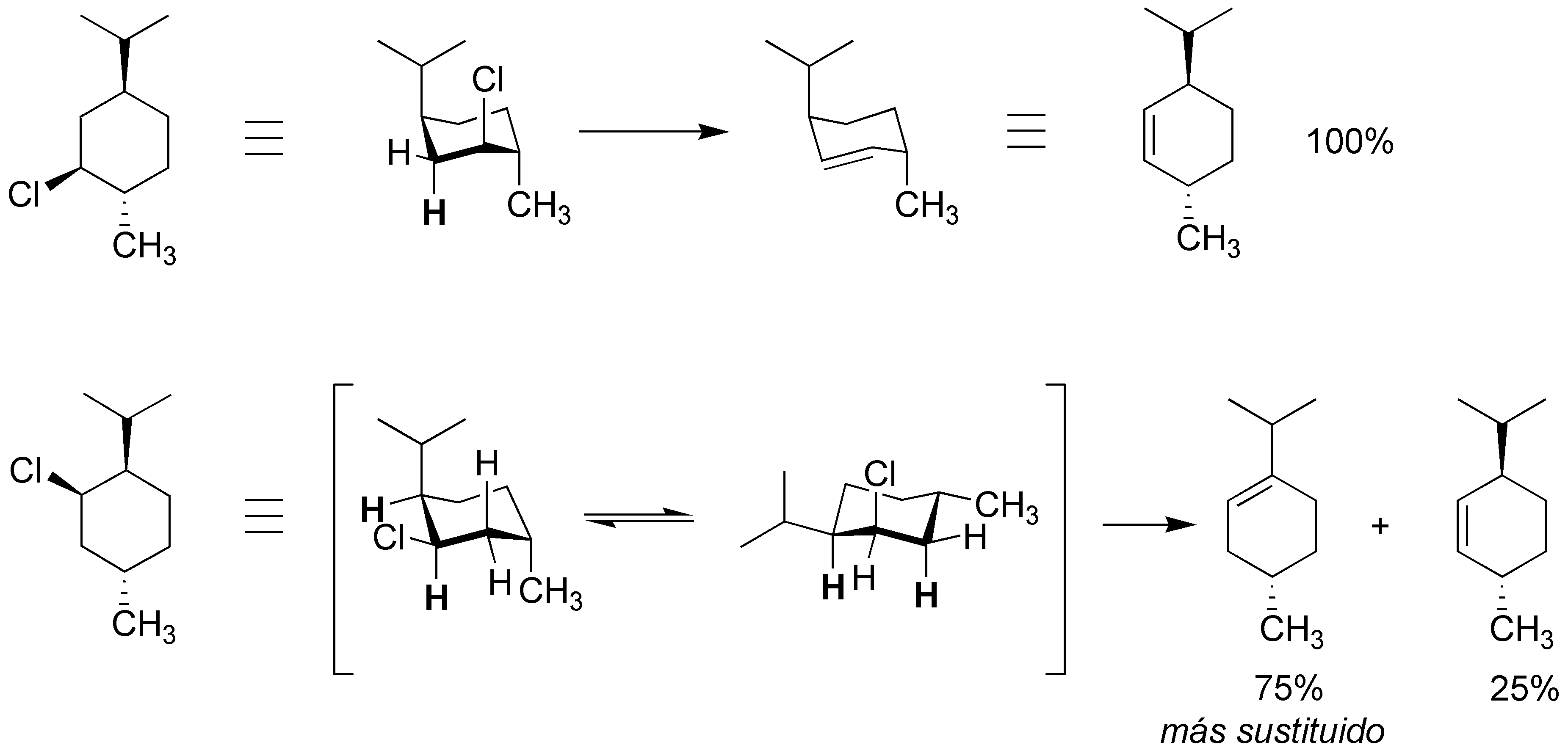
Solución 48:
El ión yoduro es un buen grupo saliente y aunque el ácido acético es un mal nucleófilo puede producir la reacción de sustitución:
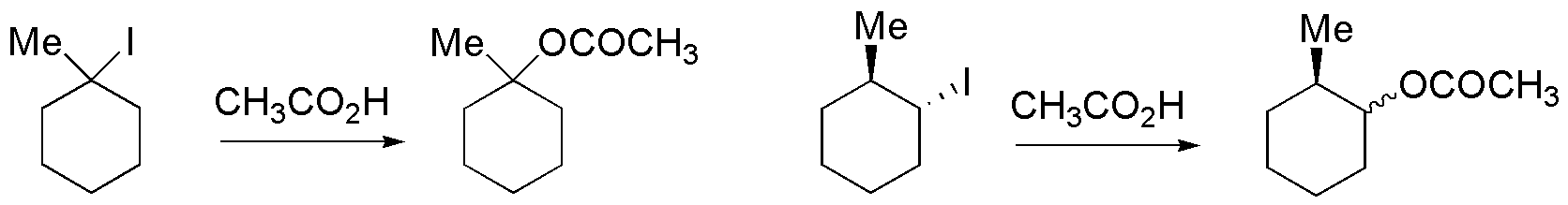
Solución 49:
a) El tratamiento con potasa alcohólica producirá una E2, que es una reacción estereoselectiva, por lo que ambos compuestos darán distintos diastereoisómeros del alqueno más sustituido (E y Z). b) Con terc-butóxido potásico, también se producirá una eliminación dando en este caso el alqueno menos sustituido. Se producirán los dos enantiómeros de dicho alqueno, manteniéndose la configuración del carbono quiral que no interviene en la eliminación. c) Con asida sódica, se producirá la SN2. Como es una reacción estereoespecífica cada uno de los estereoisómeros producirá un diastereoisómero diferente. d) Con hidruro de tri-n-butilestaño se produce la deshalogenación dando al alcano correspondiente, cada uno de los diastereómeros producirá un enantiómero diferente.
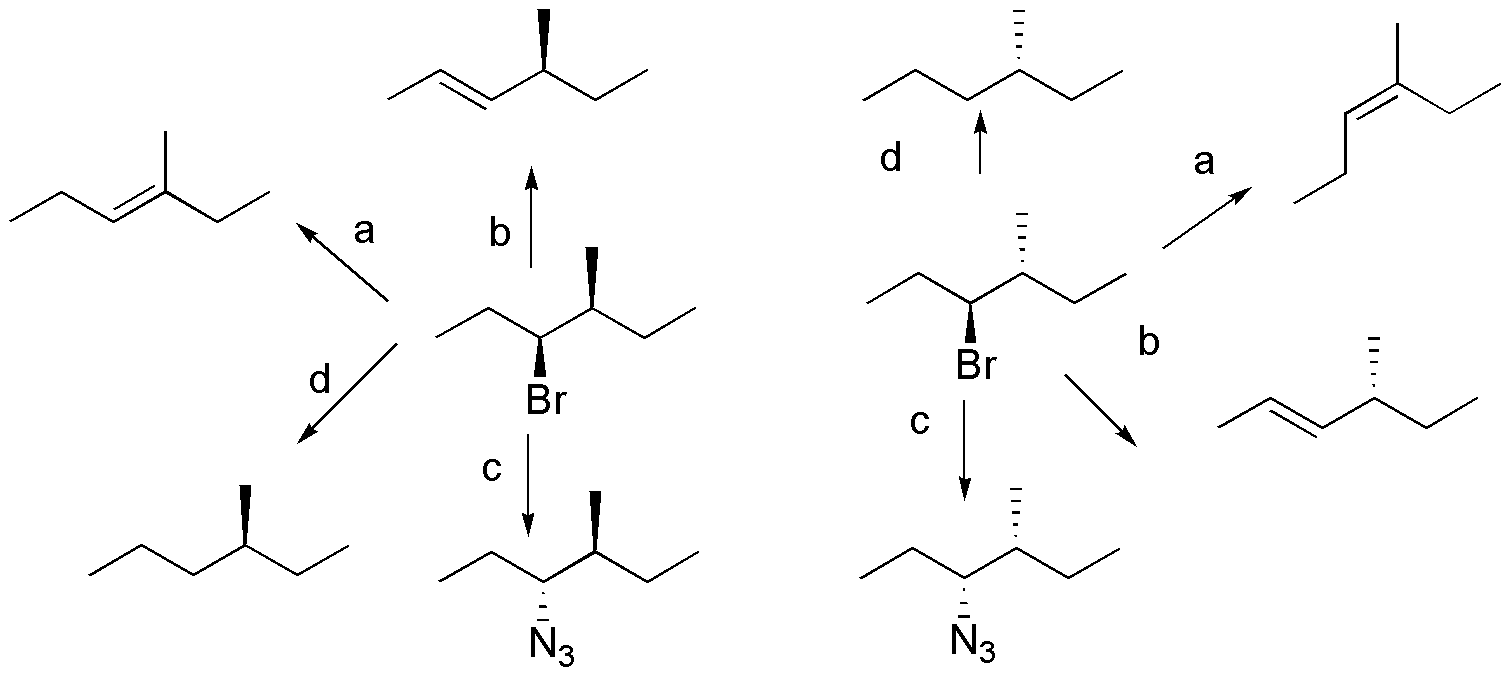
Solución 50:
Según la regla de Zaitsev será más estable el alqueno más sustituido por tanto.
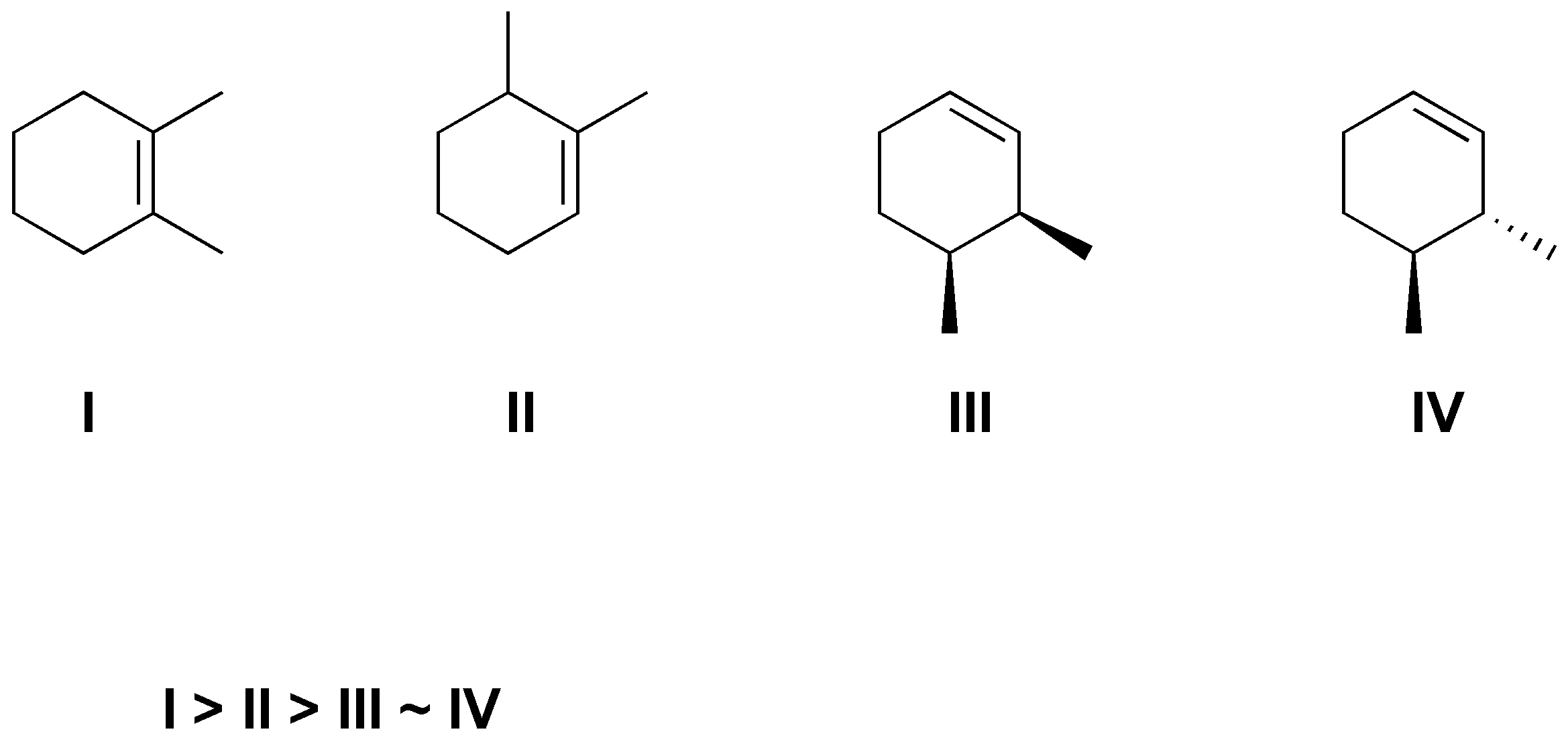
Solución 51:
Las opciones elegidas para las eliminaciones son: a) Se producirá el alqueno menos sustituido. c) Como se requiere que el bromo y el hidrógeno a eliminar se encuentren en disposición antiperiplanar la única solución es la indicada. d) Por el mismo requerimiento anterior se producirá el alqueno Z. e) Tendremos dos hidrógenos en disposición adecuada respecto al yodo, se producirá el alqueno más sustituido por ser más estable. f) Al tratar con t-BuOK se producirá el alqueno menos sustituido en este caso el exocíclico.
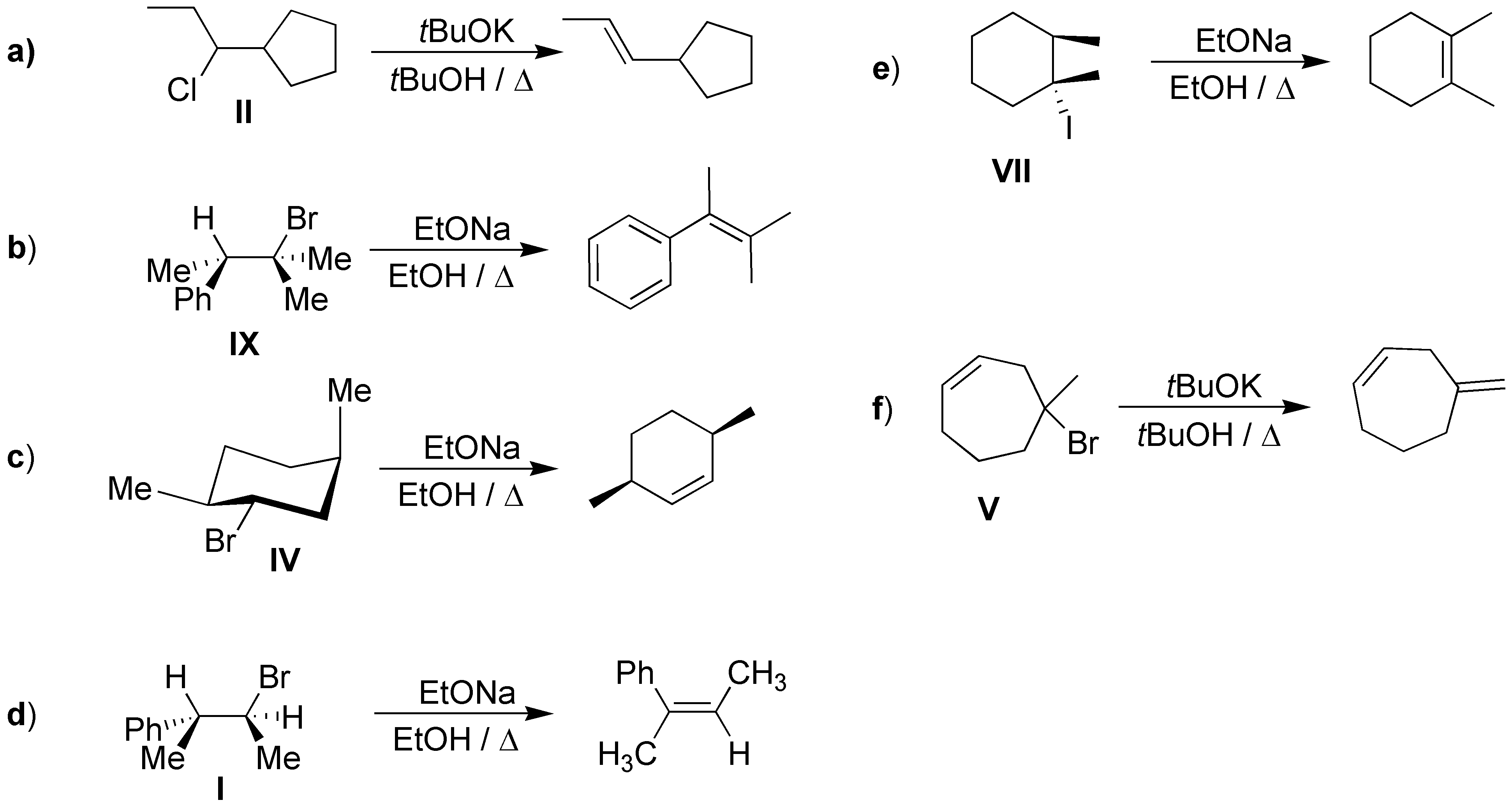
Solución 52:
Para que se produzca la eliminación bimolecular el cloro y el hidrógeno deben encontrarse en una disposición antiperiplanar. Como puede observarse en el esquema, la disposición de hidrógenos es anti con respecto al cloro, conduciendo a dos productos distintos.
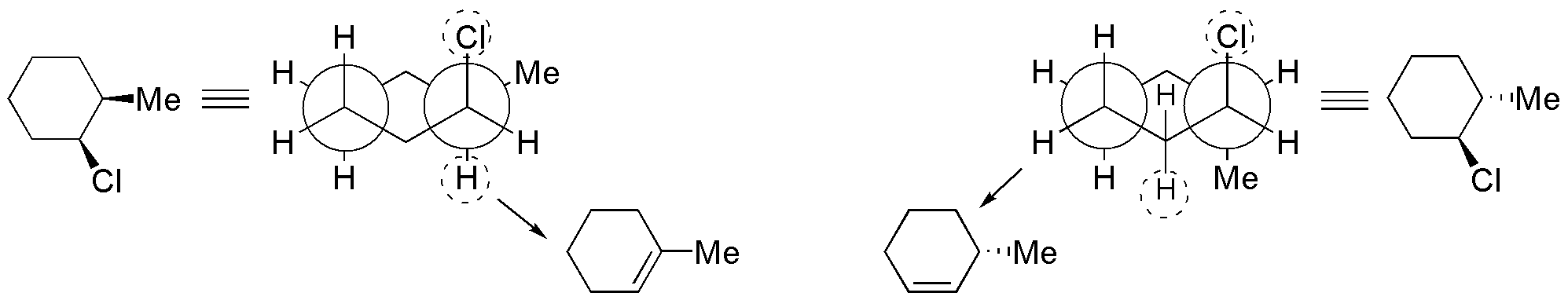
Solución 53:
La única restricción de la síntesis de Corey-House es la no utilización de un haloalcano terciario en la última etapa de la síntesis, por lo que unas posibles estrategias podrían ser:
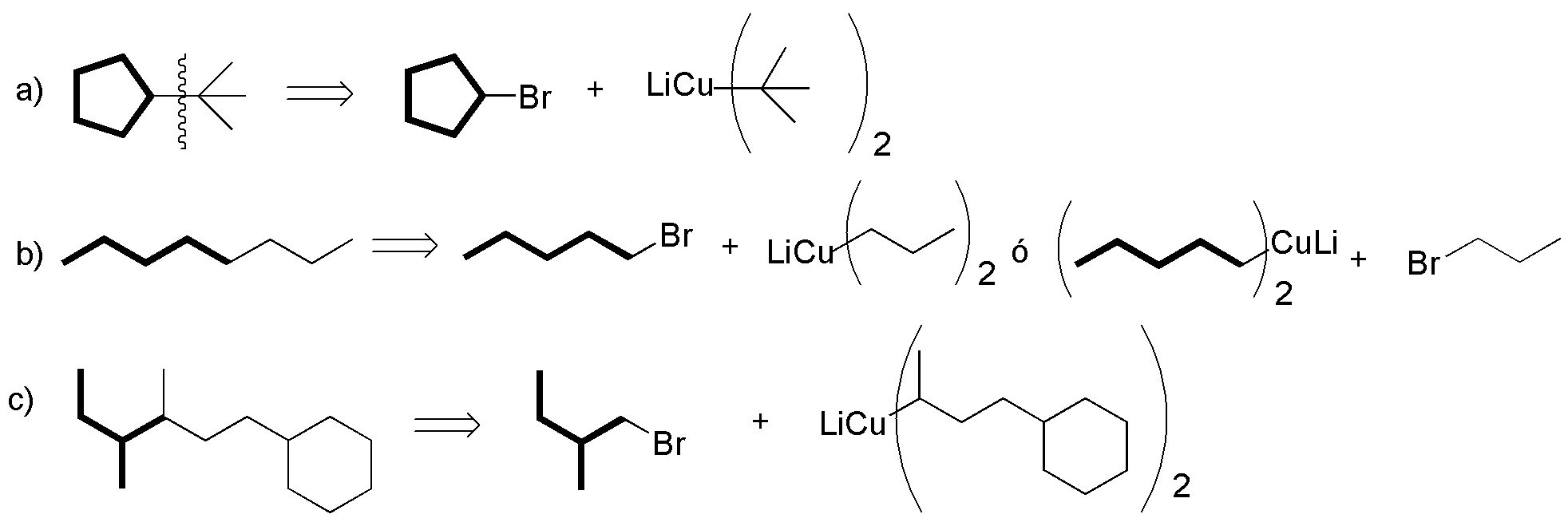
Solución 54:
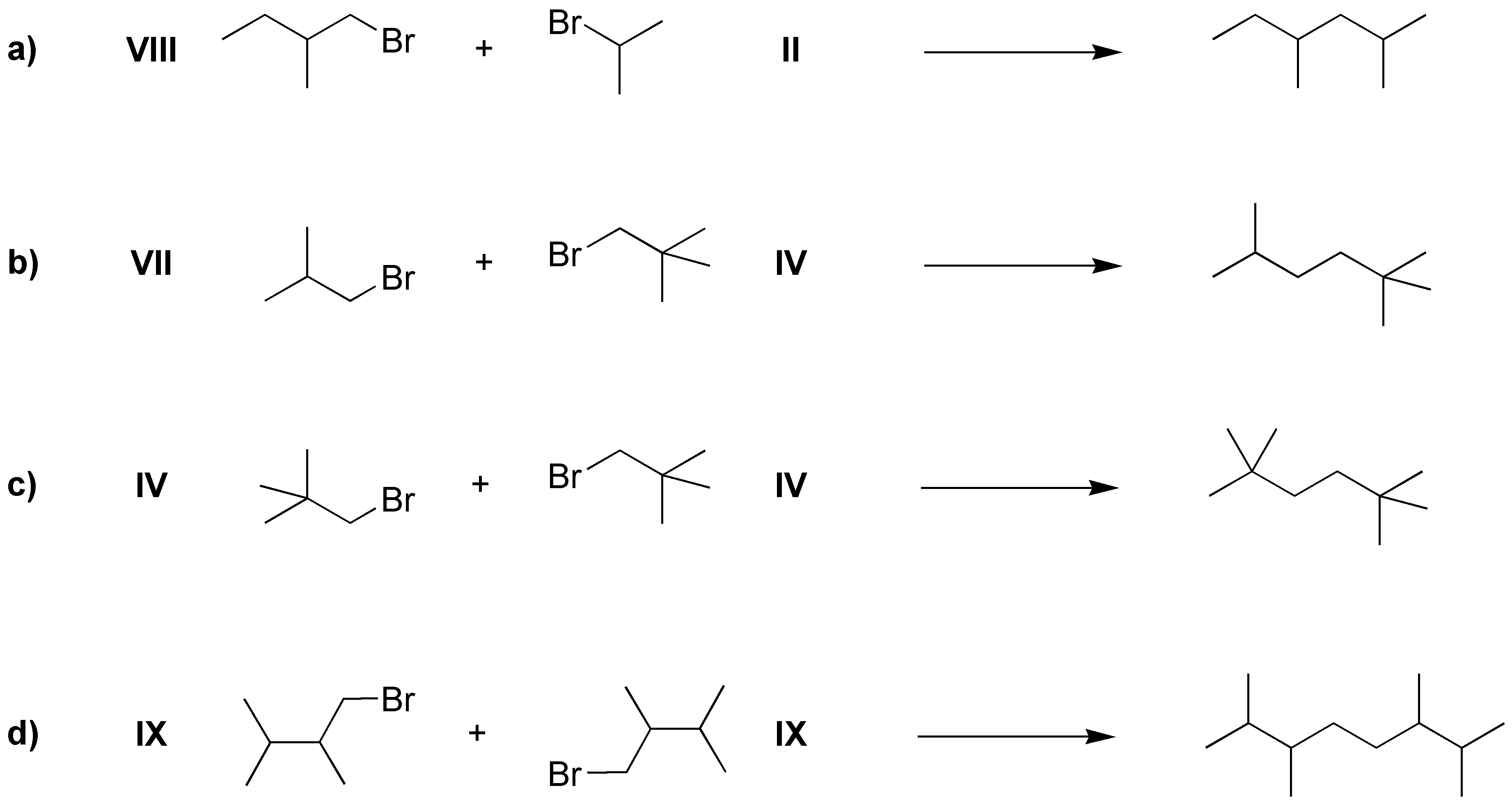
Se tratan de dos síntesis de Corey-House:
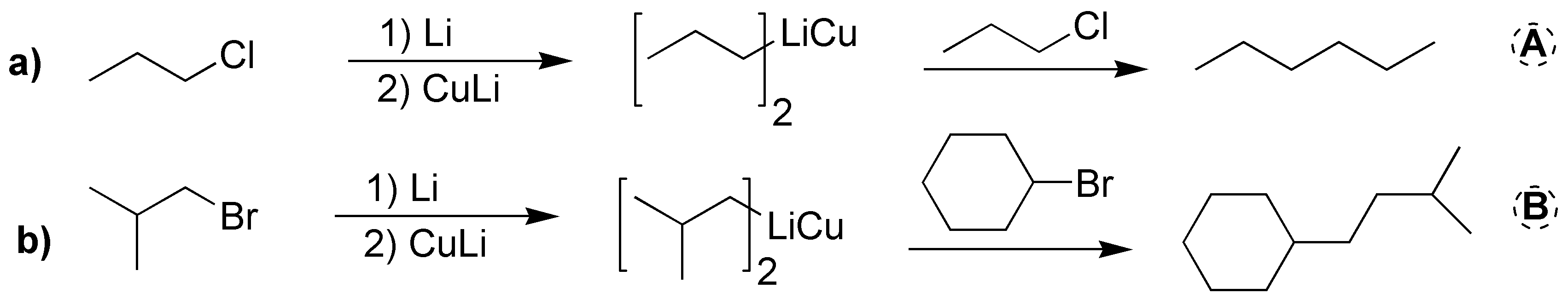
Solución 55:
La única restricción de la síntesis de Corey-House es la no utilización de un haloalcano terciario en la última etapa de la síntesis, por lo que unas posibles estrategias podrían ser: