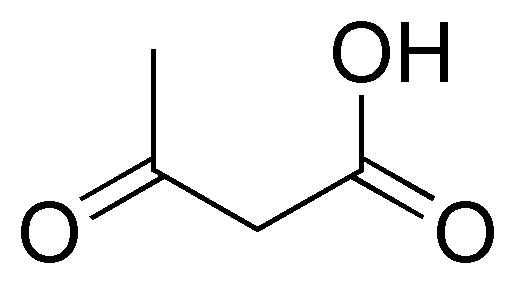
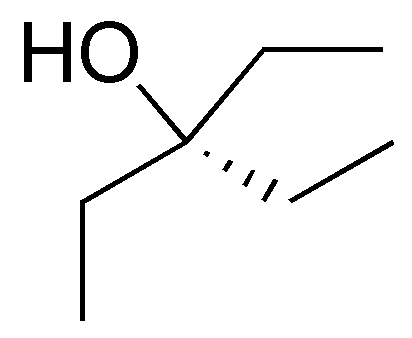
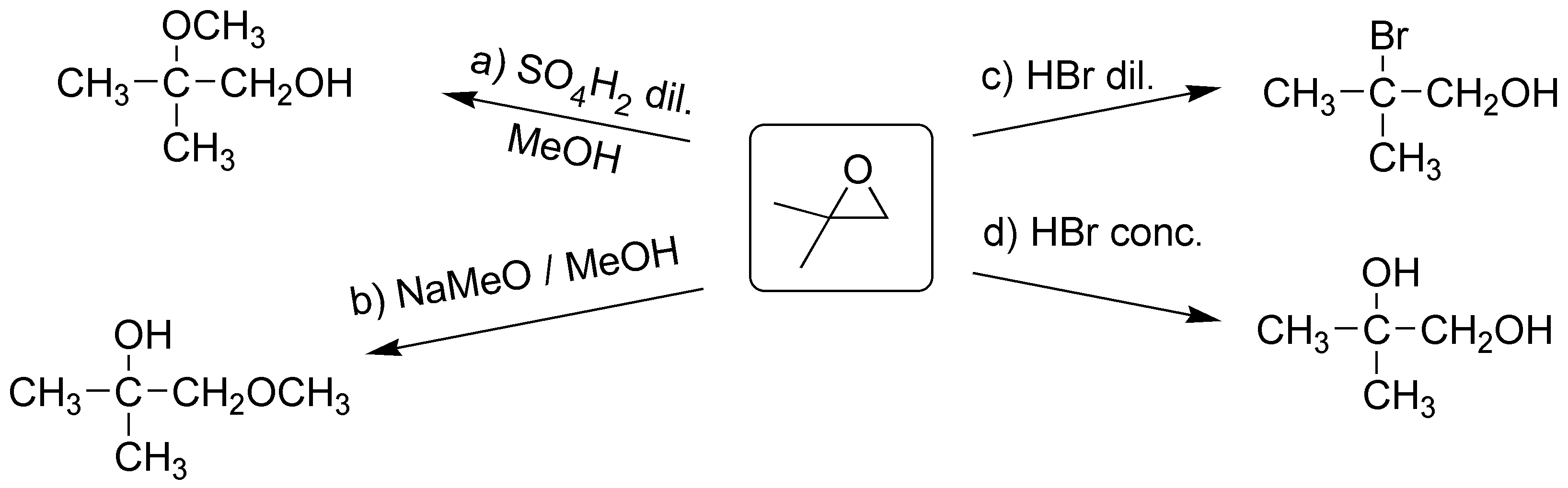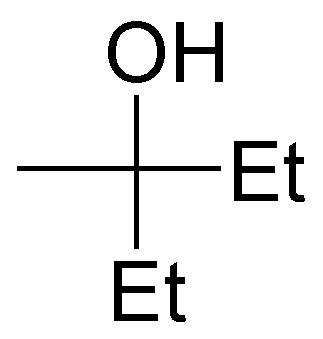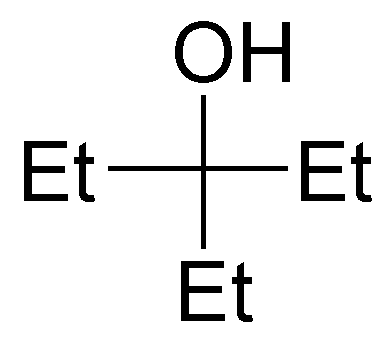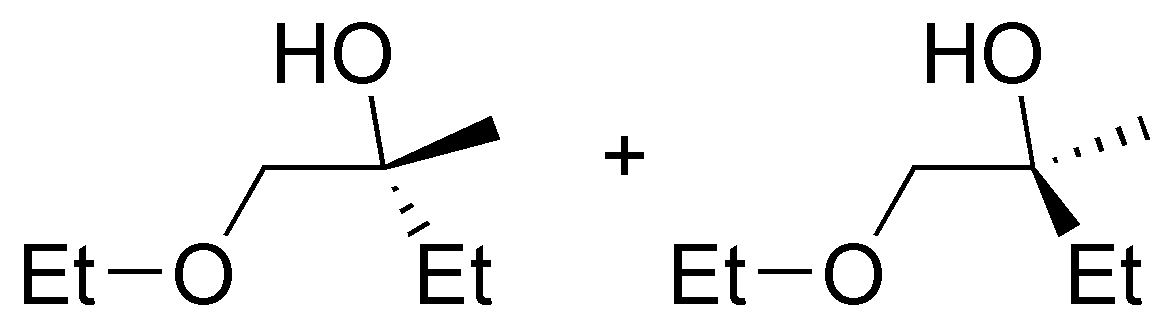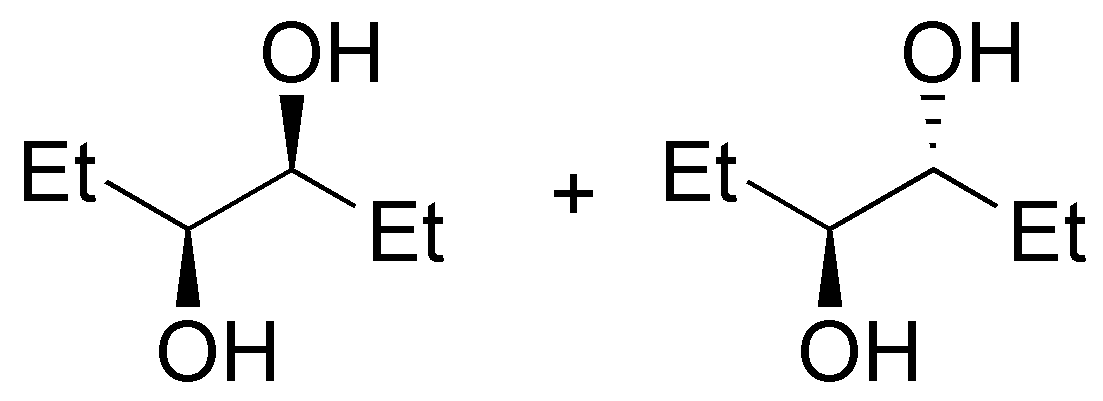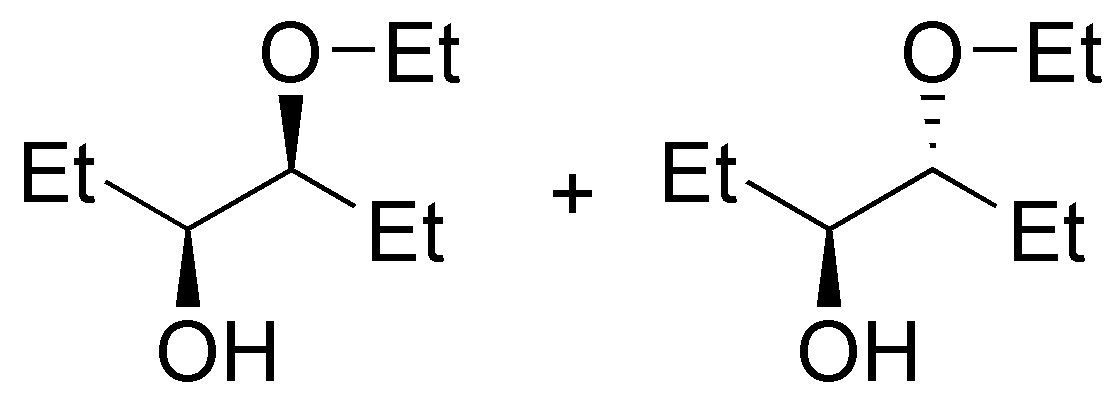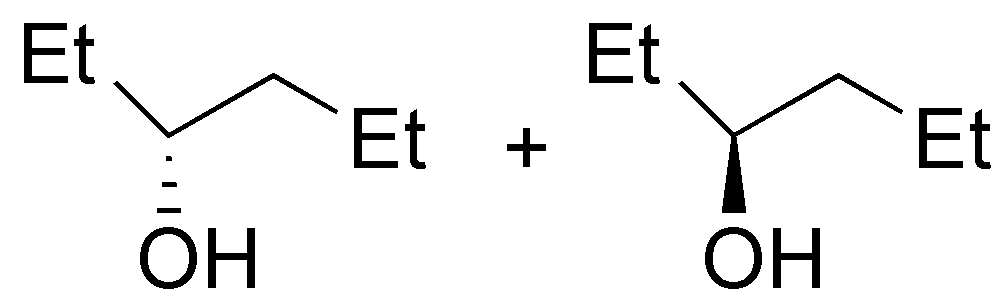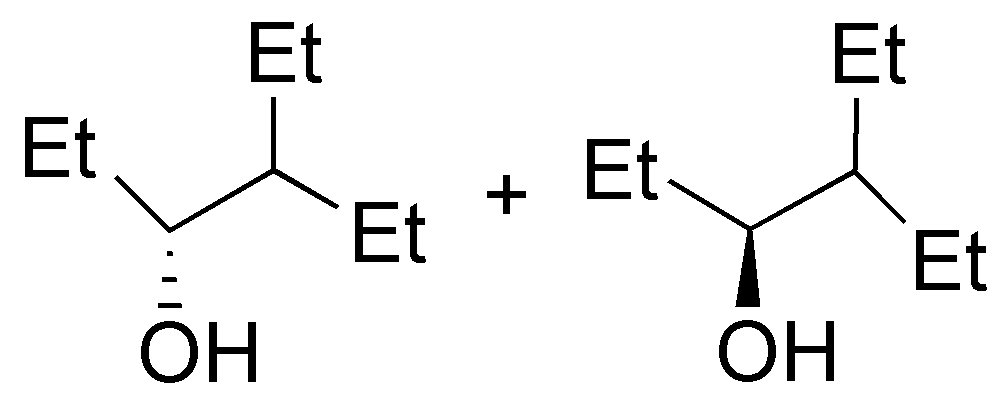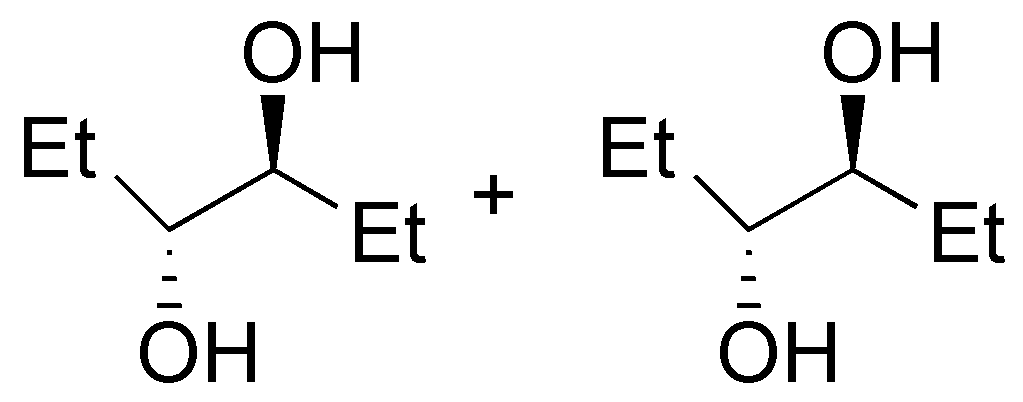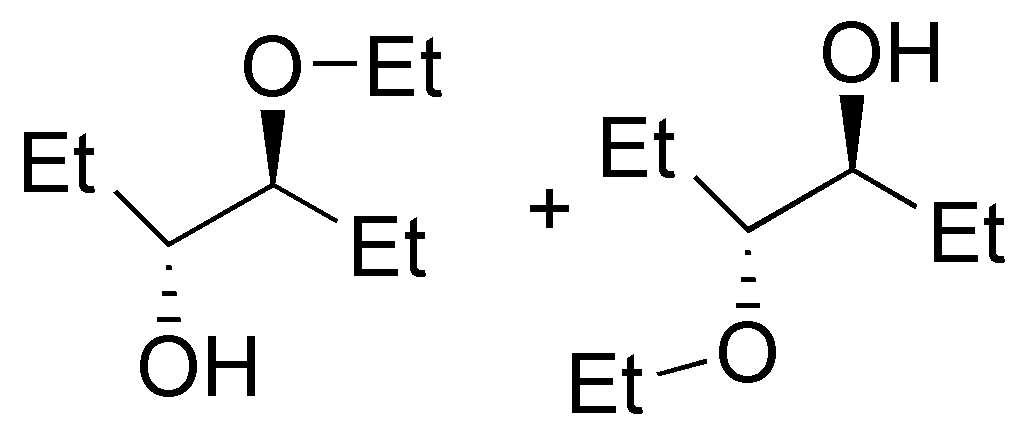Written by J.A. Dobado | Last Updated on 1 año
Ir a la página con el listado de problemas.
Alcoholes, Éteres y Oxiranos – soluciones a los problemas
Solución 1:
Serán primarios los siguientes alcoholes:
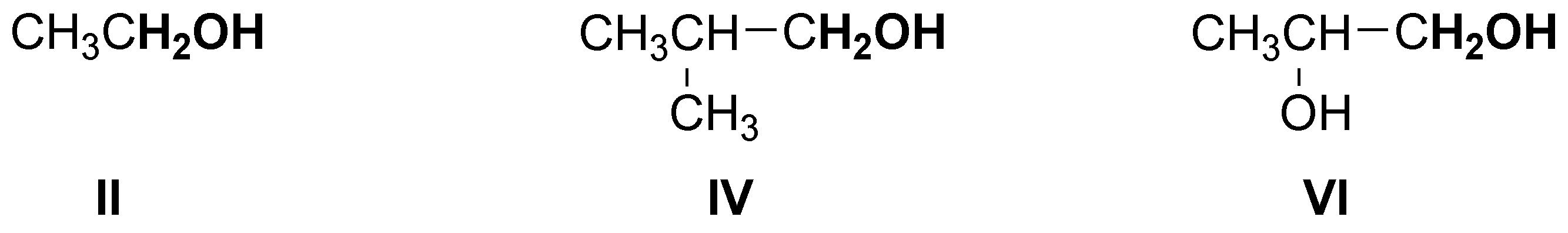
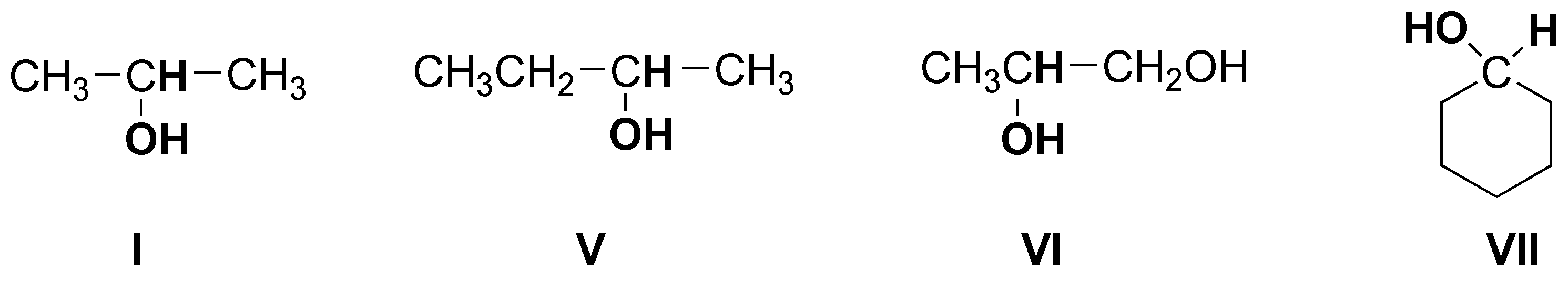
los alcoholes secundarios están unidos a un -CH- como se indica:
y sólo el compuesto III es un alcohol terciario.
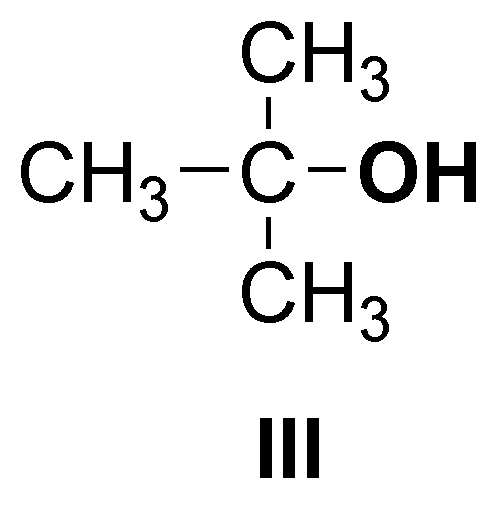
Observar que el compuesto VI es un diol (presenta dos hidroxilos) y se puede clasificar como primario y secundario.
Solución 2:
Los alcoholes son compuestos ligeramente ácidos con valores de pKa que suelen oscilar entre 15 y 18, aproximadamente. Un compuesto será tanto más ácido cuanto menor sea el pKa. El valor de pKa para los alcoholes sigue la siguiente secuencia: 3° > 2° > 1° > MeOH, como consecuencia del efecto inductivo positivo de los grupos alquilo (ceden electrones desestabilizando el anión). Las bases capaces de formar los correspondientes alcóxidos son: hidruros metálicos, metales alcalinos o amiduro sódico. En cuanto al ión HO–, no es lo suficientemente fuerte como para formar el alcóxido, sin embargo, para los alcoholes más ácidos (metanol y etanol) se establece un equilibrio de manera que si bien RO– no se obtiene en cantidad estequiométrica, si está presente en proporción suficiente como para iniciar algún proceso, actuando como base. Por tanto, formarán alcóxidos con ambos alcoholes los siguientes reactivos: Na, NaNH2 y NaH.
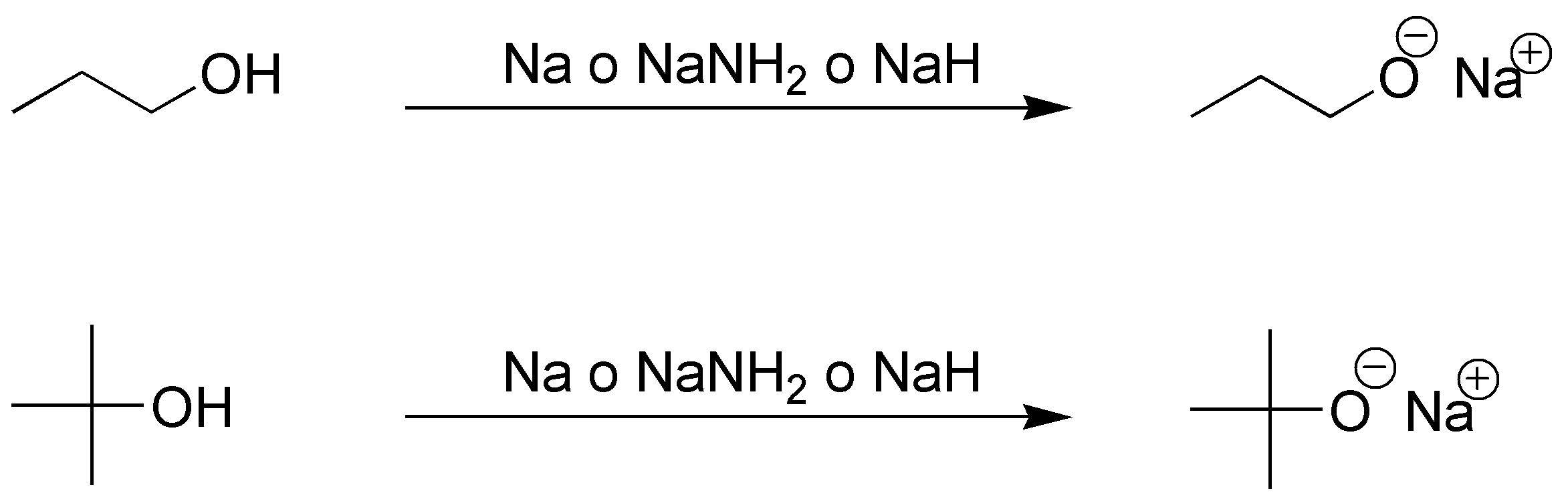
Solución 3:
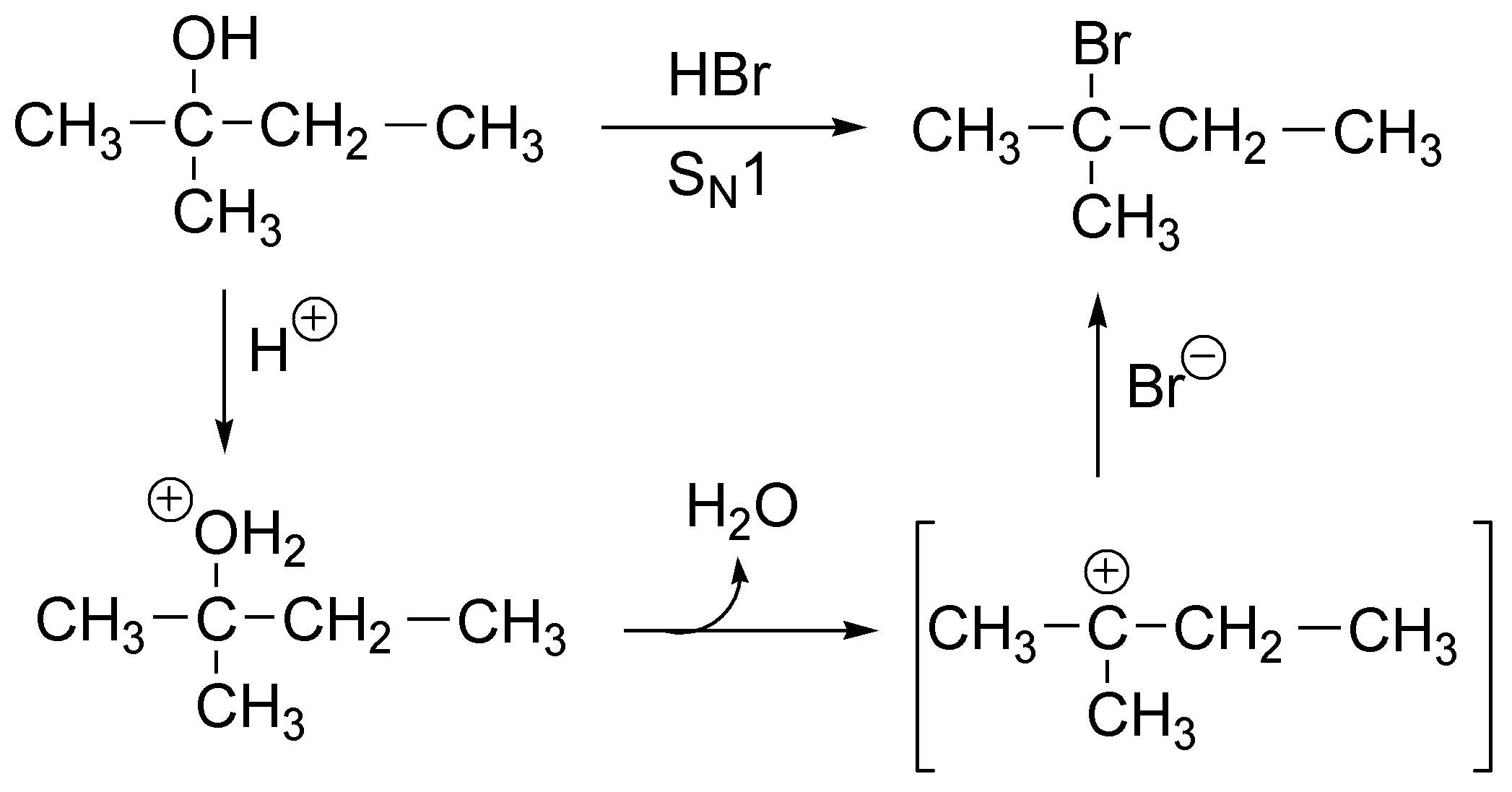
La primera etapa de la reacción es el ataque del protón del HBr sobre el grupo hidroxilo convirtiéndolo en un ión alquil hidronio, que pierde agua fácilmente produciendo un carbocatión terciario relativamente estable que reacciona con un ión bromuro dando el 2-bromo-2-metilbutano como único producto. Se trata por tanto de una SN1.
Solución 4:
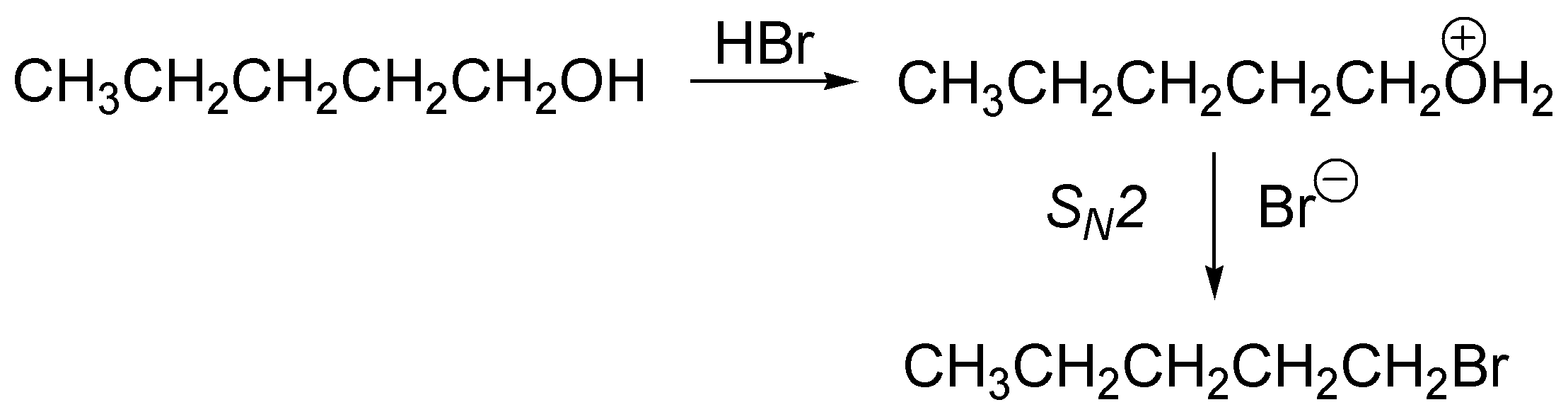
Cuando se trata de un alcohol primario la protonación produce el ión alquil hidronio pero este no pierde fácilmente agua porque el carbocatión que se generaría sería primario (poco estable) aún así es un buen grupo saliente y facilita sus sustitución por un ión bromuro mediante una SN2.
Solución 5:
La solución de ZnCl2 en HCl concentrado se conoce como reactivo de Lucas y es utilizado para la clasificación de alcoholes. La función del cloruro de zinc es convertir el grupo hidroxilo en un mejor grupo saliente mediante la formación de un complejo entre el oxigeno del grupo hidroxilo y el zinc favoreciendo la formación del carbocatión secundario que posteriormente es atacado por un ión cloruro.
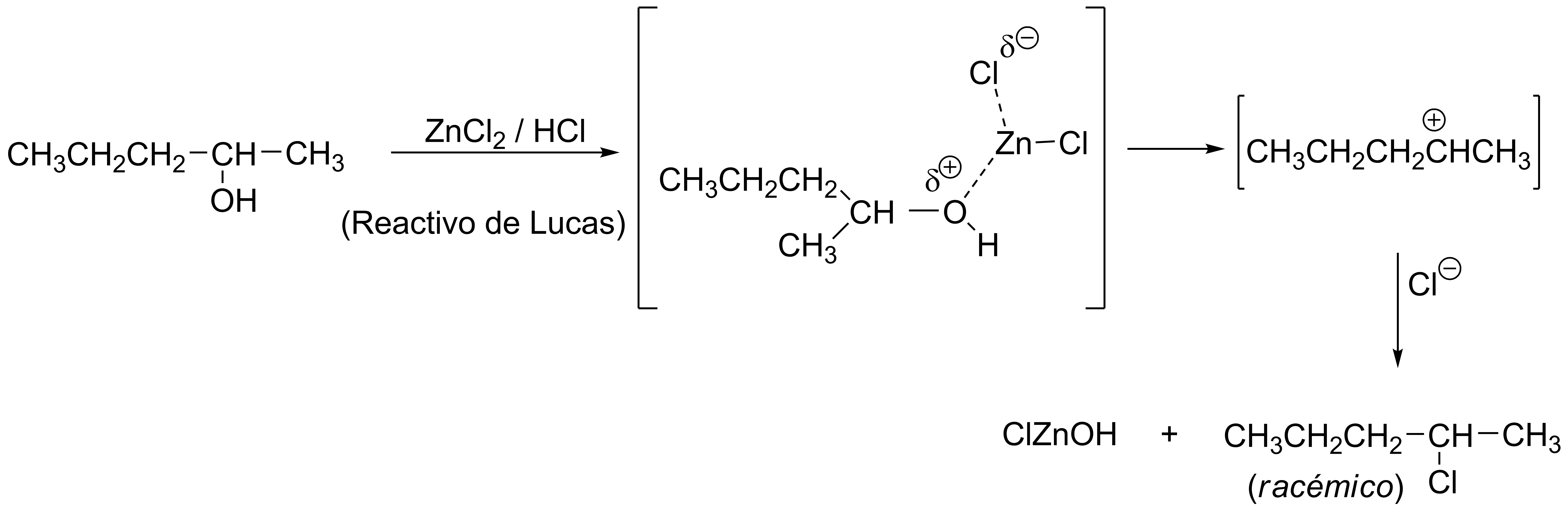
Solución 6:
Como se trata de un alcohol primario la protonación del mismo produce el ión alquil hidronio este pierde agua generando un carbocatión primario (poco estable), que con el fin de estabilizarse evoluciona a un carbocatión secundario mediante la migración (transposición) de un hidrógeno, este carbocatión (al no existir en el medio ningún buen nucleófilo) pierde un protón produciendo el alqueno más estable (el más sustituido), es decir el 2-buteno.
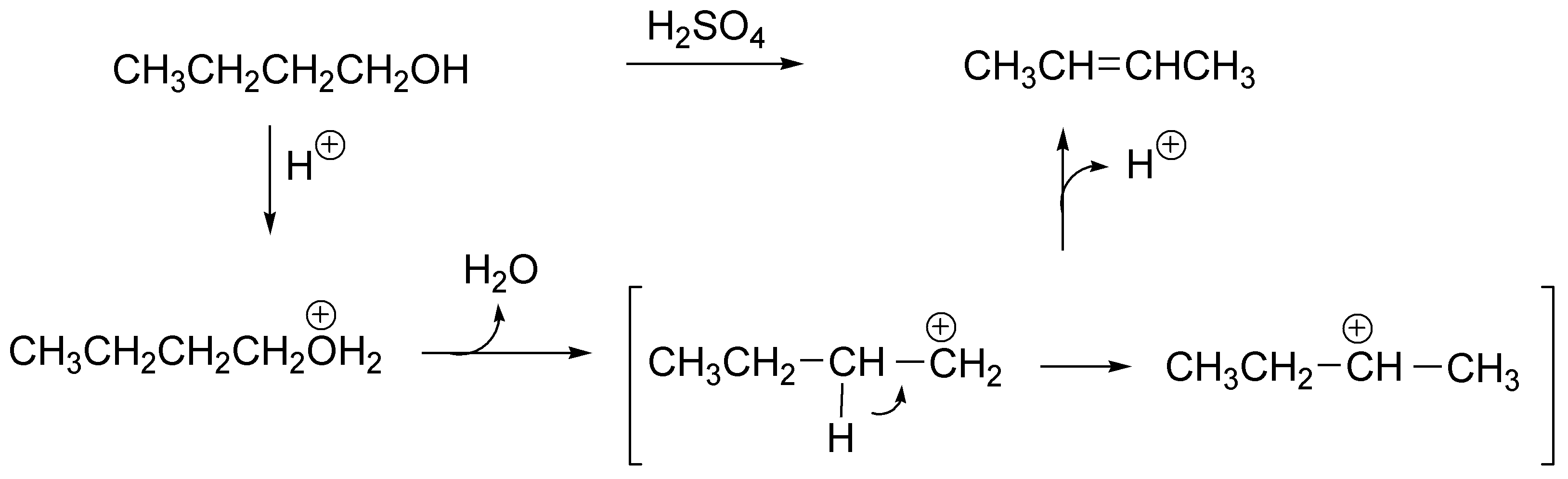
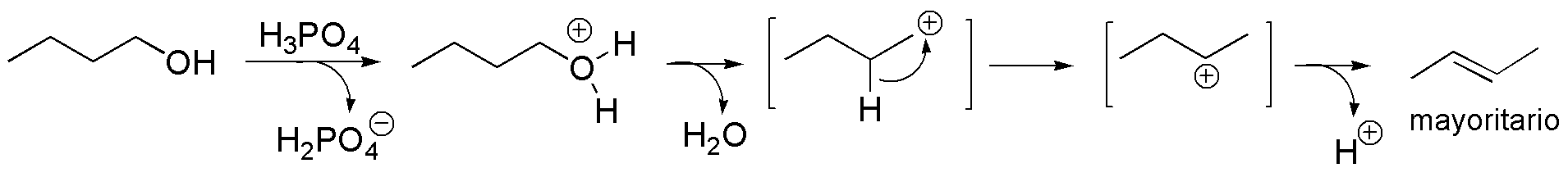
Solución 7:
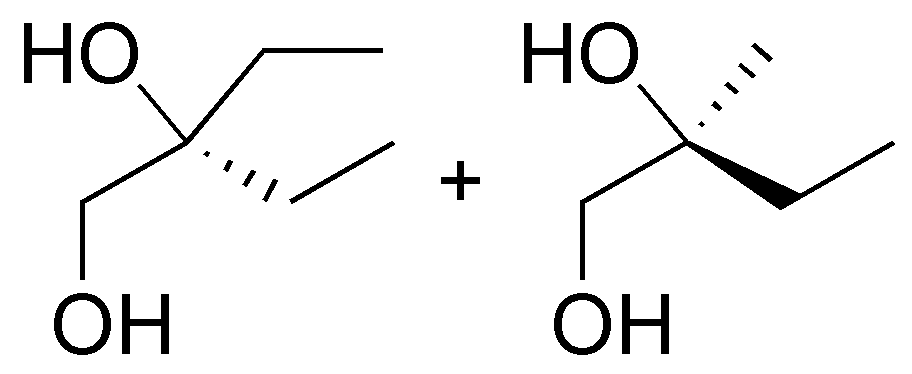
a) El butan-1-ol es un alcohol primario. El ácido mineral produce la protonación del grupo -OH. Se produce, a continuación, la pérdida de una molécula de agua, y la formación de un carbocatión primario. Dado que es muy inestable, evoluciona hacia un carbocatión secundario, por transposición de un hidrógeno, llevándose un par de electrones, es decir, como hidruro, para dar un carbocatión secundario. Dicho carbocatión evoluciona hacia un alqueno. La reacción sigue la regla de Zaitsev, que indica que se forma en mayor proporción el alqueno termodinámicamente más estable, que es el más sustituido y de estereoquímica trans.
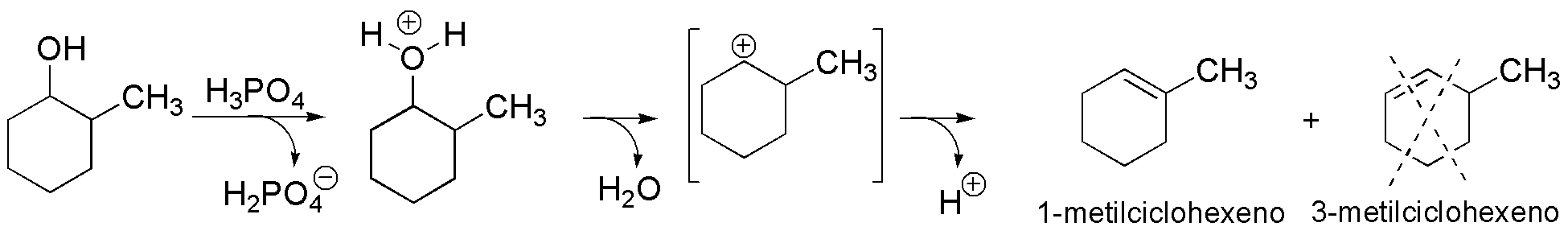
b) El 2-metilciclohexanol genera un carbocatión secundario. De los dos alquenos posibles, 3-metilciclohexeno y 1-metilciclohexeno, se forma este último, ya que es el compuesto más estable por ser el alqueno más sustituido.
c) El 2-metilpentan-3-ol es un alcohol secundario. El carbocatión que se produce por protonación del grupo hidroxilo y posterior salida de una molécula de agua es también secundario. La pérdida del hidrógeno del carbono 2 conduce a la formación de un alqueno trisustituido.
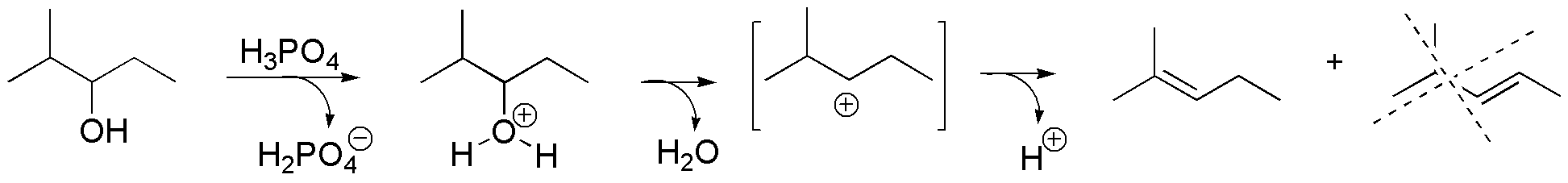
d) El tratamiento de este alcohol quiral con una ácido mineral conduce a la formación de un carbocatión terciario. Nótese que desaparece la quiralidad del carbono al que estaba unido el grupo -OH, mientras que la estereoquímica del carbono 3 no se ve alterada. La reacción finaliza con la pérdida de un protón para generar un doble enlace. El producto mayoritario proviene de la pérdida del protón del grupo isopropilo, ya que da lugar al alqueno más sustituido.
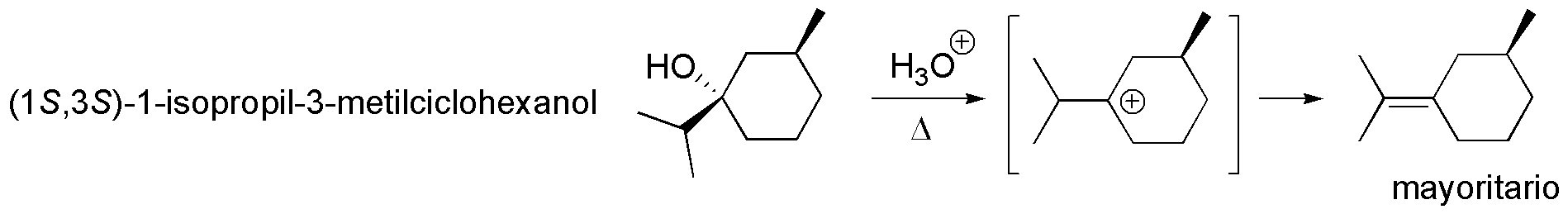
Solución 8:
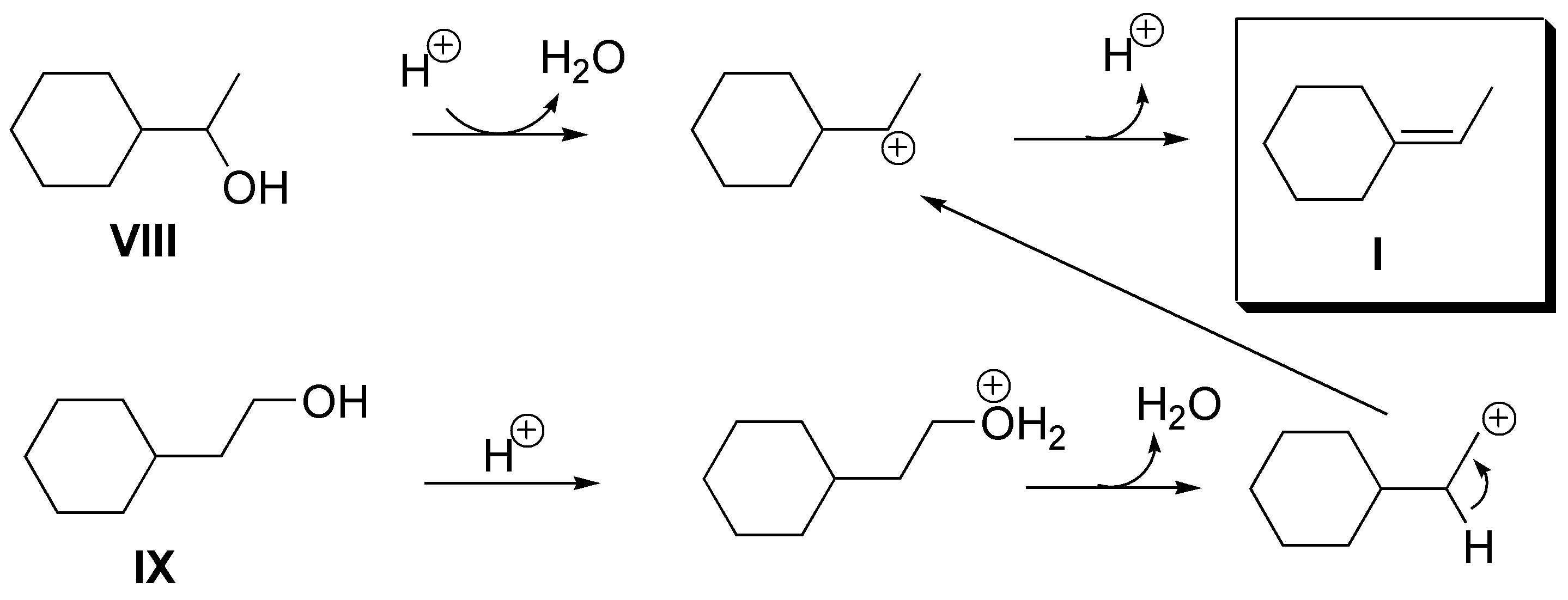
a) El alqueno I podría obtenerse a partir de los alcoholes VIII (1-ciclohexil-1-etanol) o IX (2-ciclohexil-1-etanol), si bien en el caso de VIII podría producirse una transposición a un carbocatión terciario y dar mezcla de alquenos.
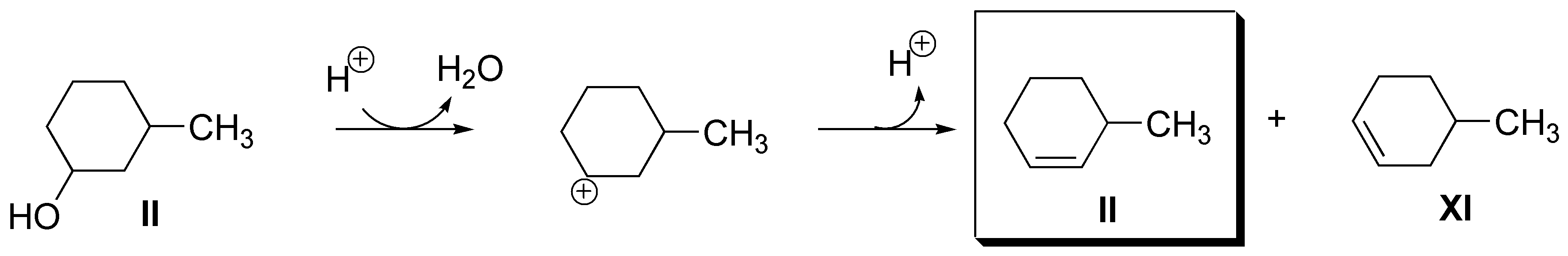
b) El mejor candidato es el 3-metilciclohexanol (X) si bien la deshidratación puede producir el 4-metilciclohexeno (VII) junto al alqueno buscado II.
c) Dos son los posibles alcoholes: el 2-metilciclohexanol (XI) o el 1-metilciclohexanol (XII):
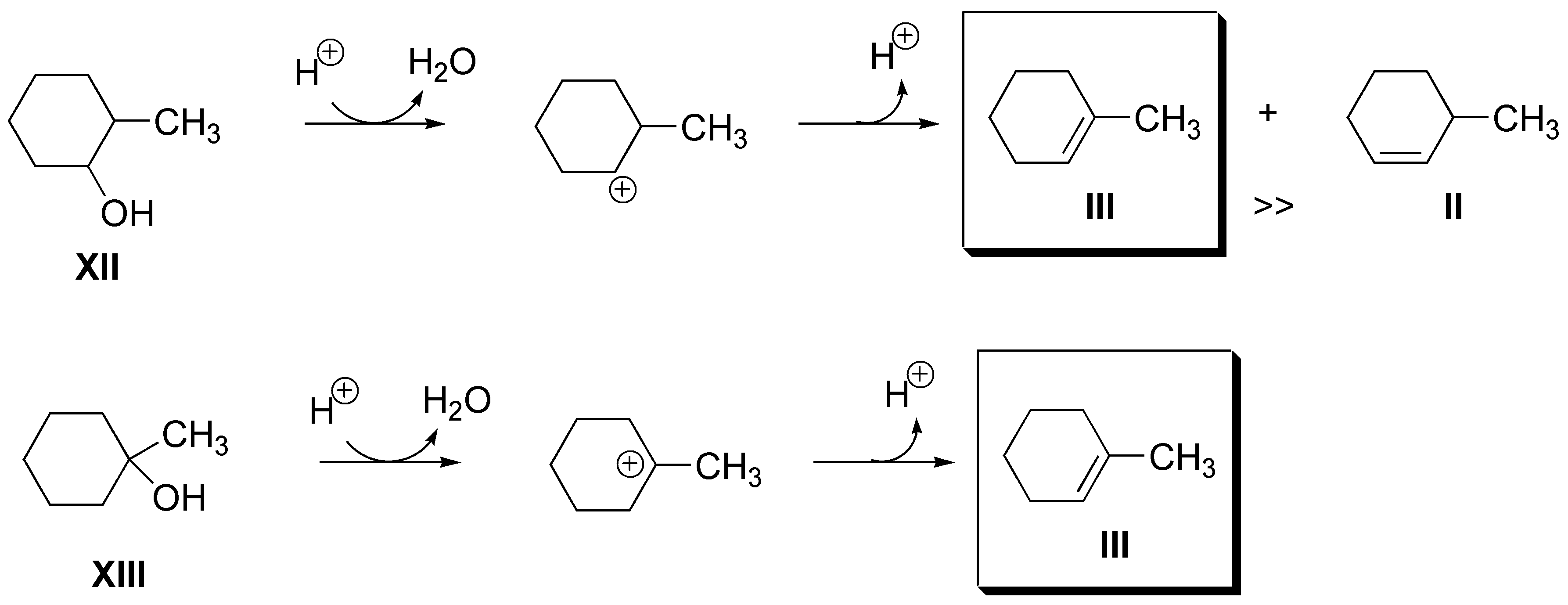
d) También para el alqueno IV (2-metilpropeno) serán dos las posibilidades: el 2-metil-2-propanol (XIII) y el 2-metil-1-propanol (XIV), ambos lo producen como único producto:
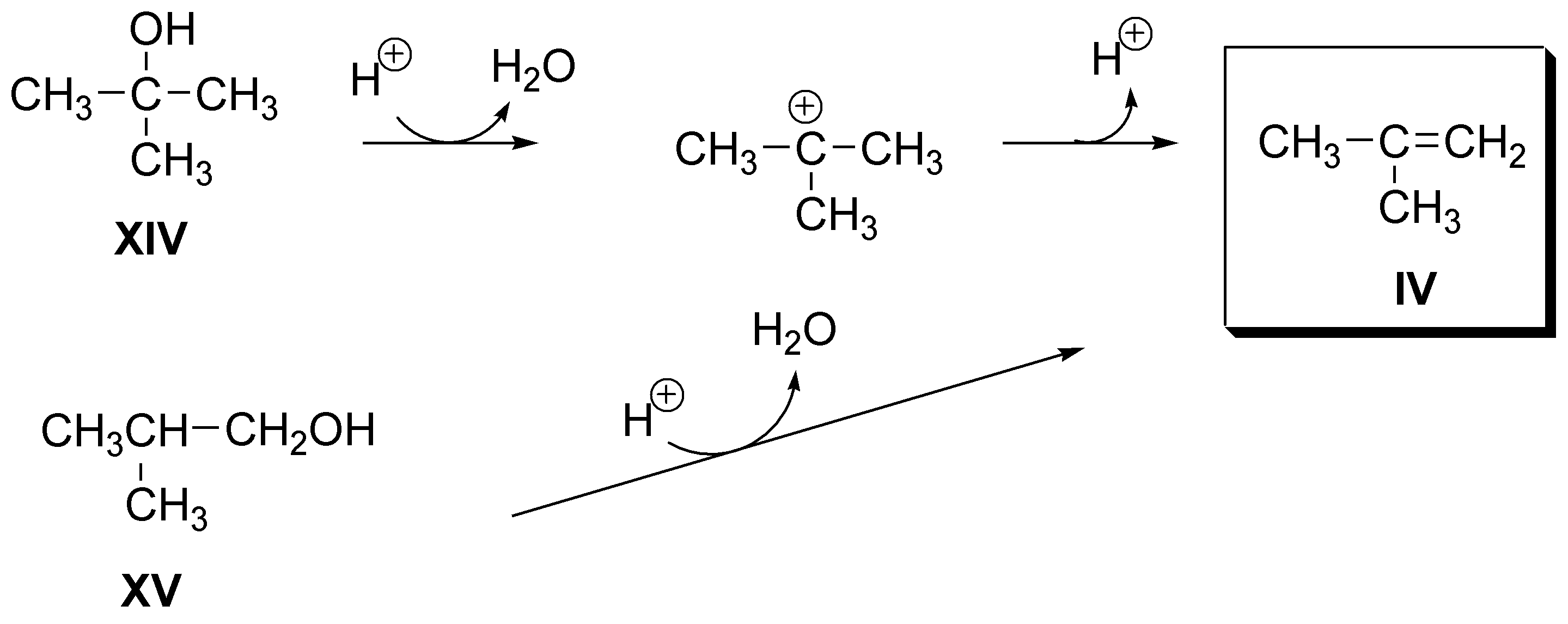
e) El alqueno V (estireno) puede obtenerse como único producto de deshidratación tanto a partir del 1-fenil-1-etanol (XV) como del 2-fenil-1-etanol (XVI):
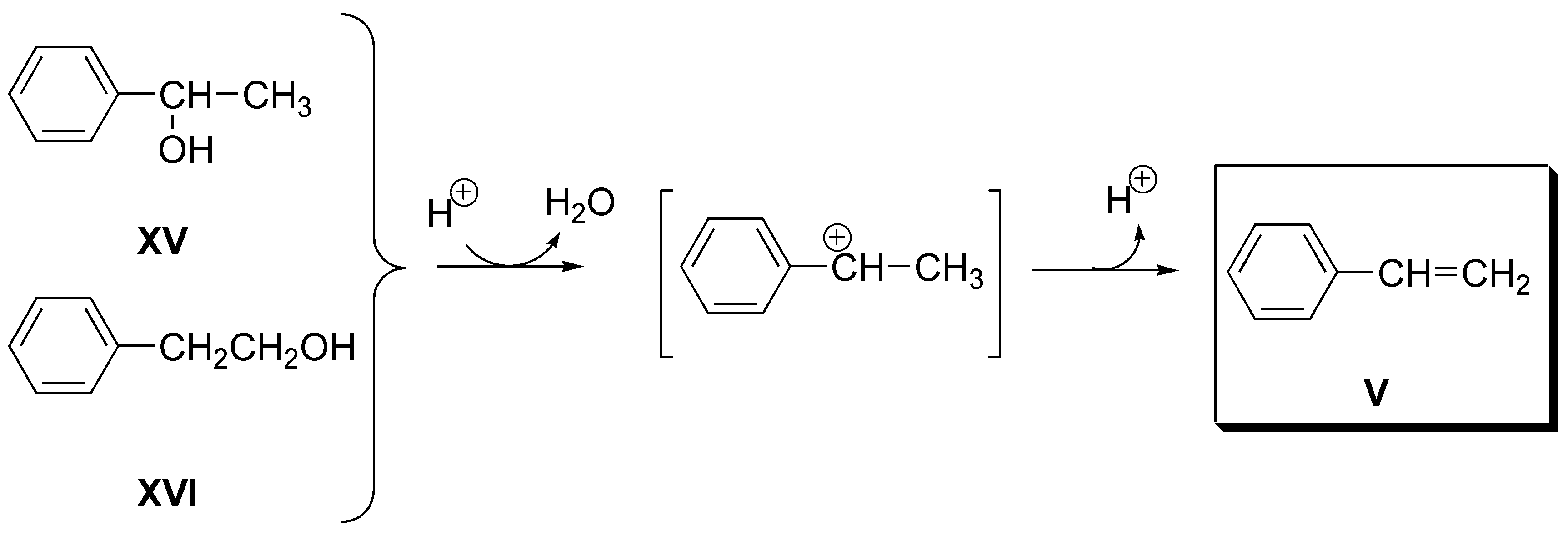
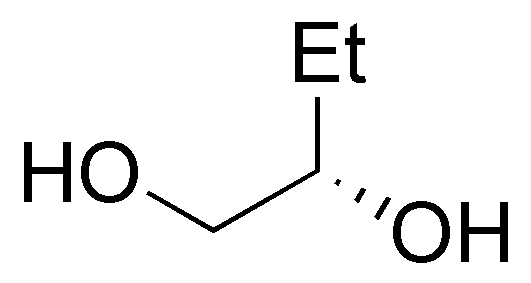
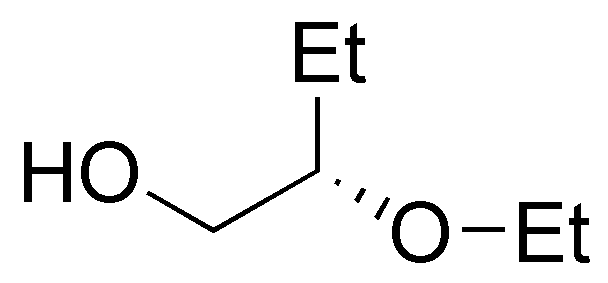
f) El 2-penteno (VI) puede obtenerse tanto a partir de 2-pentanol (XVII), como de 3-pentanol (XVIII):
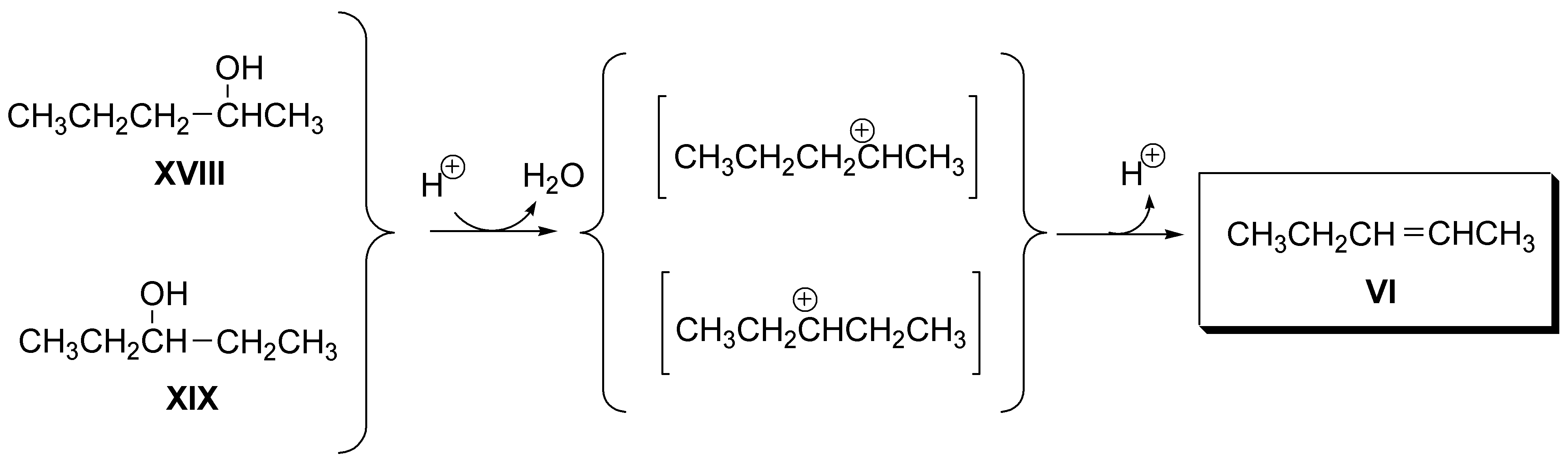
Solución 9:
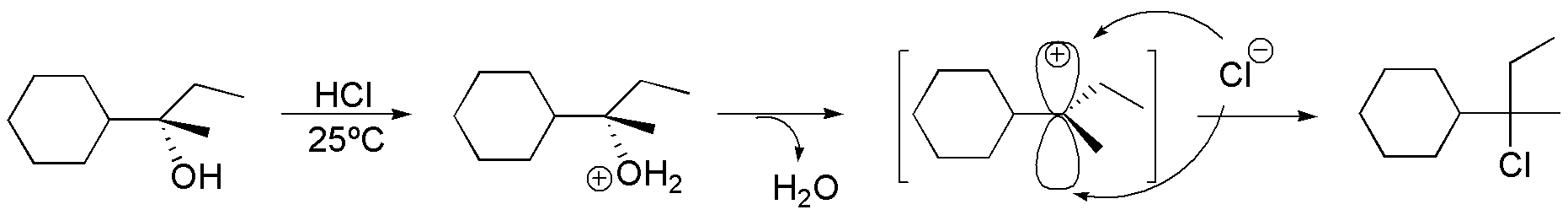
a) El producto de partida de la reacción es un alcohol terciario quiral. Por tratamiento en medio ácido se forma un carbocatión terciario. Los carbocationes son intermedios de reacción que pueden ser atacados por nucleófilos por ambas caras, con lo que se obtienen una mezcla equimolecular de los dos posibles enantiómeros (racemización). En nuestro caso el nucleófilo es el ión cloruro y el producto final de la reacción es un cloruro de alquilo terciario racémico.
b) La reacción de un alcohol con SOCl2 conduce a la formación de cloruros de alquilo, que en ausencia de una base tiene lugar mediante un mecanismo intramolecular (SNi). Como resultado se obtiene un cloruro de alquilo con retención de la configuración.
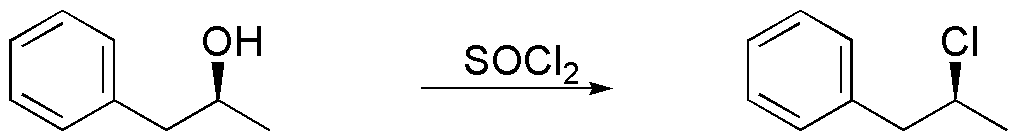
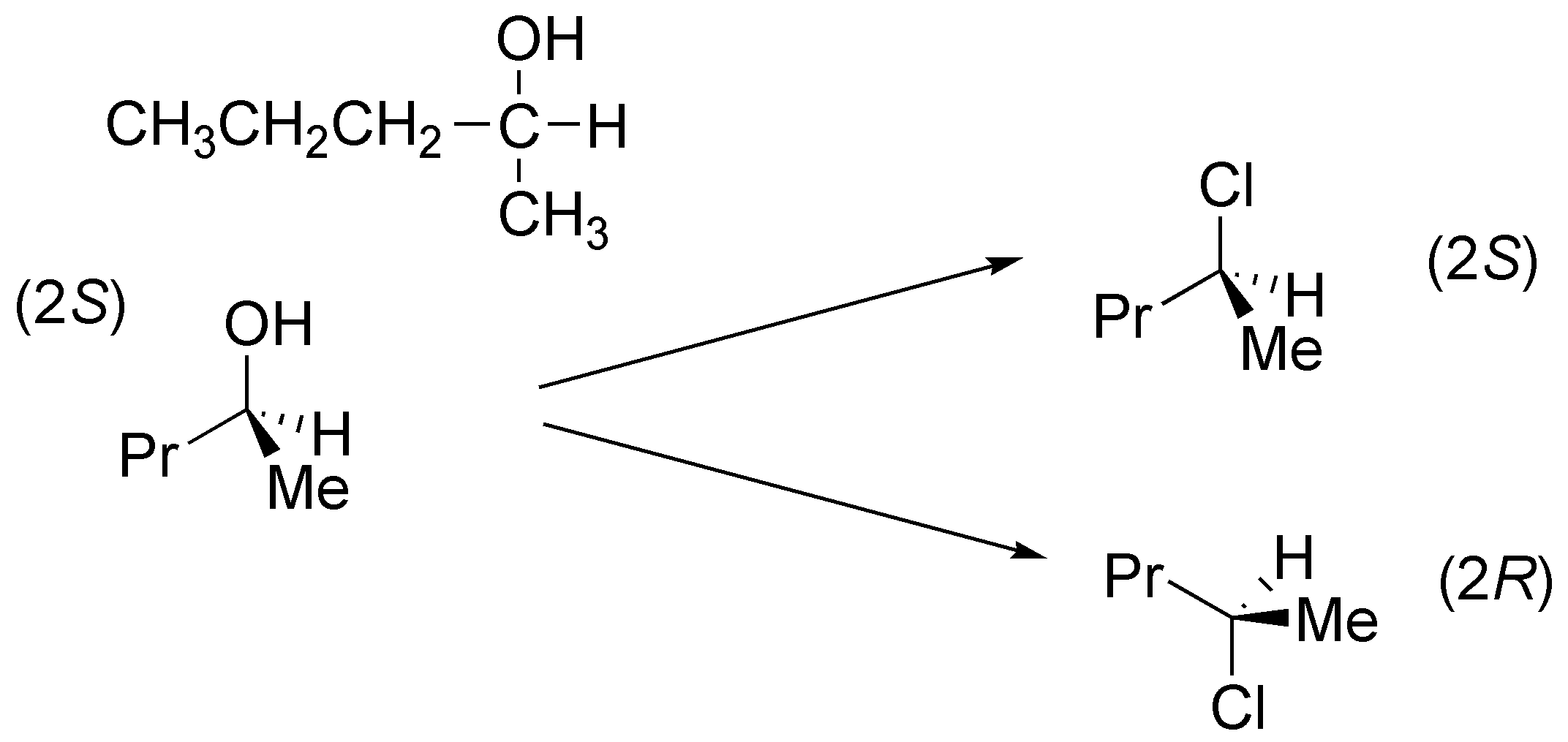
c) El tratamiento de un alcohol primario como el pentan-1-ol con tricloruro de fósforo produce la sustitución del grupo hidroxilo por el átomo de halógeno. El mecanismo de esta reacción es de tipo SN2, lo cual significa que transcurre con inversión de la configuración, aunque en este sustrato, al ser aquiral el carbono sobre el que se produce la reacción no se observan cambios estereoquímicos.
![]()
d) La reacción que se describe consta de dos pasos, en el primero de ellos el alcohol primario se trasforma en el correspondiente mesilato (metanosulfonil derivado) por tratamiento con cloruro de mesilo en medio básico de piridina. El mesilato, como el resto de sulfonatos, es un excelente grupo saliente que puede ser sustituido por hidrógeno mediante una reacción tipo SN2 en el que un hidruro del LiAlH4 actúa como nucleófilo. La reacción puede considerarse en conjunto una reducción en cuanto que globalmente hay pérdida de oxígeno y ganancia de hidrógeno.
![]()
Solución 10:
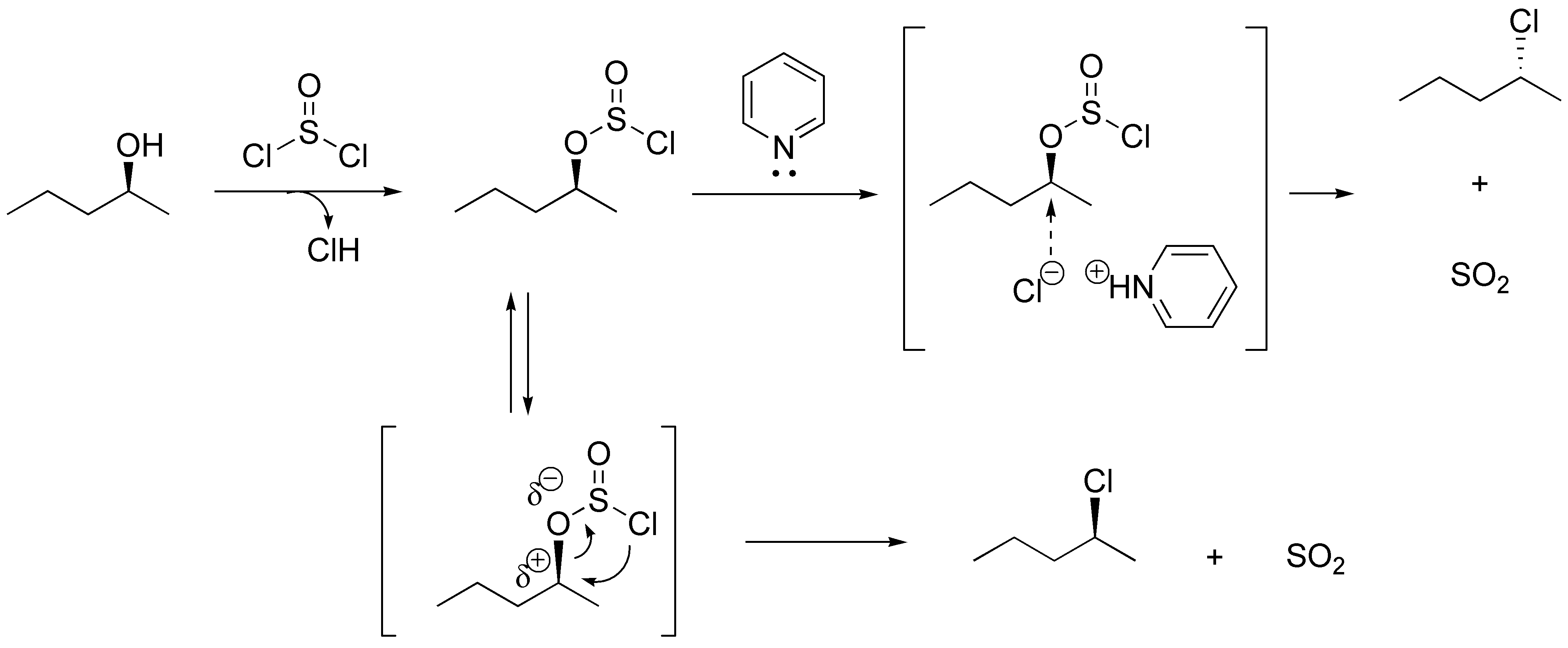
Se pueden realizar ambas reacciones con el mismo reactivo el cloruro de tionilo (SOCl2) si se realiza la reacción en presencia de piridina se produce la conversión del alcohol en haluro mediante una SN2 y por tanto se produce inversión de la configuración. Si se realiza en ausencia de base se mantiene la configuración absoluta mediante un proceso intramolecular.
Solución 11:
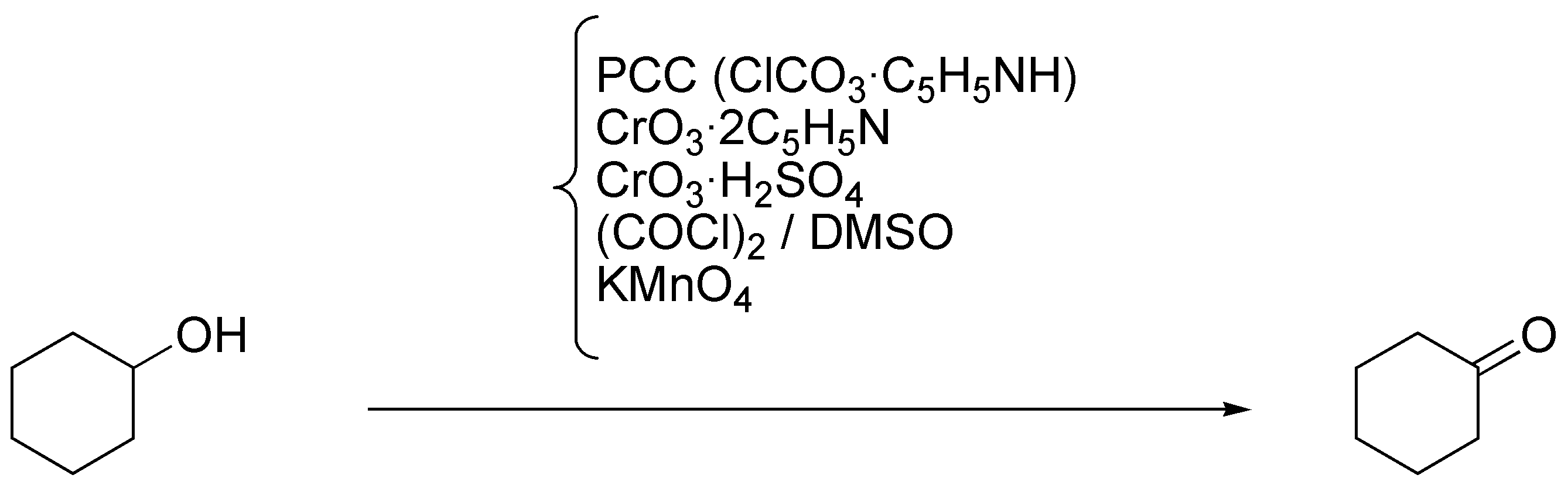
a) El ciclohexanol es un alcohol secundario, que por oxidación da una cetona. Los reactivos que pueden dar esta transformación son: PCC (ClCrO3·C5H5NH), reactivo de Collins, CrO3 • 2 C5H5N, reactivo de Jones, CrO3 • H2SO4, reactivo de Swern, (CrOCl)2/ DMSO, y permanganato potásico.
b) El ciclopentilmetanol se puede trasformar en ácido ciclopentanocarboxílico por tratamiento con permanganato potásico o bien con reactivo de Jones, CrO3 / H2SO4.
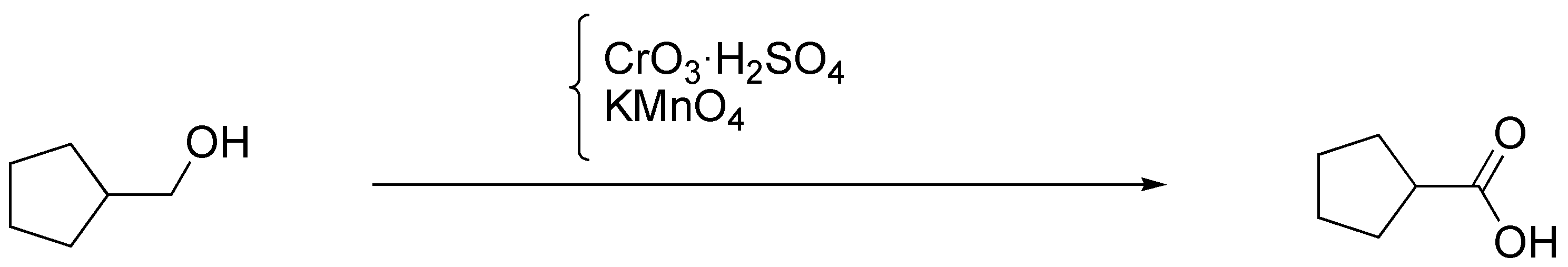
c) Sobre el mismo sustrato del ejercicio anterior en necesario usar un oxidante más suave para obtener el aldehído y que éste no se transforme en ácido carboxílico. Los reactivos que usan para este fin son: PCC (ClCrO3·C5H5NH), reactivo de Collins, CrO3 • 2 C5H5N, y reactivo de Swern, (COCl)2 / DMSO.
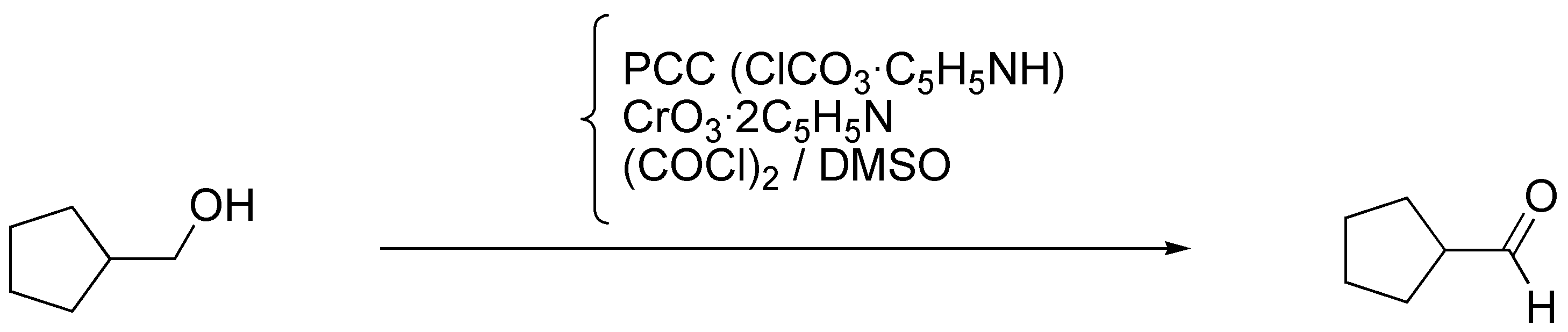
d) Para la transformación de 2-metilpent-4-en-1-ol en 2-metilpent-4-enal se puede utilizar cualquiera de los procedimientos del apartado anterior, ya que en ningún caso el doble enlace se verá afectado, en cuanto que no hay ácido prótico en ninguno de los reactivos descritos.
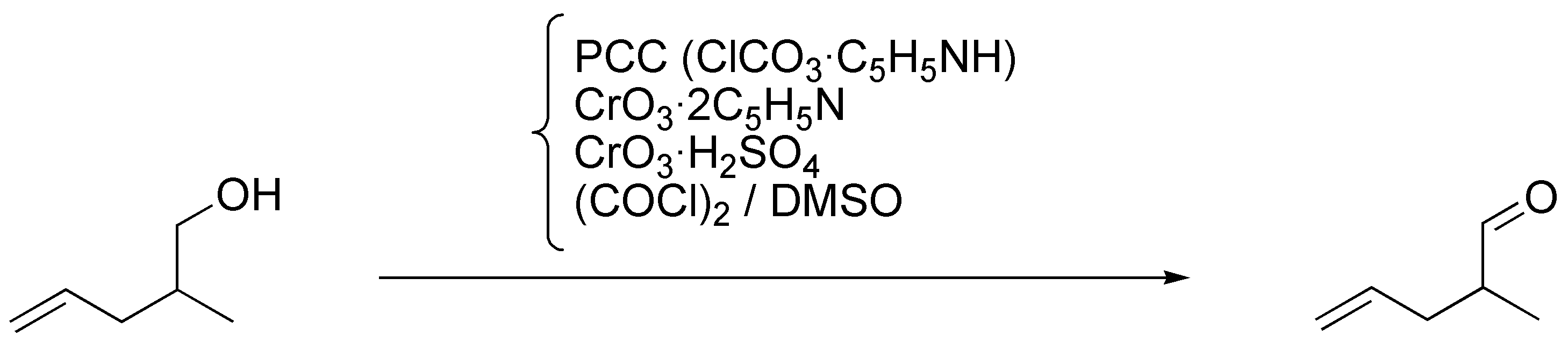
Solución 12:
a) El producto de partida del ejercicio es un alcohol primario. Con PCC se obtendrá el correspondiente aldehído con igual esqueleto carbonado. En las condiciones de reacción el doble enlace no se ve afectado.
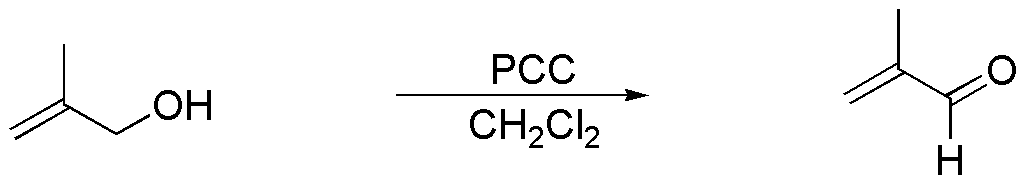
b) El hidruro de aluminio y litio es un reductor que no afecta al doble enlace. Por su carácter fuertemente básico puede generar el correspondiente alcóxido. Si la reacción se trata con cloruro amónico acuoso, como ácido débil que es, neutraliza la basicidad del medio, por lo que finalmente no se observará reacción alguna.
c) La reacción de un alcohol con cloruro de tionilo en piridina produce la sustitución del grupo hidroxilo por un átomo de cloro. La reacción transcurre mediante un mecanismo SN2. Al ser un sustrato donde el grupo -OH se encuentra en una posición primaria, desde el punto de vista estereoquímico, no se observa ninguna consecuencia debido a la inversión en el carbono unido al grupo -OH.
![]()
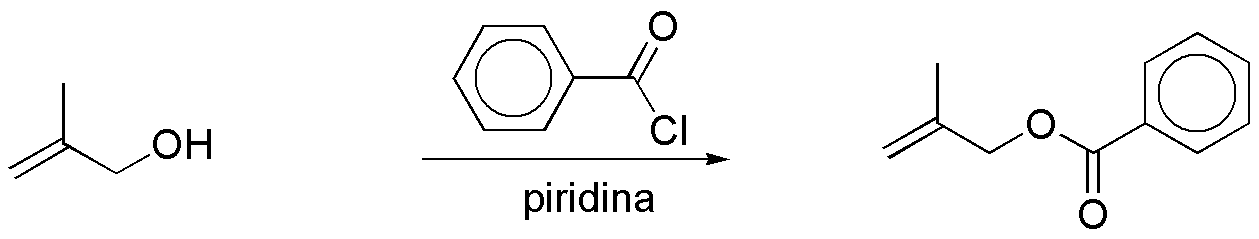
d) El reactivo de Jones es un oxidante capaz de oxidar alcoholes primarios hasta ácidos carboxílicos, y alcoholes secundarios hasta cetonas. Sin embargo, en este caso el reactivo es incompatible con el compuesto de partida, ya que el medio ácido afecta al doble enlace.e) La reacción que se describe es una reacción de esterificación, usando como agente acilante cloruro de benzoílo. El resultado es una benzoato. Para que se dé la reacción se requiere la presencia de una base.
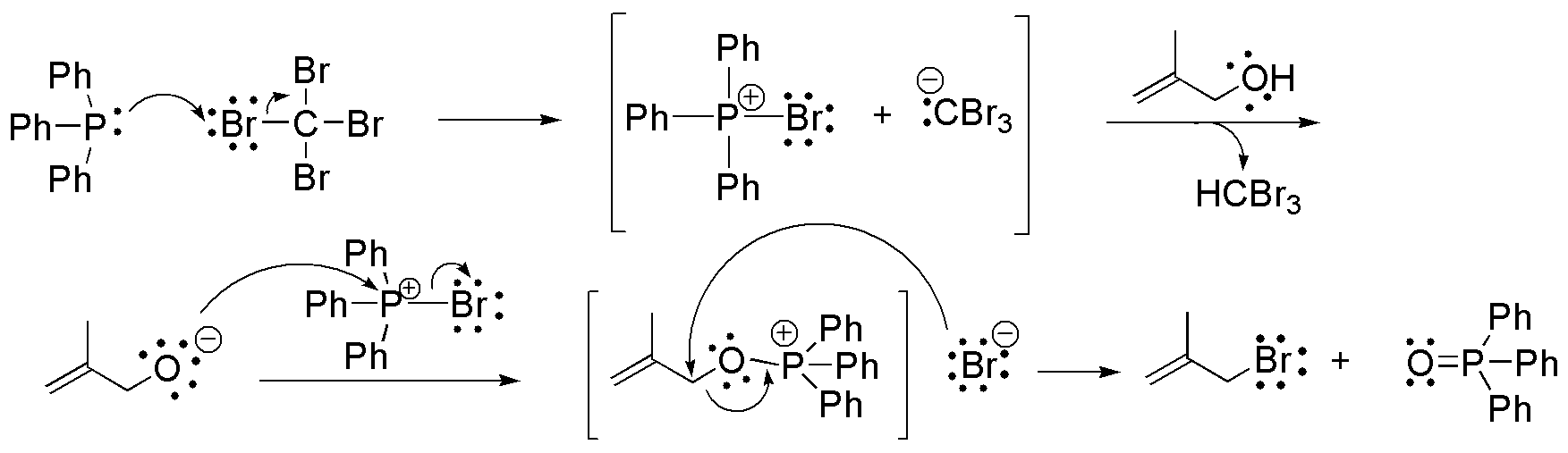
f) La reacción de Appel consiste en la sustitución de un grupo hidroxilo por un átomo de bromo usando trifenilfosfina y tetrabromo (Br4C). Las condiciones de reacción son muy suaves, y normalmente presentan rendimientos muy buenos.
![]()
Es conocido que los grupos hidroxilos son muy malos grupos salientes en reacciones de tipo SN2, por lo que no se pueden sustituir por un nucleófilo de forma directa. Es necesario formar un derivado, generalmente sulfonatos, para realizar la sustitución. En este caso, el nucleófilo (X–) se genera in situ, al mismo tiempo que la trifenilfosfina se asocia con el grupo -OH para convertirlo en un buen grupo saliente. Se produce óxido de trifenilfosfina como subproducto de la reacción.
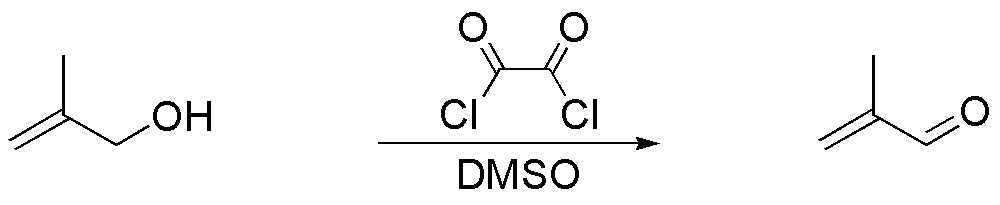
g) El sistema cloruro de oxalilo / DMSO se denomina reactivo de Swern y permite la oxidación de alcoholes primarios y secundarios hasta el correspondiente compuesto carbonílico. El alcohol primario del ejercicio da el mismo compuesto que el del apartado anterior, ya que el doble enlace no se ve afectado.
h) El hidruro sódico es una base fuerte que reacciona con los alcoholes para dar alcóxidos. El hidruro sódico es incompatible con disolventes próticos como agua o alcoholes, por lo que la reacción se debe realizar en disolventes apróticos como el THF, que como es sabido, es un éter cíclico. Los alcóxidos son nucleófilos que pueden desplazar a átomos de halógeno en haluros primarios y secundarios mediante reacciones de tipo SN2. Este procedimiento es un método general para la preparación de éteres y se denomina síntesis de Williamson. Aplicado al sustrato del problema la secuencia de reacciones es la siguiente:
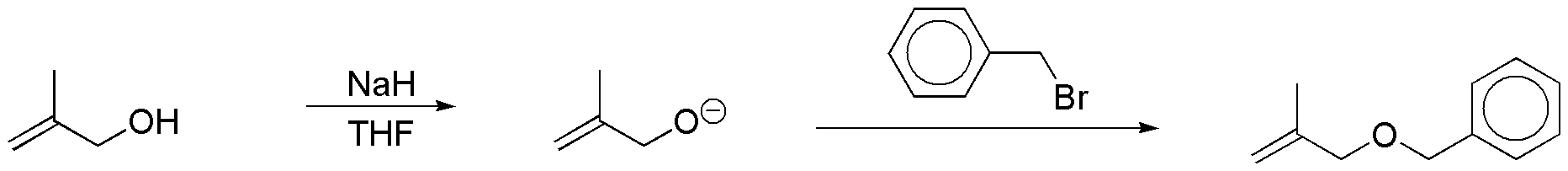
Solución 13:
Se tratará del éter di-n-propílico (A). El tratamiento del 1-propanol con sodio permite la formación del alcóxido sódico (eliminando H2), este alcóxido reaccionará con el haluro de alquilo primario mediante una SN2 (Síntesis de Williamson) produciendo un eter.
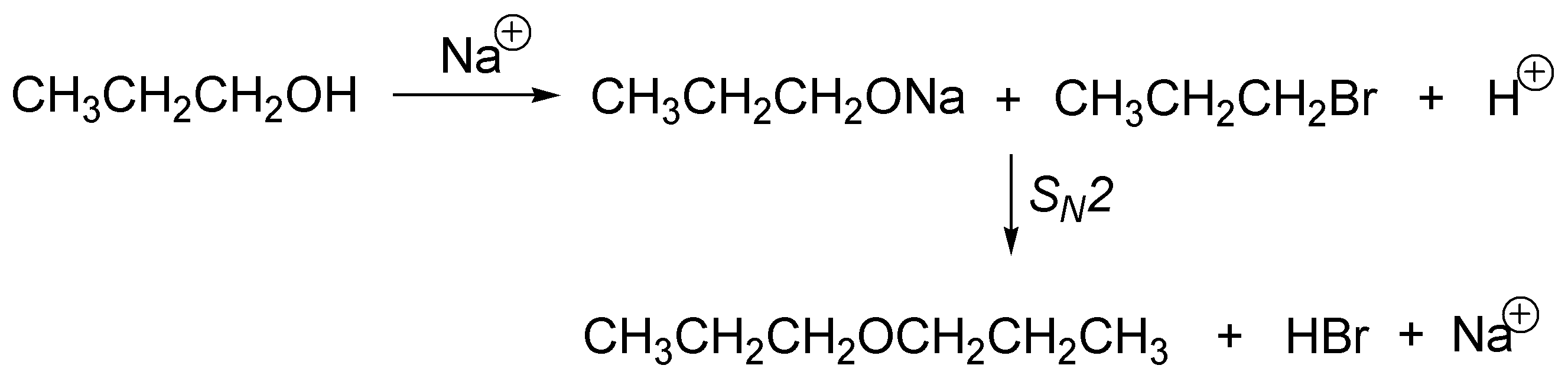
Solución 14:
La síntesis de Williamson de éteres consiste en la sustitución tipo SN2 sobre un haluro de alquilo con un alcóxido que actúa como nucleófilo. El orden de reactividad en los haluros, como es sabido, es:
primario > secundario >> terciario
Debido a que el bromo es mejor grupo saliente que el cloro, y en general, los bromuros son más estables que los yoduros, se deben elegir bromuros de alquilo primarios o como mucho secundarios de estructura adecuada para las síntesis de los compuestos del ejercicio. Aplicando estos principios para los compuestos a), b) y c) tenemos los siguientes resultados:
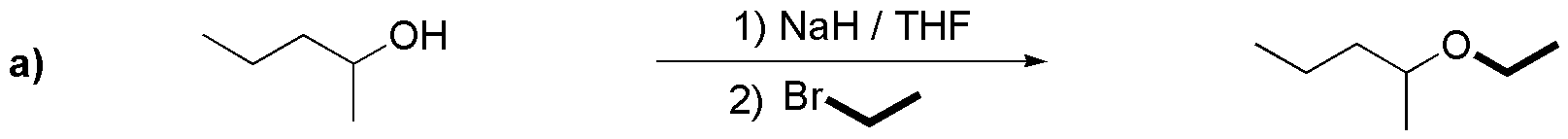
b) En este caso, se puede elegir el bromuro de alquilo y el alcohol indistintamente sobre uno u otro fragmento, ya que en ambos casos se parte de un sustrato con el grupo -OH o -X sobre un carbono primario.

c) Para este tercer compuesto el bromuro elegido debe ser bromuro bromuro de metilo y como alcóxido terc-butóxido, según el siguiente esquema:
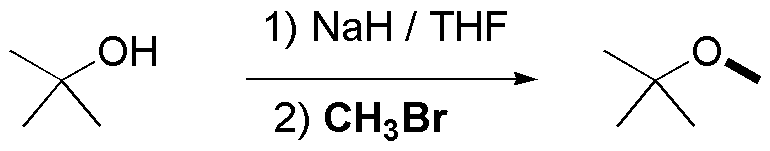
Solución 15:
La única posibilidad es el oxaciclopropano (óxido de etileno).
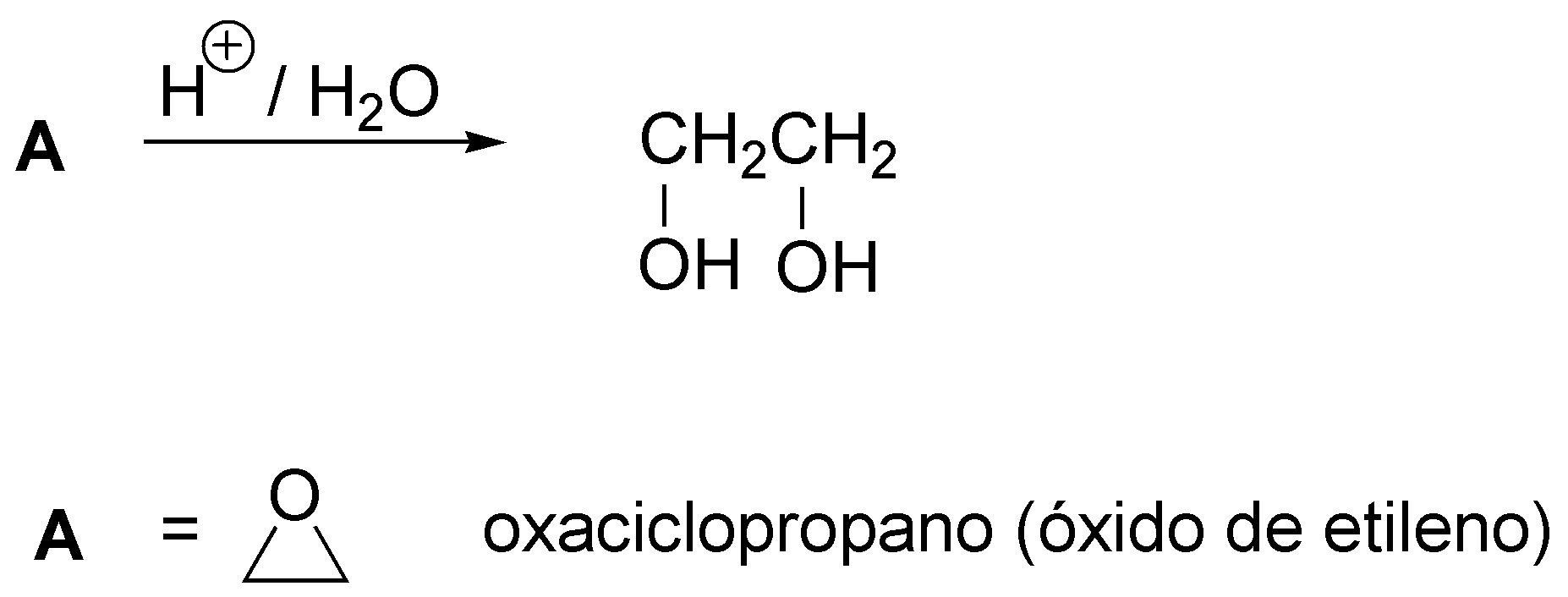
Solución 16:
Como se observa en el siguiente esquema, la única solución es el 2,3-dimetiloxaciclopropano. El problema sería mucho más complejo si se indicara la estereoquímica de los productos formados.
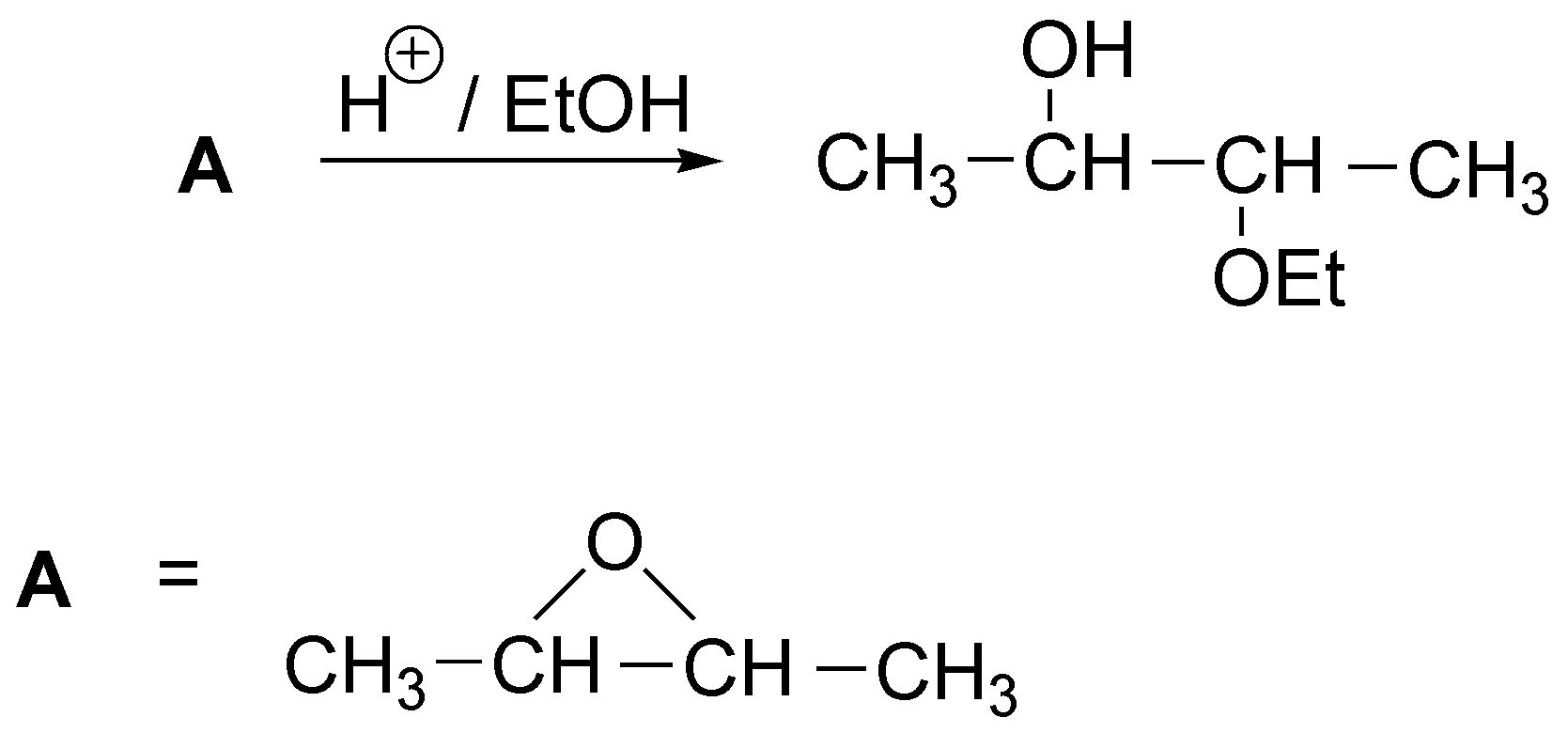
Solución 17:
a) Los epóxidos en medio ácido se abren de forma que el nucleófilo, que puede ser el propio disolvente como en este caso, ataca al carbono más sustituido, ya que es en esta posición donde se produce la mayor densidad de carga positiva. El nucleófilo queda en posición anti, con respecto al hidroxilo que se genera a partir del átomo de oxígeno del epóxido. Sobre el sustrato del ejercicio a), los dos carbonos que sustentan el anillo oxiránico están igualmente sustituidos, por lo que no hay preferencia en el ataque del nucleófilo (el agua).
b) En este segundo caso, el epóxido no se encuentra simétricamente sustituido, por lo que el ataque de la molécula de agua se produce sobre el carbono más sustituido, ya que la presencia de un grupo metilo estabiliza la carga positiva sobre este carbono.
c) El reactivo de Grignard tiene un carbono con carácter nucleófilo que atacará al carbono menos sustituido del epóxido, obteniéndose un producto, según el esquema:
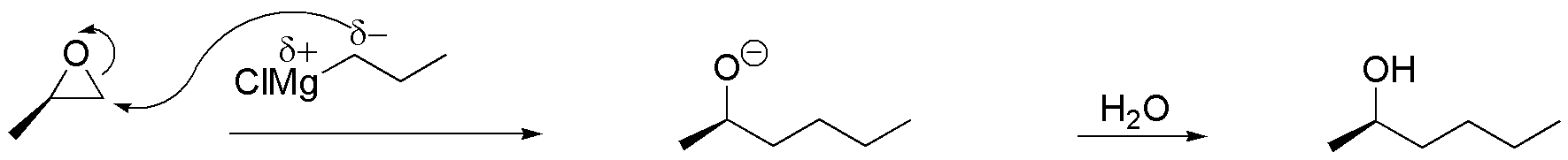
Solución 18:
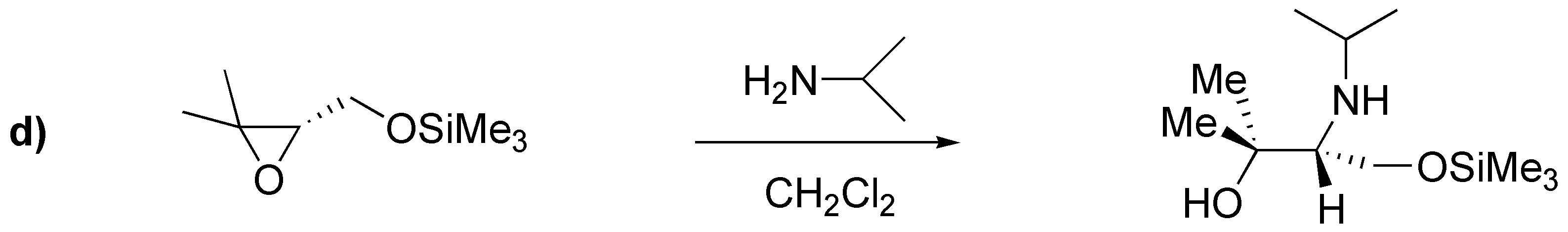
a) El compuesto proviene de la apertura de un epóxido con azida, que es un nucleófilo bastante bueno. Dado que la azida se sitúa en un carbono primario, y por la disposición del grupo hidroxilo, el epóxido de partida debe ser:
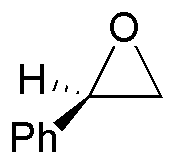
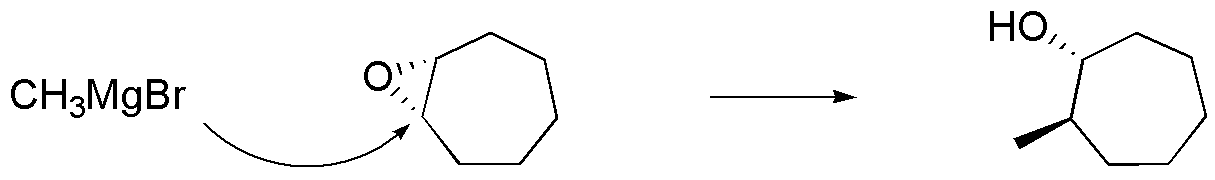
b) En este compuesto se genera un nuevo enlace C-C, por lo que el nucleófilo empleado debe ser un compuesto organometálico, como el bromuro de metilmagnesio. El ataque del nucleófilo se produce por la cara contraria de donde se encuentra el epóxido. Al producto indicado, lo acompaña su enantiómero, ya que el ataque del nucleófilo es igual de probable sobre los dos carbonos que forman parte del anillo de tres miembros.
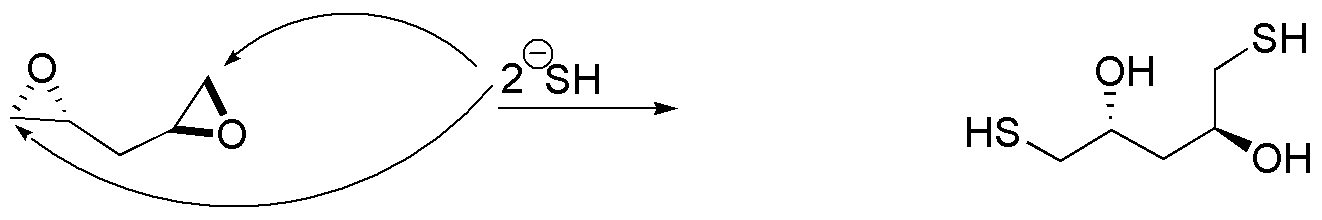
c) El producto descrito proviene de la apertura simultánea de dos epóxidos situados al extremo de una cadena carbonada, con el ión bisulfuro, como nucleófilo. Dicho nucleófilo se une al carbono menos sustituido, que en ambos casos es el carbono primario. La estereoquímica de los epóxidos de partida se puede deducir en base a la configuración de los hidroxilos del producto final.
d) Este compuesto se prepara a partir de un epóxido con metanol en medio ácido. El metanol actúa como nucleófilo atacando al carbono más sustituido, debido a que presenta la mayor densidad de carga positiva.

Solución 19:
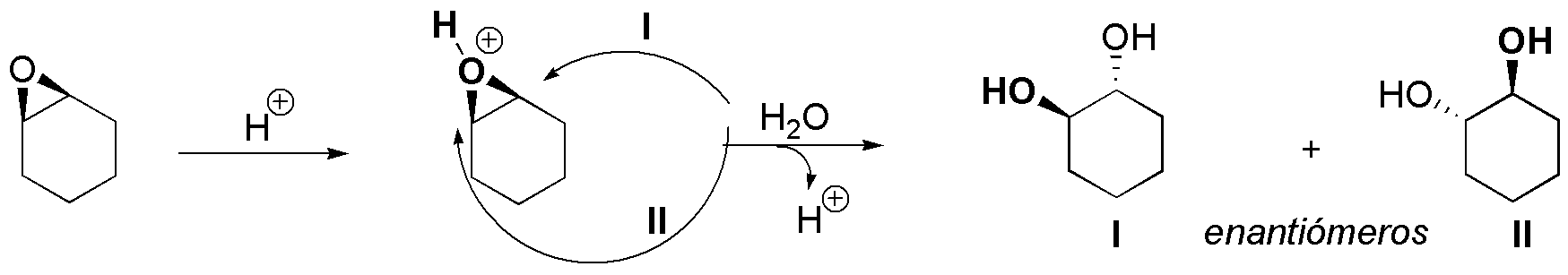
El esquema general del proceso descrito sería el siguiente: se produce la protonación del oxígeno produciendo un ión cíclico que puede evolucionar rompiéndose el un enlace C-O por la ruta I o por la ruta II, cuando es atacado por un nucleófilo como el agua. La ruta I está más favorecida que la II, ya que sobre el carbono más sustituido la carga parcial positiva que se va generando conforme se rompe el enlace C-O se encuentra más estabilizada.
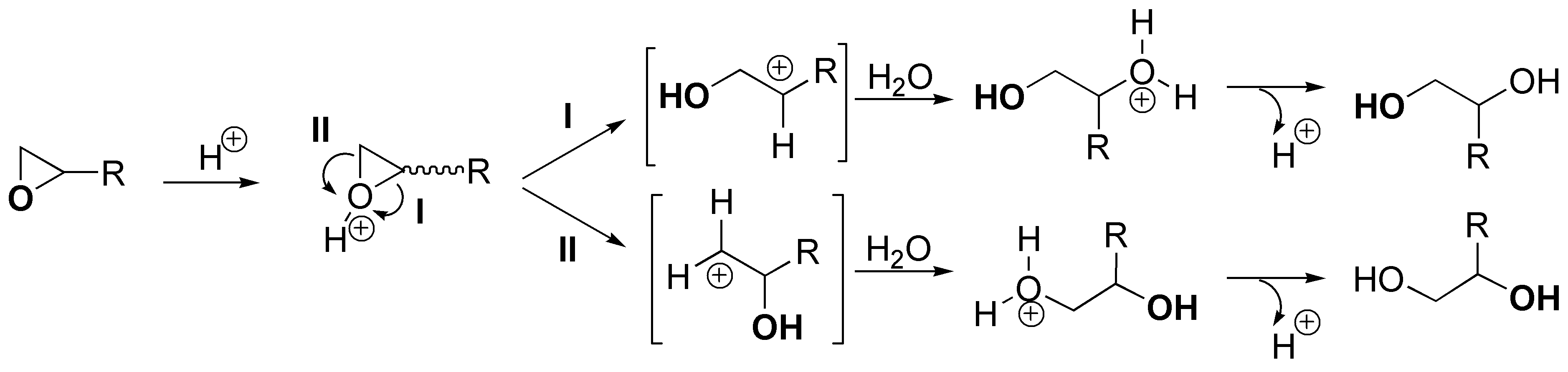
Por otro lado, cuanto mayor sea la capacidad de R de estabilizar la carga positiva, más favorecido estará el proceso, y por tanto mayor será la velocidad de la reacción. Con todas estas consideraciones la velocidad de la reacción para los distintos sustratos será:
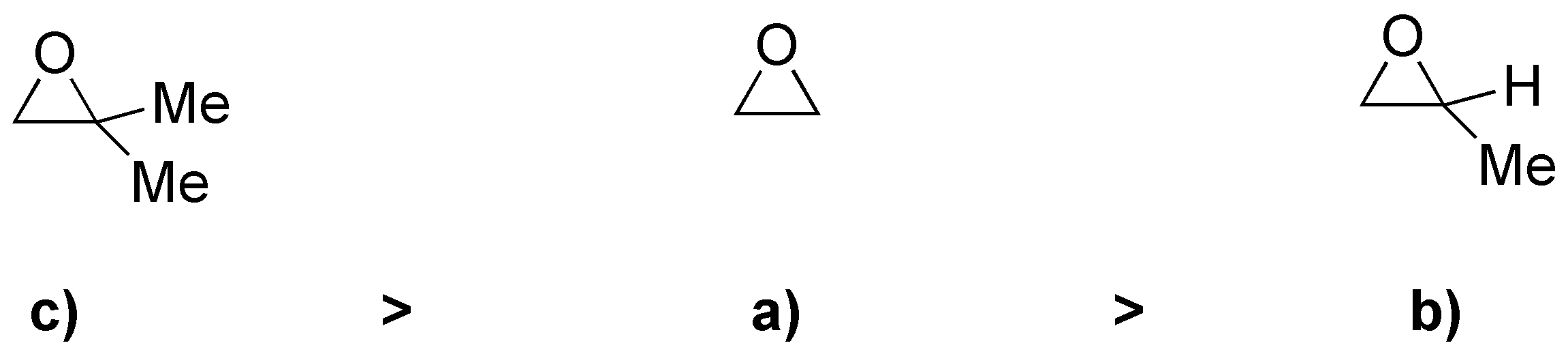
Solución 20:
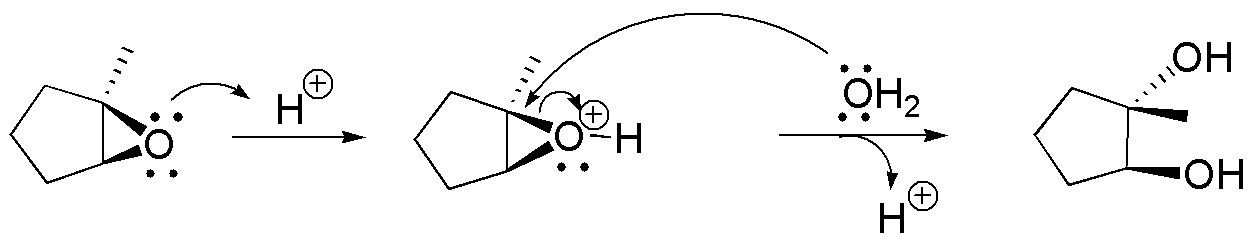
En este problema se aborda la apertura de epóxidos (oxaciclopropanos). La apertura nucleofílica se produce por ataque sobre el carbono menos impedido: casos a), c) y d); mientras que la apertura catalizada por ácidos hace que el nucleófilo ataque al carbono más sustituido: b).
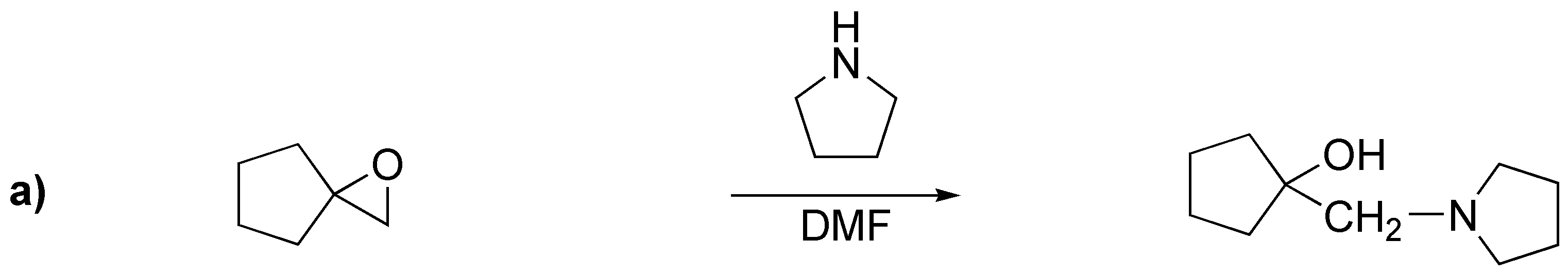
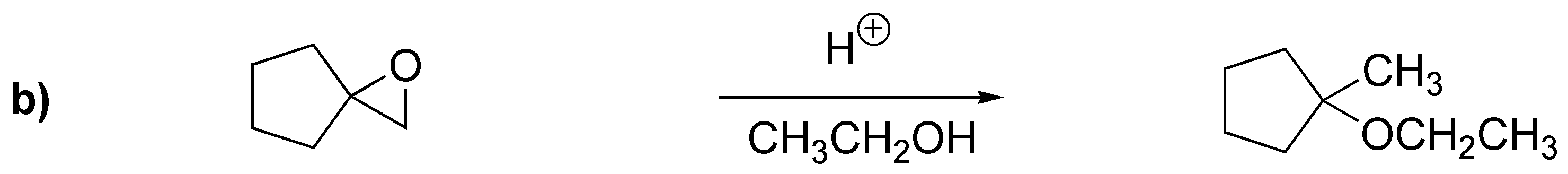
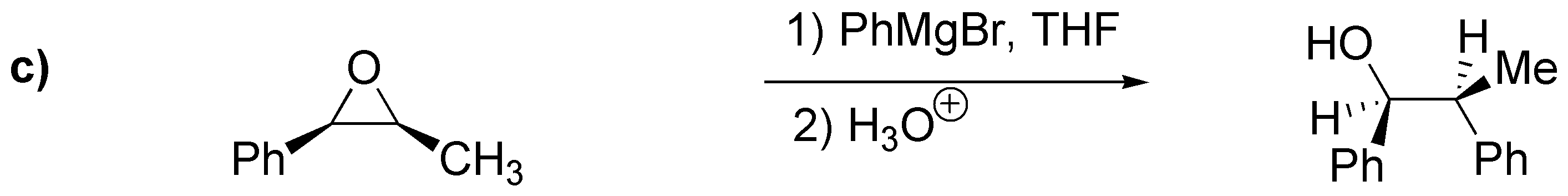
Solución 21:
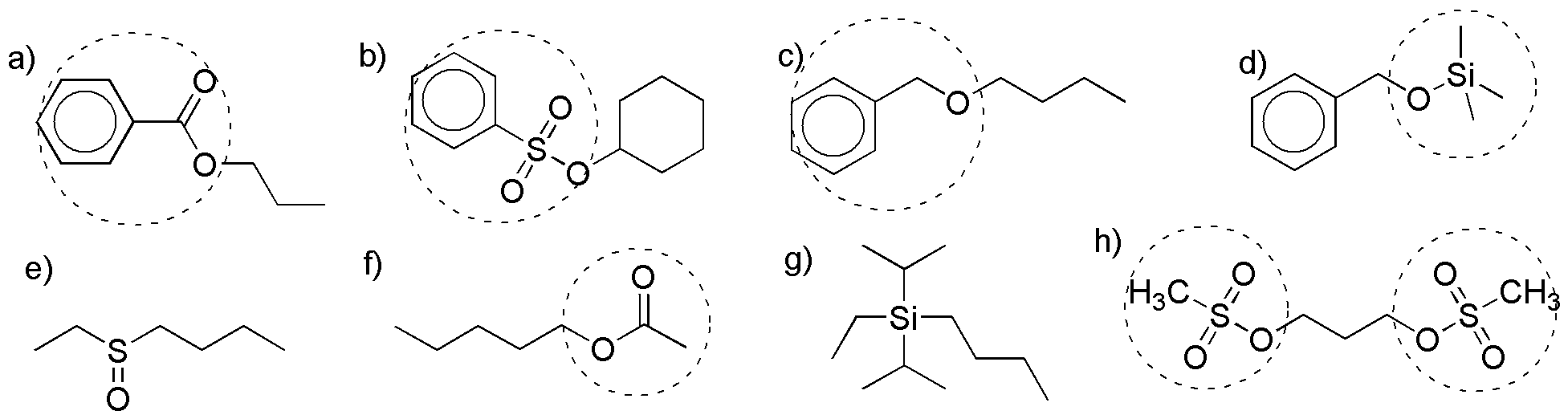
a) éster: benzoato; b) sulfonato: bencenosulfonato; c) éter: éter bencílico
d) éter de sililo: trimetilsililéter; e) sulfóxido (no es un derivado de alcohol); f) éster: acetato; h) sulfonato: mesilato
Solución 22:
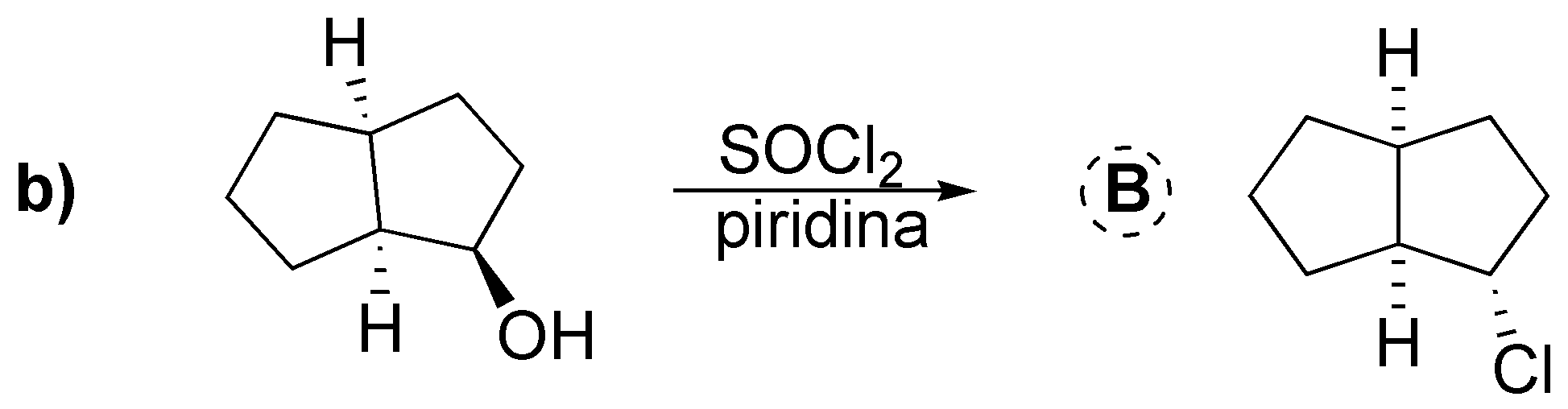
Abordamos en este problema la conversión de alcoholes en haloalcanos mediante diversos procedimientos: a) El tratamiento con HCl produce el correspondiente cloruro; b) Con cloruro de tionilo se produce el correspondiente cloruro con inversión de la configuración, al igual que en c) da el correspondiente dibromo derivado trans a partir del dialcohol trans (reacción estereoespecífica). En d) se produce la conversión en yoduro con inversión de la configuración previa transformación del hidroxilo en un tosilato que es mejor grupo saliente. En e) La protonación del grupo hidroxilo y posterior deshidratación generaría un carbocatión primario que sufre una transposición a un carbocatión terciario por migración de un grupo metilo; este carbocatión es atrapado por el ión bromuro.
![]()
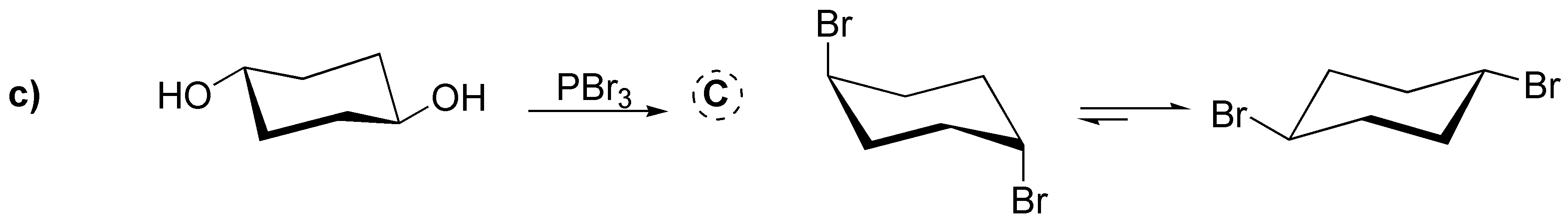
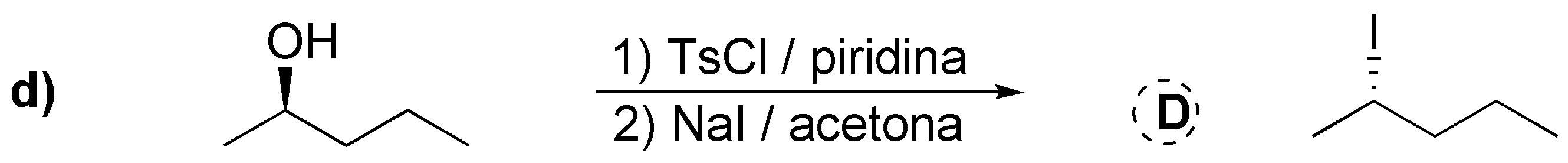
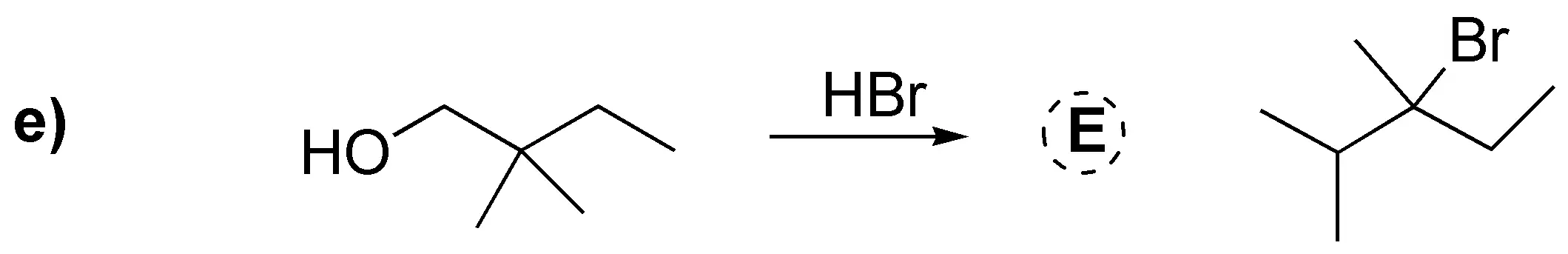
Solución 23:
La deshidratación de alcoholes cumple la regla de Zaitsev produciendo el alqueno más sustituido:
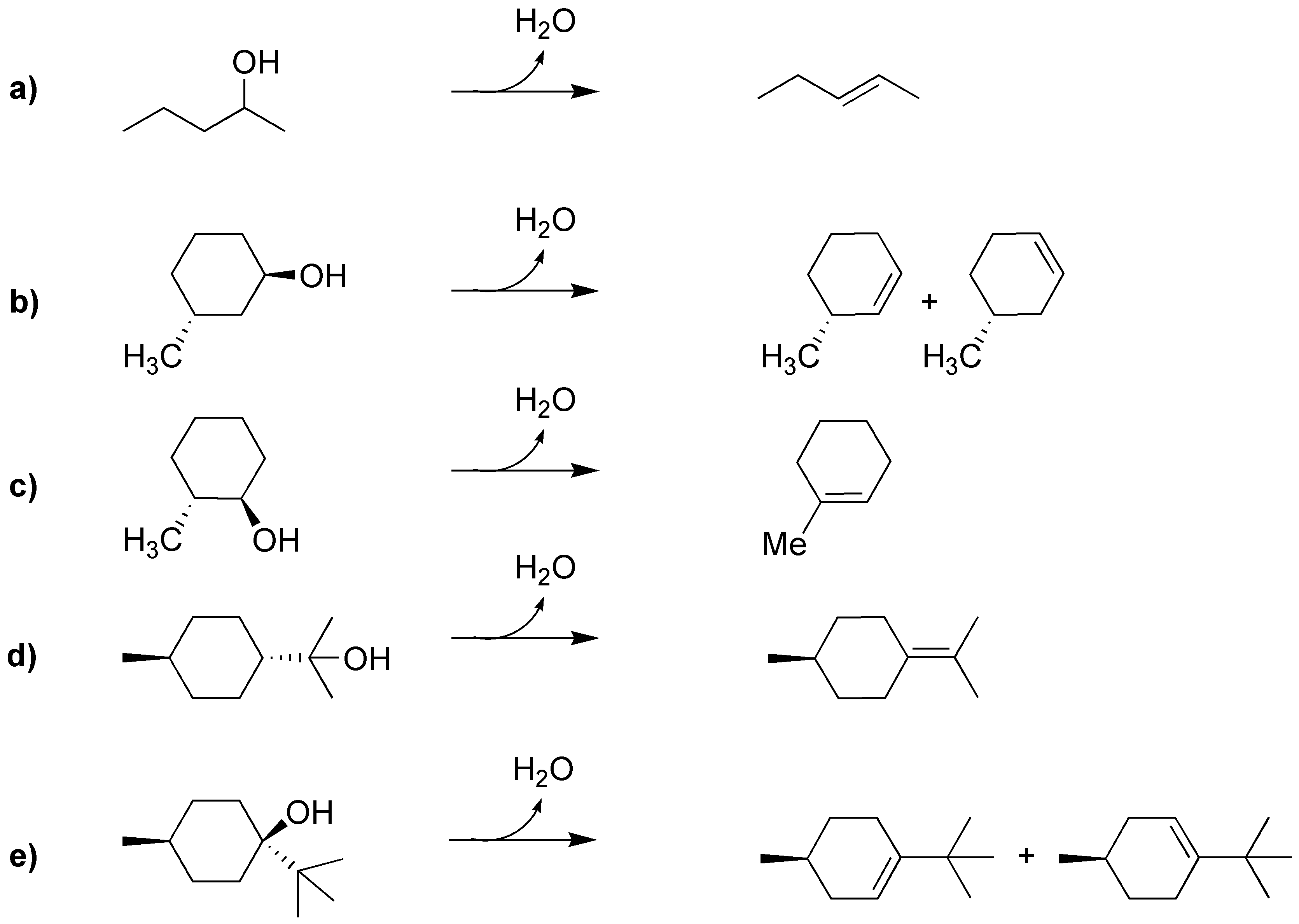
Solución 24:
La solución no suele ser única: varios alcoholes pueden dar el mismo alqueno, tal y como vemos en el esquema:
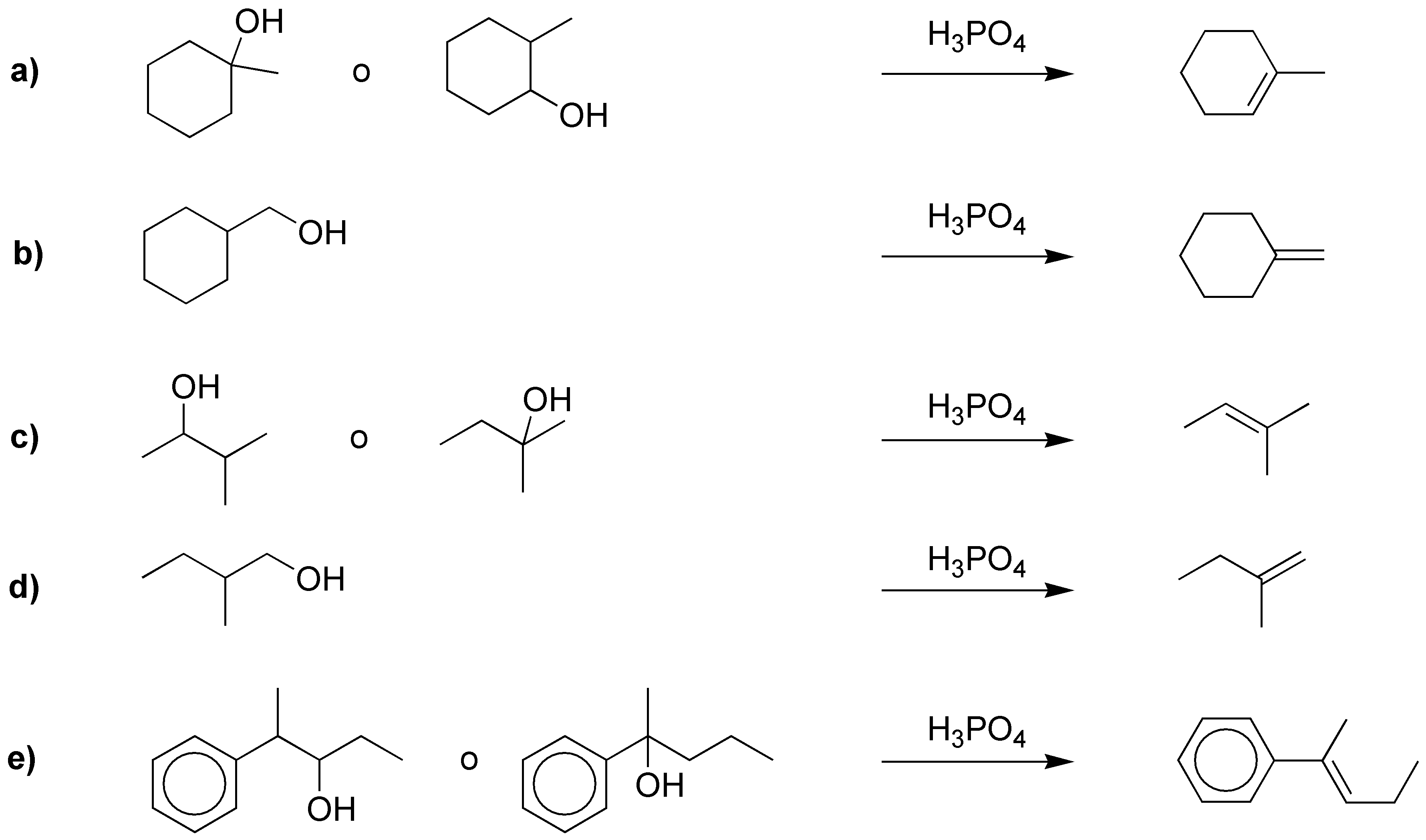
Solución 25:
Cuando un alcohol se trata con cloruro de tionilo se transforma en un cloroalcano; cuando se trata con PCC se oxida al correspondiente grupo carbonilo, en este caso a cetona y finalmente los alcoholes reaccionan con sodio formando el alcóxido o alcoholato que actúa como nucleófilo frente a haloalcanos dando éteres:
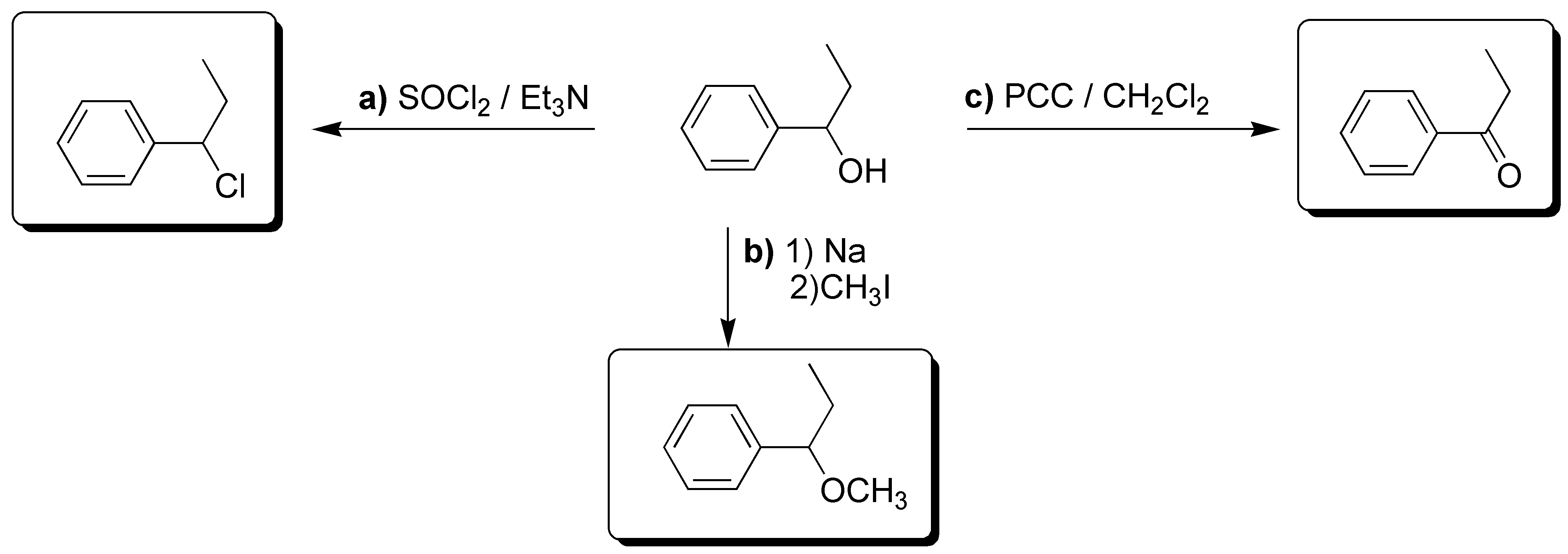
Solución 26:
La explicación más simple es la que se muestra en el esquema. La inestabilidad del anillo de ciclobutano hace que se produzca una transposición generando el catión ciclopentilo que es atrapado por el ión bromuro:
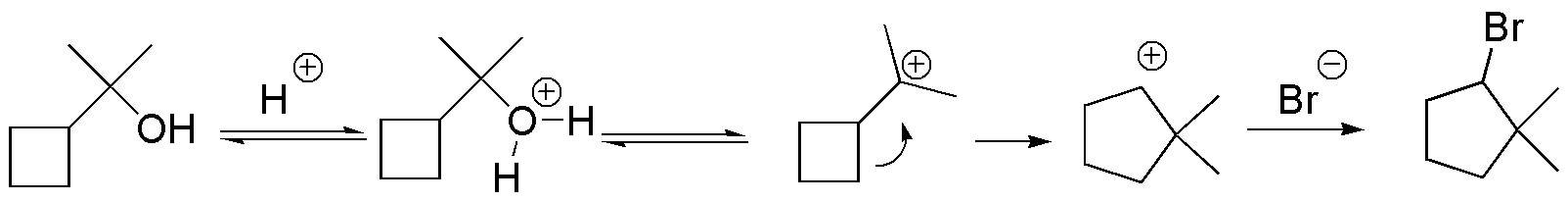
Solución 27:
Revisamos con este esquema las reacciones de oxidación de los alcoholes según su naturaleza. Los alcoholes primarios se oxidan a aldehídos con oxidantes suaves como el PCC o a ácidos con oxidantes fuertes, los secundarios a compuestos carbonílicos y los terciarios no se oxidan. Los compuestos alquilbencénicos se oxidan hasta ácidos benzoícos.
| Compuesto | PCC | Reactivo de Jones | Reactivo de Swern | KMnO4 |
|---|---|---|---|---|
 | A
| B
| C
| D
|
| E No hay reacción | F No hay reacción | G No hay reacción | H No hay reacción | |
| I
| J Mezclas, doble enlace sensible a ácidos | K
| L
|
Solución 28:
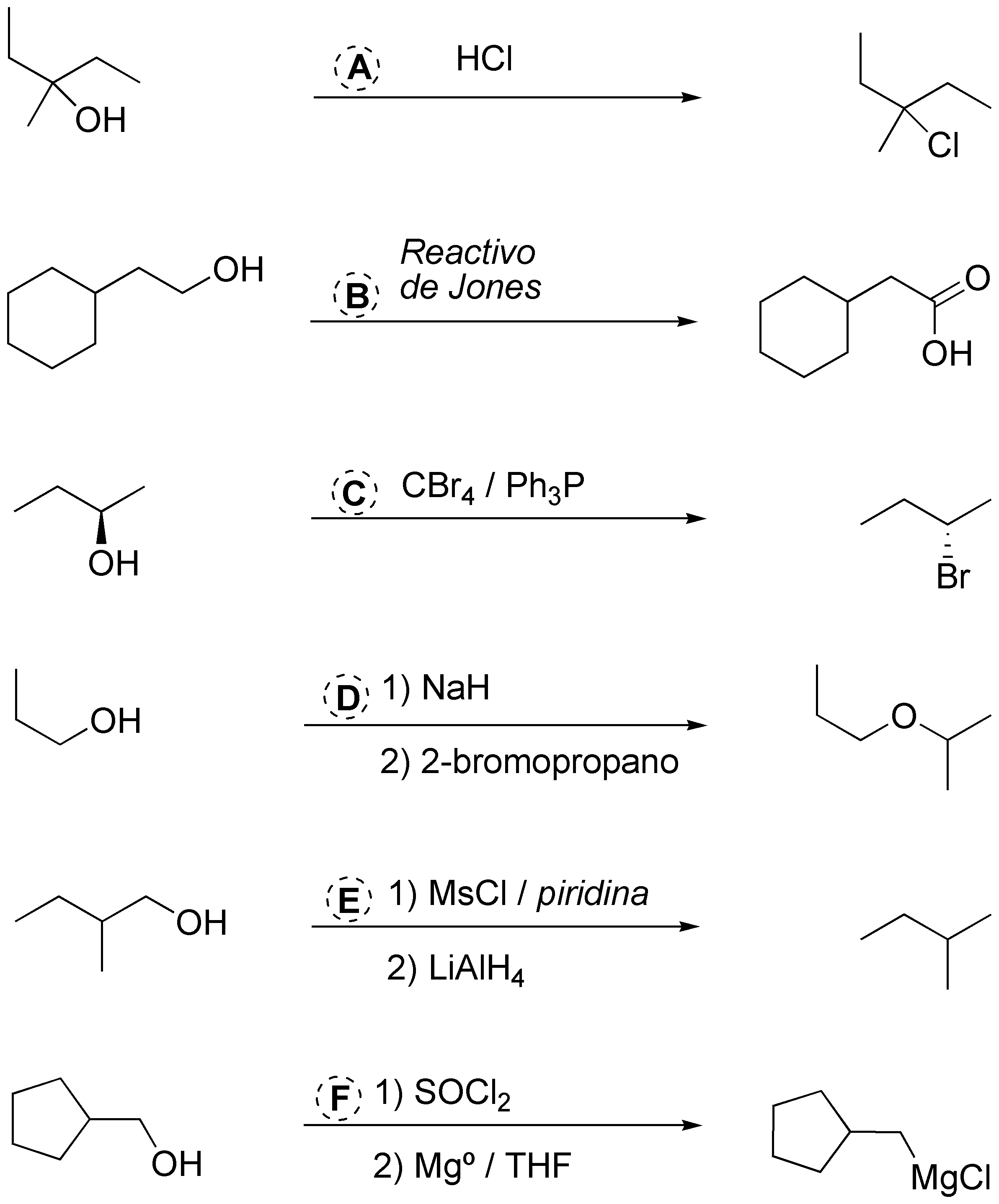
a) los alcoholes pueden convertirse en cloroalcanos por acción del HCl o el cloruro de tionilo (SOCl2). b) La oxidación a ácidos carboxílicos puede conseguirse mediante el reactivos de Jones (CrO3 / H2SO4). c) Uno de los métodos de conversión de alcoholes en bromoalcanos es la reacción de Appel (CCl4/PPh3). d) Para convertir un alcohol en un éter una buena solución es la síntesis de Williamson (tratamiento del alcoholato con haloalcano) debemos procurar usar un haloalcano primario pues de lo contrario se obtendría también producto de eliminación. e) La conversión de alcohol a alcano puede realizarse mediante sulfonación del alcohol y reducción de este con LiAlH4. f) La conversión en un compuesto de Grignard (cloruro de alquilmagnesio) se realizará previa conversión del alcohol en cloroalcano.
Solución 29:
La reacción de los éteres con HI (ácido muy fuerte) produce un ión alquiloxonio, dicho ión es atacado nucleofílicamente por el ión yoduro sobre el carbono menos impedido produciendo un alcohol y un yodoalcano:
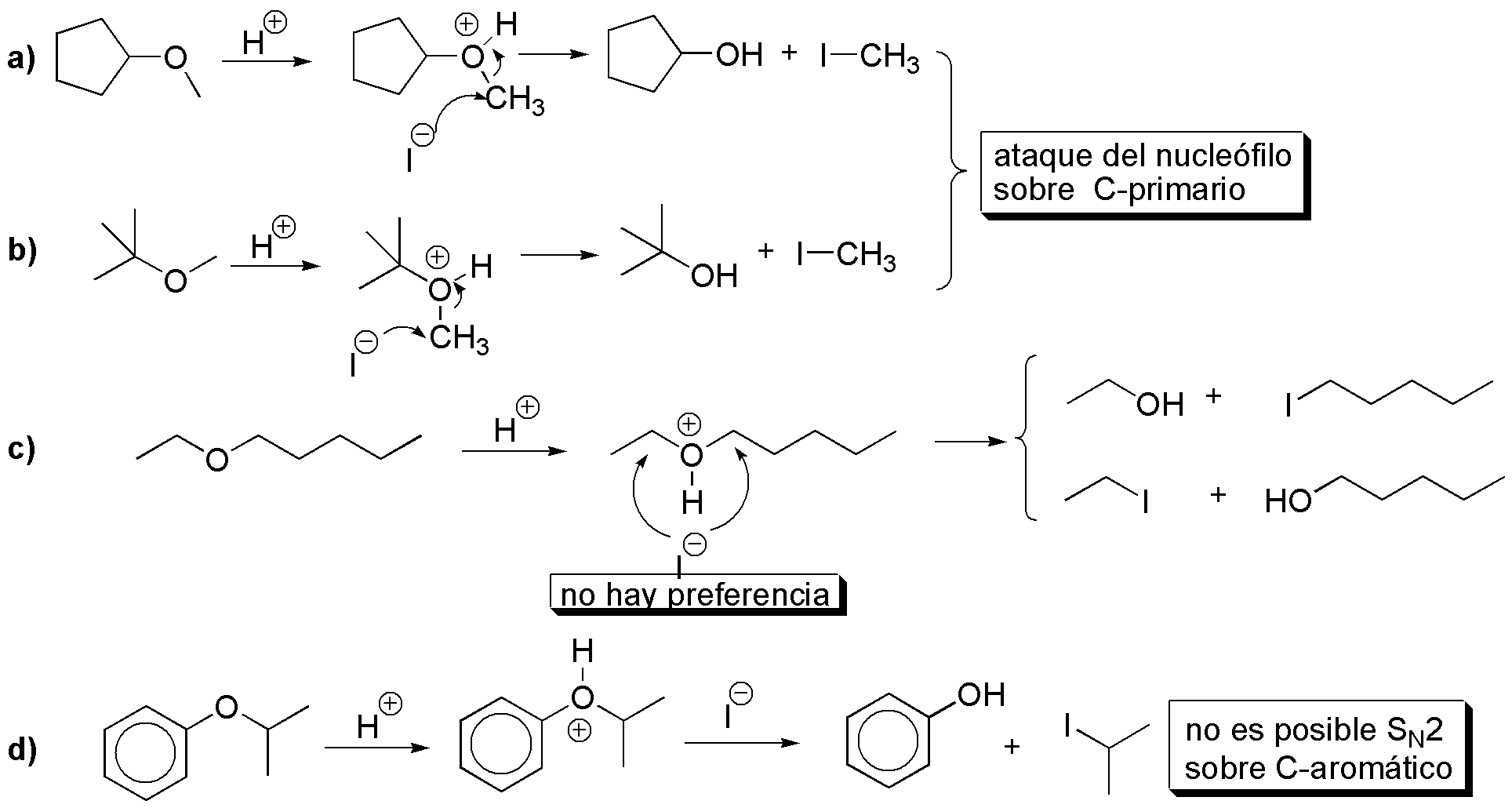
Nótese que en b) si se usa un exceso de HI, en todos los alcoholes obtenidos en la etapa descrita anteriormente, se produce la sustitución del grupo -OH por -I.
R-O-R’ + IH(exceso) → R-I + R’-I
Solución 30:
En este problema se aborda la apertura de epóxidos (oxaciclopropanos). La apertura nucleofílica se produce por ataque sobre el carbono menos impedido; mientras que la apertura catalizada por ácidos hace que el nucleófilo ataque al carbono más sustituido:
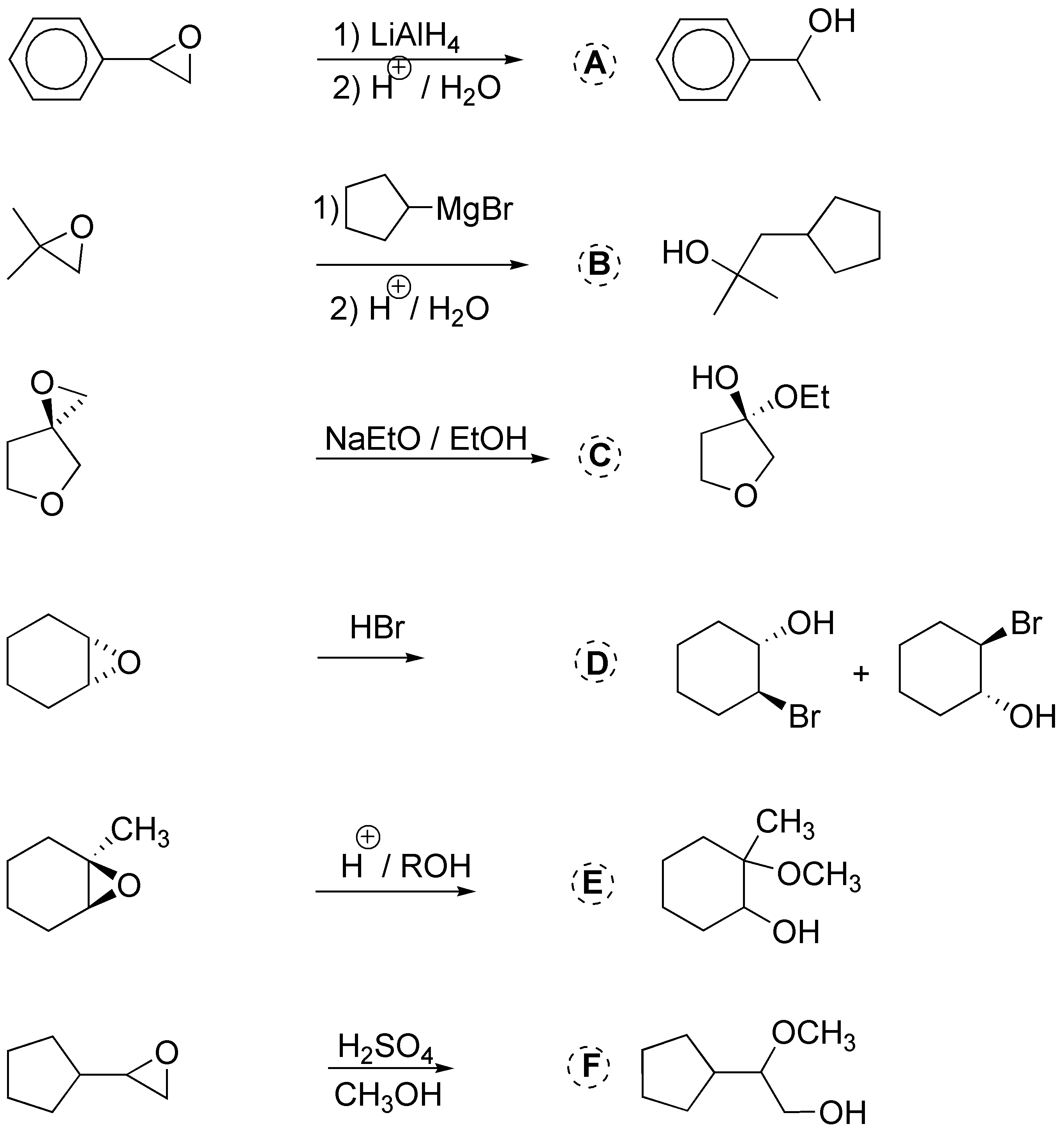
Solución 31:
Revisamos algunas reacciones de oxiranos (epóxidos, oxaciclopropanos); en A y B obtenemos alcoholes como consecuencia de la apertura con magnesianos, en C con acetiluro y en D con un tiolato, en este último caso la apertura es acompañada de una sustitución nucleofílica del cloro.
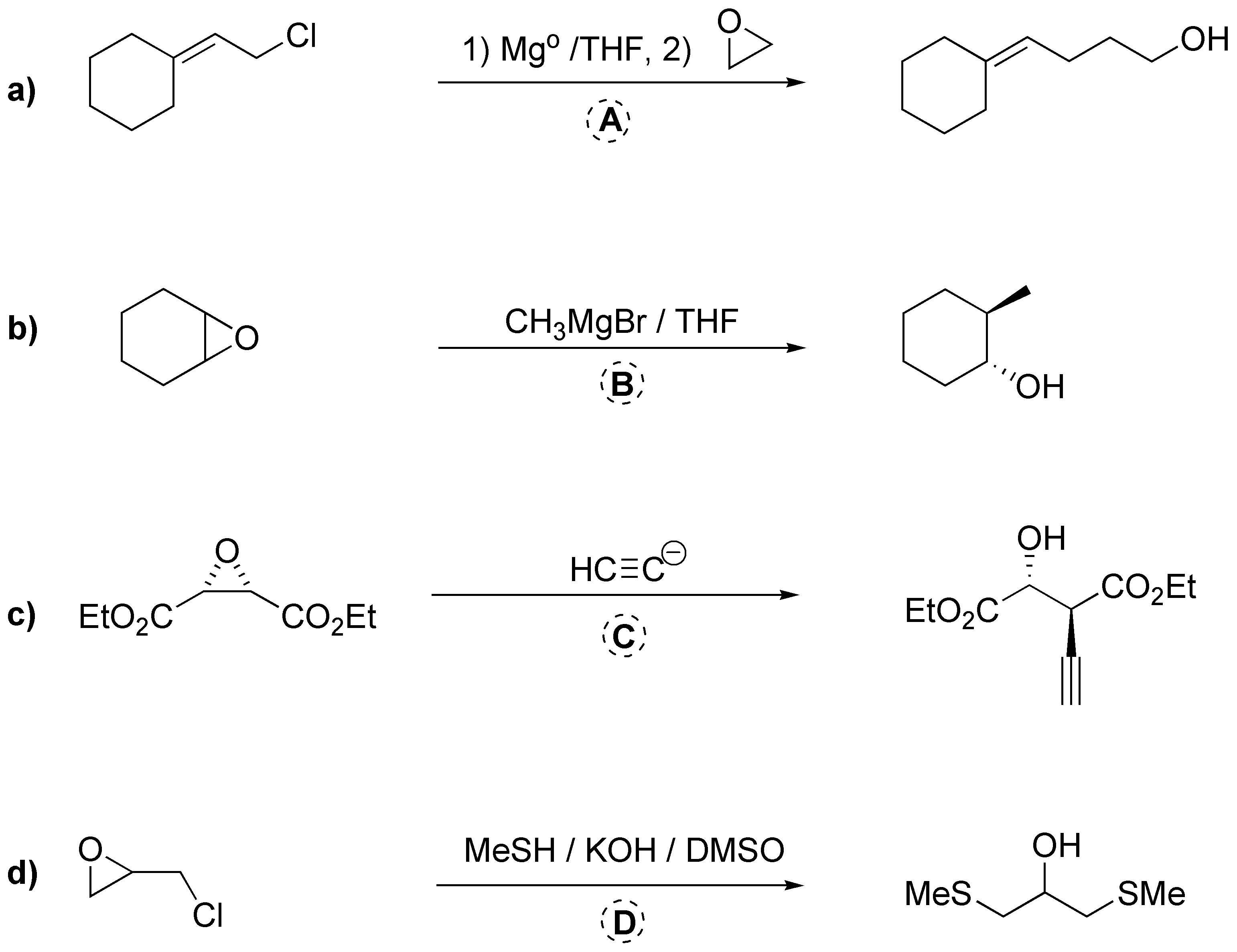
Solución 32:
En el caso a) el yodo se adiciona al doble enlace generando un ión yodonio cíclico que es atacado por el grupo hidroxilo (nucleófilo) en una reacción intramolecular que da el yodoalcohol esperado. En b) la amina actúa como nucleófilo abriendo el epóxido y posteriormente el aminoalcohol obtenido produce una nueva reacción de sustitución, generando la aziridina final.
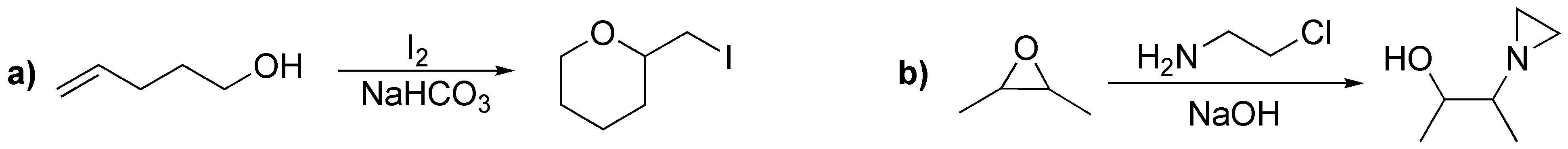
Solución 33:
La reacción de la primera columna es una reducción de los epóxidos a alcoholes (adición nucleófila del ión hidruro). La segunda es la adición nucleofílica de un organometálico (organocuprato). La tercera y cuarta son dos aperturas de epóxidos catalizadas por ácido en las que los nucleófilos son el agua y el etanol.
| Sustrato | 1) LiAlH4 ; 2) H3O+ | (Et)2CuLi | H2O / H3PO4 | CH3CH2OH / H3PO4 |
|---|---|---|---|---|
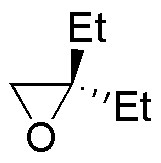 | A
| B
| C
| D
|
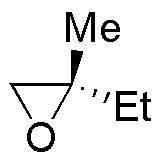 | E
| F
| G
| H
|
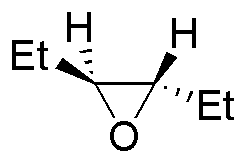 | I
| J
| K
| L
|
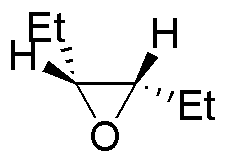 | M
| N
| Ñ
| O
|
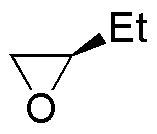 | P
| Q
| R
| S
|
Solución 34:
Revisemos algunas de las reacciones de alcoholes:
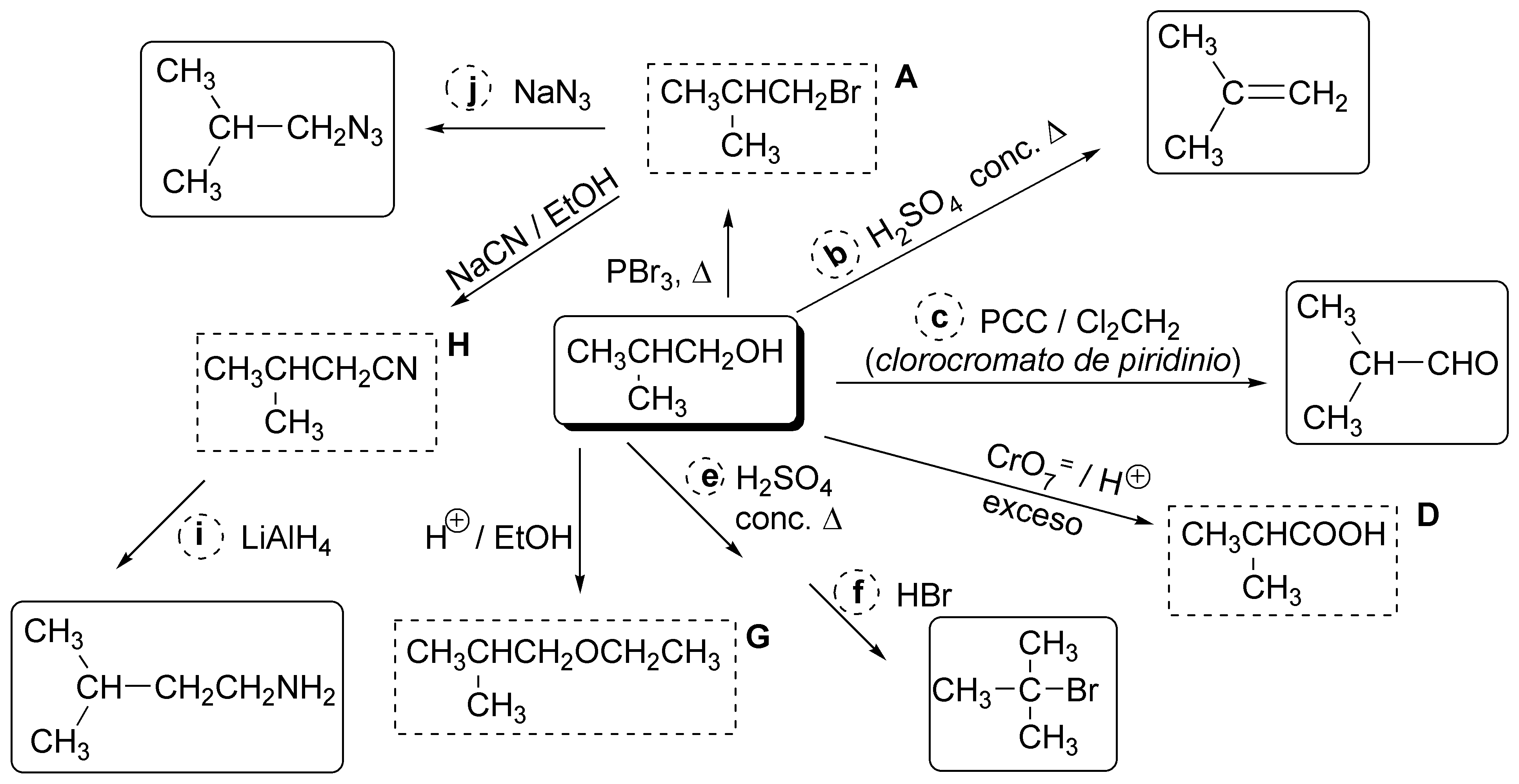
Solución 35:
El problema ilustra las dos posibilidades de apertura de los epóxidos: en medio ácido o mediante un nucleófilo:

Solución 36:
El esquema muestra reacciones generales de los alcoholes. a) formación de alcoholatos o alcóxido; b), c) y d) conversión en haloalcano, e) eliminación y f) formación de éteres.
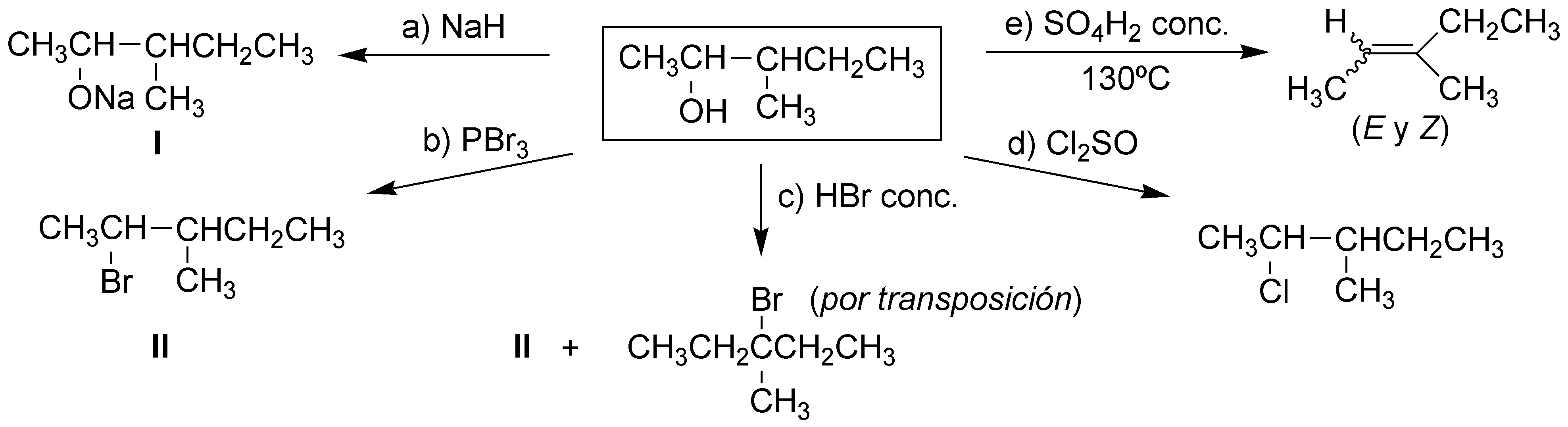
Solución 37:
El esquema ilustra las posibles aperturas de los epóxidos (oxaciclopropanos) tanto en medio ácido como en básico: