Índice
Medir volúmenes con exactitud es básico para preparar disoluciones, ajustar eluyentes en cromatografía y dosificar disolventes de reacción. La elección del material volumétrico (pipetas, micropipetas, matraces aforados, buretas, probetas, jeringas) depende del volumen, la precisión requerida y la naturaleza del líquido (volatilidad, viscosidad, toxicidad).
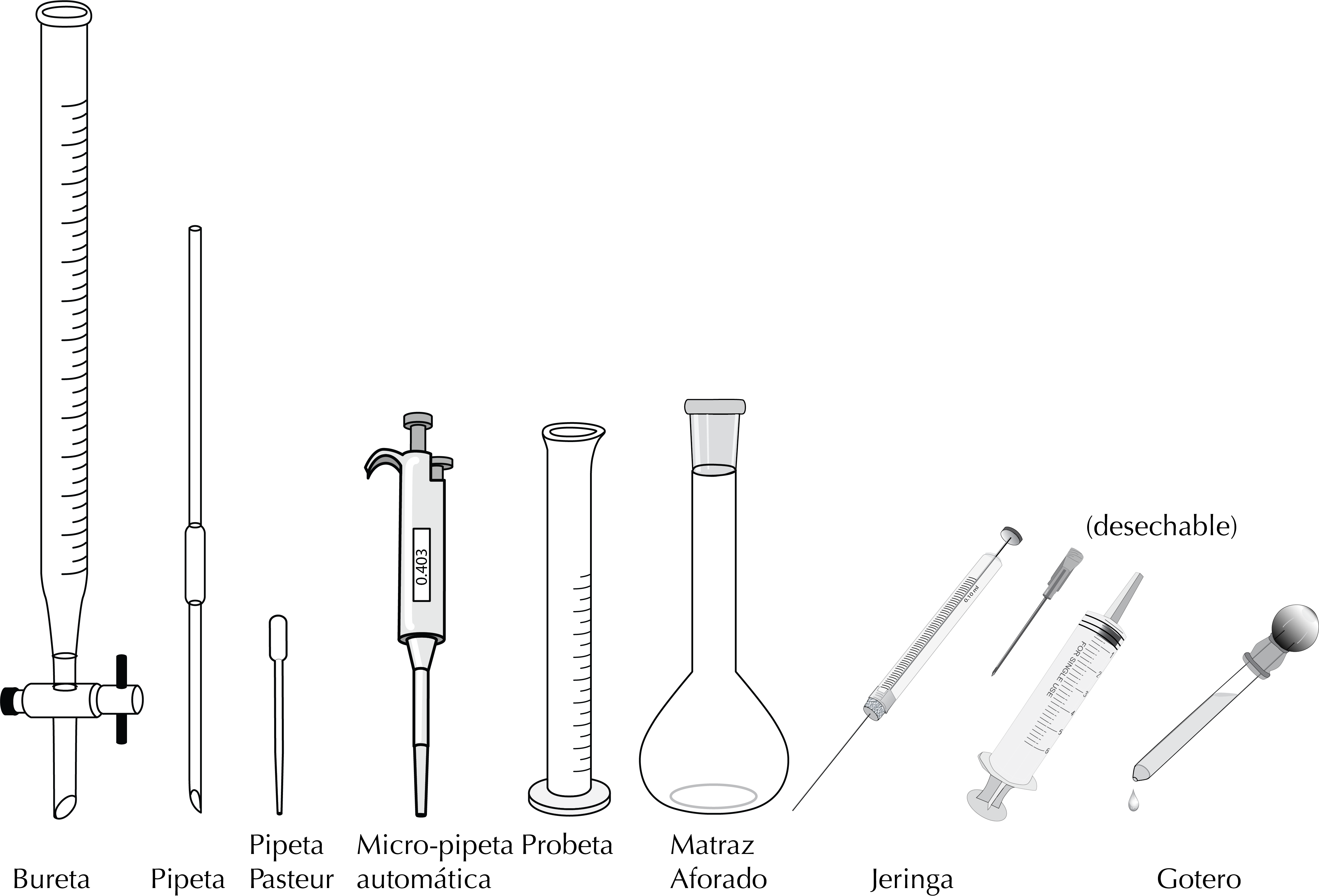
¿Cómo se miden volúmenes de líquidos en el laboratorio?
Antes de medir: revisa que el material esté limpio y desengrasado (una película hidrófoba de grasa de dedos deforma el menisco). Aclara con una pequeña porción del líquido a usar (“acondicionamiento”) cuando busques máxima exactitud.
Pipetas
Las pipetas de vidrio permiten medir con alta exactitud y transferir volúmenes definidos. Nunca pipetear con la boca: usa un pipeteador.
Pipetas graduadas (enrase sencillo)
Tienen escala; permiten medir varios volúmenes. Exactitud buena, versátiles en trabajos generales.
Pipetas aforadas (doble enrase)
De volumen fijo, mayor exactitud que las graduadas. Se enrasa primero a la marca superior y se deja caer hasta la marca inferior. Son preferibles para patrones y valoraciones.
- Acopla el pipeteador (pera/rueda) y aspira por encima de la marca.
- Retira el pipeteador, tapa con el índice y baja el menisco hasta el aforo, a nivel de ojos.
- Traslada al recipiente destino. En graduadas no fuerces la última gota; en aforadas sigue la indicación del fabricante (TD/Ex).
- Evita burbujas, mantén la pipeta vertical y no apoyes la punta en el fondo.
Lectura del menisco: alinea la base del menisco con la marca. Corrige parallax colocando los ojos a la altura de la línea.
Pipeteadores
- Pera de succión (A-S-V): A para cargar, S para aspirar, V para dispensar.
- Aspirador con rueda: émbolo con cremallera; revisa y sustituye juntas de goma si pierden vacío.
Micropipeta automática
Para 1–1000 μL. Rangos: P1000 (200–1000 μL), P200 (20–200 μL), P20 (0,5–20 μL). Usa puntas desechables, mantén la pipeta vertical y sumerge solo 2–5 mm para evitar sobreaspiración.
Uso correcto
- Coloca la punta y ajusta el volumen.
- Presiona al primer tope, sumerge y suéltalo para aspirar.
- Dispensa apoyando en la pared del recipiente: primero hasta el primer tope y 1 s después al segundo tope para expulsar remanentes.
- Expulsa la punta con el eyector. Evita salpicaduras.
Exactitud: mejora con puntas adecuadas, ritmo constante del pulgar y temperatura cercana a 20 °C. Para líquidos viscosos o volátiles, considera puntas con filtro o correcciones.
Matraz aforado
Vidrio calibrado para contener un volumen exacto (marca única de aforo). Imprescindible para preparar disoluciones con concentración conocida.
Preparación de una disolución (paso a paso)
- Pesa o mide el soluto y disuélvelo parcialmente en un vaso.
- Transfiere al matraz aforado con embudo; añade disolvente hasta ~80–90%.
- Enrasa con pipeta Pasteur hasta que la base del menisco coincida con la marca.
- Tapa y homogeneiza invirtiendo y agitando (no remolinos violentos).
Dispensador automático
Se acopla a las botellas de reactivo; dispensa volúmenes repetitivos (≥ 0,1 mL). Purgar hasta eliminar aire (si no, subdosifica). Ideal para ácidos fuertes (H2SO4, HNO3). Evitar disolventes que dañen juntas.
Probeta
Cilindro graduado (5–2000 mL). Precisión moderada; adecuada para volúmenes grandes o preliminares antes de aforar. Lee el menisco a la altura de los ojos; seca el exterior antes de registrar el valor.
Jeringa
Émbolo en tubo graduado; útil para pequeños volúmenes y zonas inaccesibles, incluidos gases o líquidos viscosos. Las de vidrio (borosilicato) ofrecen mayor exactitud; lava inmediatamente: disolvente adecuado → agua desionizada → acetona.
Bureta
Tubo graduado con llave (robinete). Fundamental en valoraciones. Tolerancias típicas (± mL): 10→0,02; 25→0,03; 50→0,05.
Uso correcto
- Acondiciona con el reactivo (enjuagues), llena por encima de 0 y purga la burbuja tras la llave.
- Ajusta a cero, elimina gotas en la punta y registra la lectura inicial.
- Dispensa sin prisa, agitando el Erlenmeyer; cerca del punto final, ve gota a gota.
- Al final, recoge la gota colgante tocando la punta con la pared del recipiente. Anota la lectura final y calcula por diferencia.
Seguridad y buenas prácticas
- EPI: bata, guantes, gafas. Trabaja en campana con volátiles o corrosivos.
- Revisa GHS/SDS y compatibilidades antes de medir.
- Material limpio y seco; evita tocar marcas con los dedos.
- Residuos: gestiona según normativa (no verter por desagüe sin autorización).
Lee también: Seguridad en el laboratorio · Sistema GHS
FAQs
¿Qué uso para 25,00 mL exactos?
Matraz aforado (para preparar) o pipeta aforada (para transferir). Para titulaciones, bureta.
¿Cuándo usar probeta?
Volúmenes grandes o precisión moderada. Para exactitud, finaliza en matraz aforado o pipeta.
¿Cómo evito error de menisco?
Ojos a nivel de la marca; alinea la base del menisco con el aforo; limpia el vidrio.
¿Y con líquidos volátiles/viscosos?
Trabaja rápido y tapado (volátiles); usa tiempos de escurrido y puntas adecuadas (viscosos). Considera correcciones o técnicas alternativas.
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier. ISBN: 978-0-12-803893-2.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
