Índice
Written by J.A. Dobado | Last Updated on 5 meses
Practica de la Sísntesis de la Aspirina
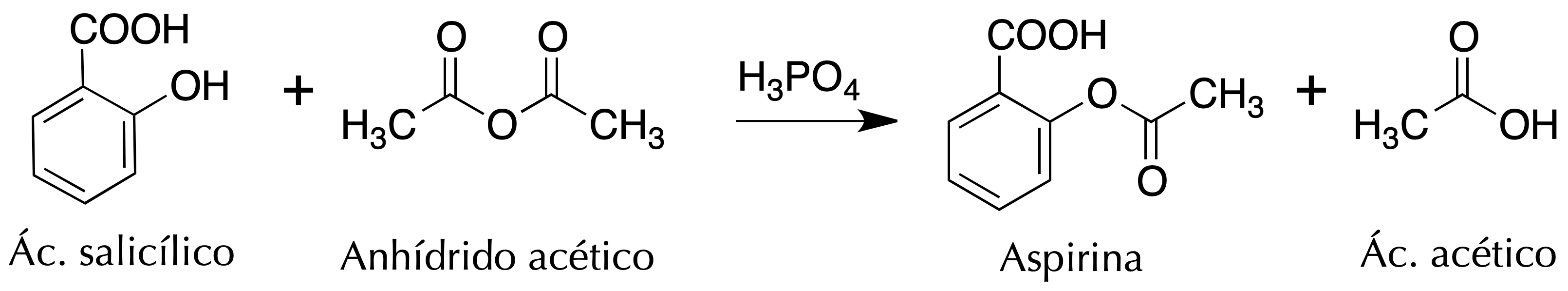
El propósito de esta práctica es familiarizarse con la reacción de esterificación obteniendo aspirina (ácido acetil salicílico) a partir del ácido salicílico y anhídrido acético.
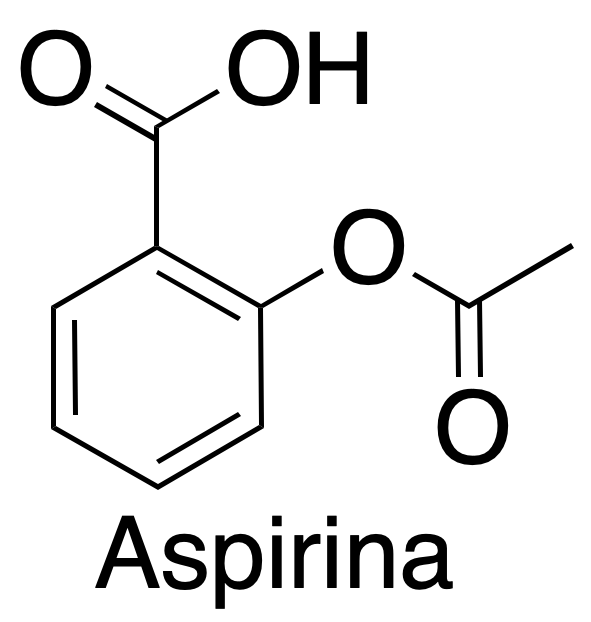 |
| Estructura 3D |
Ácido Acetilsalicílico
El ácido acetilsalicílico se comercializa con el nombre de aspirina por la casa Bayer, siendo uno de los medicamentos más consumidos en el mundo. Fue sintetizado en 1897 por el químico alemán Félix Hofmann.
Se emplea una reacción de esterificación catalizada en medio ácido (H2SO4 o H3PO4 ), donde el ácido salicílico tratado con anhídrido acético da ácido acetilsalicílico (aspirina). En dicha reacción, se transforma un grupo hidroxilo hasta un ester, obteniéndose como subproducto ácido acético.
Es un medicamento que se encuentra en la lista de medicamentos esenciales de la OMS. Actúa como antipirético y fundamentalmente como analgésico. Como antipirético ejerce su efecto a dos niveles: aumenta la disipación térmica mediante vaso-dilatación (acción poco significativa) y actúa sobre el termostato hipotalámico, que es el centro regulador de la temperatura del organismo.
Su vía de administración es oral, ya que se absorbe bien por el tracto gastrointestinal. El ácido acetilsalicílico puede estar parcialmente hidrolizado; esto, además de notarse fácilmente por el olor a ácido acético, se puede reconocer haciendo un ensayo con FeCl3 y observando si se produce coloración violeta.
Mecanismo de reacción
La reacción está catalizada por ácido (ácido fosfórico, H3PO4). En un primer paso se produce la protonación del anhídrido acético como se indica en la figura.
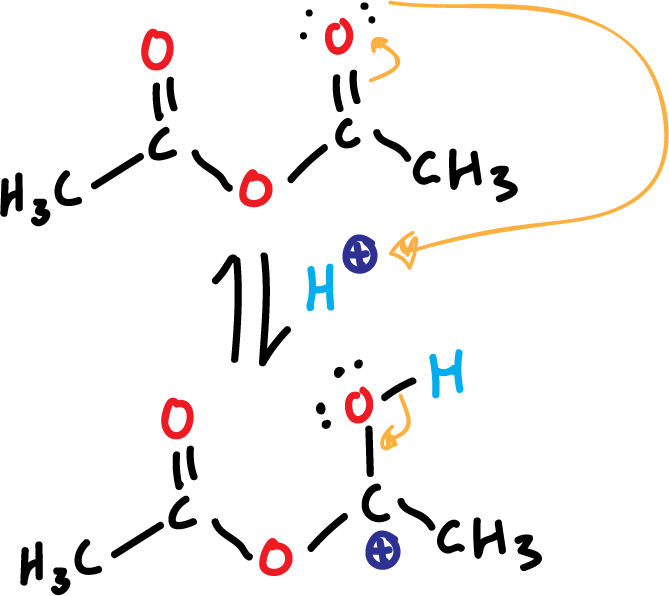
Esto va a favorecer la reactividad del anhídrido acético, que queda cargado positivamente en uno de los carbonos. Es una reacción de esterificación de fenol que implica la rotura de un enlace O–H, y se lleva a cabo con anhídrido acético.
En una segunda etapa, se produce una adición: el par de electrones del fenol ataca al carbono cargado positivamente del anhídrido acético.
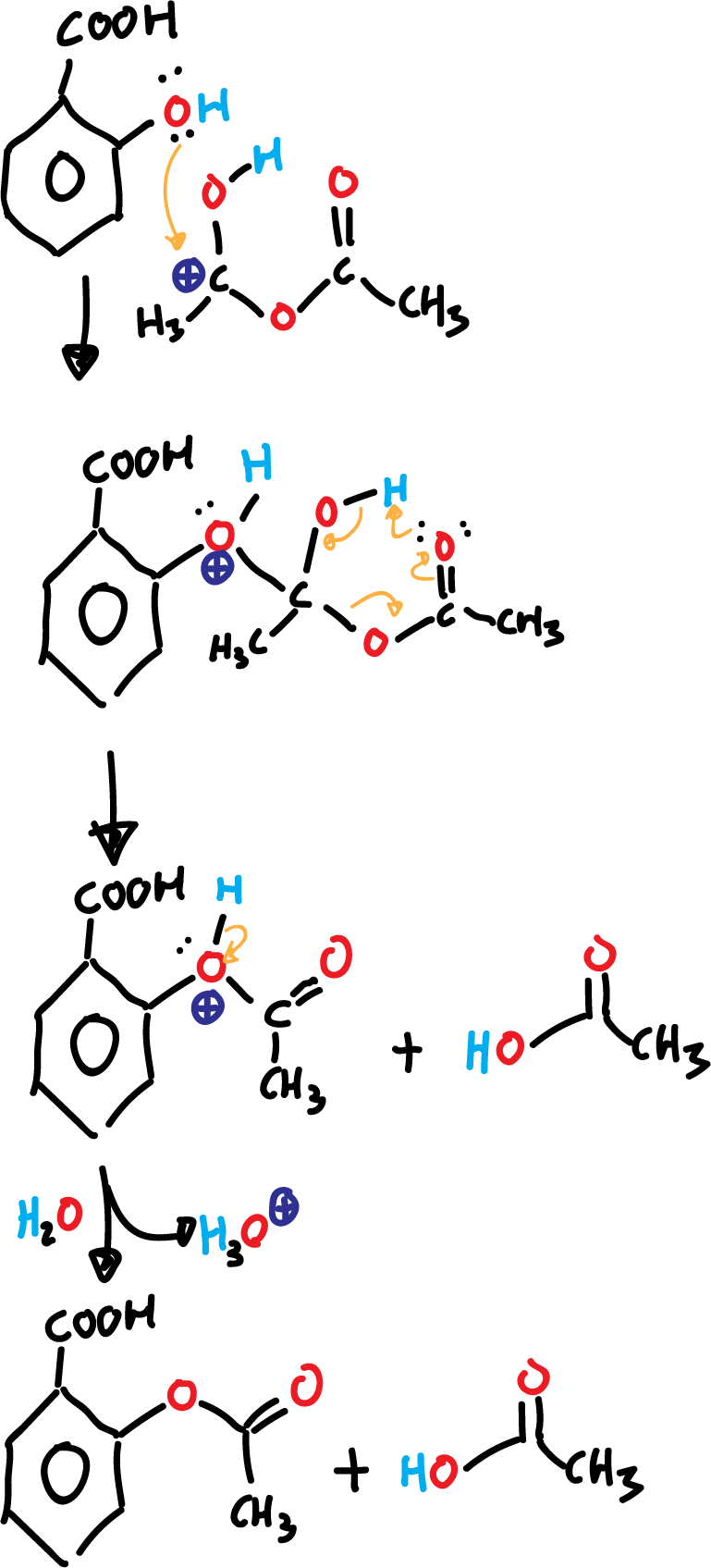
En una tercera etapa ocurre una eliminación: produciendo ácido acético y ácido acetil salicílico protonado. La cuarta y última etapa es una desprotonación por efecto del agua que se añade al final de la reacción.
Procedimiento experimental
Se colocan 3 g (0.022 mol) de ácido salicílico en un matraz de 100 ml. A continuación, se agregan 6 ml de anhídrido acético y luego de 6 a 8 gotas de ácido fosfórico (H3PO4) del 85 %. Posteriormente, se agita suavemente para mezclar las capas y se sumerge el matraz acoplado en un equipo de reflujo en un baño de agua caliente (70-80 ºC), durante 15 min.
| ¡PELIGRO! «El anhídrido acético reacciona violentamente con el agua y la mezcla puede salpicar.» |
Se aparta el matraz del baño y, mientras aún está caliente, se añade gota a gota alrededor de 1 ml de agua, agitando después de cada adición. Una vez se ha adicionado el primer ml de agua, pueden ya añadirse rápidamente otros 20 ml de la misma.
El matraz se enfría en un baño de hielo, con lo que el producto debe comenzar a cristalizar. Se filtra a vacío y se calcula el rendimiento del producto seco (rendimiento estimado 70 % y punto de fusión 134-136 ºC). Se puede recristalizar con EtOH (10 ml aprox.).
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido acético | 60.05 | 16.2 | 118 | 1.049 |
| Ácido acetilsalicílico | 180.16 | 134-136 | - | - |
| H3PO4 | 98.00 | 40 | 158 | 1.685 |
| Anhídrido acético | 102.09 | -73.1 | 139.8 | 1.080 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido acético |   |
| Ácido acetilsalicílico |  |
| H3PO4 |  |
| Anhídrido acético |    |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido acético | QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| Ácido acetilsalicílico | BSYNRYMUTXBXSQ-UHFFFAOYSA-N |
| H3PO4 | NBIIXXVUZAFLBC-UHFFFAOYSA-N |
| Anhídrido acético | WFDIJRYMOXRFFG-UHFFFAOYSA-N |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
- D. B. Brown and L. B. Friedman, The Aspirin Project. Laboratory Experiments for Introductory Chemistry, Journal of Chemical Education 50 (1973), no. 3, 214, DOI 10.1021/ed050p214
