Objetivo
El propósito de esta práctica es la obtención de un éter asimétrico de interés industrial, partir de naftalen-2-ol (β-naftol) utilizando dos métodos sintéticos.
Antecedentes
Los éteres se pueden obtener a partir de alcoholes mediante reacciones de sustitución nucleófila (SN2).
El 2-metoxinaftaleno (éter β-naftilmetílico) es un sólido blanco de punto de fusión 73 ºC que recibe el nombre comercial de nerolina. Se usa en perfumería por su olor floral, como estabilizante de pólvoras especiales y como intermedio para la síntesis de antiinflamatorios no esteroideos. Se puede obtener mediante dos métodos sintéticos: usando la reacción de Williamson o por tratamiento de MeOH y β-naftol (naftalen-2-ol) con H2SO4 en caliente.
Como es sabido, la síntesis de Williamson es un proceso que permite la preparación de una amplia gama de éteres, tanto simétricos como asimétricos, siempre y cuando el alcohol no esté impedido, ya que se puede variar fácilmente la estructura de cada reactivo. La reacción se produce a partir de un alcohol y un haluro de alquilo en medio básico.
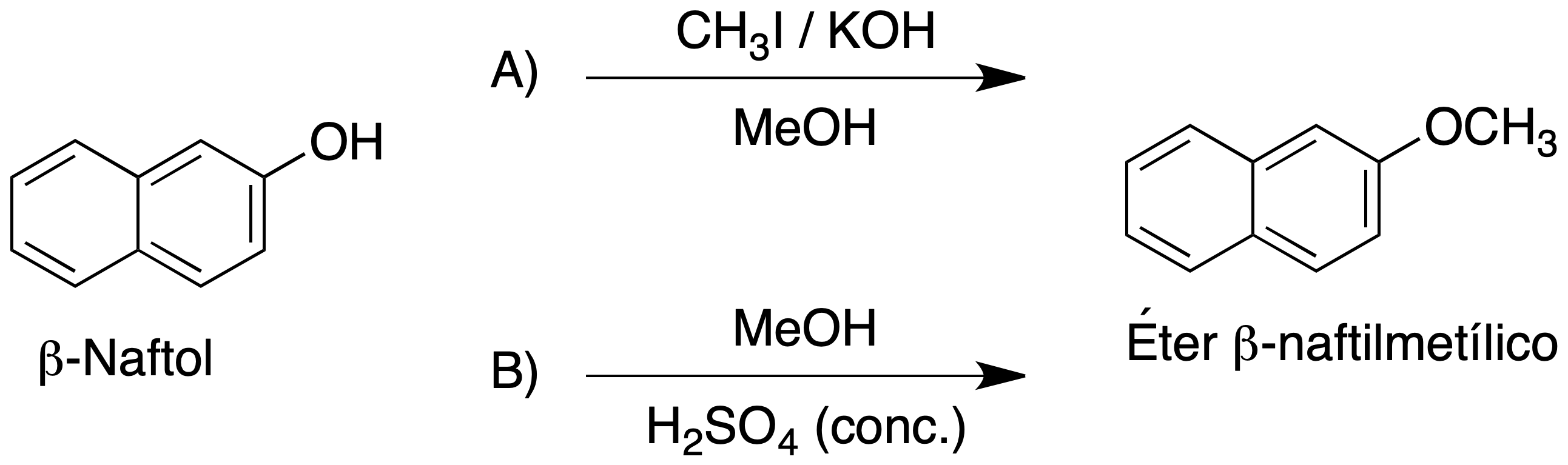
Los éteres también se pueden preparar mediante reacción de un alcohol en medio ácido. En este caso, el hidroxilo (muy mal grupo saliente) se protona transformándose en un excelente grupo saliente (ión alquiloxonio), ya que se libera agua. Esto permite la reacción con nucleófilos no tan buenos, como puede ser otra molécula de alcohol, mediante una reacción de sustitución nucleófila.
En este segundo procedimiento, que utilizaremos en este experimento, el ión alquiloxonio, se forma por la reacción del MeOH con H2SO4. En una etapa posterior, el ión alquiloxonio es atacado por una molécula de β-naftol produciendo el correspondiente éter β-naftilmetílico.
Normalmente este segundo método permite la obtención únicamente de éteres simétricos. Otro problema adicional es la tendencia a la deshidratación para formar alquenos, lo que está muy favorecido con alcoholes secundarios.
Mecanismos de reacción
Formación del éter en medio básico
La formación del éter se realiza en medio básico, el mecanismo a través del cual transcurre este proceso implica los siguientes pasos:
- Desprotonación del β-naftol en medio básico.
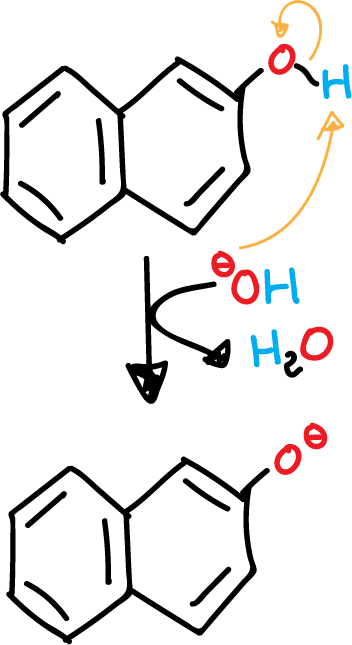
El β-naftol presenta un fenol (alcohol aromático) que se puede desprotonar con facilidad. Se obtiene un fenolato (alcóxido aromático), que es más nucleófilo que el alcohol inicial.
- Reacción de sustitución nucleófila.
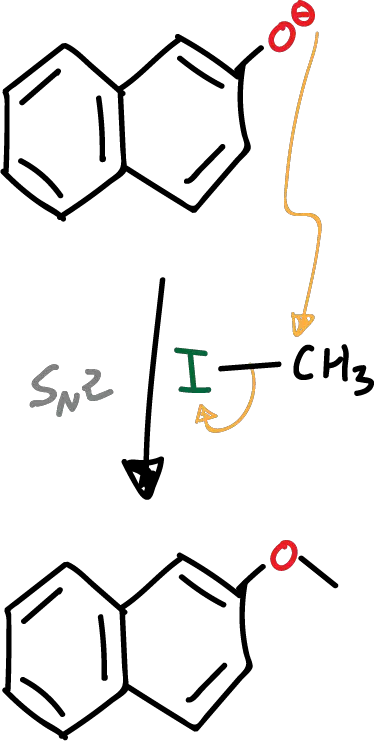
Posteriormente a la desprotonación, se produce el ataque del fenolato nucleófilo al ioduro de alquilo. Dado que tenemos un buen nucleófilo y un muy buen grupo saliente en un carbono primario, la reacción transcurre a través de un mecanismo de tipo SN2.
Formación del éter en medio ácido
- Protonación del metanol en medio ácido
Los alcoholes tienen carácter anfótero actuando como ácidos o bases. En este caso, al tratar un alcohol con un ácido fuerte, el alcohol actúa como base y se protona.
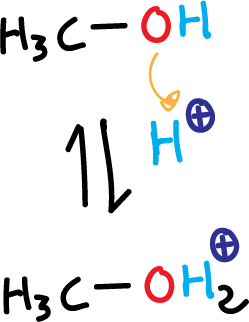
De esta manera se transforma el hidroxilo (HO⊖), que es mal grupo saliente, en un grupo saliente excelente (ión alquiloxonio H2O⊕) dado que se libera agua, una molécula neutra. Por tanto, pueden participar en reacciones de sustitución nucleófila.
- Reacción de sustitución nucleófila.
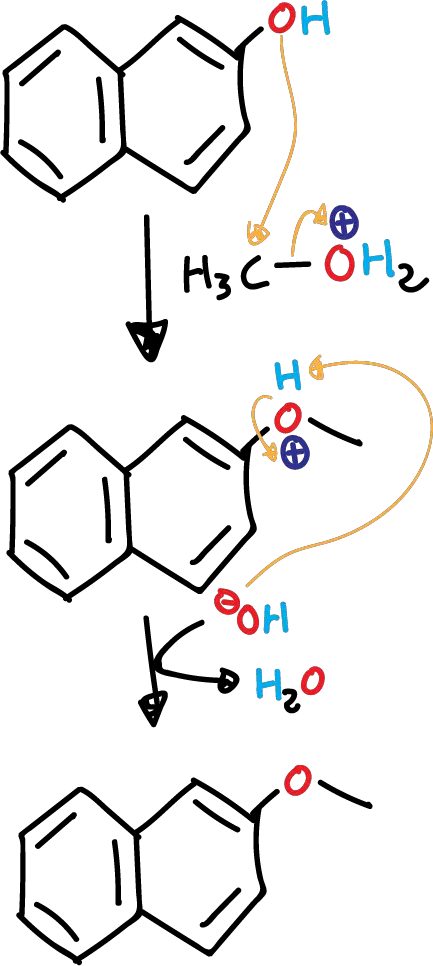
La forma protonada del metanol reacciona con el naftol para formar el éter correspondiente. Al ser un átomo de carbono primario, la reacción transcurre de nuevo a través de un mecanismo de tipo SN2.
Cabe destacar que, en este caso, la síntesis del éter en medio ácido no presenta competencia con reacciones de eliminación ya que ninguno de los alcoholes puede dar reacciones de eliminación.
Se podría dar la reacción del ión metiloxonio con MeOH en lugar de 2-naftol, pero en ese caso el producto es el dimetiléter, que es muy volátil (p.e. = -24 ºC) y se elimina del medio. Este hecho hace posible la obtención del éter no simétrico entre el 2-naftol y el metanol en medio ácido.
Procedimiento experimental
Obtención del éter β-naftilmetílico mediante síntesis de Williamson
En un matraz de fondo redondo de 100 ml provisto de un imán, se mezclan 2.88 g (20 mmol) de β-naftol (2-hidroxinaftaleno), 1.46 g (26 mmol) KOH y 20 ml de MeOH. Se acopla un tapón y la mezcla se agita a temperatura ambiente hasta la disolución del sólido. Con ayuda de una jeringa, se adicionan 1.4 ml (23 mmol) de yoduro de metilo (CH3I).
| ¡PELIGRO! «Realizar el experimento en vitrina debido a la peligrosidad del yoduro de metilo (CH3I).« |
Seguidamente, se acopla un refrigerante de reflujo y una torre de de desecante y se calienta durante 1 h. La mezcla se deja enfriar hasta alcanzar la temperatura ambiente y se añade agua hasta la aparición de un precipitado. El sólido se filtra a vacío y se recristaliza en EtOH (rendimiento estimado 75 %, punto de fusión 73 ºC).
Obtención del éter β-naftilmetílico en medio ácido
En un matraz de fondo redondo de 100 ml, se colocan 5 g de β-naftol, 25 ml de MeOH y 5 ml de H2SO4. La mezcla se mantiene a reflujo durante 1 h.
El crudo de reacción se deja enfriar y se vierte sobre 100 ml de agua/hielo. El éter precipitado, se filtra a vacío. El precipitado se lava en el Büchner dos veces con agua helada, una vez con 20 ml de NaOH al 10 % y otra vez con agua helada.
El producto obtenido se recristaliza en EtOH, decolorándose con carbón activo si fuera necesario (rendimiento estimado 70 %).
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| β-naftol | 144.17 | 120-122 | 285-286 | 1.280 |
| CH3I | 141.94 | -64 | 41-43 | 2.280 |
| H2SO4 | 98.08 | 3 | - | 1.80-1.84 |
| EtOH | 46.07 | -114.1 | 78.5 | 0.790 |
| NaOH | 40.00 | 318 | 1,390 | 2.130 |
| MeOH | 32.04 | -98 | 64.7 | 0.791 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| β-naftol |   |
| CH3I |   |
| H2SO4 |  |
| EtOH |  |
| NaOH |  |
| MeOH |    |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| β-naftol | JWAZRIHNYRIHIV-UHFFFAOYSA-N |
| CH3I | INQOMBQAUSQDDS-UHFFFAOYSA-N |
| H2SO4 | QAOWNCQODCNURD-UHFFFAOYSA-N |
| EtOH | LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| NaOH | HEMHJVSKTPXQMS-UHFFFAOYSA-M |
| MeOH | OKKJLVBELUTLKV-UHFFFAOYSA-N |
Volver a la página de prácticas de Síntesis Orgánica.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
