Written by J.A. Dobado | Last Updated on 1 año
¿Qué es el ácido clorhídrico?
El ácido clorhídrico es un ácido mineral inorgánico de fórmula general HCl·H2O. Es el sistema químico más sencillo formado por cloro y agua.
Índice
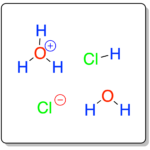
Está formado por la disolución de cloruro de hidrógeno gas en agua. Esta disolución está compuesta por moléculas de cloruro de hidrógeno, agua, e iones como el anión cloruro Cl⊖ y el catión oxonio u oxidanio H3O⊕. La IUPAC no recomienda el uso del nombre hidronio, a éste catión.
- HCl + H2O → H3O⊕ + Cl⊖
Es un líquido incoloro de olor intenso. Se le denomina también: ácido muriático, espíritu de sal, ácido marino, ácido de sal, ácido hidroclórico, o agua fuerte o salfumán.
Este ácido es producido de forma natural en los sistemas digestivos de la mayoría de las especies animales, incluidos los humanos, como componente natural del ácido gástrico.
Propiedades fisicoquímicas
Es muy corrosivo y ácido y se utiliza ampliamente como reactivo químico. Al ser un ácido fuerte, se disocia completamente en agua. Una disolución concentrada de ácido clorhídrico presenta un pH < 1.
Es un ácido monoprótico, solo puede liberar un protón H⊕, y el otro ion formado Cl⊖puede usarse para preparar sales llamadas cloruros, como el cloruro de sodio.
Los ácidos monopróticos tienen una constante de disociación ácida, Ka, que para ácidos fuertes presenta un valor alto. Al agregar cloruros, como el NaCl, a una disolución acuosa de HCl, el valor de pH prácticamente no cambia, lo que indica que el ion Cl− es una base conjugada notablemente débil, y que el HCl está casi completamente disociado en disoluciones acuosas. Por lo tanto, para disoluciones de ácido clorhídrico de concentración relativamente altas, se asume que la concentración de H⊕ es igual a la de HCl.
Es uno de los ácidos fuertes menos peligrosos de manipular y a pesar de su acidez. Sus disoluciones de concentraciones intermedias son bastante estables (hasta 6 M), manteniendo sus concentraciones con el paso del tiempo.
Por tanto, lo convierten hacen un excelente reactivo acidificante, y empleado también en volumetrías ácido-base.
Se utiliza frecuentemente en análisis químico y para digerir muestras para análisis. Asimismo, las disoluciones concentradas se emplean para disolver algunos metales, formando cloruros metálicos oxidados y hidrógeno gaseoso.
A la mezcla 1:3 (relación molar) de ácido nítrico y ácido clorhídrico se le denomina agua regia. El nombre proviene de la Alquimia debido a que esta disolución disolvía metales nobles como oro, y platino.
Producción
El ácido clorhídrico es un reactivo químico importante en laboratorios en industria. Así, se utiliza en la producción de cloruro de polivinilo (PVC) en polímeros plásticos. El ácido clorhídrico diluido a menudo se usa, como agente descalcificador doméstico. También, en la industria alimentaria, se emplea como aditivo y en la producción de gelatina. Además es muy utilizado también en el procesamiento del cuero.
Fue descubierto por el alquimista Jabir ibn Hayyan en el año 800 dc. Históricamente, se llamaba acidum salis y espíritus de sal porque se producía a partir de sal de roca y «vitriolo verde» (FeSO4) y más tarde a partir de la sal común químicamente similar y el H2SO4. El ácido clorhídrico fue descrito formalmente por primera vez en el siglo XVI por Libavius. Más tarde, fue utilizado por químicos como Glauber, Priestley y Davy en sus investigaciones. A menos que esté presurizado o enfriado, el ácido clorhídrico se convierte en un gas si el porcentaje de agua es del 60 % o menor.
Se obtiene en el laboratorio calentando ácido sulfúrico en presencia de cloruro de sodio a 150 °C.
H2SO4 + 2NaCl → 2HCl + NaSO4
A escala industrial, se producen grandes cantidades de ácido clorhídrico en las reacciones orgánicas de cloración de las sustancias orgánicas con dicloro.
Otro método de producción a gran escala es el utilizado por la industria cloro-alcali. Este método consiste en la electrólisis de una disolución de sal común (NaCl), produciendo cloro, hidróxido de sodio e hidrógeno. El cloro gaseoso obtenido reacciona con el hidrógeno para dar HCl gaseoso químicamente puro. A las instalaciones se las denomina hornos de HCl debido al carácter exotérmico de la reacción.
