Written by José | Last Updated on 2 meses
Ir a la página con el listado de problemas.
Ácidos carboxílicos y derivados – soluciones a los problemas
Solución 1:
La acidez en los ácidos carboxílicos aumenta con la presencia de grupos electrón atrayentes próximos al grupo carboxilo, ya que por un lado debilita el enlace O-H, lo cual ayuda a liberar un protón, y por otro estabilizan el ión carboxilato, dispersando la carga negativa entre los dos átomos de oxígeno de dicho ión y haciendo que sea más estable. Cuanto mayor sea la electronegatividad de los grupos, mayor sea su número y más cerca se encuentren del grupo carboxilo, mayor será la acidez. Por otro lado los grupos alquilo son electrón-donantes, por lo que su presencia dificulta la rotura del enlace O-H. De acuerdo con estos criterios el orden de acidez será el siguiente para las distintas series:
a) HCOOH > CH3-COOH > CH3-CH2-COOH
b) CCl3-COOH > CHCl2-COOH > CH2Cl-COOH > CH3-COOH
c) CH2F-COOH > CH2Cl-COOH > CH2Br-COOH
d) CH3-CHCl-COOH > CH2Cl-CH2-COOH > CH3-CH2-COOH
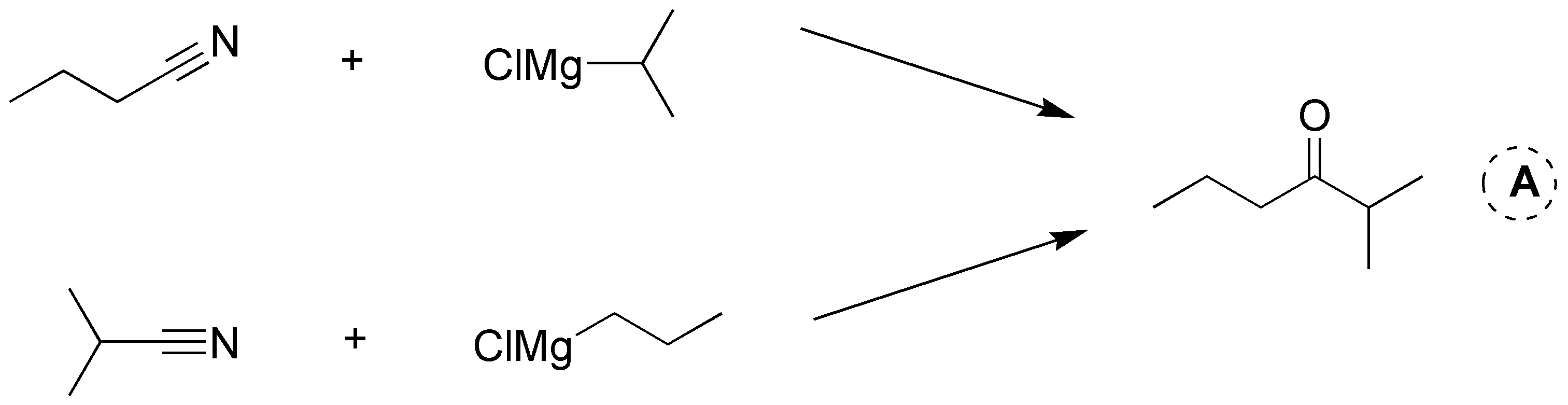
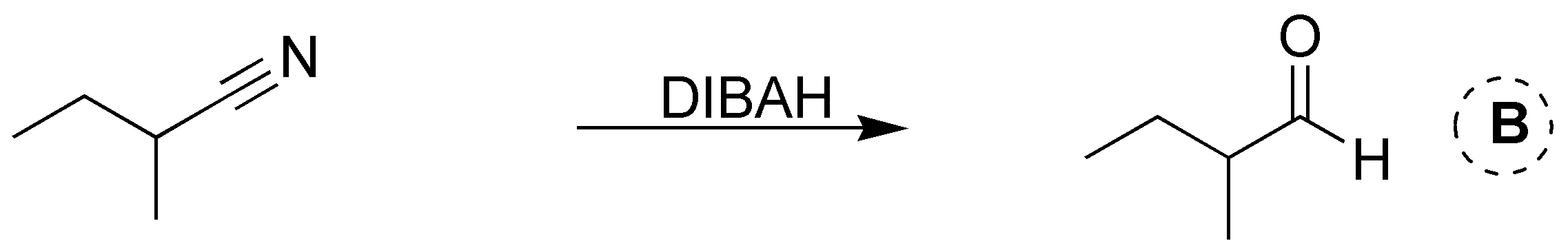
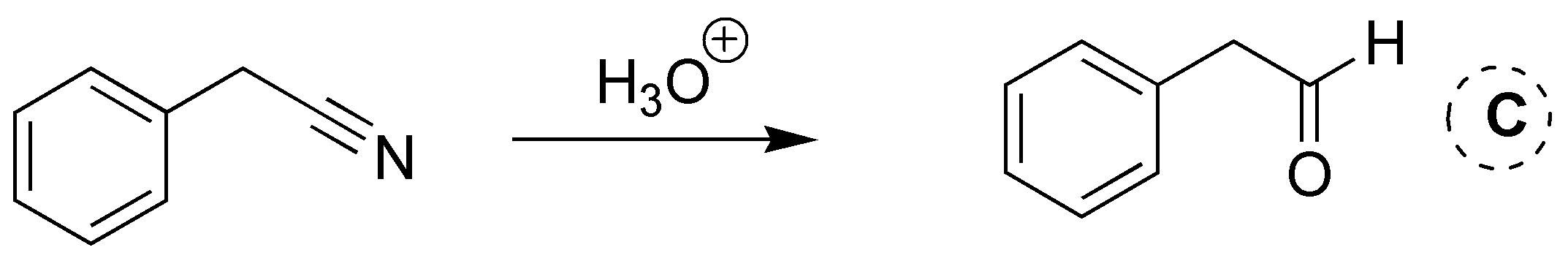
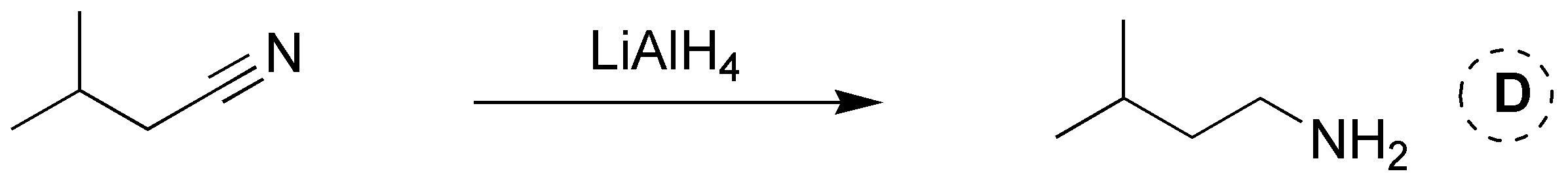
Solución 2:
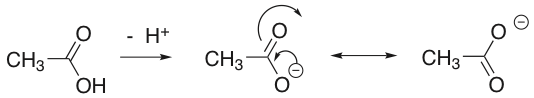
Solución 3:
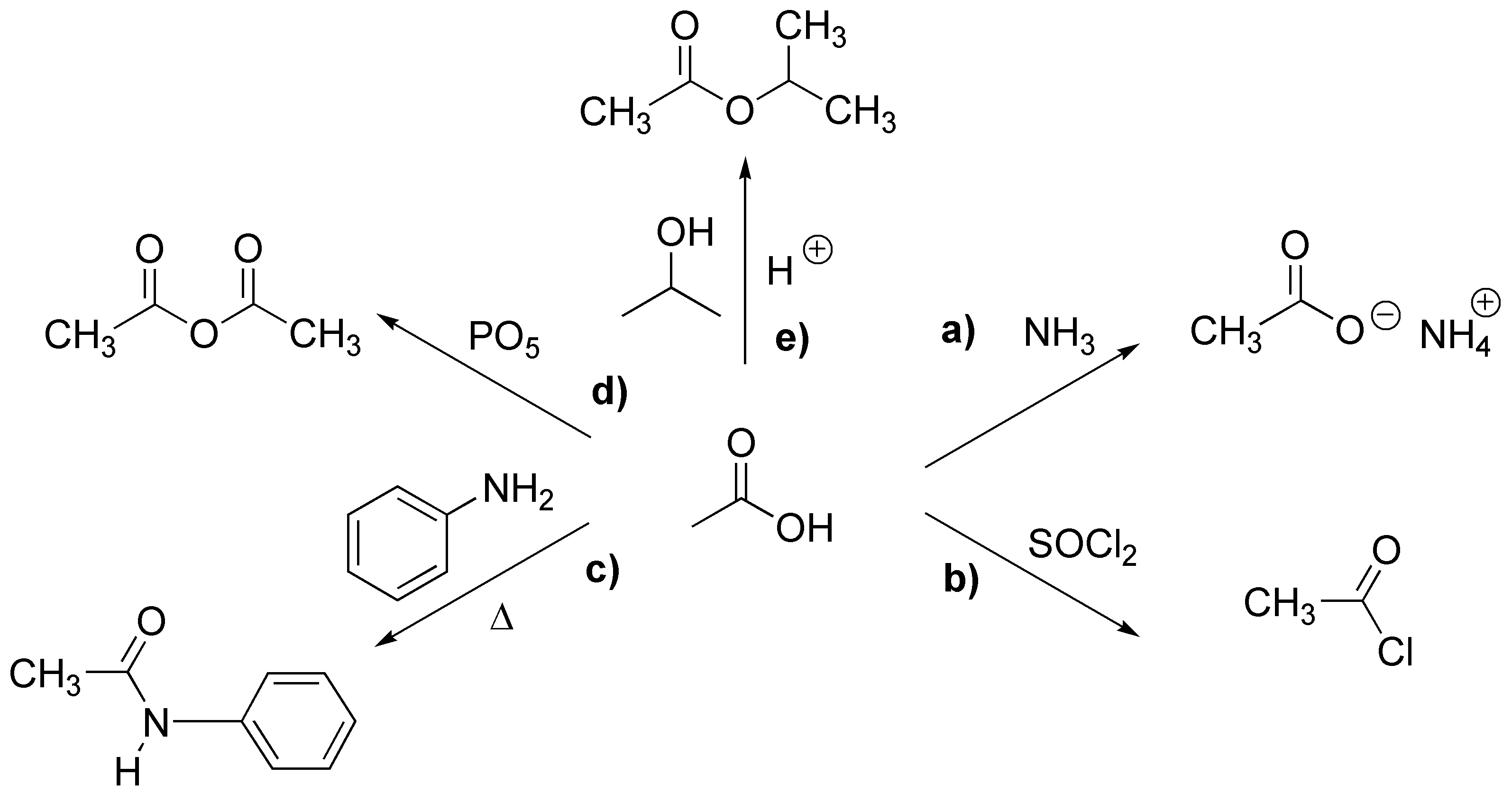
Solución 4:
La reacción de estereficación es un proceso de equilibrio que transcurre mediante el siguiente mecanismo:
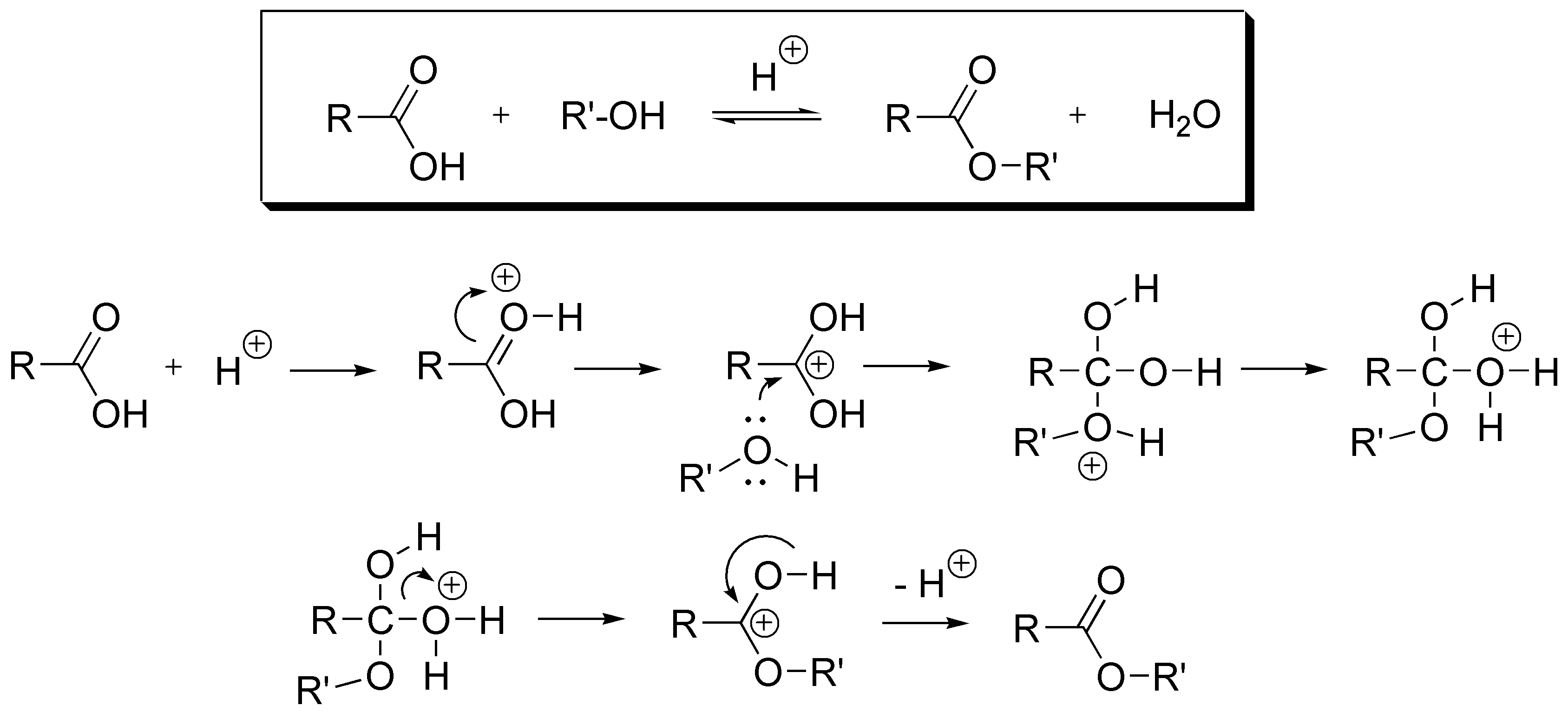
Para desplazar el equilibrio hacia la derecha se puede usar un agente deshidratante que retire el agua, y por tanto haga que el equilibrio se desplace hacia la formación del éster. O bien, si las propiedades físicas de los componentes de reacción lo permiten, eliminar del crudo de reacción el éster formado. Todo esto se realiza mediante un proceso de destilación si el punto de ebullición del éster es inferior al del ácido y al del alcohol de partida.
Solución 5:
La reacción es una trans-esterificación:

Solución 6:
Se formará preferentemente la amida siempre que haya en el medio de reacción una base que atrape el HCl que se libera. El átomo de nitrógeno es más nucleófilo que el oxígeno, pero si no hay una base en el medio, como por ejemplo piridina o trietilamina, el nitrógeno del 4-aminobutan-1-ol se irá protonando en el curso de la reacción formando la correspondiente sal de amonio, lo cual hace que el par de electrones del nitrógeno no estén disponibles y será entonces el grupo -OH el que atacará al carbono del cloruro de ácido.
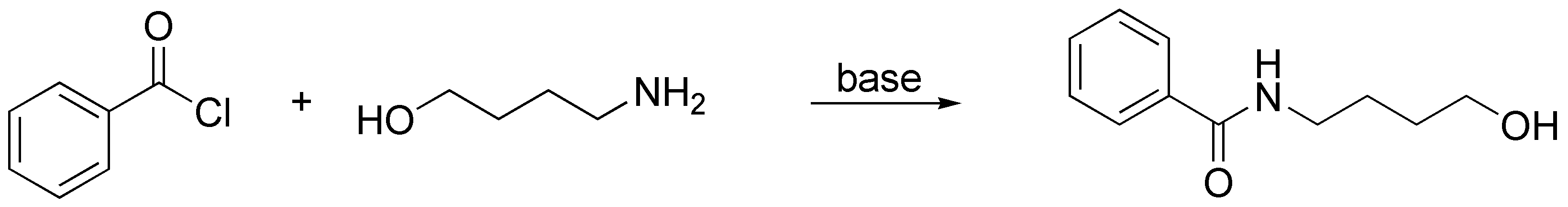
Solución 7:
Los anhídridos reaccionan tanto con alcoholes como con aminas, pero con estas la reacción es más rápida pues son más nucleófilas que los alcoholes.
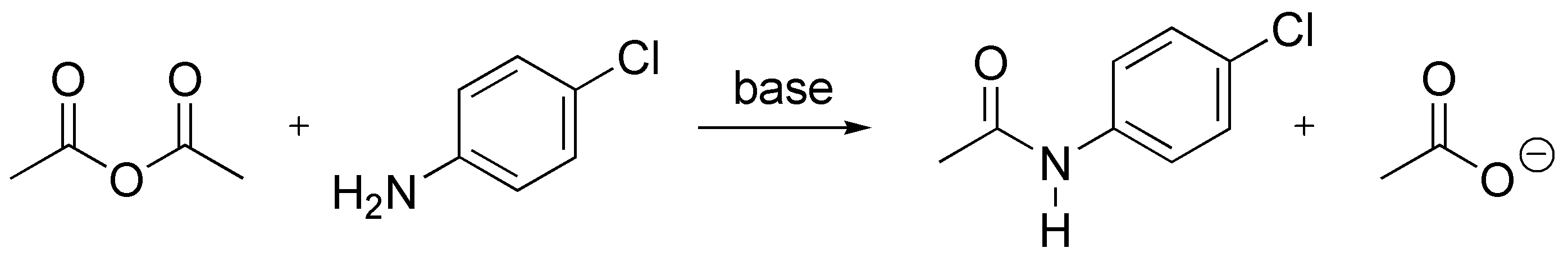
Solución 8:
a) El cloruro de acetilo reacciona violentamente con el agua produciendo vapores de HCl, mientras que el clorobenceno y el clorobutano no reaccionan. De esta forma tendremos identificada la primera botella.
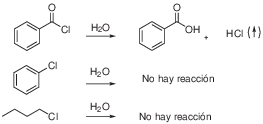
b) Para distinguir entre clorobenceno y clorobutano, tratamos con una disolución de hidróxido sódico. El clorobenceno es inerte a estas condiciones, puesto que el cloro unido al anillo aromático no se puede sustituir por el OH–, mientras que el átomo de cloro del clorobutano se sustituye con relativa facilidad, dado que es un haluro de alquilo primario. Neutralizamos ambas disoluciones y añadimos unas gotas de disolución de nitrato de plata. La aparición de un precipitado denota la presencia de ión cloruro para la muestra de clorobutano.
Solución 9:
El resultado es la formación del ácido acetilsalicílico (aspirina). Como subproducto se obtiene ácido acético. La reacción se cataliza por adición de unas gotas de ácido mineral como ácido sulfúrico o ácido fosfórico.
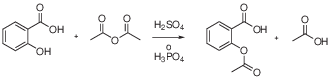
Solución 10:
Se produce la apertura del ciclo y se obtiene ácido 3-(etilcarbamoil)propanoíco.
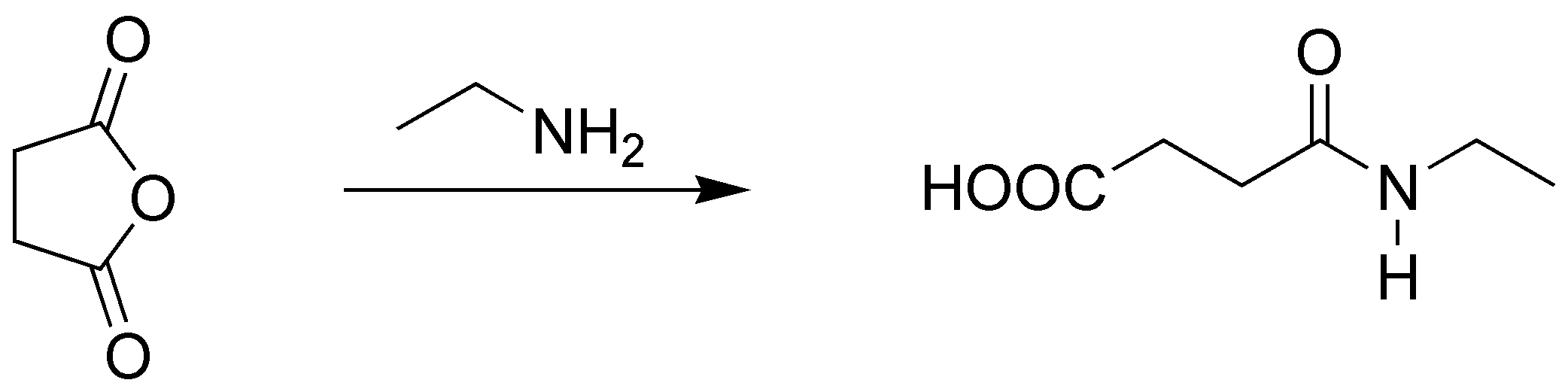
Solución 11:
Por tratamiento con una amina los esteres se transforman en amidas.
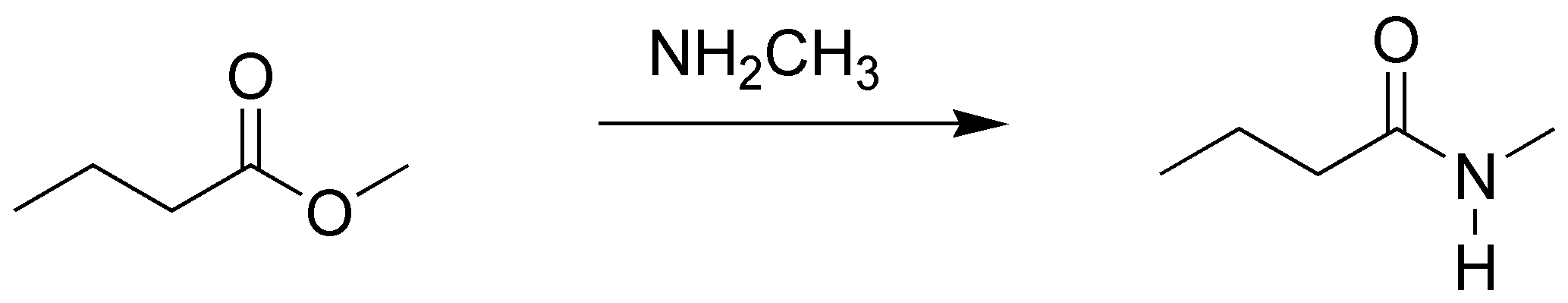
Solución 12:
En condiciones de catálisis ácida (HCl) se obtienen los correspondientes ácidos a) etanoíco y b) propanoíco, así como los alcoholes a) etílico y b) metílico, respectivamente. En catálisis básica (NaOH) los ácidos carboxílicos formarían las correspondientes sales sódicas, a) etanoato sódico y b) propanoato sódico. Nótese que la reacción catalizada por ácido es de equilibrio mientras que la básica no lo es.
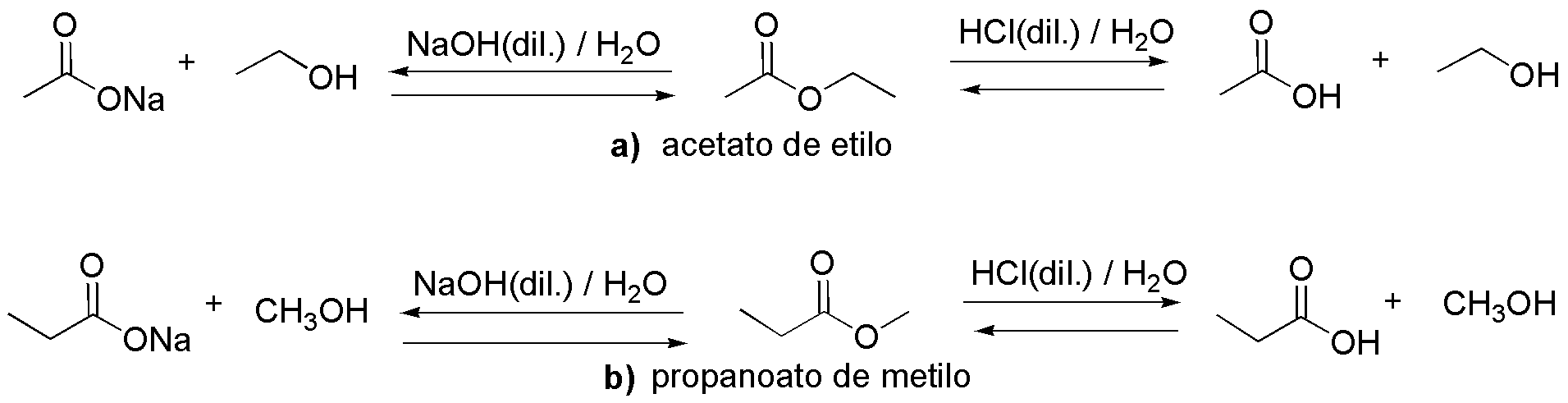
Solución 13:
El reactivo es una grasa (triéster de glicerina), que en condiciones básicas se hidroliza en 3 moléculas de la sal sódica del correspondiente ácido carboxílico y glicerol. Esta reacción se denomina saponificación y la sal sódica de ácidos grasos se utiliza como jabón.
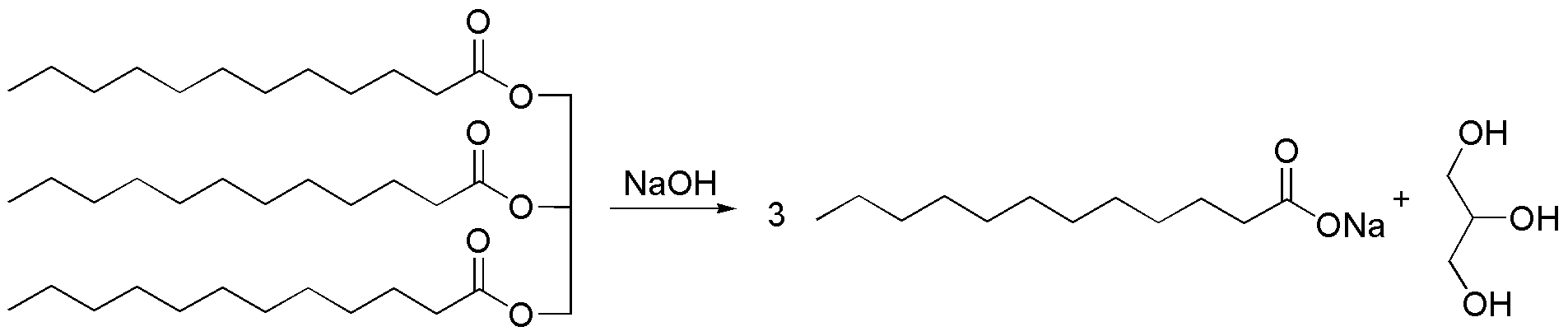
Solución 14:
a) se obtiene el correspondiente haluro de ácido.
b) en medio básico el ácido se desprotona para dar el ión carboxilato.
c) usando CH2N2 con un ácido se obtiene el éster metílico correspondiente.
d) es una reacción de esterificación que da el éster etílico que se indica en la figura.
e) Los ácidos carboxílicos se reducen hasta alcohol usando hidruro de aluminio y litio, en este caso se genera un alcohol secundario.
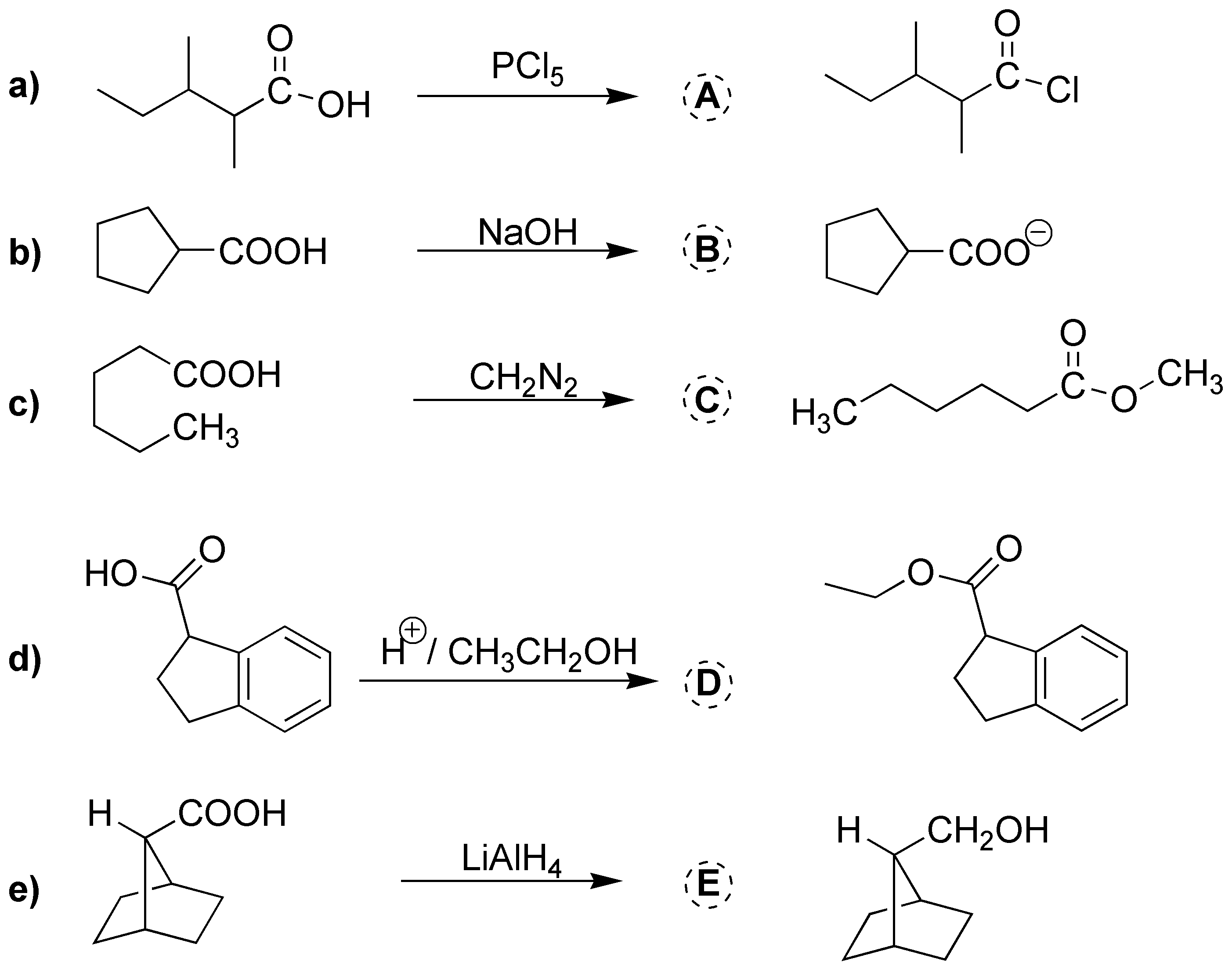
Solución 15:
La obtención del bromuro de ácido se puede hacer empleando PBr3. b) La reducción hasta alcohol se realiza con LiAlH4. c) La esterificación se realiza con el alcohol de la figura en medio ácido. d) para generar el anión carboxilato se emplea medio básico. e) El éster metílico se obtiene mediante el uso del diazometano, CH2N2.
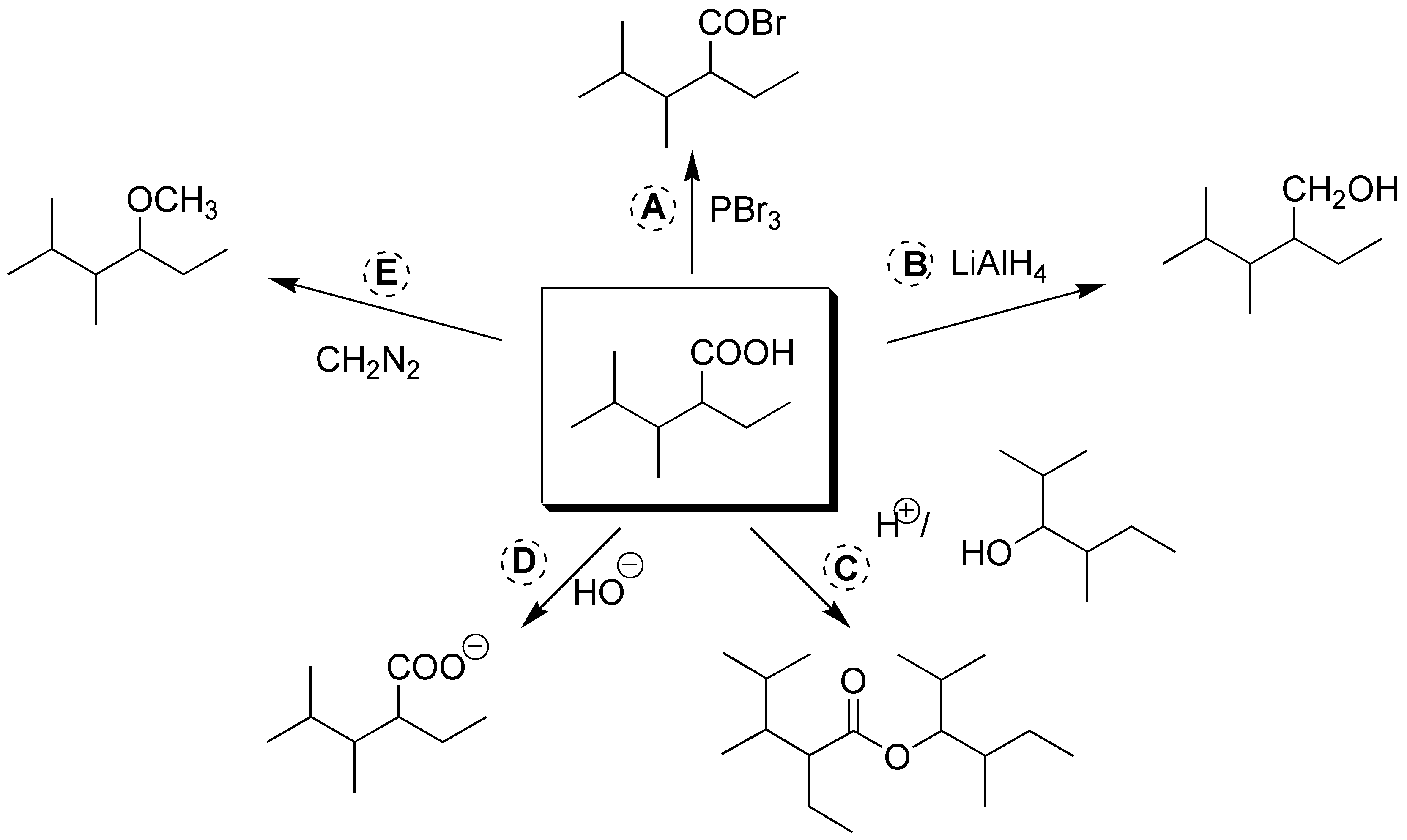
Solución 16:
Los reactivos y productos necesarios para completar el esquema se muestran en la siguiente figura:
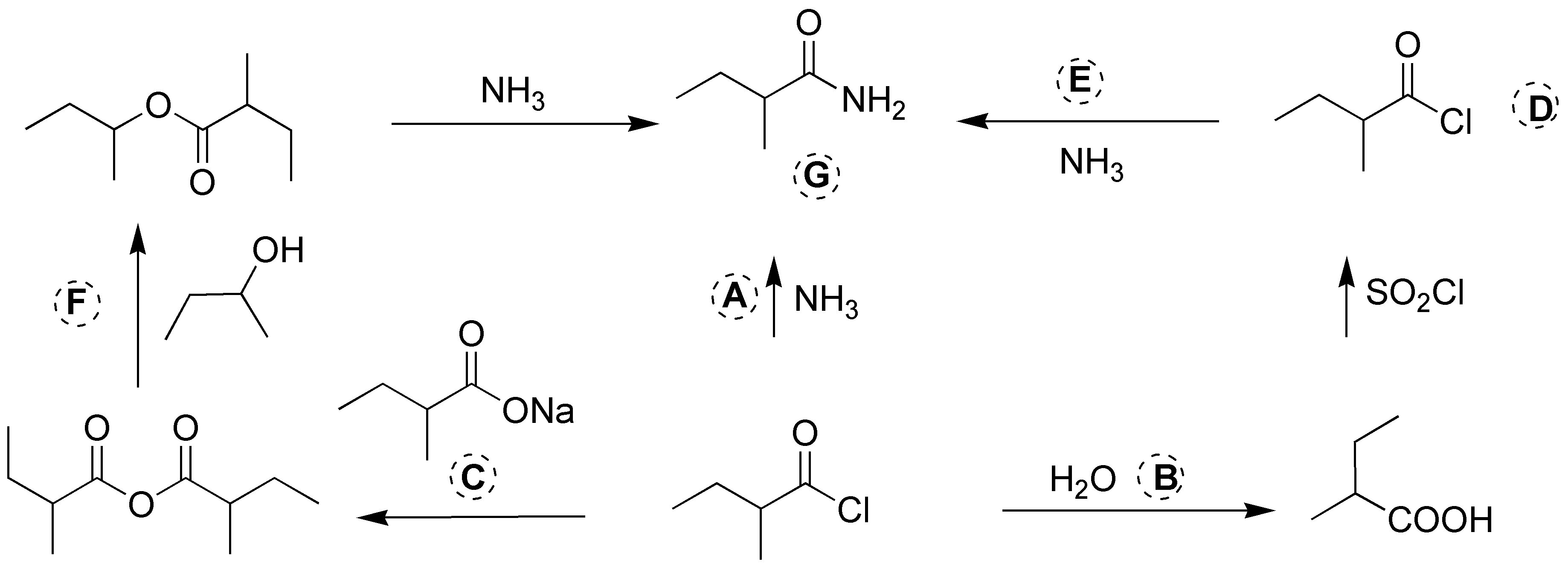
Solución 17:
Es una reacción de formación de imida a partir de un ácido carboxílico, en este caso los dos grupos funcionales ácido están unidos a un anillo aromático. El amoníaco, mediante una reacción ácido-base), reacciona con los ácidos carboxílicos para dar la correspondiente sal (se necesitan 2 moles de NH3 para reaccionar con los dos grupos ácido). Esta sal al calentarse forma la imida (análogo al anhídrido de ácido pero en lugar de tener un oxígeno entre los grupos carbonilo presenta un NH), desprendiéndose dos moléculas de agua y una de amoníaco.
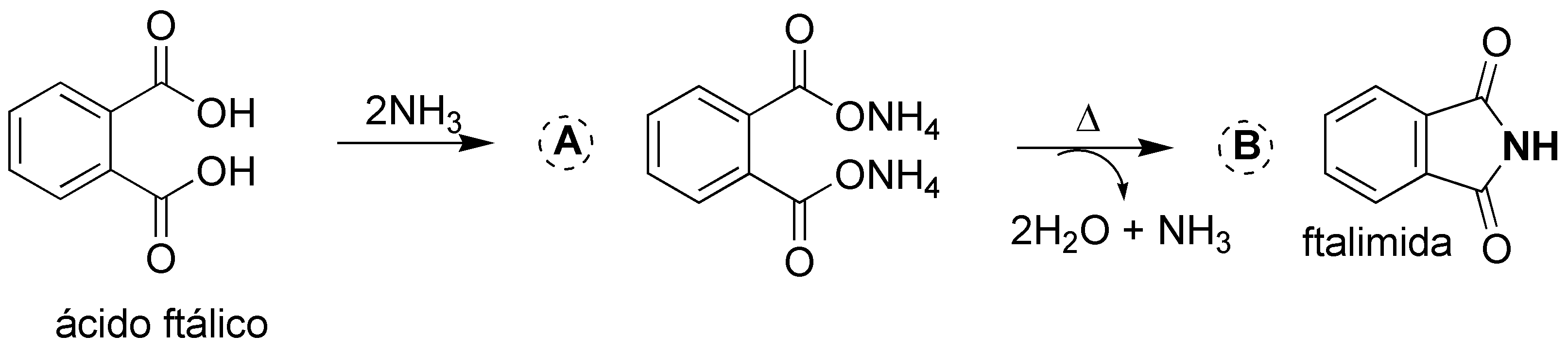
Solución 18:
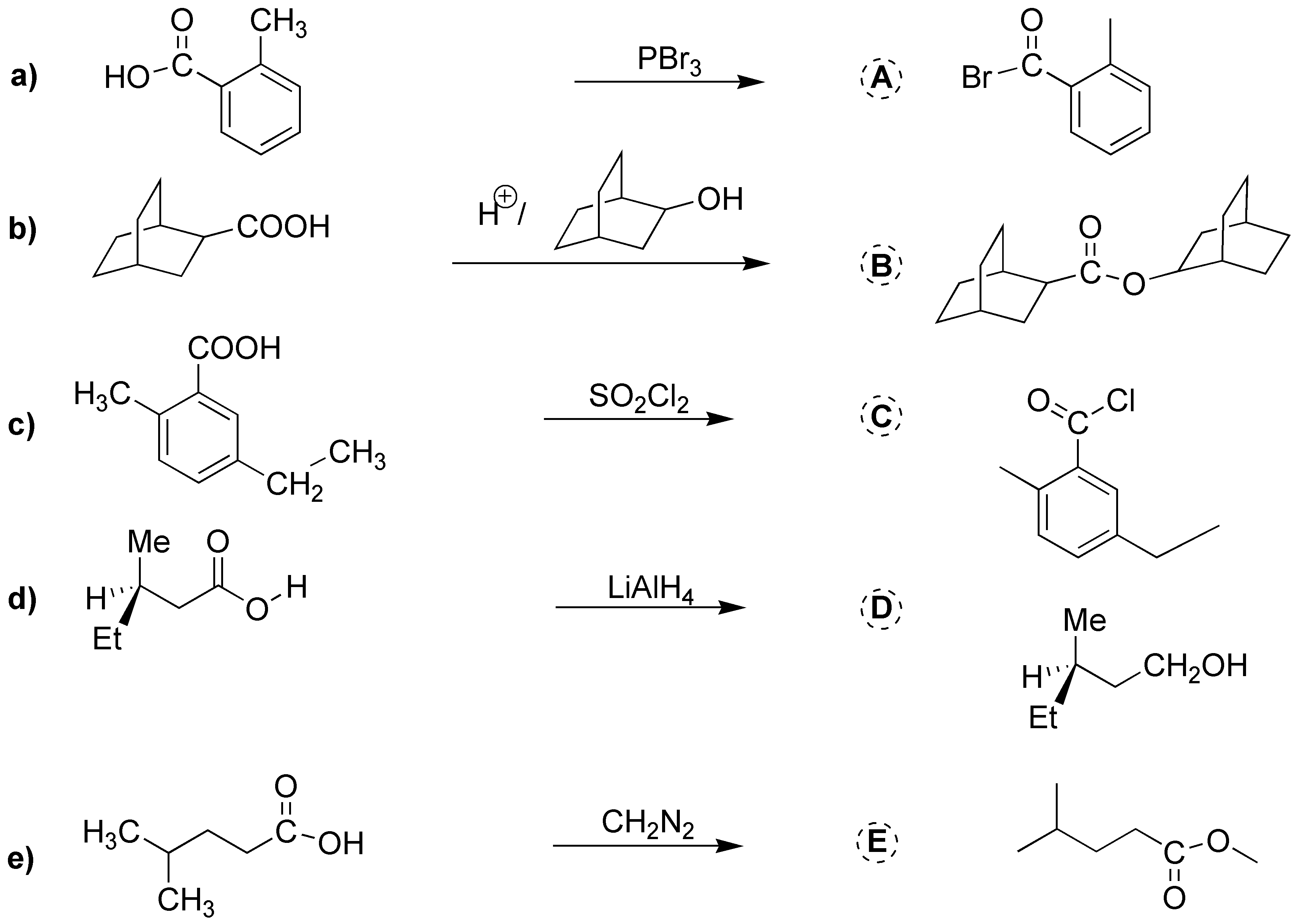
Solución 19:
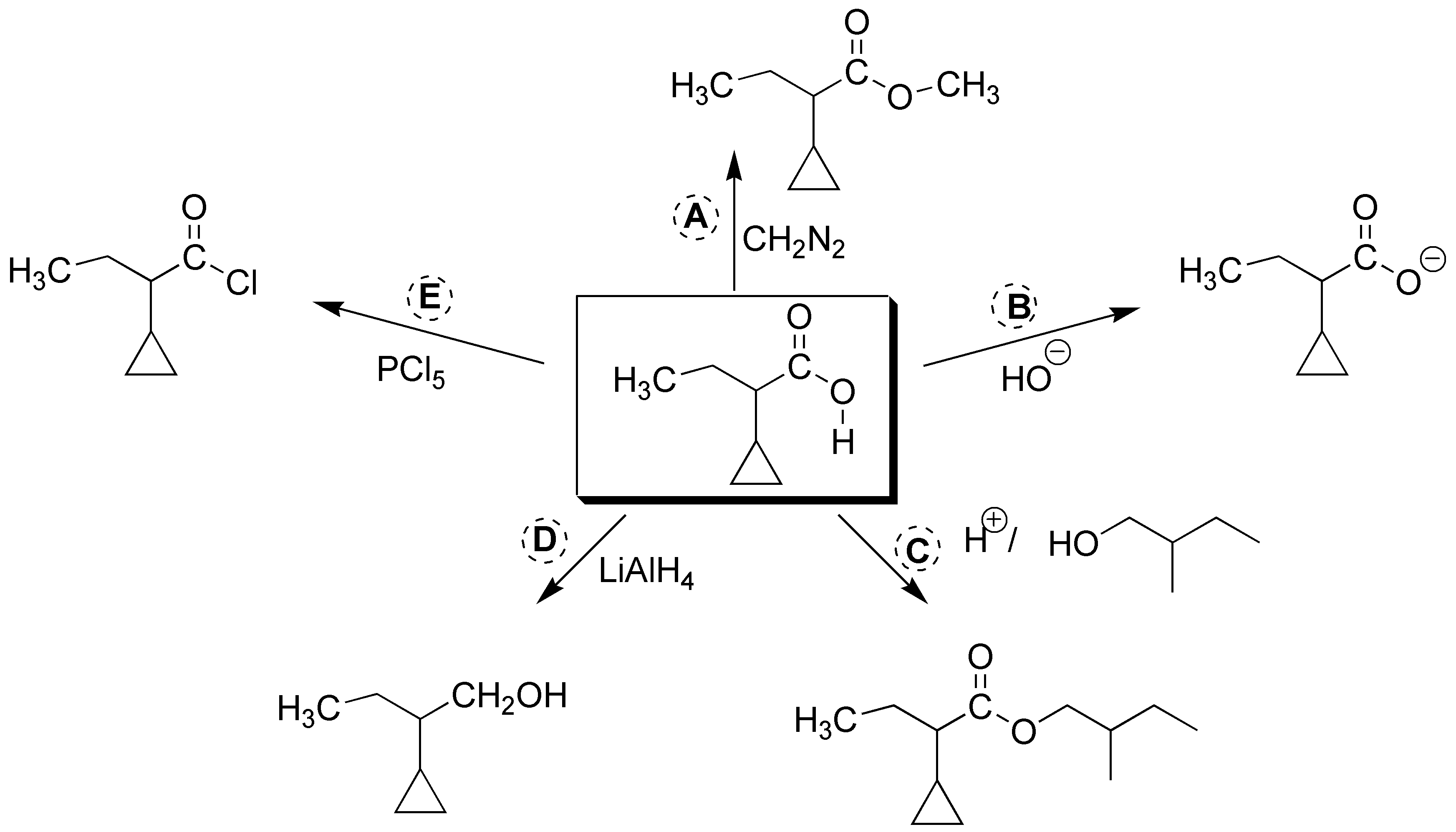
Solución 20:
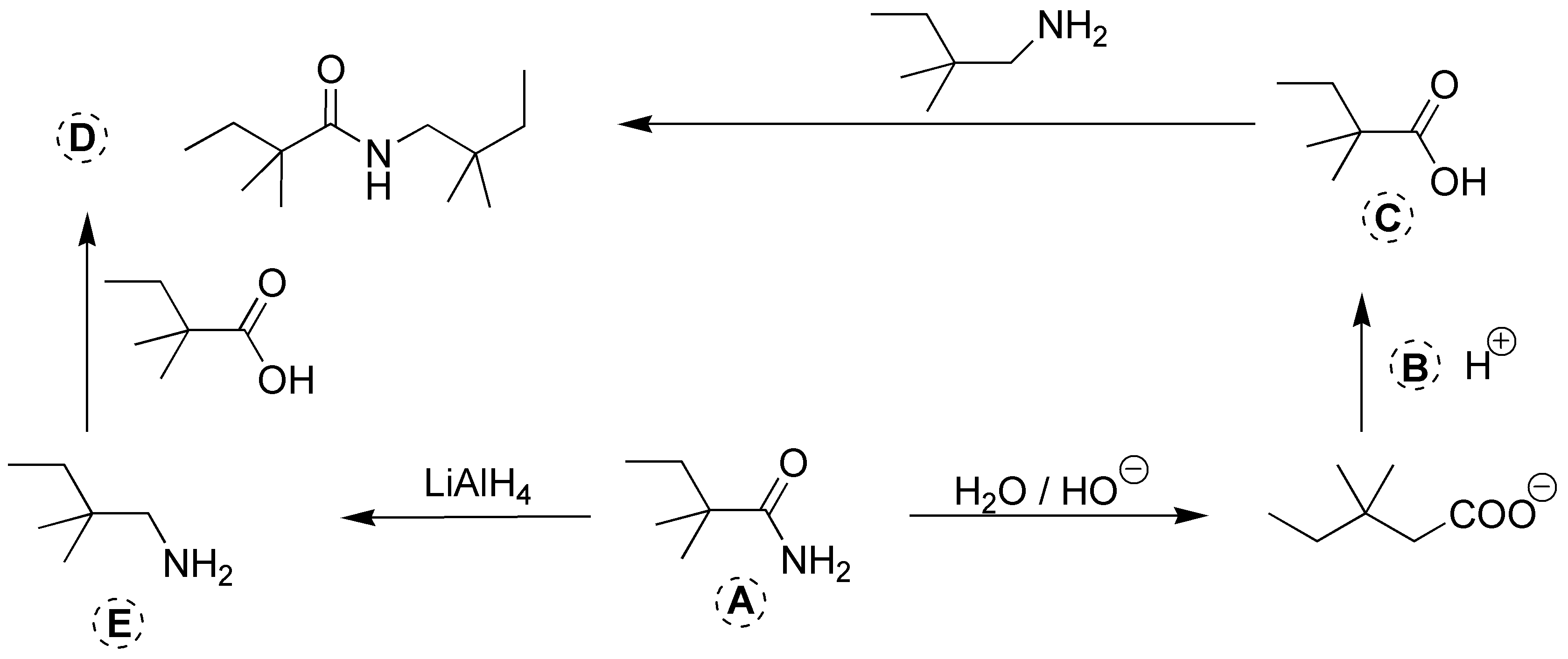
Solución 21:
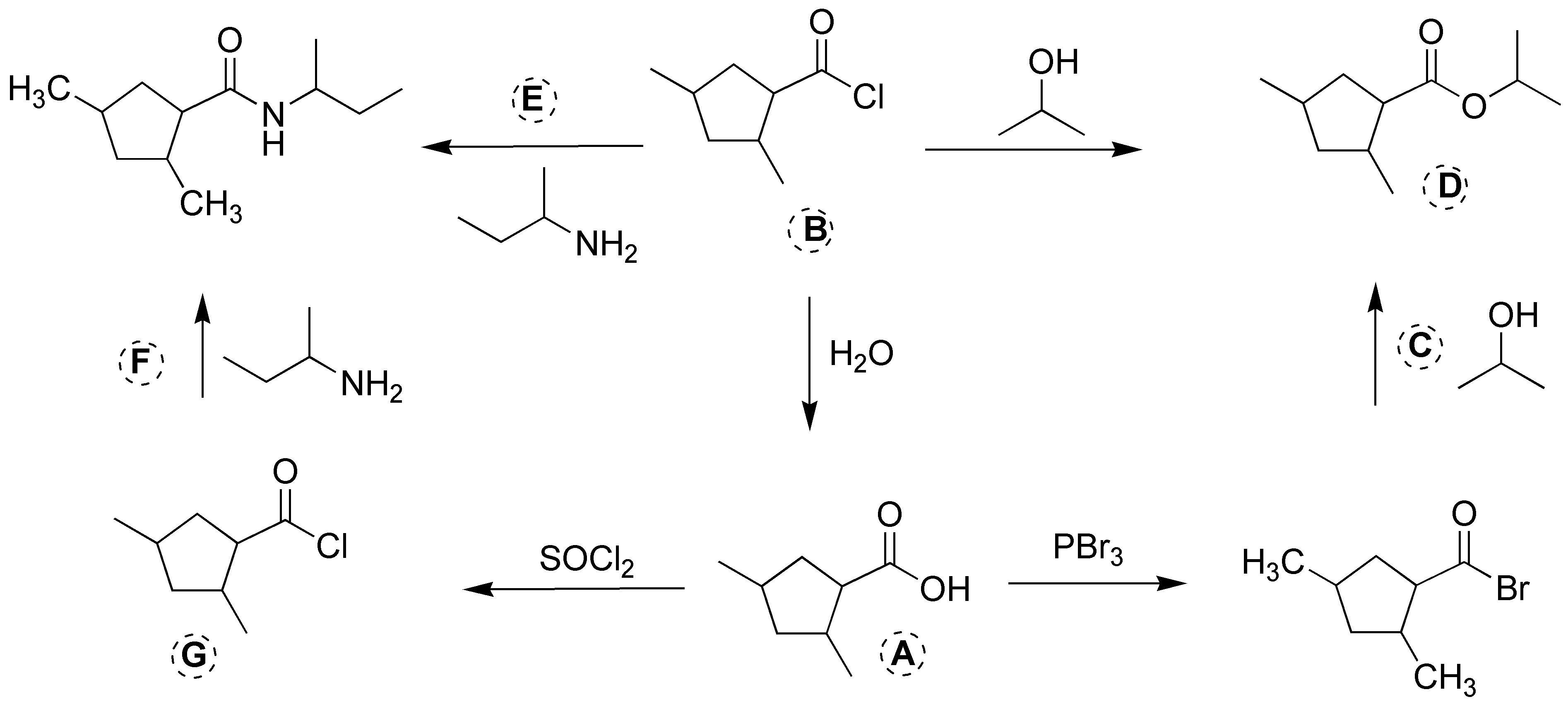
Solución 22:
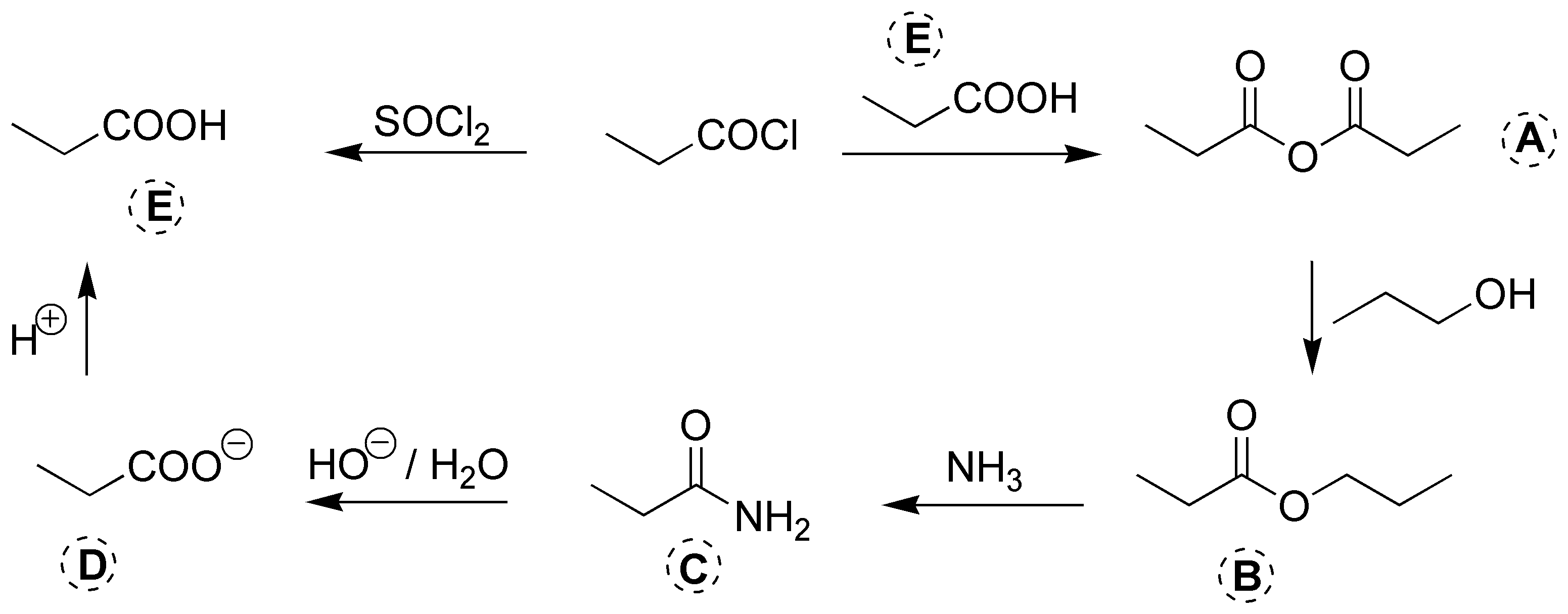
Solución 23:
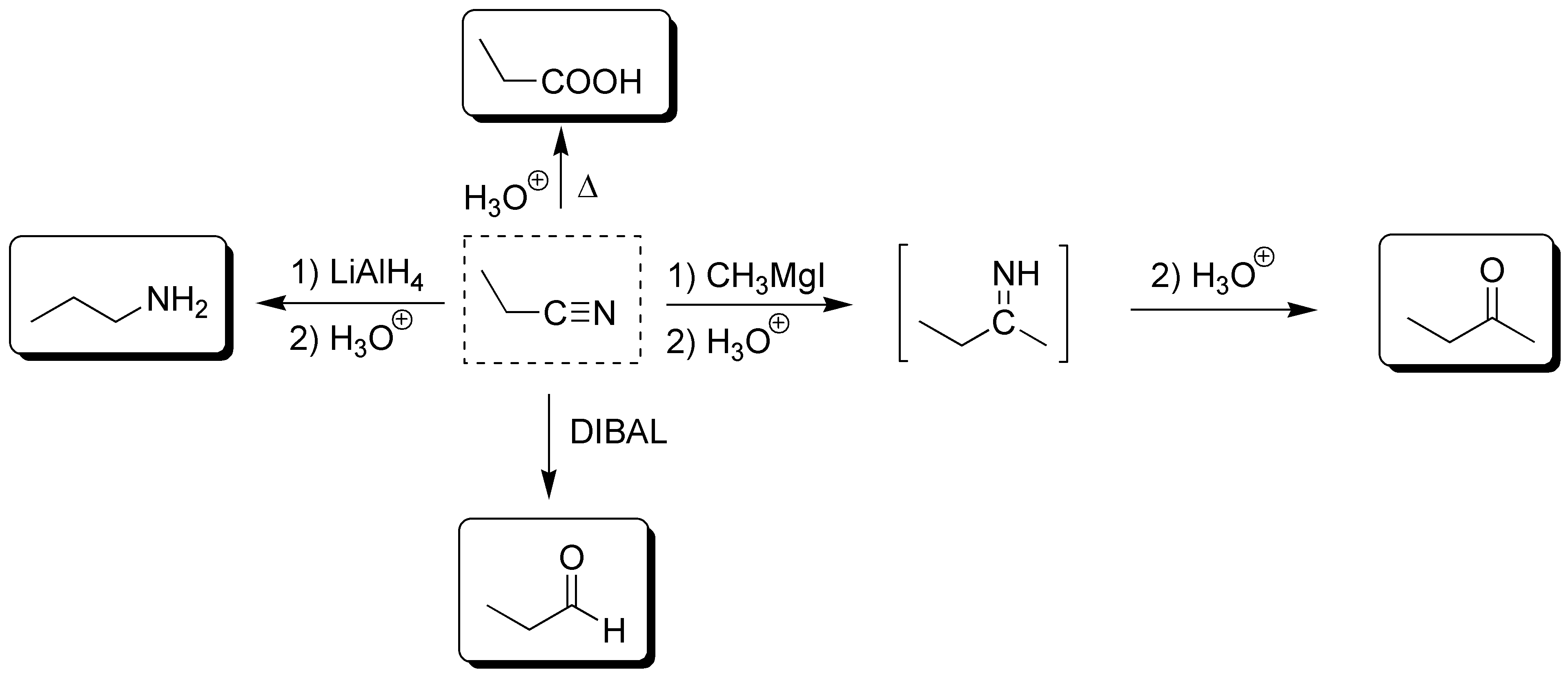
Solución 24:
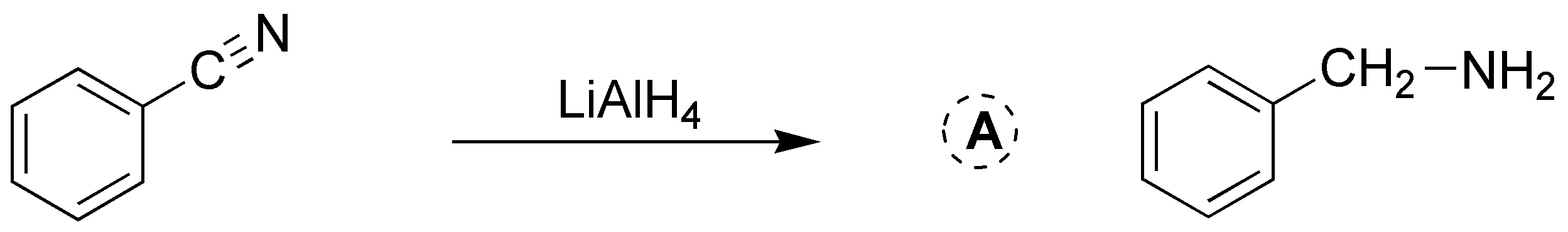
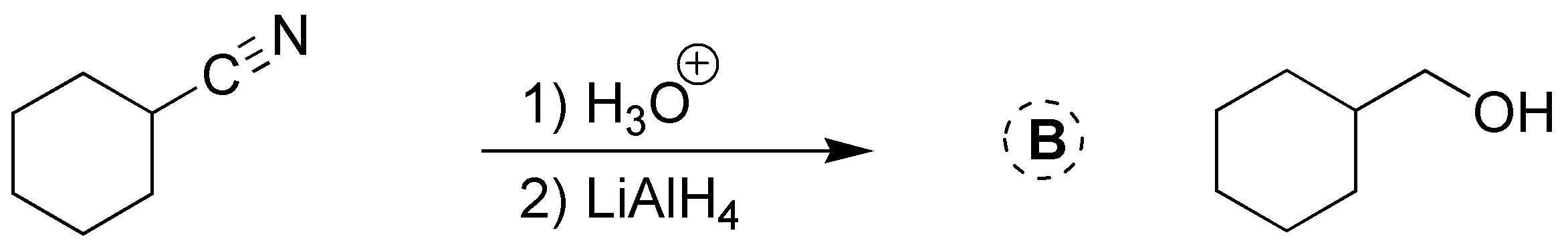
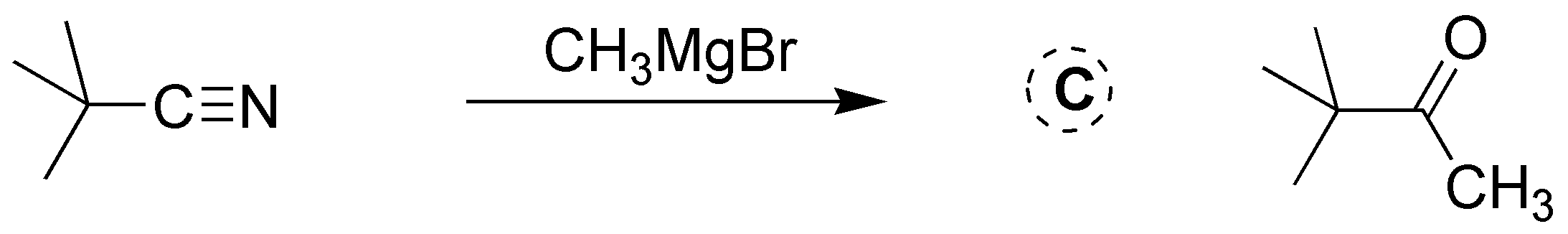
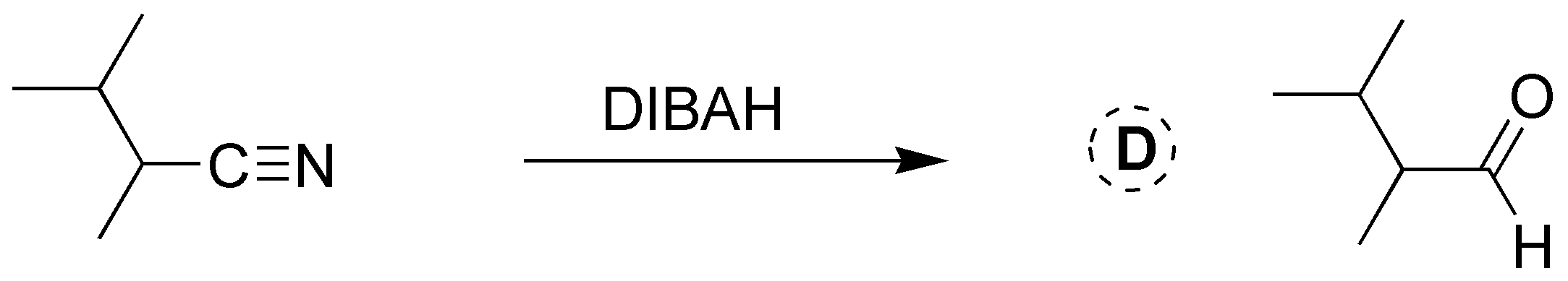
Solución 25:
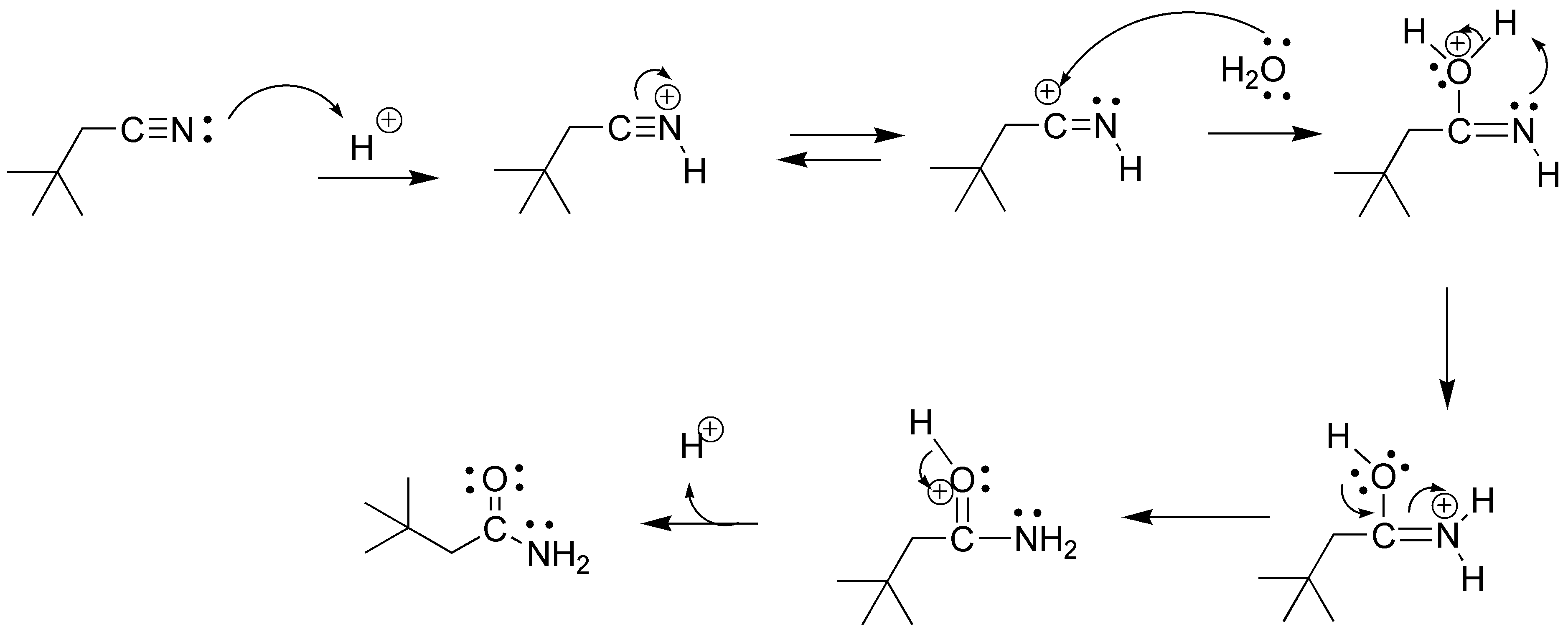
Solución 26: