Written by J.A. Dobado | Last Updated on 1 año
Objetivo
Aislamiento de cafeína a partir de café soluble (de un producto comercial), por extracción con un disolvente orgánico y separación por centrifugación de la fase acuosa y la fase orgánica obtenida.
Índice
Antecedentes
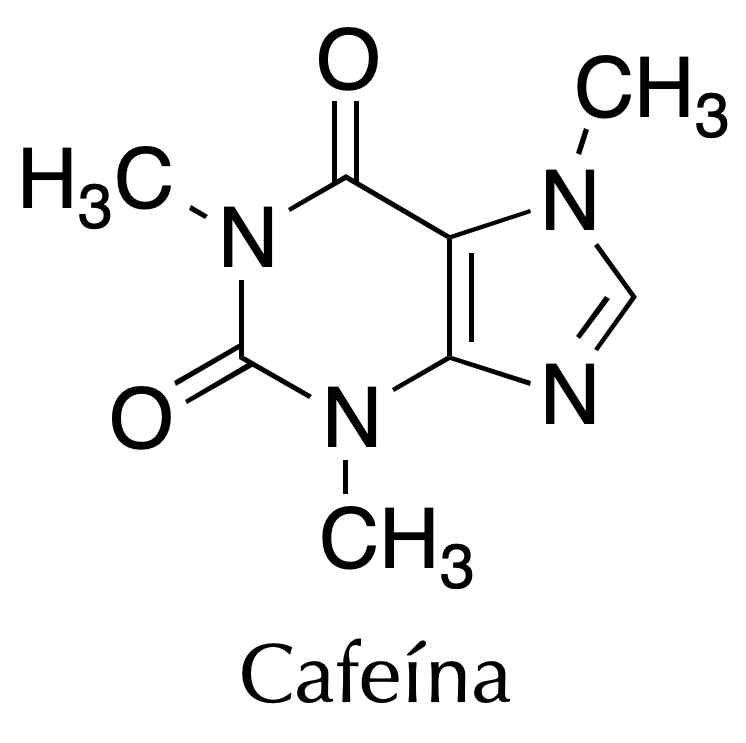
La cafeína es un alcaloide de la familia de las xantinas. Cuando está pura es un sólido blanco inodoro de punto de fusión 234-236 ºC parcialmente soluble en agua (100 mM). Como es sabido, la cafeína tiene un efecto estimulante, y se encuentra en plantas como el café o el té.
El café instantáneo o café soluble es un producto ampliamente difundido en el mercado que se obtiene a partir de la infusión mediante el proceso de liofilización.[1]
Según los fabricantes, el café instantáneo contiene entre 55 y 62 mg de cafeína por cada taza que se ha preparado con una cucharadita del producto.
En esta práctica se va a proceder a la obtención cafeína a partir de un extracto obtenido del producto comercial.
Procedimiento experimental
El aislamiento de cafeína a partir de café soluble se realiza de la siguiente manera:
En un vaso de precipitados se colocan 2 g de carbonato sódico y 2 g de café soluble instantáneo.[2] Se añaden 9 ml de agua desionizada muy caliente y se agita la mezcla hasta ebullición. A continuación, la mezcla se deja enfriar hasta temperatura ambiente.
El contenido del vaso de precipitado se vierte en un tubo de centrífuga de 15 ml, se le añaden 2 ml de cloruro de metileno (CH2Cl2), se cierra el tubo y se agita vigorosamente durante 1 min. A continuación, se centrifuga durante 90 s. Se separa la disolución amarillenta de CH2Cl2 de la fase acuosa con ayuda de una pipeta Pasteur. Se repite la operación dos veces más.[3]
Los extractos orgánicos se reúnen y se secan sobre sulfato sódico anhidro (Na2SO4). Se elimina el sólido mediante filtración por gravedad. Se lava con unos ml más de disolvente el desecante en el filtro de papel y se reúne con el resto de CH2Cl2. La disolución se transfiere a un matraz previamente tarado, se elimina el disolvente en el rotavapor y finalmente se pesa el matraz y se calcula la cafeína obtenida. La cafeína se puede purificar por recristalización de EtOH.
Propiedades fisico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Cafeína | 194.19 | 234-236.5 | - | 1.230 |
| CH2Cl2 | 84.93 | -97 | 40.0 | 1.33 |
| EtOH | 46.07 | -114.1 | 78.5 | 0.790 |
| Na2CO3 | 105.99 | 851 | - | 2.532 |
| Na2SO4 | 142.04 | 884 | - | 2.630 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Cafeína |  |
| CH2Cl2 |  |
| EtOH |  |
| Na2CO3 |  |
| Na2SO4 | No peligroso |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Cafeína | RYYVLZVUVIJVGH-UHFFFAOYSA-N |
| CH2Cl2 | YMWUJEATGCHHMB-UHFFFAOYSA-N |
| EtOH | LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Na2CO3 | CDBYLPFSWZWCQE-UHFFFAOYSA-L |
| Na2SO4 | PMZURENOXWZQFD-UHFFFAOYSA-L |
Referencias y notas
[1] Proceso en el que se congela el producto y posteriormente se hace el vacío para eliminar el agua por sublimación.
[2] De esta forma nos aseguramos que ninguno de los hidrógenos estará protonado, lo cual facilitará su disolución en un disolvente orgánico.
[3] Alternativamente se puede realizar la separación de las dos fases por decantación, pero resulta menos eficaz.
Volver a la página de prácticas de Operaciones Básicas de Laboratorio.
