Written by J.A. Dobado | Last Updated on 1 año
Ir a la página con el listado de problemas.
Alcanos – soluciones a los problemas
Solución 1:
a) Sólo existen tres isómeros: el n-pentano (I), el 2-metilbutano (II) y el 2,2-dimetilpropano (III).
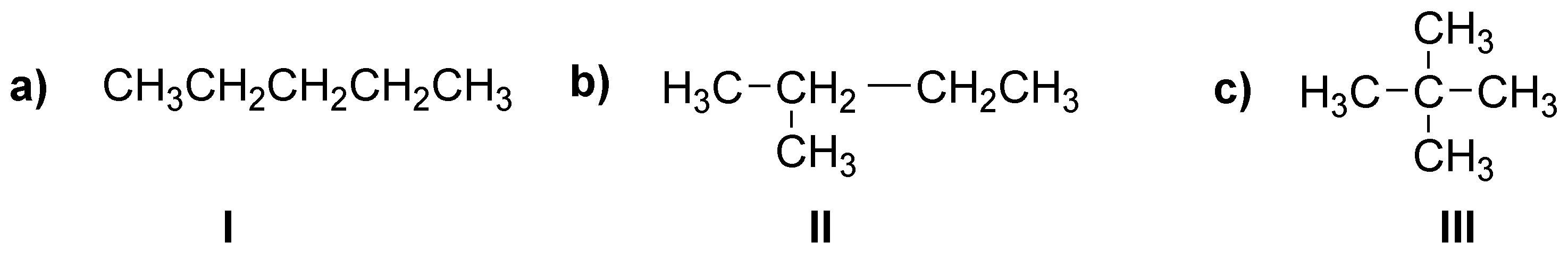
b) Serán primarios todos los hidrógenos metílicos (CH3), secundarios los metilénicos (CH2) y terciarios los metínicos (CH).
c) El único isómero que posee un solo tipo de hidrógenos y por tanto dará un solo producto de monobromación será el 2,2-dimetilpropano (III).
Solución 2:
Solución 3:
La halogenación radicalaria de alcanos y cicloalcanos depende de:
- La naturaleza del hidrocarburo
- El número de hidrógenos de una misma clase
- El halógeno empleado
Para el propano la reacción de cloración es el resultado de la sustitución de un hidrógeno en posición primaria en un 45%, y un hidrógeno en posición secundaria en un 55%, a pesar de que la relación entre hidrógenos primarios y secundarios es 3:1 (el propano presenta 6 hidrógenos primarios (2×(CH3-) y 2 hidrógenos secundarios (-CH2-)). Luego, para la cloración, las reactividades relativas de los hidrógenos serán:
Reactividad primario = rendimiento/nº de hidrógenos primarios = 45/6 = 7.5 Reactividad secundario = rendimiento/nº de hidrógenos secundarios = 55/2 = 27.5
Dividiendo por el menor valor:
Reactividad relativa secundario/primario = 3.66/1
Para la bromación, el producto mayoritario es el que proviene de la sustitución de un hidrógeno secundario.Dado que la entalpía de disociación para Cl2 y Br2 es similar (58 kcal/mol y 46 kcal/mol, respectivamente), la diferencia fundamental entre ambas reacciones está en el proceso abstracción del átomo de hidrógeno. Para la bromación, por tanto, las reactividades relativas de los hidrógenos serán:
Reactividad primario = rendimiento/nº de hidrógenos primarios = 3/6 = 0.5 Reactividad secundario = rendimiento/nº de hidrógenos secundarios = 97/2 = 48.5
Dividiendo por el menor valor:
Reactividad relativa secundario/primario = 97/1
Procediendo de igual forma para el 2-metilpropano determinamos las reactividades relativas de los hidrógenos terciarios respecto a los primarios:
Para la cloración:
Reactividad primario = rendimiento/nº de hidrógenos primarios = 64/9 = 7.1 Reactividad terciario = rendimiento/nº de hidrógenos terciarios = 36/1 = 36.0
Dividiendo por el menor valor:
Reactividad relativa terciario/primario = 5.1/1
Para la bromación:
Reactividad primario = rendimiento/nº de hidrógenos primarios = 1/9 = 0.1 Reactividad terciario = rendimiento/nº de hidrógenos terciarios = 99/1 = 99.0
Dividiendo por el menor valor:
Reactividad relativa terciario/primario = 990/1
La explicación hay que buscarla en la teoría de colisiones. Cuando se forma el radical X·, la probabilidad de choque con hidrógenos primarios es mayor que con hidrógenos secundarios (factor estadístico), pero la energía de activación para la formación del 1-halopropano es mayor que la de la formación del 2-halopropano. Se necesita menos energía para formar el radical secundario que el primario. Pequeñas diferencias en la energía de activación se traducen en que un camino de reacción predomine sobre otro (factor energético).
Por otro lado, aunque los radicales Cl· y Br· presentan una estabilidad muy diferente (El Cl· es mucho menos estable que el Br·). Su tendencia a colisionar de forma efectiva “con cualquier” hidrógeno compensa parte del factor energético, por lo que aumenta la proporción de producto de sustitución en posición primaria.
Solución 4:
La monocloración del 2,3-dimetilbutano viene dada por la siguiente ecuación:
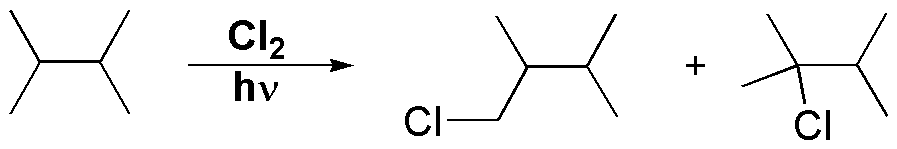
El 2,3-dimetilbutano presenta un total de 12 hidrógenos primarios y 2 hidrógenos terciarios. La reactividad relativa de cada uno de los diferentes tipos de hidrógenos se puede calcular a partir de los datos de la cloración del 2-metilpropano. Esta molécula tiene el mismo tipo de hidrógenos, con 9 hidrógenos primarios 3×(CH3-), y un hidrógeno terciario (>CH-). La reactividad correspondiente a cada hidrógeno será:
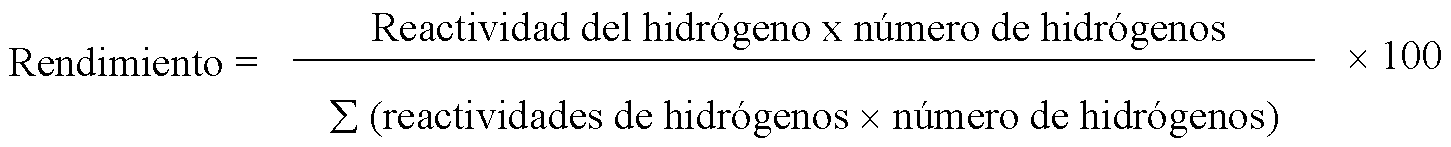
En el 2,3-dimetilbutano el rendimiento se obtiene aplicando la misma fórmula, que para la formación del 1-cloro-2,3-dimetilbutano es:
rendimiento (%) = [(1×12)/(1×12 + 5×2)] × 100 = 54.5%
y para el 2-cloro-2,3-dimetilbutano es:
rendimiento (%) = [(5×2)/(1×12 + 5×2)] × 100 = 45.5%
Solución 5:
Para el propano será en 2-bromopropano, para el butano en 2-bromobutano, para el 2-metilpropano el 2-bromo-2-metilpropano, para el ciclopentano el Bromociclopentano y para el metilciclopentano el 1-bromo-1-metilciclopentano.
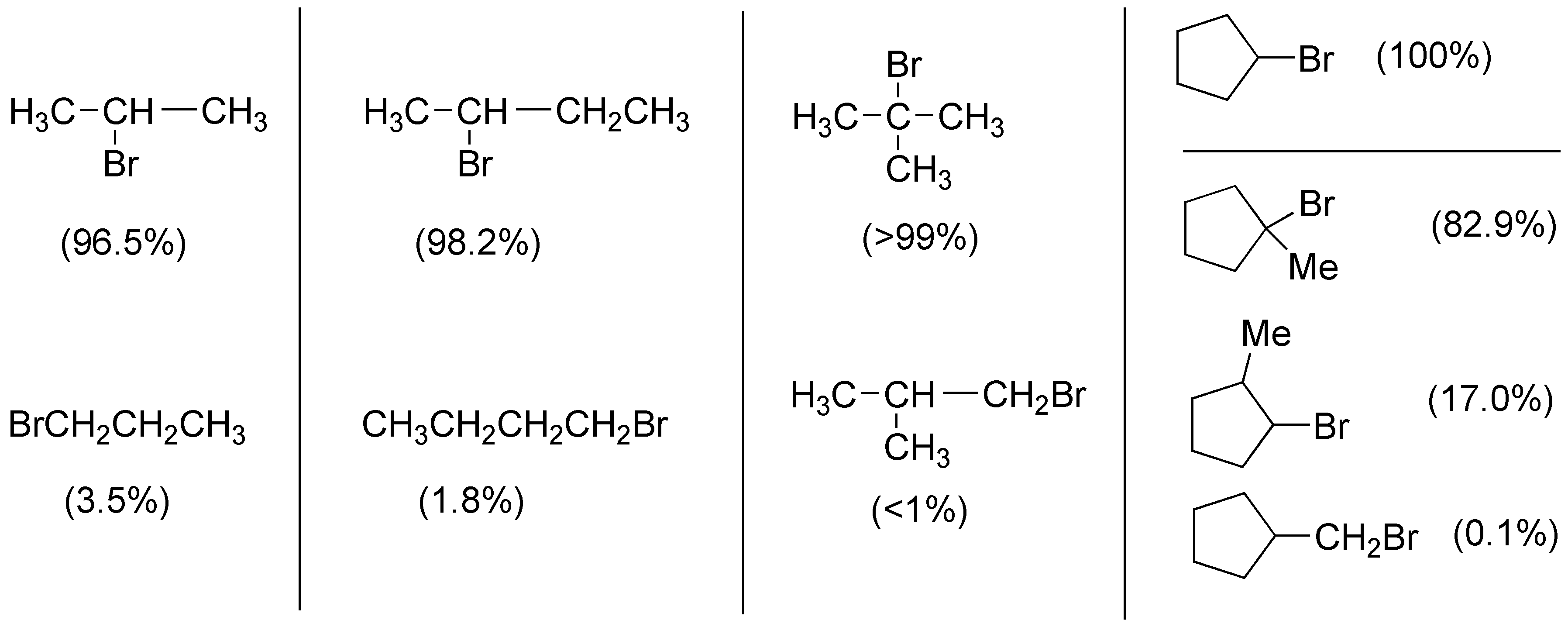
Solución 6:
I) El 3-metilpentano tiene 9 hidrógenos primarios, correspondientes a los 3 metilos de los extremos 3×(CH3-), 4 hidrógenos secundarios de los dos metilenos -CH2– y 1 hidrógeno terciario en la posición 3 de la cadena que da lugar al radical más estable y por tanto, el que genera el producto de sustitución.
II) El etilciclohexano presenta 3 hidrógenos primarios, 12 secundarios y un único hidrógeno terciario, el del carbono unido al grupo etilo, que será el que dé lugar al producto de sustitución.
III) El 2,3,4-trimetilpentano tiene 15 hidrógenos primarios y 3 terciarios, estos últimos de dos tipos (con una relación 2:1), por lo que la reacción de bromación radicalaria debe dar una mezcla cercana al 66% de 2-bromo-2,3,4-trimetilpentano (IIIa) y 33% de 3-bromo-2,3,4-trimetilpentano (IIIb).
IV) El compuesto 2,2,4-trimetilhexano tiene 15 hidrógenos primarios, 4 secundarios y un único hidrógeno terciario por lo que el producto mayoritario de la reacción será el 4-bromo-2,2,4-trimetilhexano.
V) El 1,1,2,3,3,4-hexametilciclopentano tiene dos hidrógenos terciarios en posiciones 2 y 4, dos hidrógenos secundarios en el metileno de la posición 5 y 18 hidrógenos primarios de los metilos. La reacción de bromación da una mezcla de 1-bromo-1,2,2,3,5,5-hexametilciclopentano y 1-bromo-1,2,2,3,4,4- hexametilciclopentano.
VI) El alcano 2,2,3,3-tetrametilbutano sólo tiene 18 hidrógenos primarios, con lo cual el producto de la monobromación de dicho compuesto dará como producto 1-bromo-2,2,3,3-tetrametilbutano.
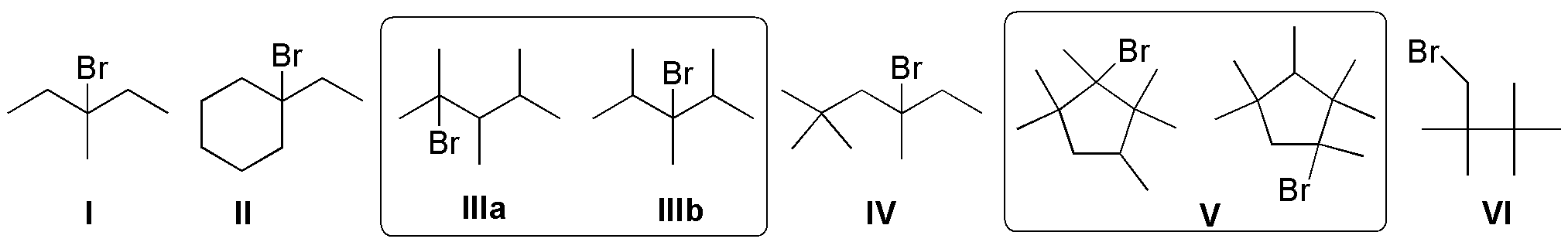
Solución 7:
El 2,4-dimetilpentano es una molécula simétrica, por lo que el número de isómeros constitucionales se reduce.
![]()
La forma más segura de resolver el problema es ir situando los átomos de cloro de izquierda a derecha a lo largo de la cadena principal, en principio no equivalentes:
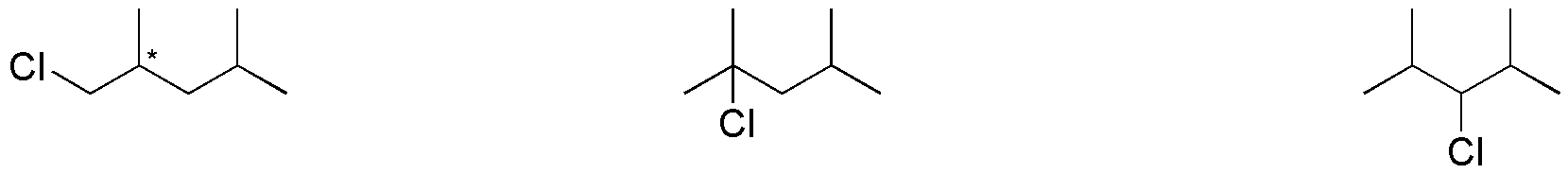
De esta forma, obtenemos las 3 estructuras que se indican en la figura anterior: el 1-cloro-2,4-dimetilpentano, el 2-cloro-2,4-dimetilpentano y el 3-cloro-2,4-dimetilpentano, respectivamente. Cualquier otra sustitución de cloro resulta coincidente con alguna de las opciones anteriores.
Respecto a la quiralidad de los productos obtenidos, para el 1-cloro-2,4-dimetilpentano, el carbono de la posición 2 (indicado mediante un asterisco) está unido a cuatro sustituyentes diferentes (ClCH2-, (CH3)2CH2CH2-, CH3– y H-), es por tanto, un carbono quiral. En el resto de los productos de monocloración no se da esta circunstancia, por lo que no presenta carbonos quirales.
Solución 8:
El metilpropano presenta tres metilos, con un total de 9 hidrógenos primarios y un hidrógeno terciario en posición 2. Las posibilidades de sustitución de dos hidrógenos simultáneamente son:
- Sustitución de dos hidrógenos unidos a carbonos diferentes
- Sustitución de dos hidrógenos unidos a un mismo carbono
De la primera posibilidad, se deducen las dos estructuras del recuadro, y de la segunda opción el 1,1-diclorometilpropano.
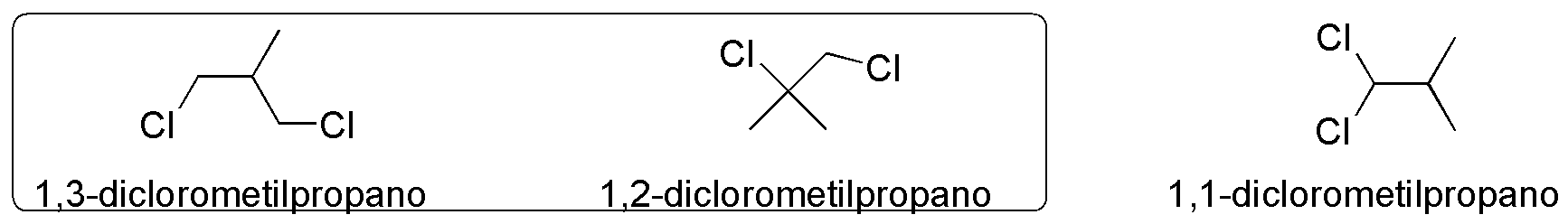
Solución 9:
Los productos de bromación serán tres:
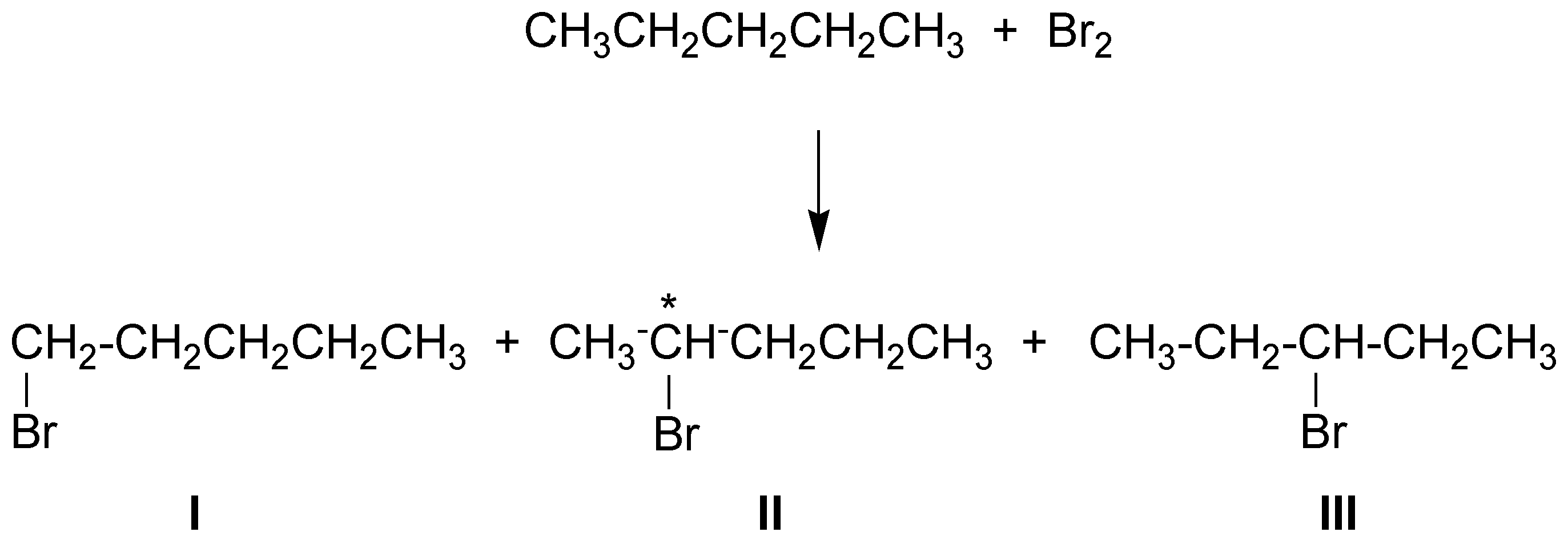
en el caso del 2-bromopentano al crearse un carbono asimétrico (el C-2) este aparecerá como racémico
Solución 10:
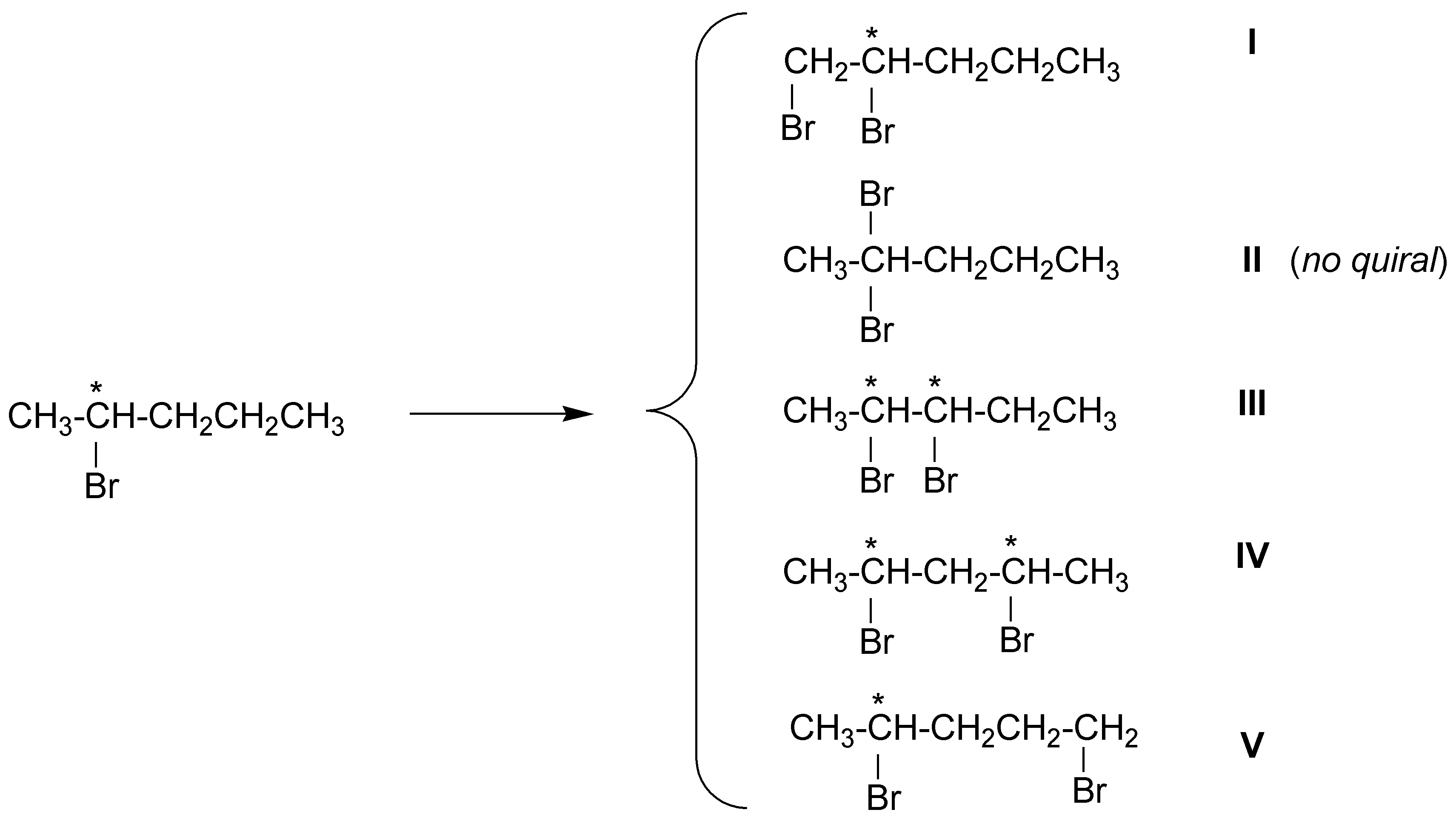
Teniendo en cuenta la reactividad relativa de los hidrógenos, se formará:
II > III ≈ IV > I ≈ V
y al haberse creado nuevos carbonos asimétricos los productos anteriores aparecerán como:
I y V como parejas de enantiómeros (mezclas racémicas).
III como 4 estereoisómeros.
IV como 3 estereoisómeros.
Solución 11:
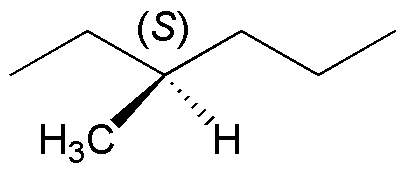
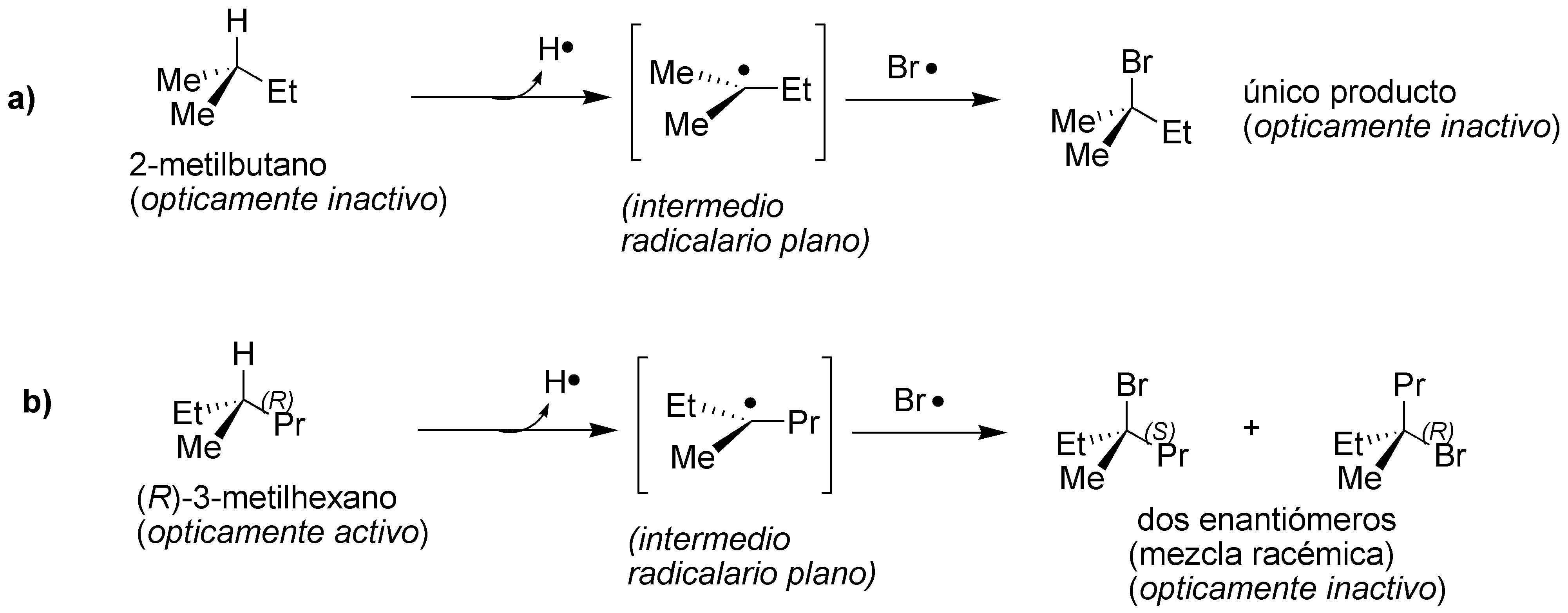
Si el producto de partida es enanioméricamente puro presentará actividad óptica. La reacción de monobromación conduce mayoritariamente al producto de sustitución en la posición 3, ya que el radical que se genera en dicha posición es terciario y la bromación, como se ha explicado con anterioridad, es altamente selectiva. La razón por la que se produce un crudo de reacción ópticamente inactivo se debe a la estructura del radical intermedio. Éste es plano y la probabilidad de ataque del radical bromo es la misma por una u otra cara del radical, con lo que se produce una racemización de la muestra.
Solución 12:
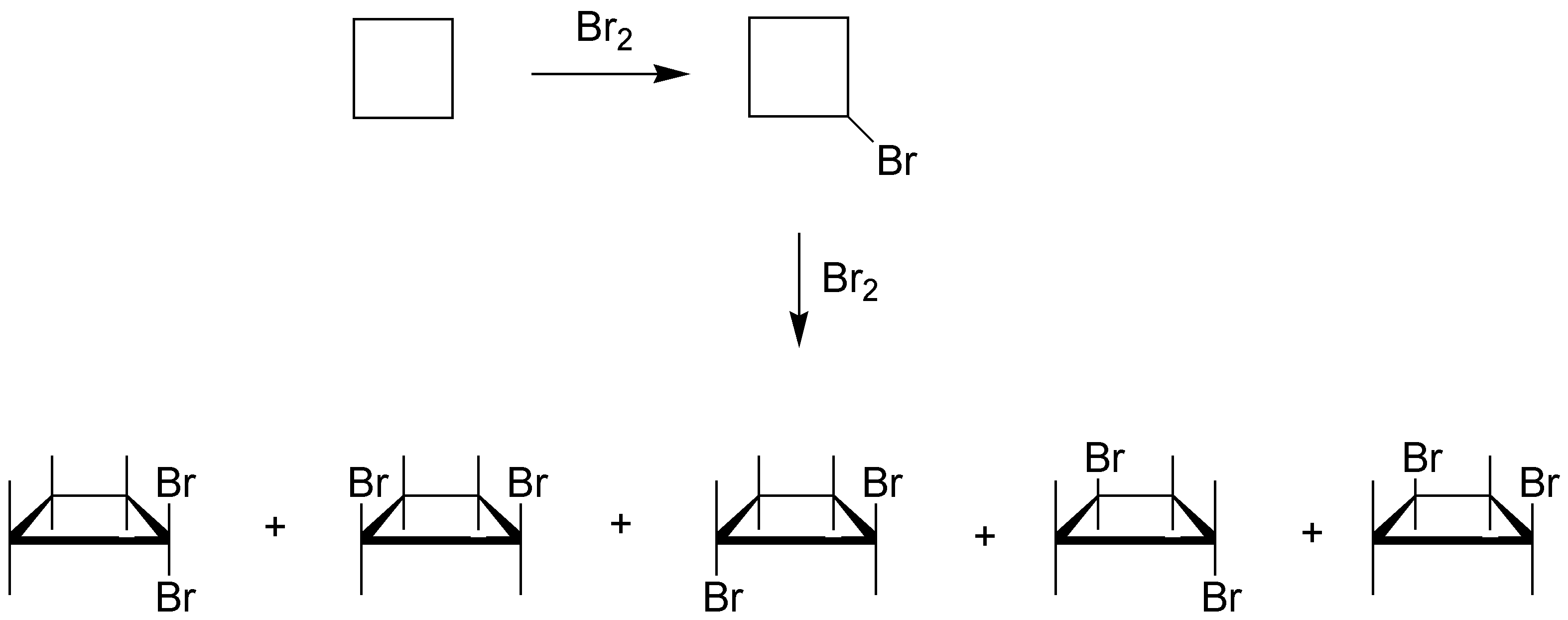
Solución 13:
Las reacciones de pirólisis en alcanos usando diversos tipos de catalizadores producen la rotura homolítica de los enlaces C-C. El proceso es aleatorio, por lo que se dan todas las posibilidades estadísticas:
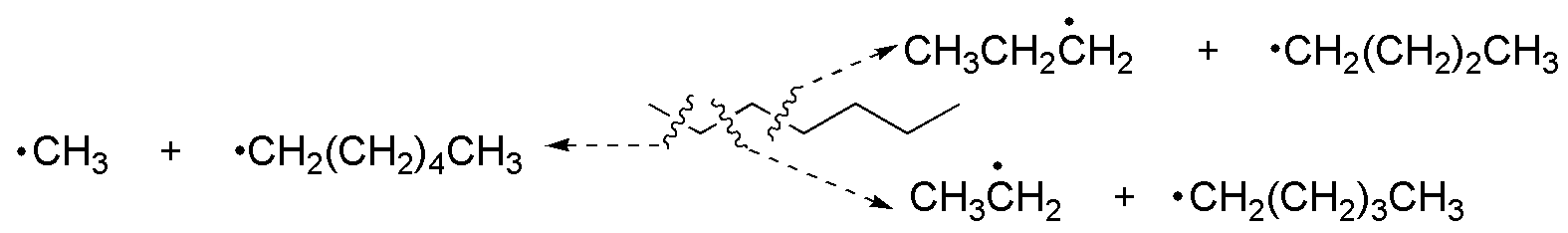
Se obtienen radicales metilo, etilo, propilo, butilo, pentilo y hexilo que pueden combinarse entre sí, para dar desde etano hasta dodecano. Todas las combinaciones posibles aparecen en la siguiente tabla.
Desde el punto de vista industrial, las combinaciones más interesantes son las que implican la formación de hidrocarburos de menor masa molecular que es el procedimiento que se emplea para la obtención de gasolina a partir de fracciones más pesadas del petróleo usando los catalizadores adecuados. En la siguiente tabla, se listan las combinaciones posibles de los fragmentos obtenidos en la pirólisis del heptano:
| metilo | etilo | propilo | butilo | pentilo | hexilo | |
|---|---|---|---|---|---|---|
| metilo | etano | |||||
| etilo | propano | butano | ||||
| propilo | butano | pentano | hexano | |||
| butilo | pentano | hexano | heptano | octano | ||
| pentilo | hexano | heptano | octano | nonano | decano | |
| hexilo | heptano | octano | nonano | decano | undecano | dodecano |
Además, de los alcanos, se generan alquenos por transferencia de hidrógeno de un radical a otro y formación de un doble enlace:
R’-CH2-CH2· + R· → R’-CH=CH2 + R-H
Solución 14:
La combustión completa (oxidación) del n-pentano da dióxido de carbono y agua. Para ajustarla, hay que proceder de la siguiente manera:
paso-1) El número de carbonos en CO2 debe ser el mismo que el número de carbonos en C5H12 (n-pentano)
C5H12 + O2 → 5CO2 + H2O
paso-2) El número de hidrógenos en el H2O debe ser el mismo que el de hidrógenos en C5H12
C5H12 + O2 → 5CO2 + 6H2O
paso-3) El número de oxígenos en CO2 y H2O (16) debe ser el mismo que el del O2
C5H12 + 😯2 → 5CO2 + 6H2O
Solución 15:
Procediendo igual que en el caso anterior.
paso-1) El número de carbonos en CO2 debe ser el mismo que el número de carbonos en C6H14 (n-hexano)
C6H14 + O2 → 6CO2 + H2O
paso-2) El número de hidrógenos en el H2O debe ser el mismo que el de hidrógenos en C6H14
C6H14 + O2 → 6CO2 + 7H2O
paso-3) El número de oxígenos en CO2 y H2O (19) debe ser el mismo que en O2
C6H14 + 9.5O2 → 6CO2 + 7H2O
paso-4) Para evitar un número fraccionario se multiplican todos los términos por 2
2C6H14 + 19O2 → 12CO2 + 14H2O
Solución 16:
En una combustión incompleta el producto de la reacción es CO y agua. Procederíamos igual que en los casos anteriores:
paso-1) El número de carbonos en CO debe ser el mismo que el número de carbonos en C8H18 (isooctano)
C8H18 + O2 → 8CO + H2O
paso-2) El número de hidrógenos en el H2O debe ser el mismo que el de hidrógenos en C8H18 (isooctano)
C8H18 + O2 → 8CO + 9H2O
paso-3) El número de oxígenos en CO2 y H2O (17) debe ser el mismo que en O2
C8H18 + 8.5O2 → 8CO + 9H2O
paso-4) Para evitar un número fraccionario se multiplican todos los términos por 2
2C8H18 + 17O2 → 16CO + 18H2O
Solución 17:
Se formarían los siguientes productos:
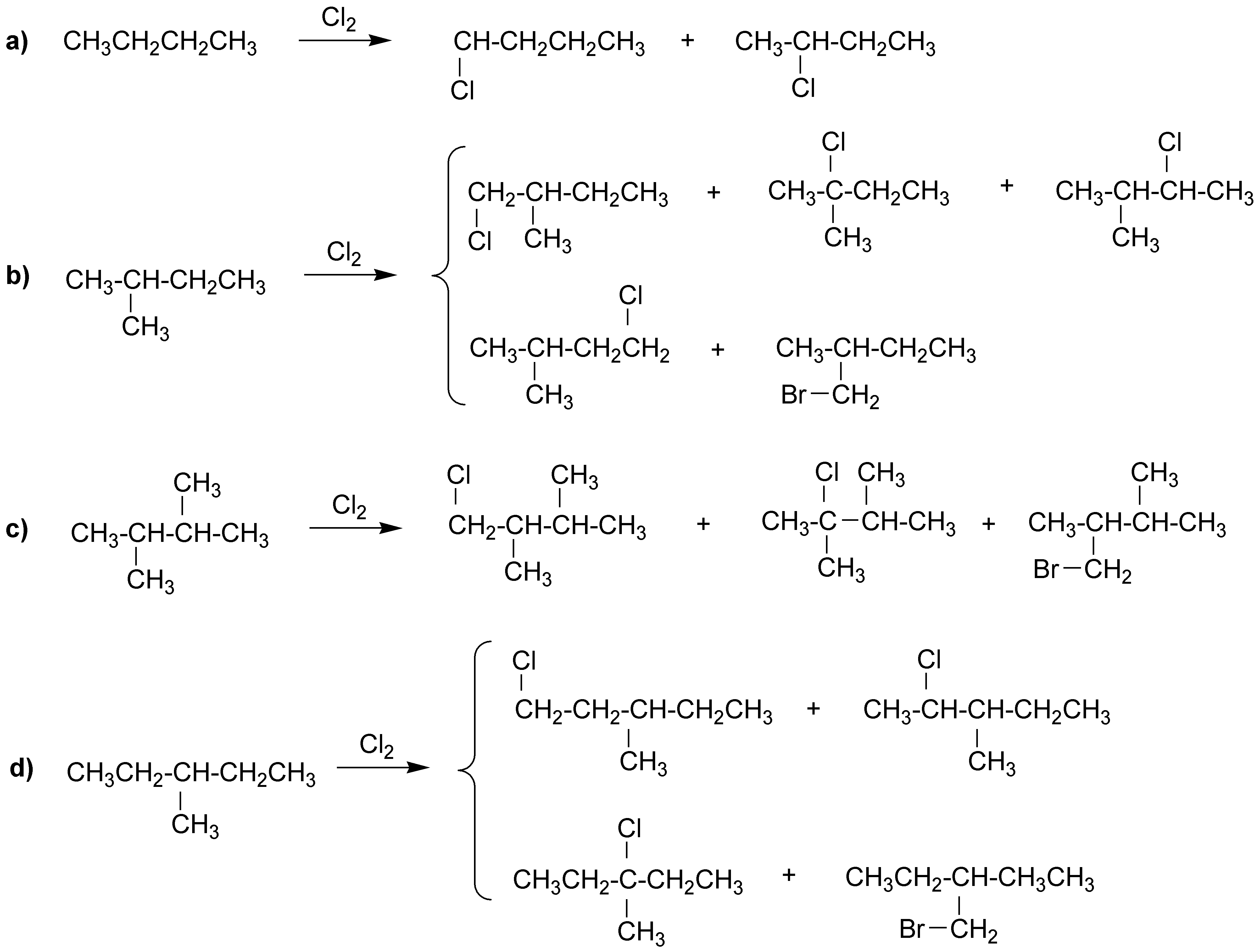
Para calcular las proporciones de cada isómero debemos tener en cuenta las reactividades relativas 1º/2º/3º = 1/3.66/5.1. Tendríamos entonces:
a) 1-Clorobutano: 29.07% y 2-clorobutano: 70.93%
b) 1-cloro-2-metilbutano: 28%; 2-cloro-2-metilbutano: 23.8%; 2-cloro-3-metilbutano: 34.2% y 1-cloro-3-metilbutano: 14%
c) 1-Cloro-2,3-dimetilbutano: 54% y 2-Cloro-2,3-dimetilbutano: 46%.
d) 1-Cloro-3-metilpentano: 20.88%; 2-Cloro-3-metilpentano: 50.94%; 3-Cloro-3-metilpentano: 17.75% y 1-Cloro-3-etilbutano: 10.44%.
Solución 18:
Se formarían los siguientes productos:
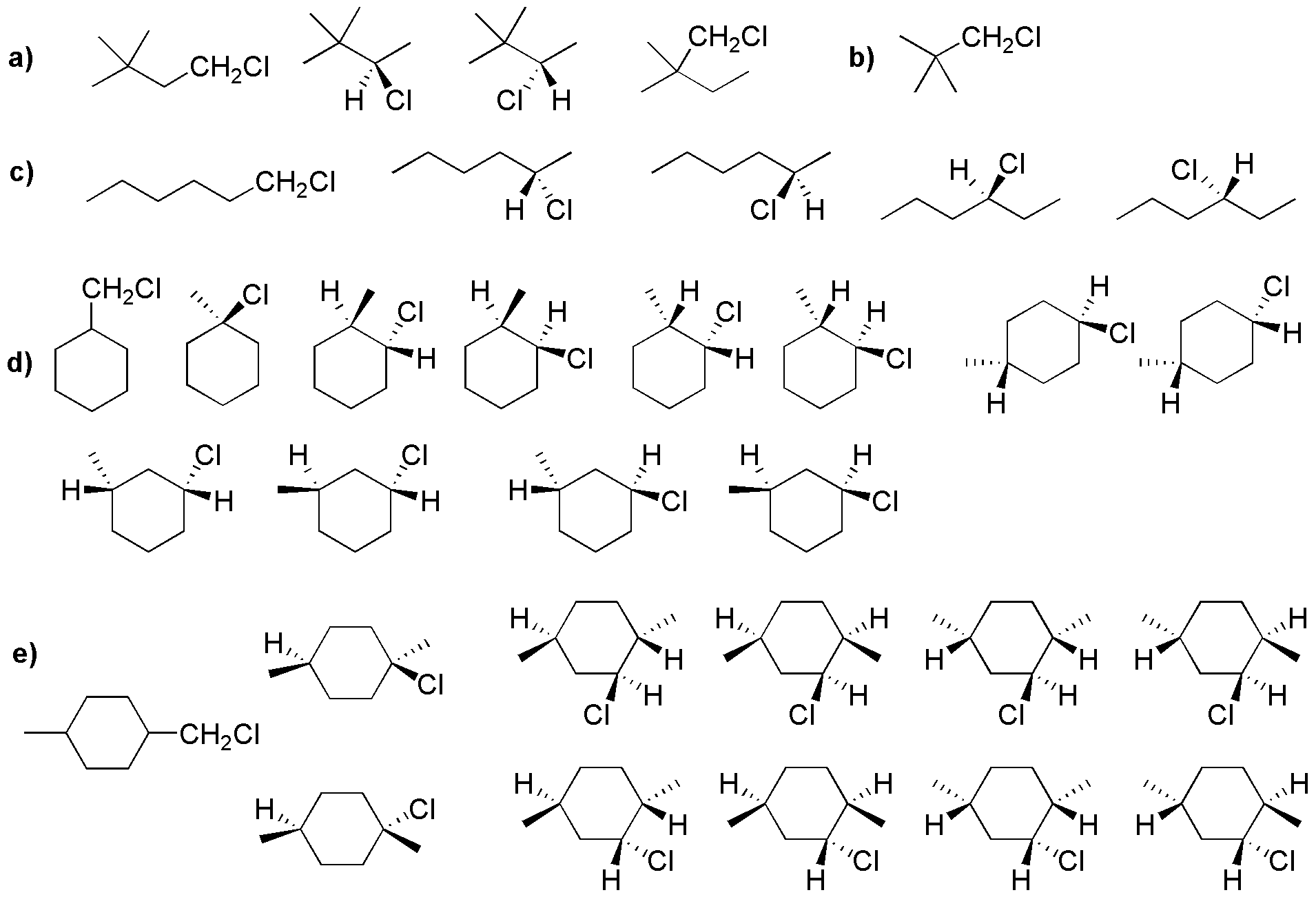
Solución 19:
De la monocloración del 2,4-dimetilpentano se obtienen los 4 productos indicados en la figura, siendo enantiómeros los dos primeros. Sin embargo, el crudo de la mezcla no presentaría poder óptico rotatorio, ya que se obtiene la misma cantidad del R y del S.
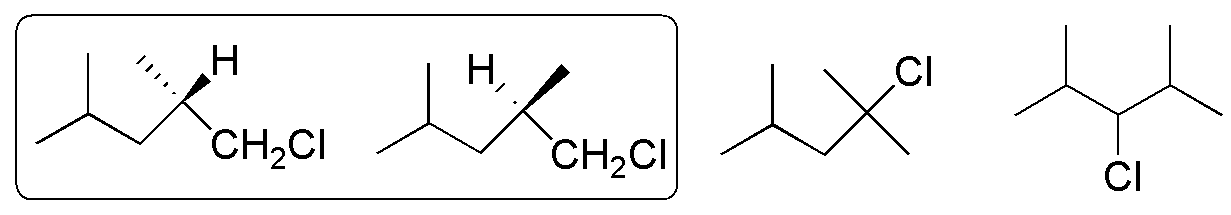
Solución 20:
Se obtienen 16 productos dibromados, de los cuales los 15 resaltados por recuadros presentan carbonos quirales.
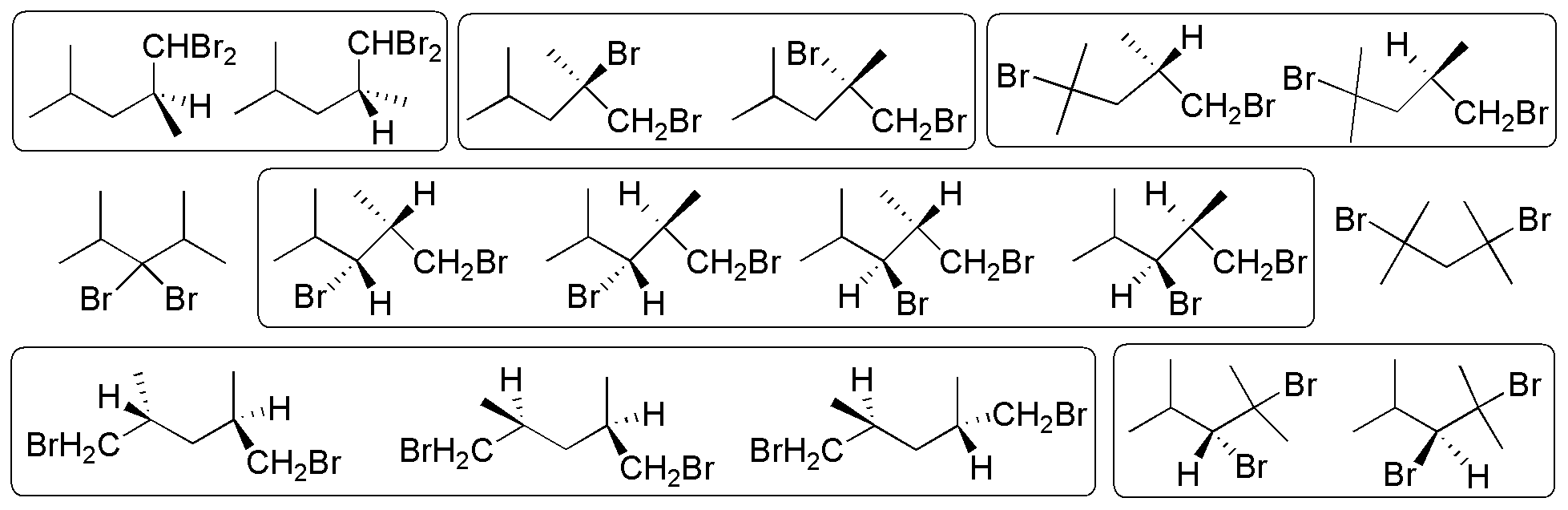
Solución 21:
Teniendo en cuenta que en el butano tenemos 6 hidrógenos primarios y 4 secundarios las reactividades relativas serán:
| Hidrógenos primarios | Hidrógenos secundarios | Reactividad de los hidrógenos | Reactividad relativa secundario/primario | ||
|---|---|---|---|---|---|
| 6 | 4 | primarios = 28 / 6 = 4.6 | 18 / 4.6 = 3.9 1 : 3.9 | ||
| secundarios = 72 / 4 = 18 | |||||
Solución 4.22:
De igual forma que en el caso anterior, para el 2-metilbutano tendremos:
| Hidrógenos primarios (CH3)2 | Hidrógenos primarios CH3 | Hidrógenos secundarios CH2 | Hidrógenos terciarios CH | Reactividad de los hidrógenos | Reactividad relativa 3º : 2º : 1º : 1º | |
|---|---|---|---|---|---|---|
| 6 | 3 | 2 | 1 | primarios (CH3)2– 27 / 6 = 4.5 | 5.1 : 4 : 1 : 1 | |
| primarios CH3– 14 / 3 = 4.6 | ||||||
| secundarios -CH2– 36 / 2 = 18.0 | ||||||
| terciarios -CH- 23 / 1 = 23.0 | ||||||
Solución 23:
Para el 2,2,4-trimetilpentano los productos obtenidos y su proporción serán:
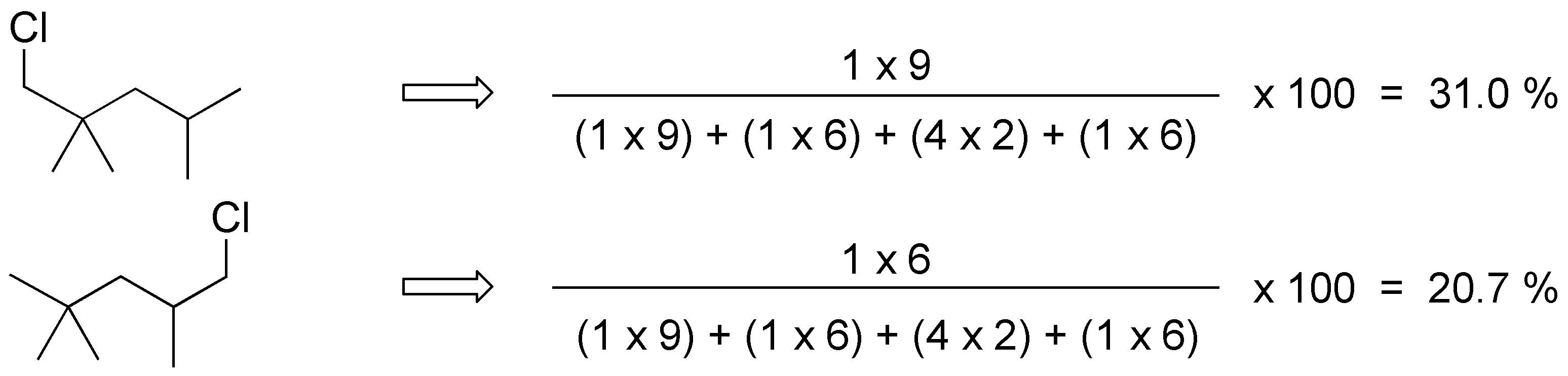
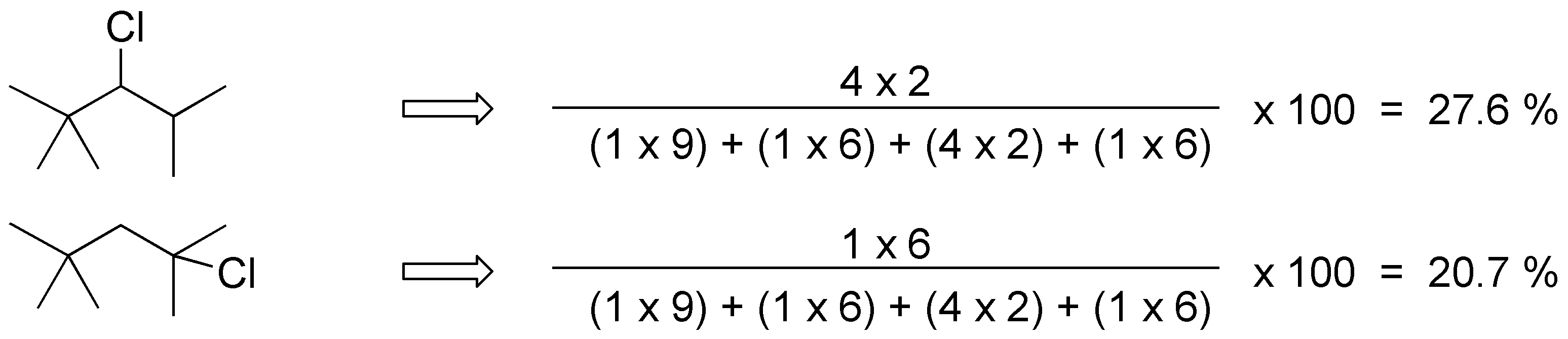
Solución 24:
Teniendo en cuenta las reactividades relativas los productos mayoritarios serán:
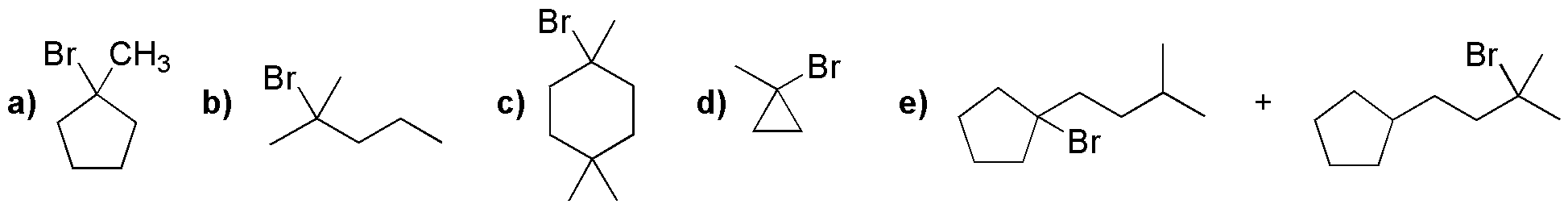
Solución 25:
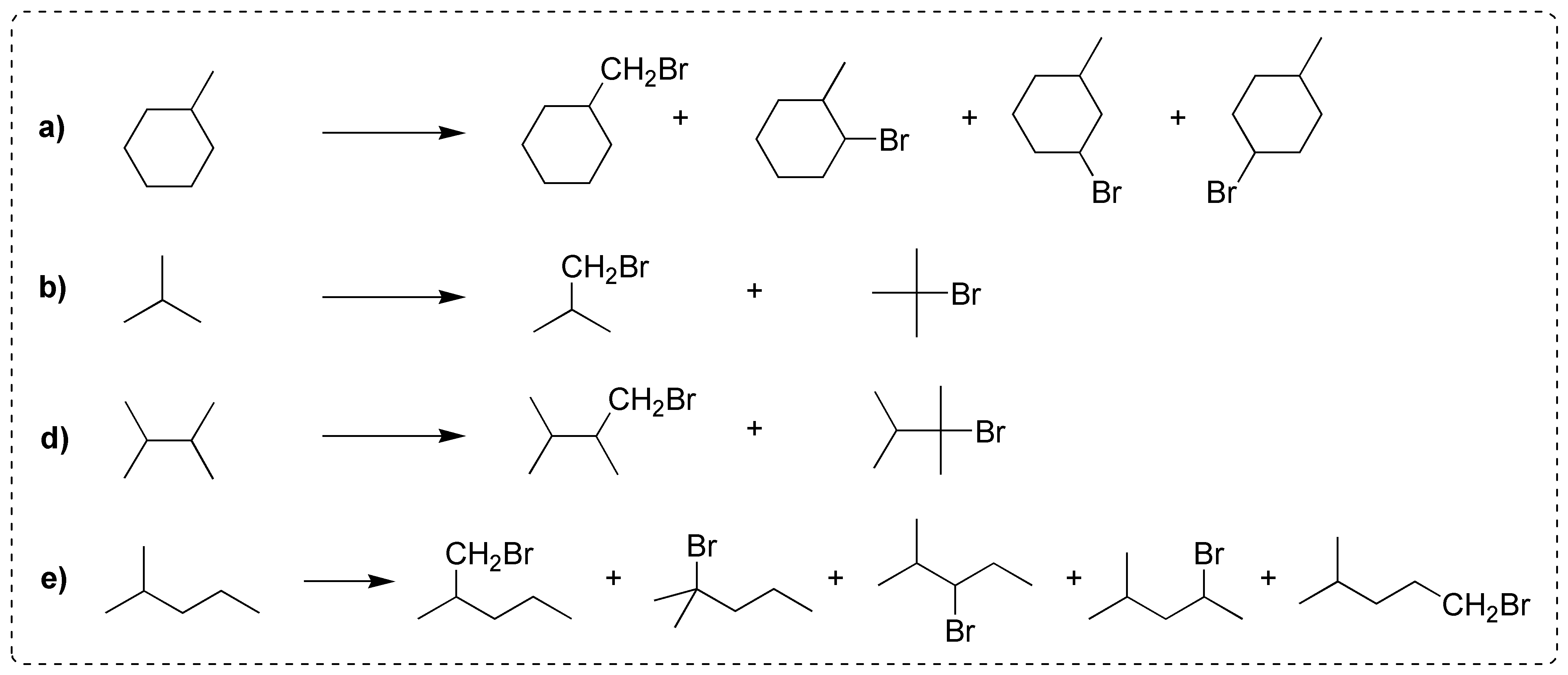
La mejor elección sería los compuestos c y f, porque dan en la halogenación un único producto, ya que todos sus hidrógenos son equivalentes.
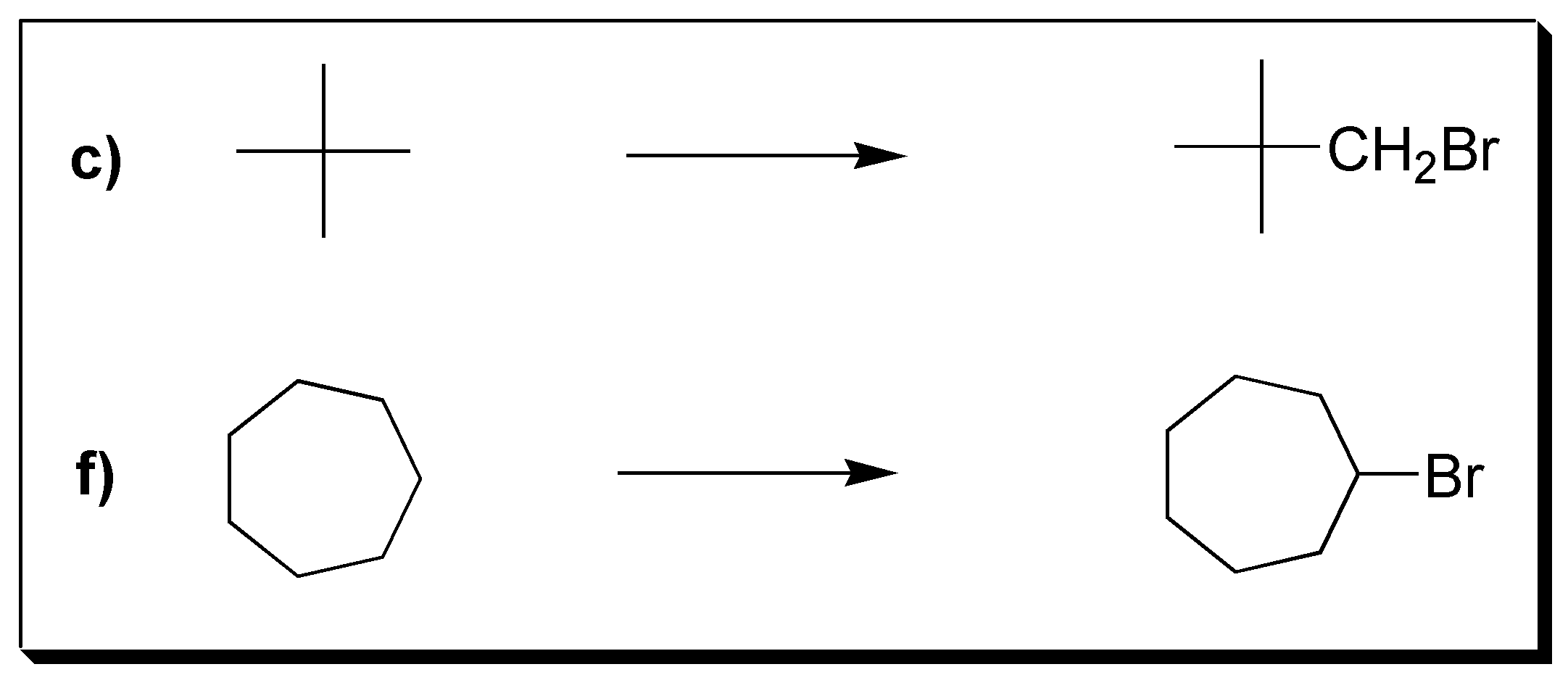
El resto da mezcla de productos, ya que tienen distintos tipos de hidrógenos (primarios, secundarios, terciarios).
Solución 26:
El radical intermedio que se forma en ambos casos es plano y su bromación radicalaria conlleva el ataque del radical Br· por las dos caras del intermedio, llevando a la formación de un único producto en a) y de una mezcla racémica en b). Ambos casos son ópticamente inactivos.
Solución 27:
a) La fragmentación del propano da los radicales metilo y etilo. Con la reacción de los mismos se pueden obtener etano, propano y butano.
b) En la fragmentación del pentano se obtienen los siguientes radicales: metilo, etilo, propilo y butilo. La recombinación de los mismos da los productos listados en la siguiente tabla:
| metilo | etilo | propilo | butilo | |
|---|---|---|---|---|
| metilo | etano | |||
| etilo | propano | butano | ||
| propilo | butano | pentano | hexano | |
| butilo | pentano | hexano | heptano | octano |
c) La pirólisis del 2,3-dimetilpentano conduce a la formación de: metilo, 1,2-dimetilpropilo e isopropilo. La recombinación de esos radicales se da en la siguiente tabla:
| metilo | 1,2-dimetilpropilo | isopropilo | |
|---|---|---|---|
| metilo | etano | ||
| 1,2-dimetilpropilo | 2,3-dimetilbutano | 2,3,4,5-tetrametilhexano | |
| isopropilo | 2,3,4-trimetilpentano | 2,2,3-trimetilbutano | 2,3-dimetilbutano |
Solución 28:
Teniendo en cuenta el balance de materia entre reactivos y productos se tendría:
2C4H10 + 13O2 → 8CO2 + 10H2O
Solución 29:
Teniendo en cuenta el balance de materia entre reactivos y productos se tendría:
2C12H26 + 25O2 → 24CO + 26H2O
