Written by José | Last Updated on 2 meses
Ir a la página con el listado de problemas.
Aldehídos y Cetonas – soluciones a los problemas
Solución 1:
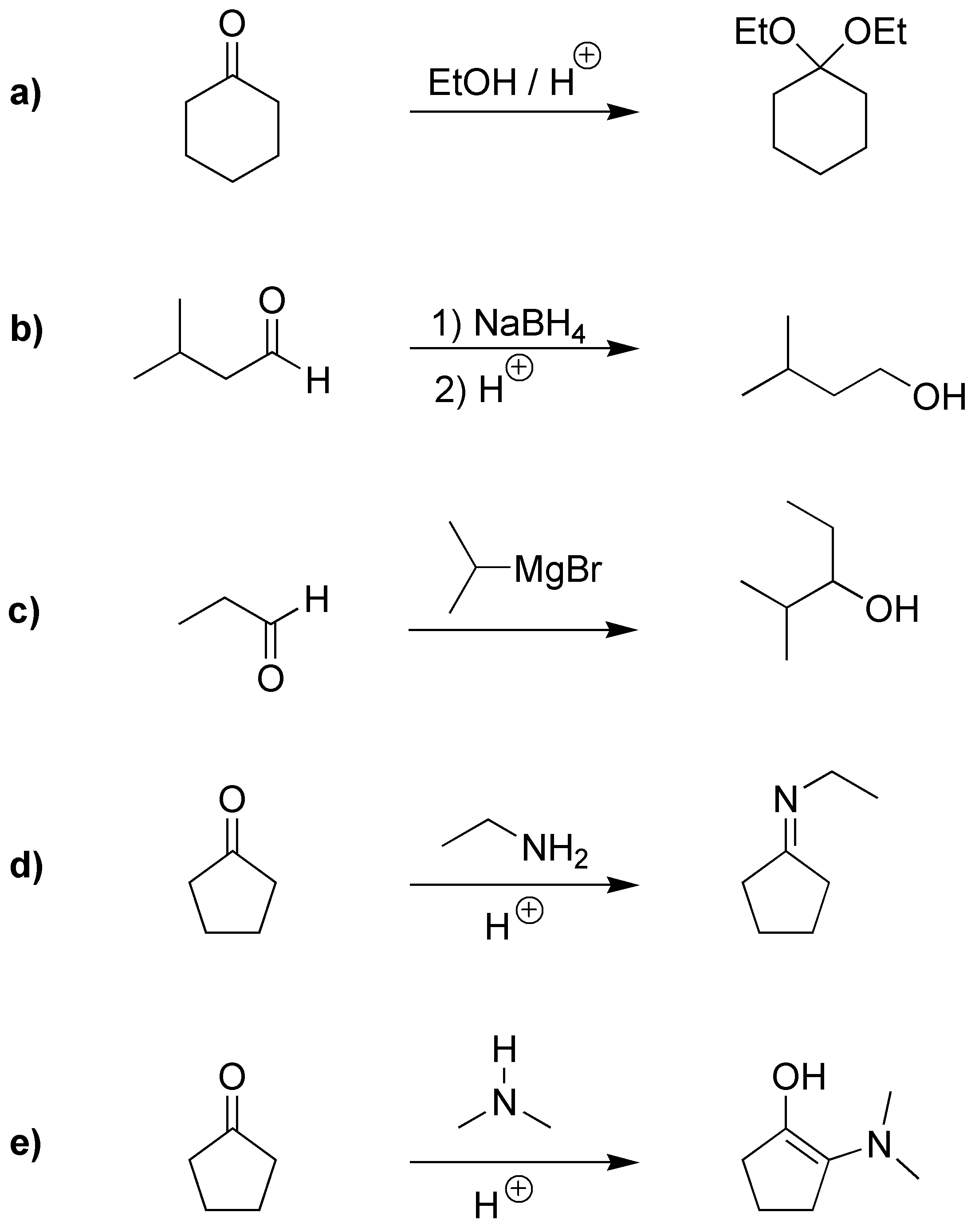
a) La hidratación de un aldehído o cetona da lugar a la formación del correspondiente hidrato. b) La reducción produce el correspondiente alcohol. c) Los compuestos de Grignard se adicionan nucleofílicamente a los aldehídos produciendo alcoholes secundarios. d) Las aminas primarias se adicionan a las cetonas produciendo iminas. e) Si la amina es secundaria se producen enaminas.
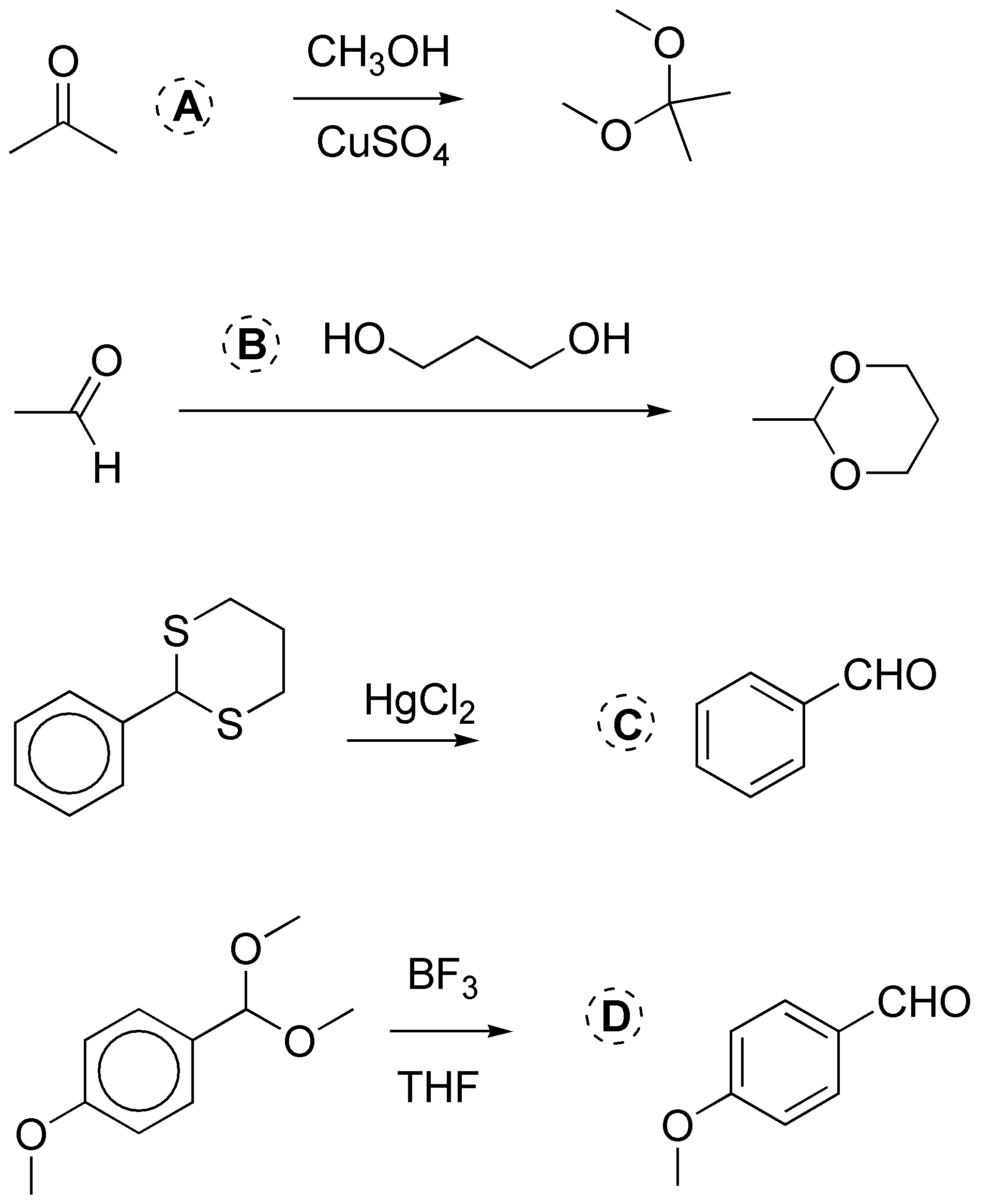
Solución 2:
a) Los aldehídos cuando se tratan con alcoholes en medio ácido se transforman en los correspondientes hemiacetales. Si la reacción continua, se transforman en el correspondiente acetal. b) Los hidroxialdehídos suelen encontrarse en equilibrio con su forma hemiacetálica. c) El HCN se adiciona a los aldehídos y cetonas formando la correspondiente cianhidrina.
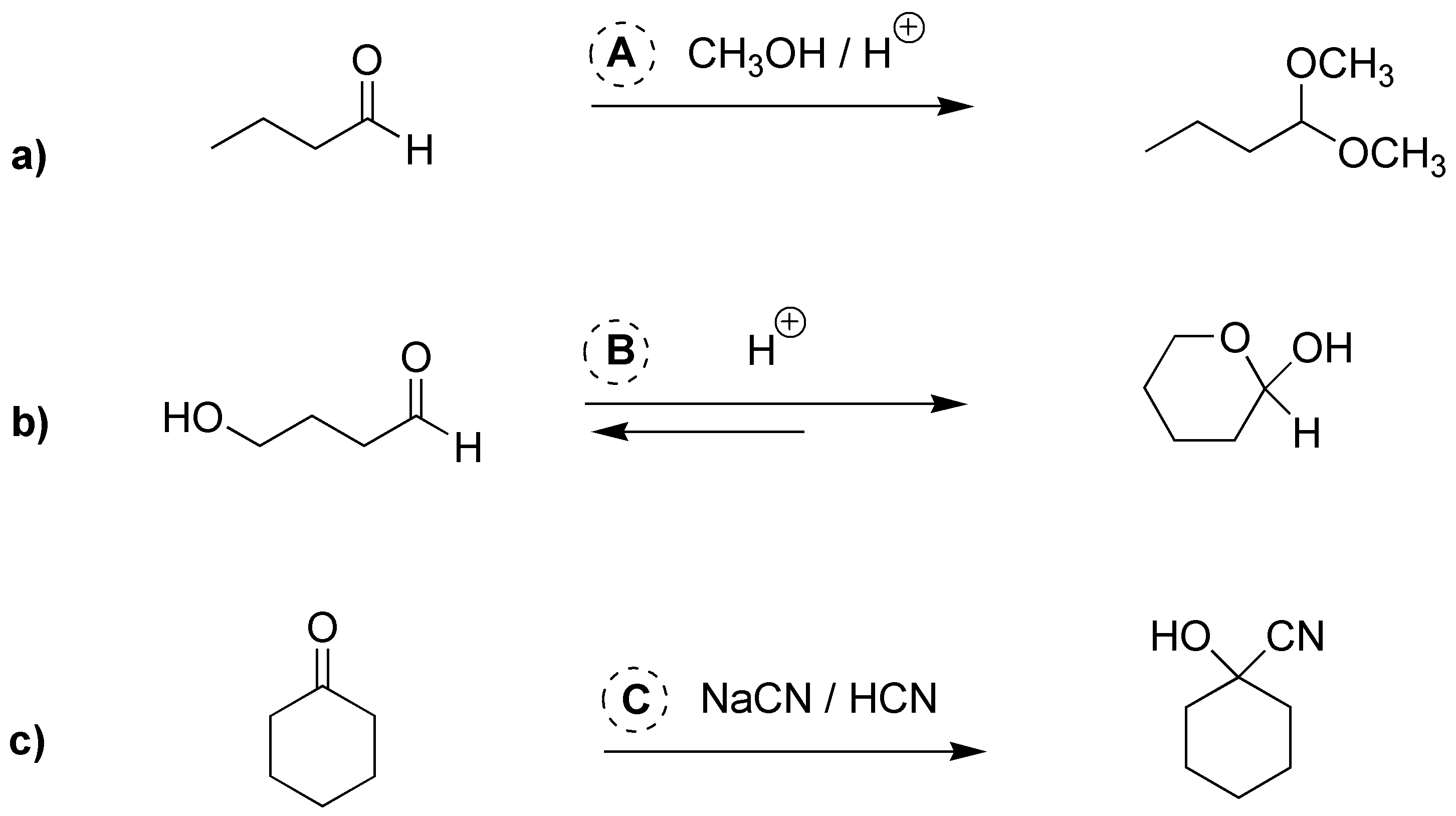
Solución 3:
a) Los aldehídos y cetonas reaccionan con tioles para formar los correspondientes tioacetales los cuales por hidrogenación catalítica producen el correspondiente alcano. Dando como resultado global de ambas reacciones la desoxigenación (reducción) hasta alcano. b) Los magnesianos (compuestos de Grignard) se adicionan a los carbonilos dando alcoholes. c) Las aminas primarias se adicionan a los carbonilos produciendo iminas. d) Los glicoles reaccionan con los aldehídos y cetonas produciendo cetales y acetales cíclicos.
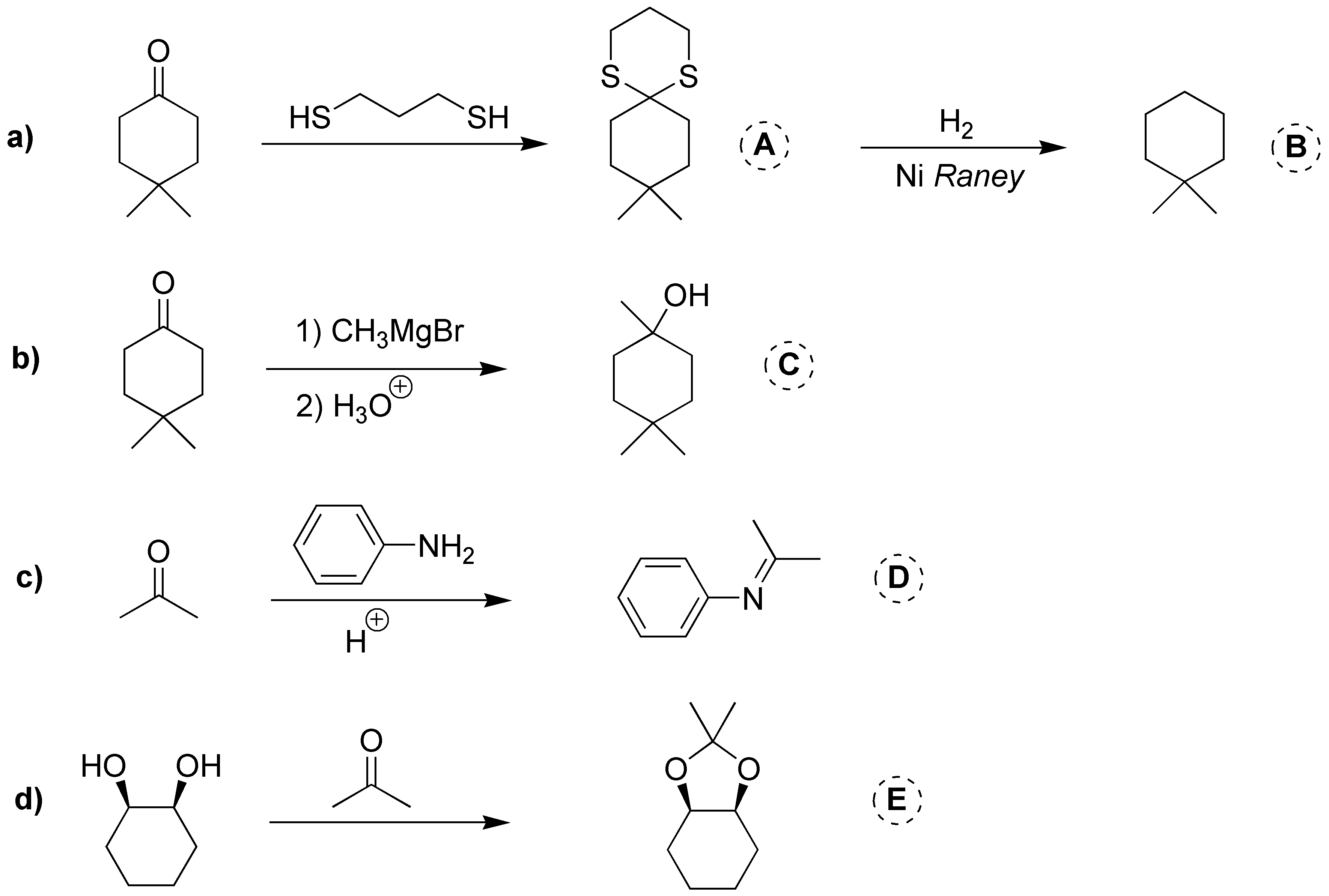
Solución 4:
a) Como el producto es una cianhidrina resultado de la adición de HCN a la ciclopentanona. b) La fenilhidrazina reacciona con las cetonas dando hidrazonas, luego B debe ser la 3-pentanona. c) El producto final es un acetal por lo que debe ser resultado de la adición de dos alcoholes a un compuesto carbonílico, 1,9-dihidroxi-5-nonanona. d) Al igual que los compuestos de Grignard, los organolíticos reaccionan con aldehídos para producir alcoholes secundarios, en este caso será el ciclohexilmetanal (ciclohexilcarbaldehído).
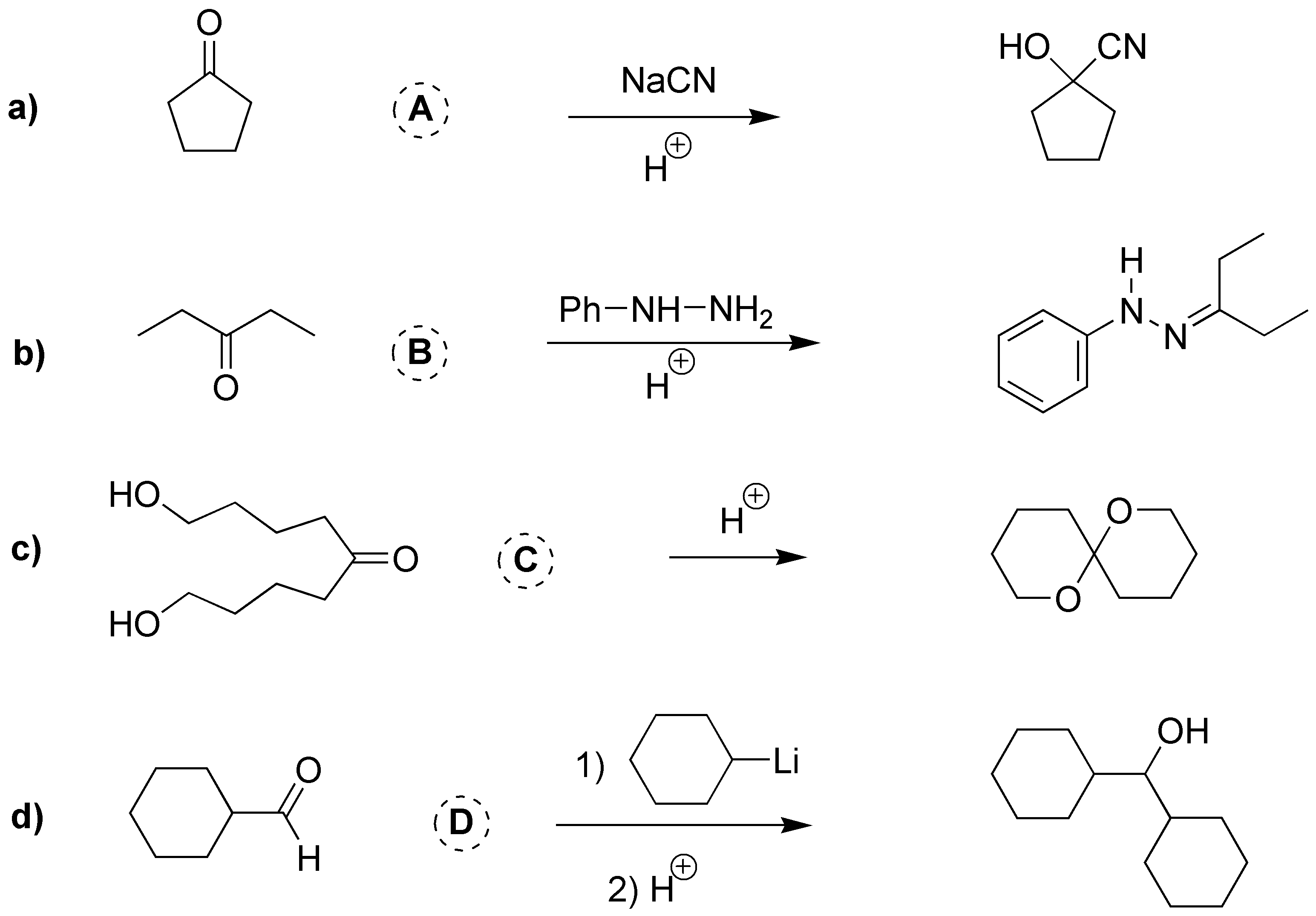
Solución 5:
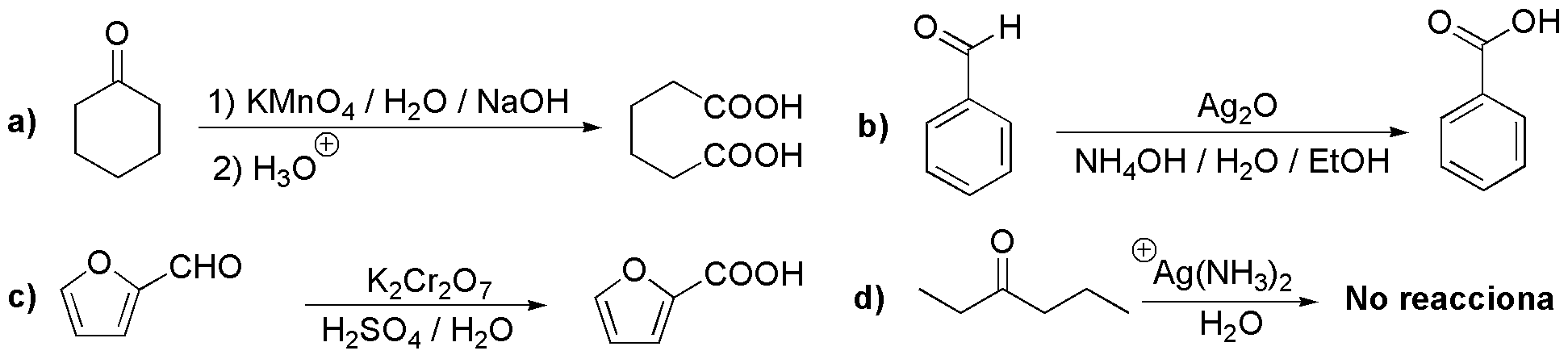
a) Para evitar las mezclas de productos de oxidación de cetonas, la oxidación con oxidantes fuertes se usa con cetonas simétricas que incluyen las cetonas cíclicas. Las cetonas cíclicas como la ciclohexanona, se oxidan al correspondiente ácido dicarboxílico.
b) y c) Los aldehídos como el benzaldehído, o el furfural, se oxidan a los ácidos correspondientes con agentes oxidantes suaves, Ag2O, o fuertes, KMnO4.
d) Sin embargo, contrariamente, las cetonas no reaccionan con agentes oxidantes suaves, Ag(NH3)2+.
Solución 6:
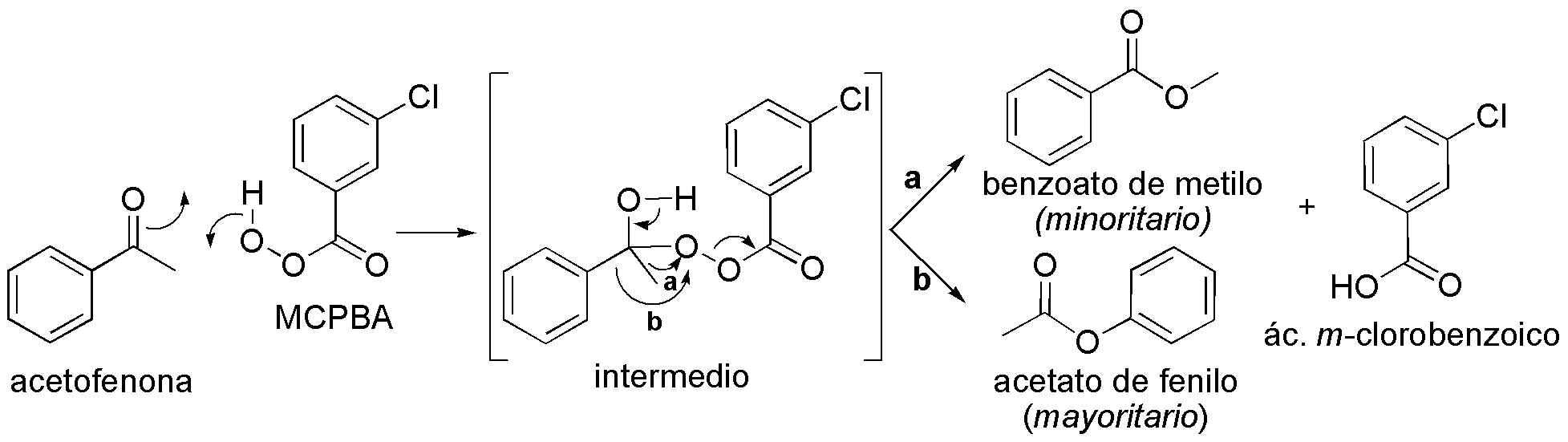
Es una oxidación de Baeyer-Villiger. El intermedio que se forma se describe en la figura. En principio, podrían migrar tanto el metilo, a, como el fenilo, b. Debido a que el orden de prioridad es mayor para el fenilo el producto mayoritario es el acetato de fenilo.
Solución 7:

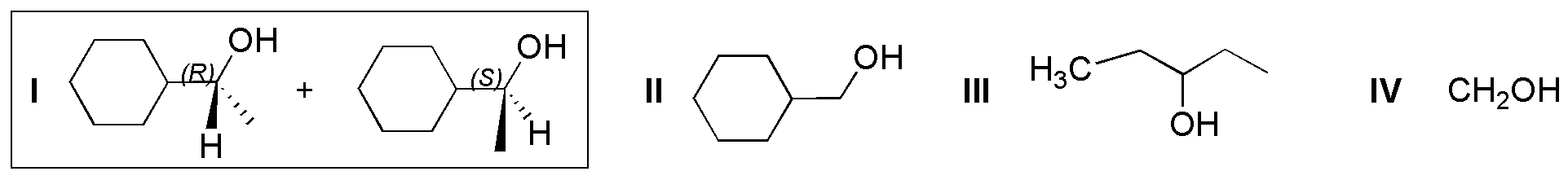
La hidrogenación catalítica transforma los aldehídos y cetonas en alcoholes. Hay que considerar que el doble enlace C=C es más reactivo que el carbonilo C=O, por lo cual ambos se reducirán si están presentes en la misma molécula (compuestos I y II). Además, si la cetona presenta dos sustituyentes distintos (I), se genera un carbono quiral que da lugar a un racémico (mezcla de los dos enantiómeros R y S).
Solución 8:
El LiAlH4 se utiliza junto con disolventes apróticos (éter etílico, THF, etc.) debido a que es muy reactivo (reacciona explosivamente con agua y alcoholes, liberando hidrógeno que puede ocasionar incendios). El LiAlH4 reduce con facilidad aldehídos y cetonas, pero tiene el inconveniente de que también puede reducir ésteres y ácidos carboxílicos. (Véase Tabla A6 de reductores y oxidantes).
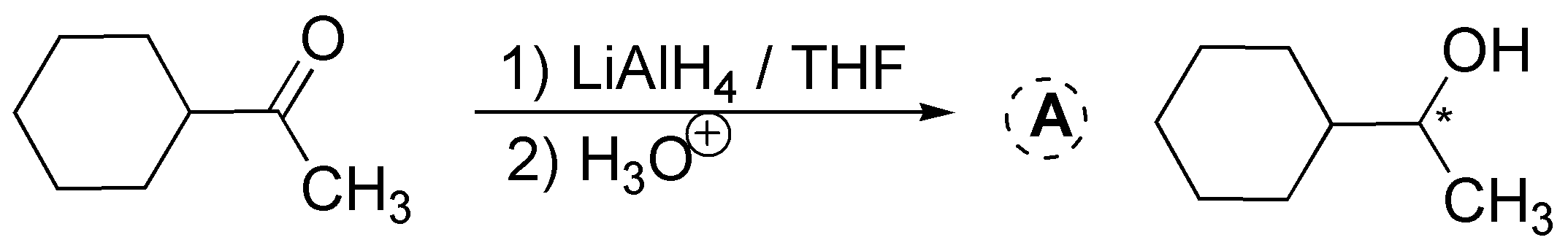
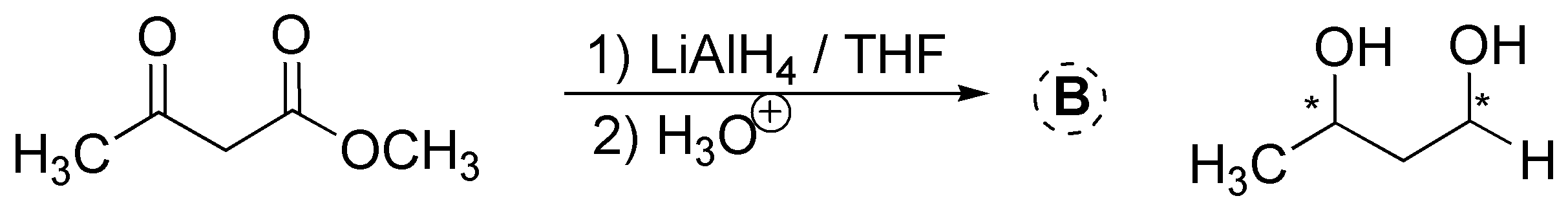
Solución 9:
El NaBH4 a diferencia del LiAlH4 es un reductor más suave y selectivo, reacciona lentamente con alcoholes y con agua (a pH básico) prueba de esto es que se usan alcoholes como disolventes (EtOH, MeOH, etc.) en estas reacciones. Sólo reduce a aldehídos y cetonas, sin interferir con otros grupos carbonilos (ésteres y ácidos carboxílicos) presentes en la molécula. En ambos casos, se obtiene una mezcla racémica, ya que se genera un centro quiral en la reducción.
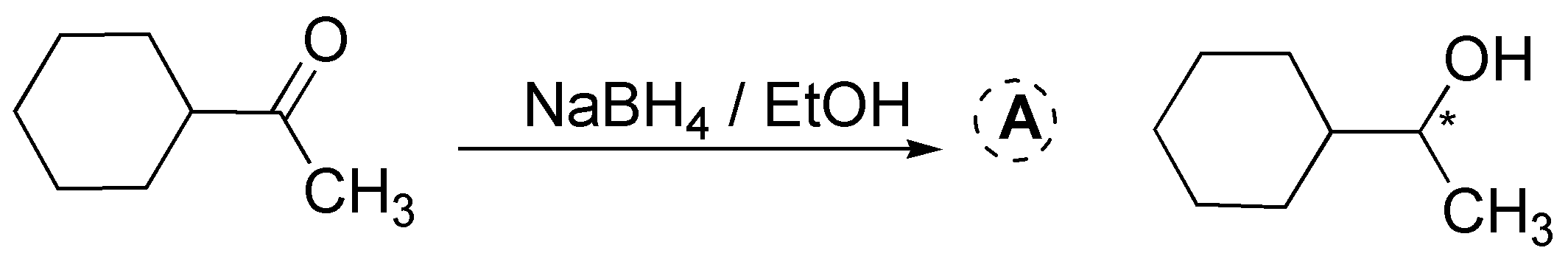
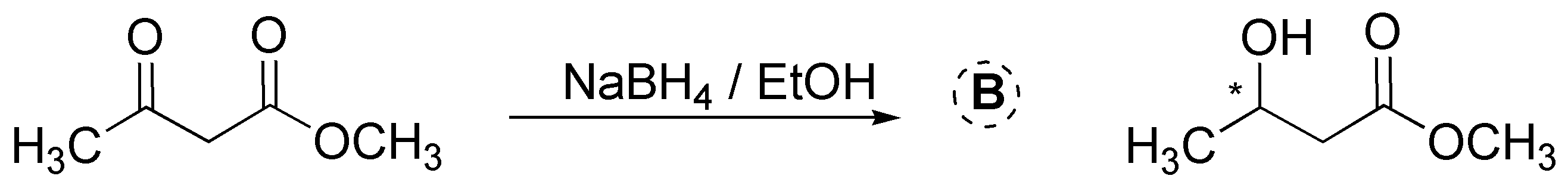
Solución 10:
Hay dos posibilidades para la formación del 2-metilpent-2-eno mediante la reacción de Wittig, la primera partiendo de la acetona y la segunda opción a partir del propanaldehído, estos deben reaccionar con los correspondientes iluros que se indican en la figura.
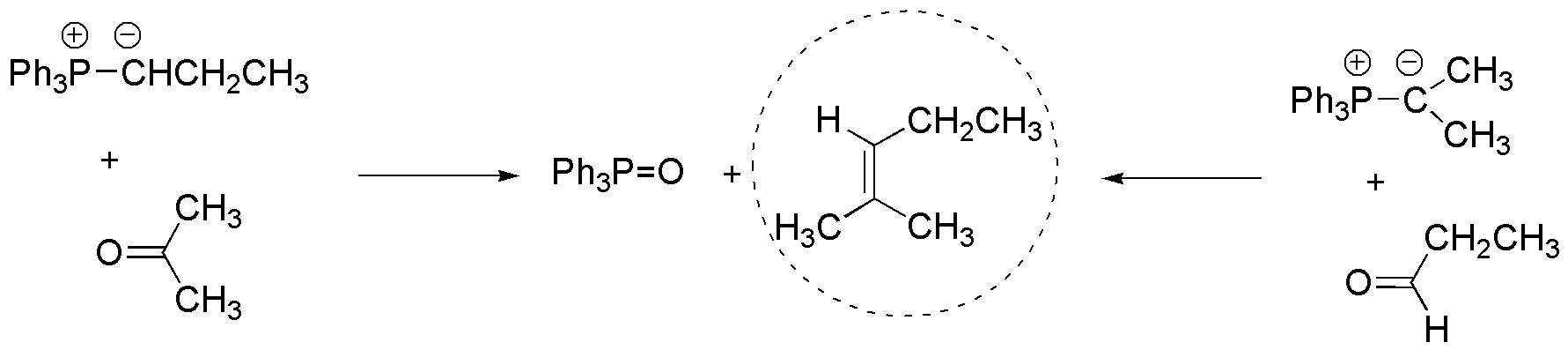
Solución 11:
En ambos casos, el primer paso de la reacción corresponde a una adición a los carbonos carbonílicos de los grupos etil, a), y propinil, b), respectivamente; formándose los correspondientes alcóxidos. Posteriormente, se produce un paso de protonación de dicho alcóxido para dar los alcoholes terciarios de las dos reacciones a) y b).

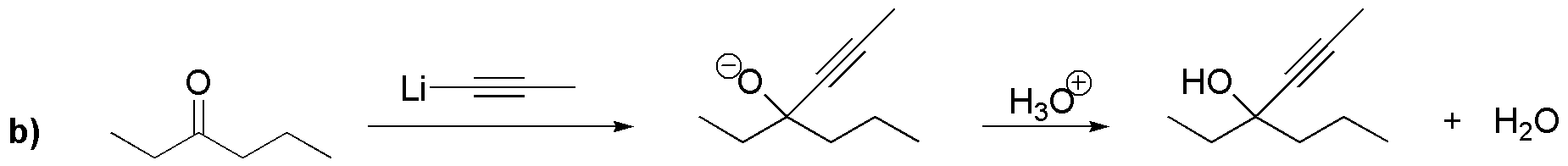
Solución 12:
El pH es crucial en este tipo de reacciones. Si el medio de reacción es demasiado ácido, necesario para que se protone el carbonilo aumentando la reactividad, se protona también la amina desapareciendo el poder nucleófilo (ausencia del par de electrones). Debemos elegir unas condiciones de compromiso, llevando a cabo la reacción en una disolución tampón con pH óptimo de 4.5.
![]()
Solución 13:
Corresponde a una aminación reductiva, un proceso (en dos pasos) en el cual una cetona se transforma en amina. En primer lugar, se produce el ataque de la amina al carbonilo y la pérdida de agua, se genera un intermedio A, base de Schiff (imina), que posteriormente por hidrogenación se reduce hasta la amina B.
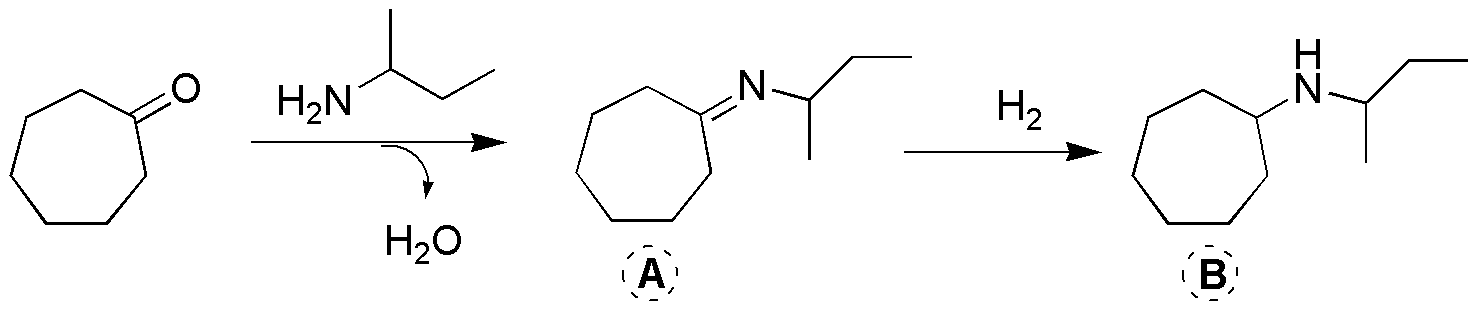
Solución 14:
a) El compuesto I es un hidrato de una cetona. Se pueden obtener por tratamiento de la cetona de partida con agua. La reacción es un proceso de equilibrio, en donde el valor de la constante de equilibrio suele ser inferior a 1, salvo para el caso del formaldehído que presenta un valor de 18. El proceso se cataliza con la presencia de un ácido y no tiene interés sintético.
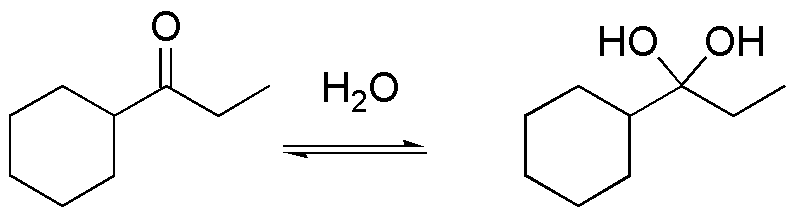
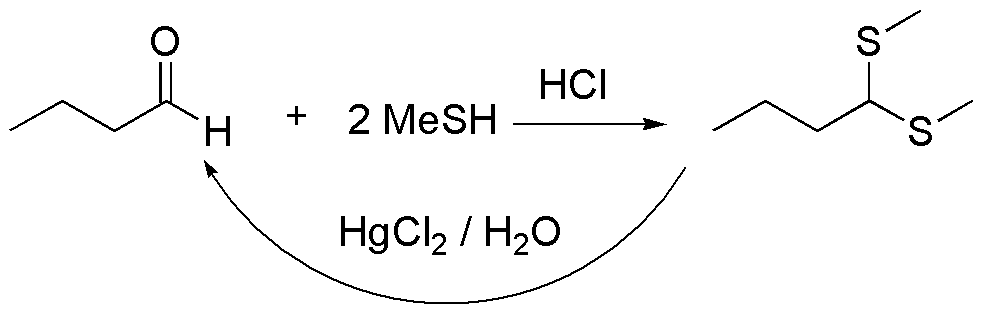
b) El compuesto II es un tioacetal, que provienen de la reacción entre el butanal y el metanotiol. La reacción se cataliza con ácidos minerales, como el ácido clorhídrico o bien con ácidos de Lewis. Los tioacetales son estables en medio básico, frente a nucleófilos y electrófilos, salvo MeI, por lo que se utilizan como grupos protectores de aldehídos y cetonas, los cuales se pueden regenerar tratándolos con sales mercúricas.
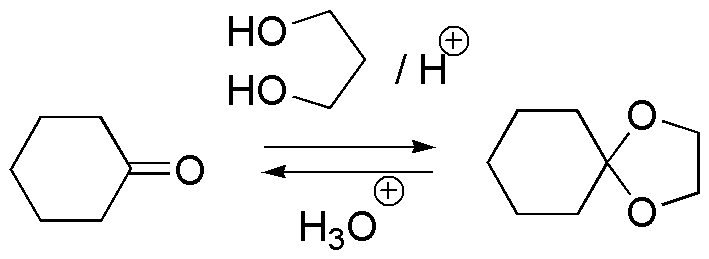
c) El compuesto III es un acetal cíclico que proviene de una cetona, la ciclohexanona, y de un alcohol con dos grupos hidroxilo sobre la misma molécula con lo que se genera un segundo ciclo de cinco miembros en los que dos de los átomos componentes del ciclo son de oxígeno. Los acetales son estables en medio básico, frente a nucleófilos, oxidantes y reductores. El compuesto carbonílico de partida se regenera mediante hidrólisis ácida.
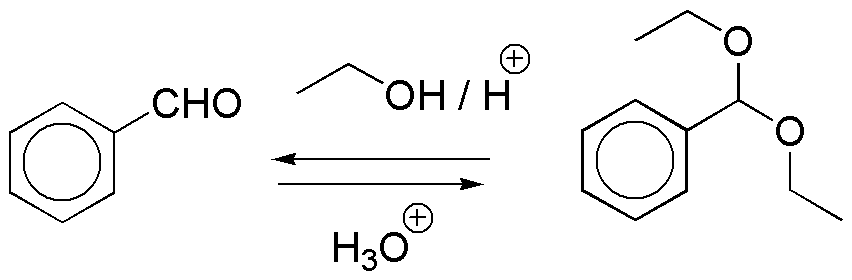
d) De nuevo se trata de un acetal obtenido a partir de benzaldehído y etanol en medio ácido. Al igual que el caso anterior el compuesto de partida se obtiene mediante hidrólisis ácida.
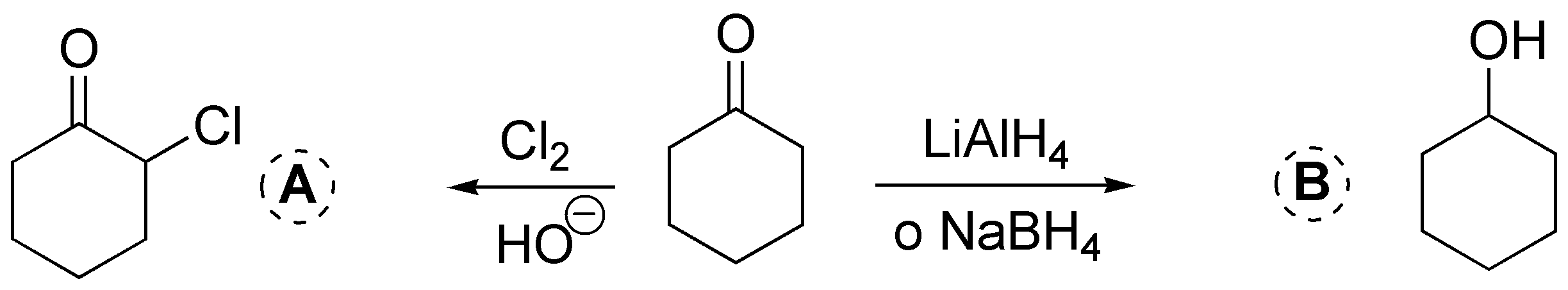
Solución 15:
a) La primera reacción corresponde a la halogenación de una cetona. Los hidrógenos contiguos a un grupo carbonilo son relativamente ácidos y en medio básico puede sustituirse por un halógeno (cloro o bromo). b) La reducción de un cetona produce el correspondiente alcohol secundario.
Solución 16:
De los dos posibles productos de la reacción de oxidación de Baeyer-Villiger, se observa mayoritariamente el éster que proviene de la rotura del enlace C-C correspondiente al carbono más sustituido, debido a que la aptitud migratoria es mayor.
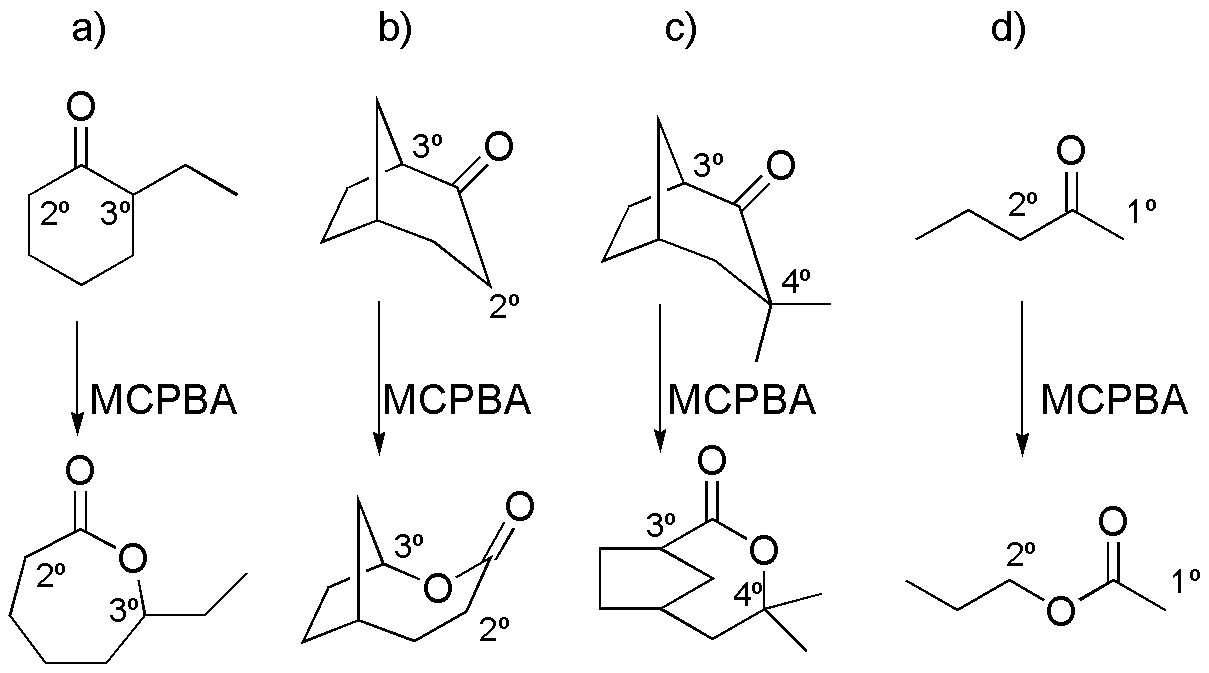
Solución 17:
El 4-hidroxipentanal en medio ácido está formando un hemiacetal cíclico que al protonarse puede sustituirse por un nucleófilo como el metanol produciendo el correspondiente acetal cíclico.
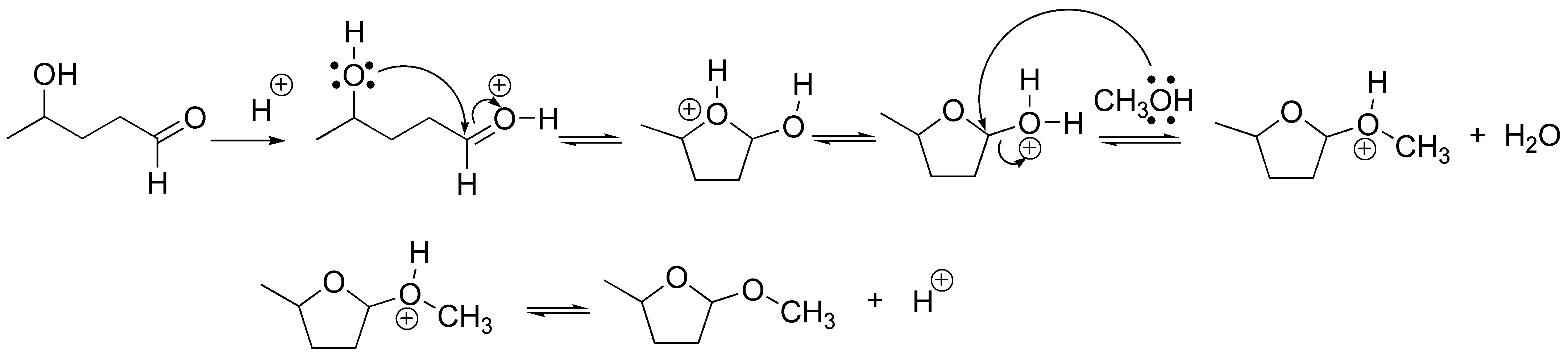
Solución 18:
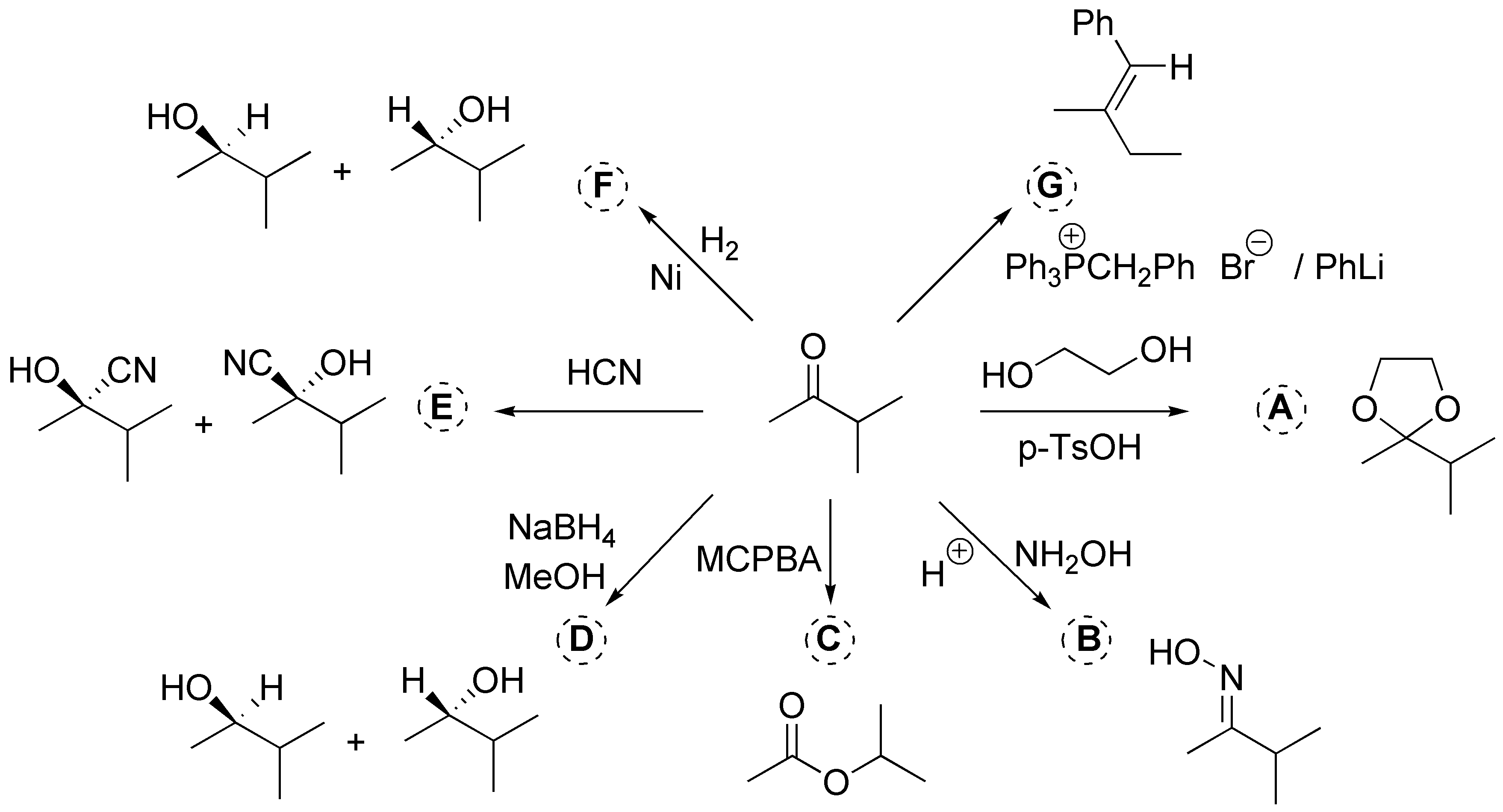
a) Corresponde a la formación de un cetal cíclico; b) la formación de una oxima; c) una oxidación de Baeyer-Villiger; d) una reducción; e) formación de una cianhidrina; f) hidrogenación (reducción) y g) es una reacción de Wittig.
Solución 19:
a) Se trata de la formación de una imina, pues la amina es primaria; b) formación de una enamina al ser la amina secundaria; c)hidratación de un aldehído (formación de un hidrato) y d) Halogenación en α de una cetona:
Solución 20:
Las reacciones necesarias para transformar la ciclopentanona en estos tres productos serían: Una reducción para dar a), la adición de un organometálico para dar b) y una reacción de Wittig para dar el hidroxialqueno c).
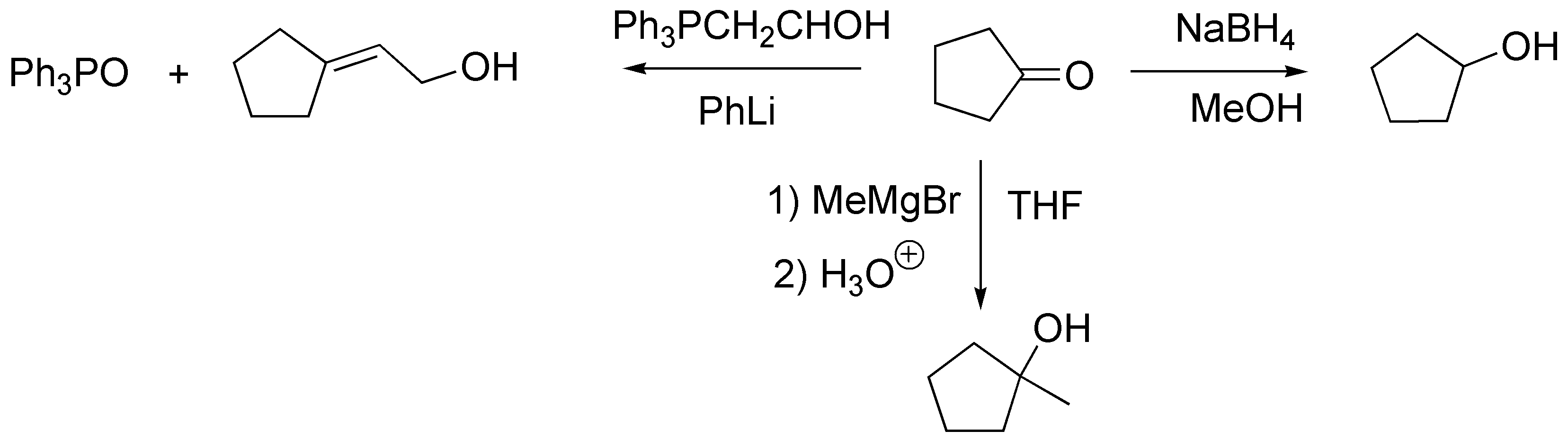
Solución 21:
La condición necesaria para dar la reacción de Cannizzaro es que el grupo el átomo de carbono contiguo al aldehído no posea ningún hidrógeno por lo que A y C darán la reacción de Cannizzaro.

Solución 22:
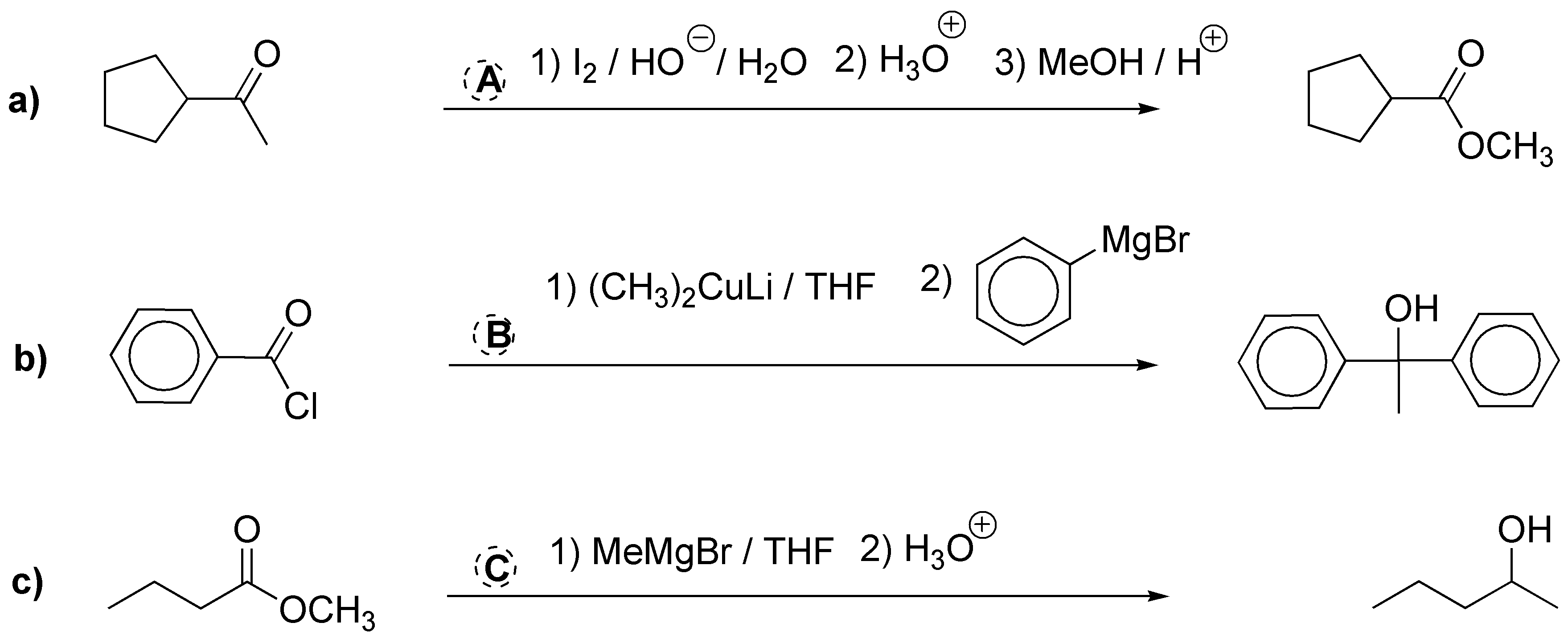
Solución 23:
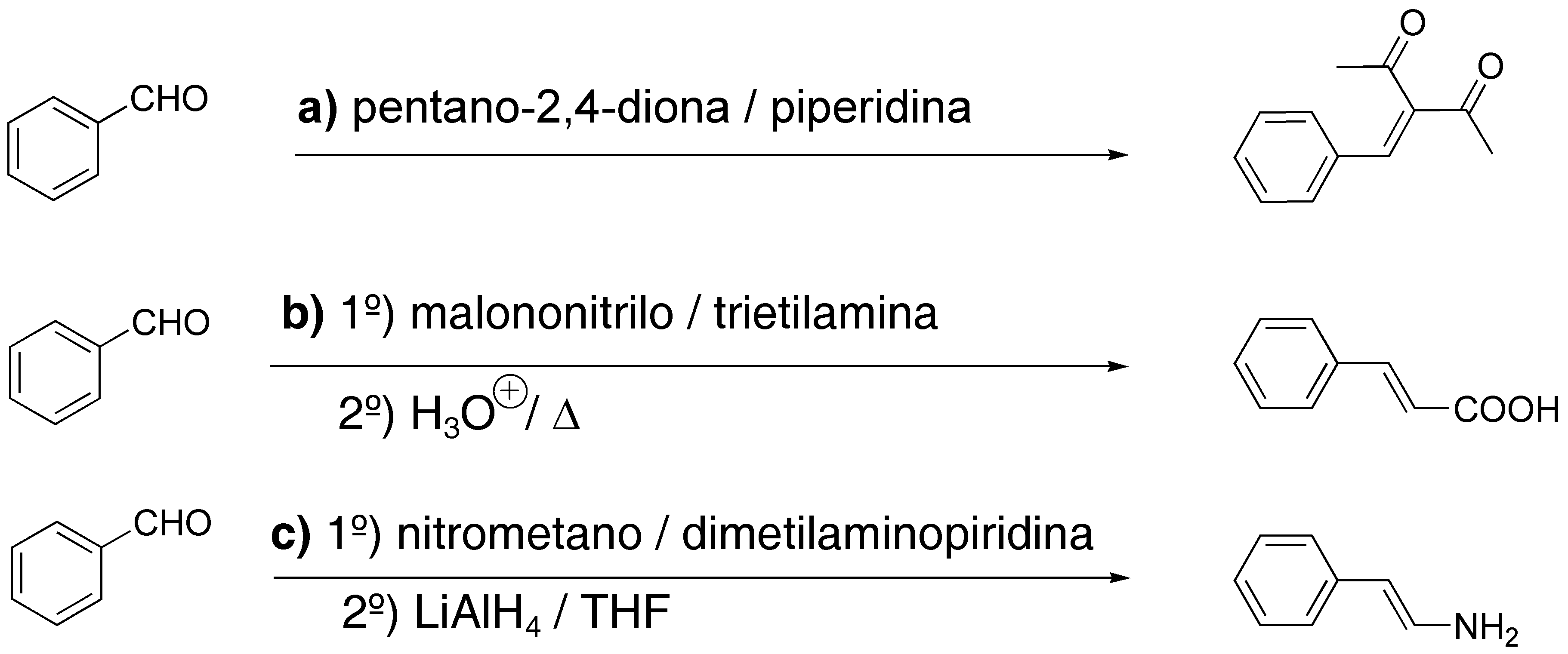
Solución 24: