Written by José | Last Updated on 2 meses
Ir a la página con el listado de problemas.
Alquenos y Dienos – soluciones a los problemas
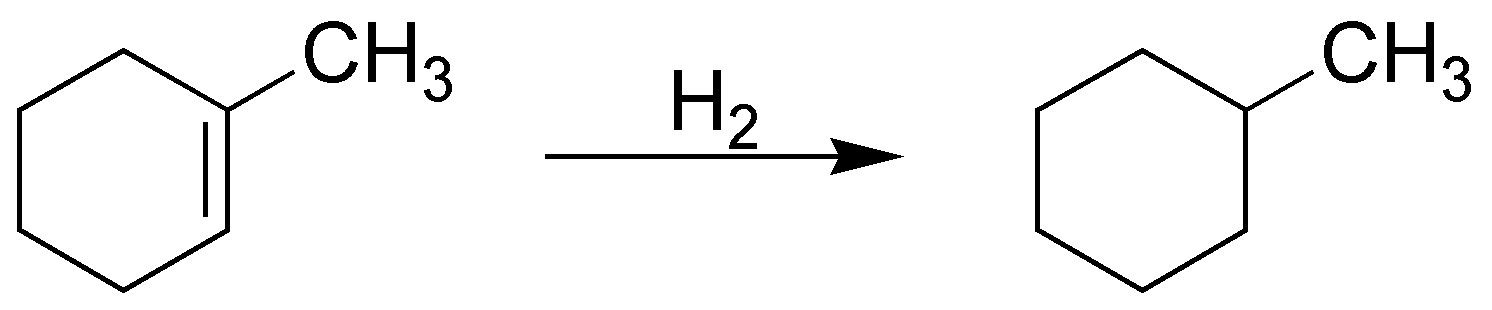
Solución 1:
La reacción de hidrogenación, independientemente de la estereoquímica de la misma, producirá un alcano. En este caso es el metilciclohexano, que como podemos observar es un producto simétrico y único (no posee estereoisómeros).
Solución 2:
La reacción de hidrohalogenación comienza por el ataque de un protón del ácido sobre la nube π de la olefina para producir un carbocatión (cumple la regla de Markovnikov) y por tanto el hidrógeno se enlazará al carbono menos sustituido, en este caso al carbono-1 produciendo un carbocatión terciario, el cual a su vez reacciona con el ión bromuro dando el 2-bromo-2-metilbutano.
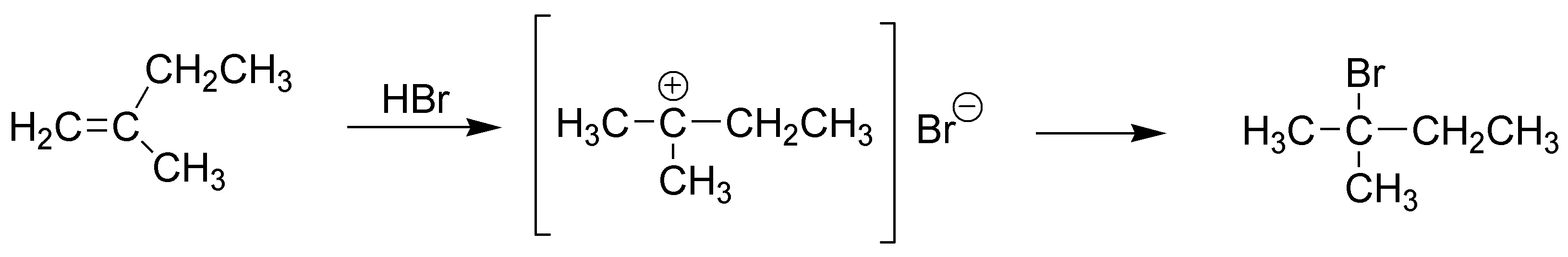
Solución 3:
La reacción de halogenación produce como intermedio un ión bromonio cíclico, que posteriormente es atacado por el ión bromuro por la cara opuesta, produciendo en ambos casos un 2,3-dibromobutano.
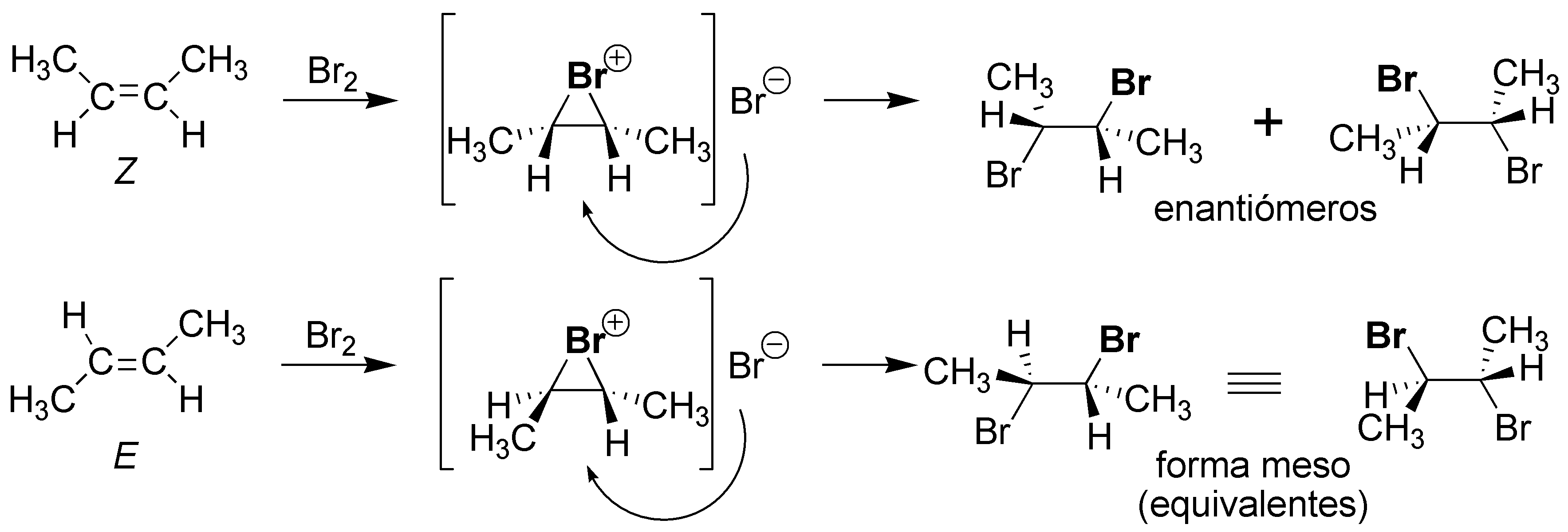
Pero mientras que el isómero Z (cis) produce la pareja de enantiómeros (2R,3R)/(2S,3S)-2,3-dibromobutano, el isómero E (trans) produce el (2R,3S)-2,3-dibromobutano que es una forma «meso» y por tanto es un producto único. Cuando una reacción se comporta de esta manera, es decir la misma reacción con dos estereoisómeros diferentes produce estereoisómeros distintos se dice que es estereoespecífica.
Solución 4:
La reacción de adición de borano en THF seguida de peróxido de hidrógeno en medio básico produce un alcohol con la regioselectividad «anti-Markonvikov» y una estereoselectividad «sin«, es decir el grupo hidroxilo irá al carbono menos sustituido y el hidrógeno al más sustituido y ambos grupos deben entrar por la misma cara de la molécula con lo que se obtendrá el trans-2-metilciclohexanol como una pareja de enantiómeros: (1R,2R) y (1S,2S).
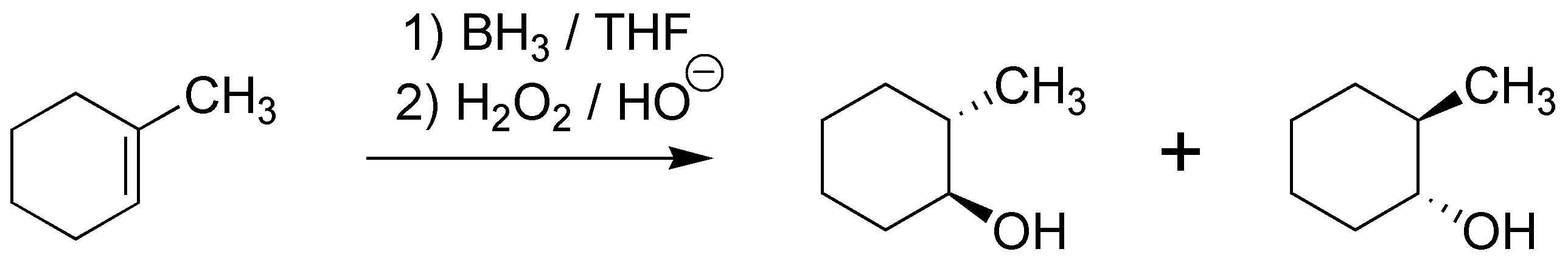
Solución 5:
La reacción de hidratación catalizada por ácidos comienza por el ataque de un protón del ácido sobre la nube π de la olefina para producir un carbocatión.
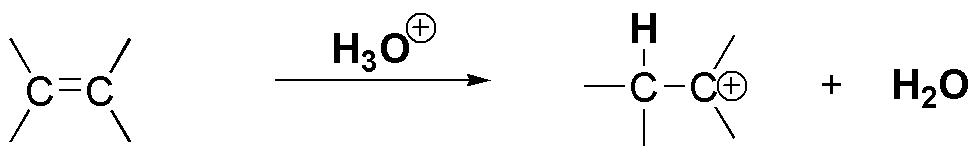
Por un lado, la densidad electrónica de la nube π aumenta, conforme aumenta la sustitución del doble enlace ya que los grupos alquilo presentan un ligero efecto electrón donante. Al aumentar la densidad electrónica aumenta su reactividad frente a electrófilos, pero la razón de mayor peso es el tipo de intermedio que se genera en cada caso.
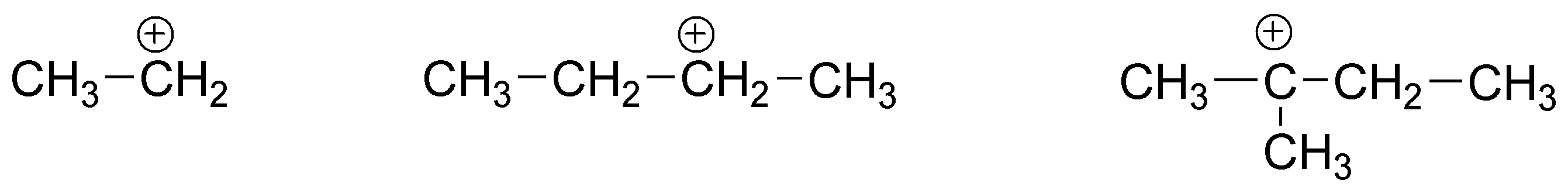
Para el eteno, se produce un carbocatión primario, para el (E)-but-2-eno un carbocatión secundario y para el 2,3-dimetilbut-2-eno un carbocatión terciario. Como es sabido, el orden de reactividad de los carbocationes es:
terciario > secundario > primario > metilo
La distinta estabilidad de estos carbocationes se traduce en cambios sustanciales en la energía de activación, con lo que se justifica perfectamente el orden de reactividad propuesto.
Solución 6:
A) El compuesto A se obtiene por reacción electrófila de HBr. Se produce una adición Markovnikov dando el 2-bromo-2-metilpropano (bromuro de terc-butilo).
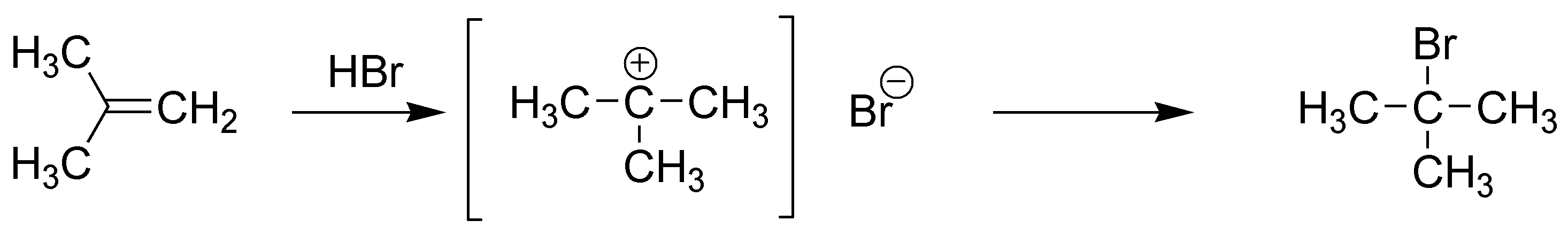
B) La reacción con Br2 conduce a la formación de un dibromoalcano: 1,2-dibromo-2-metilpropano. La adición de bromo a alquenos es anti a través de un ión bromonio intermedio, actuando como electrófilo el ión Br+. Posteriormente, se produce el ataque del nucleófilo en este caso el ión bromuro Br–.
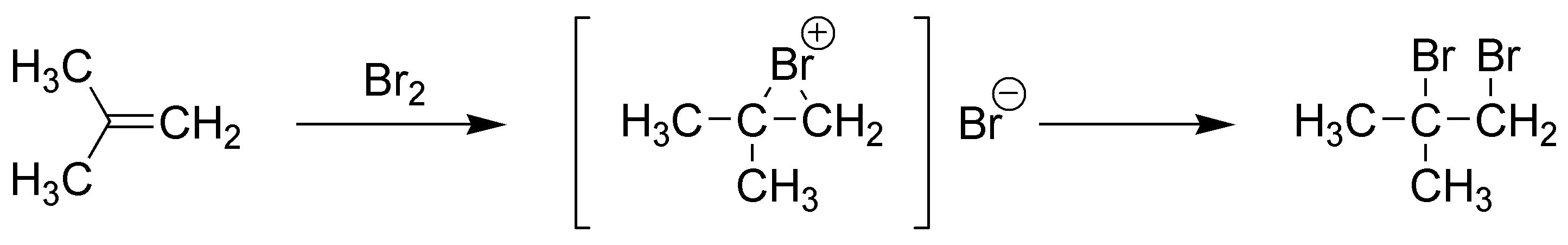
C) El permanganato es un oxidante que puede dar un glicol, en el caso de que el pH sea neutro y se realice la reacción a temperaturas bajas, o bien producir la rotura del doble enlace si el pH del medio es básico y se realiza la reacción en caliente. En este caso se produciría el 1,2-dihidroxi-2-metilpropano.
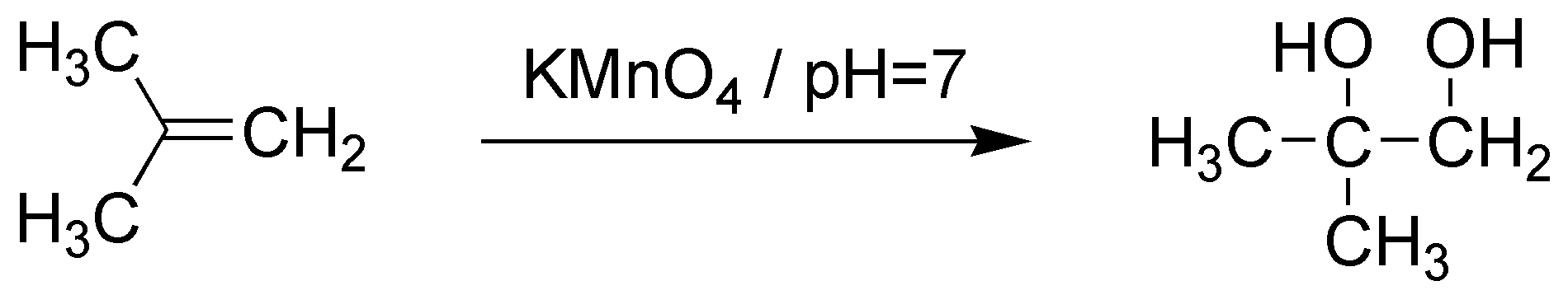
D) La adición de bromo a alquenos es anti a través de un ión bromonio intermedio, actuando como electrófilo el ión Br+. Posteriormente, se produce el ataque del agua como nucleófilo. El ataque se produce sobre el carbono más sustituido que es el que tiene mayor densidad de carga positiva, en este caso se formará el 1-bromo-2-metil-2-propanol.
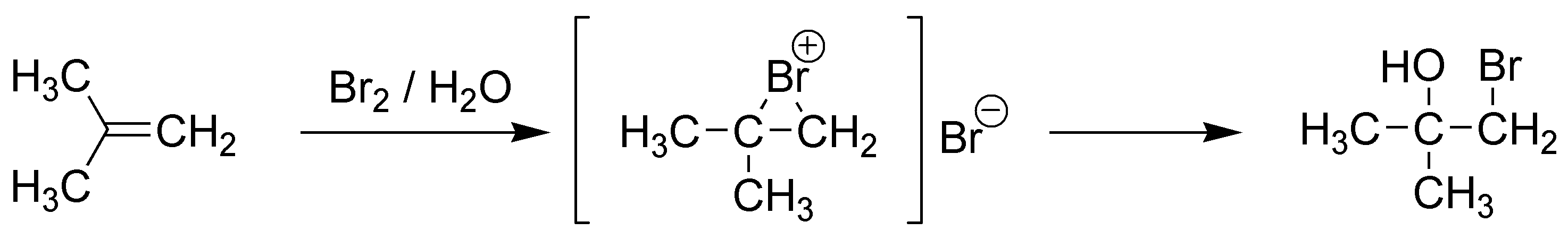
E) La reacción del cloruro de metilsulfenilo es una reacción electrofílica tipo Markovnikov, en la que el electrófilo es el metilsulfenilo (MeS+ y por tanto se unirá al carbono menos sustituido. El ión cloruro (nucleófilo) atacará al carbono más sustituido.
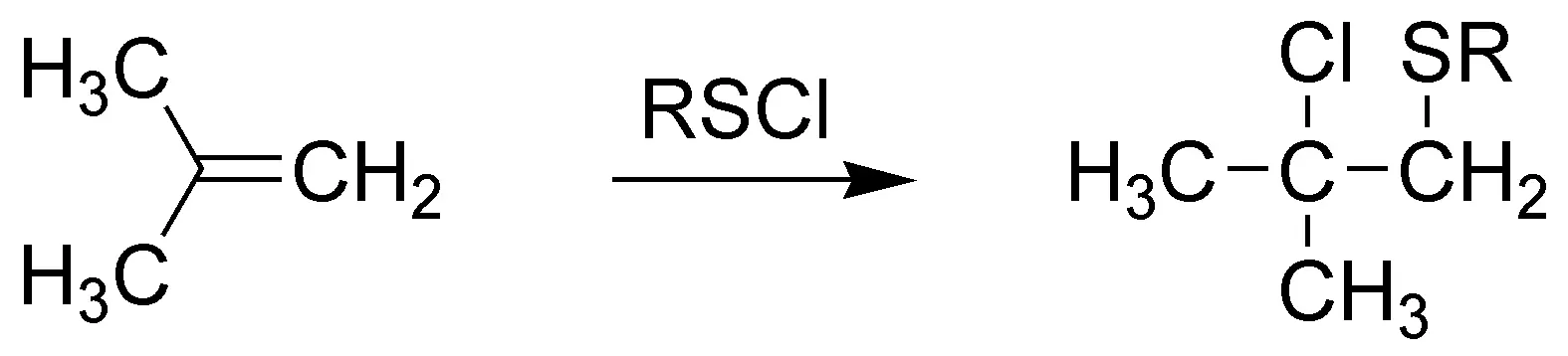
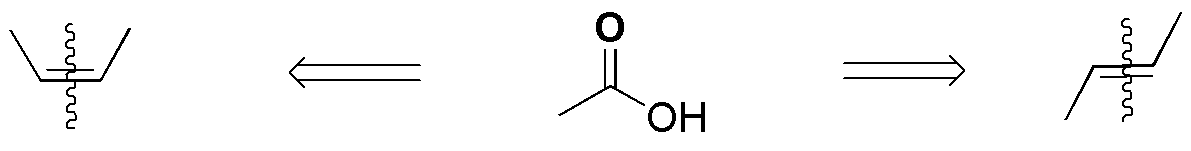
F) La reacción de un alqueno con un perácido (en este caso ácido peracético) conduce a la formación de epóxidos (oxaciclopropanos). En este caso se formaría el 1,1-dimetiloxaciclopropano.
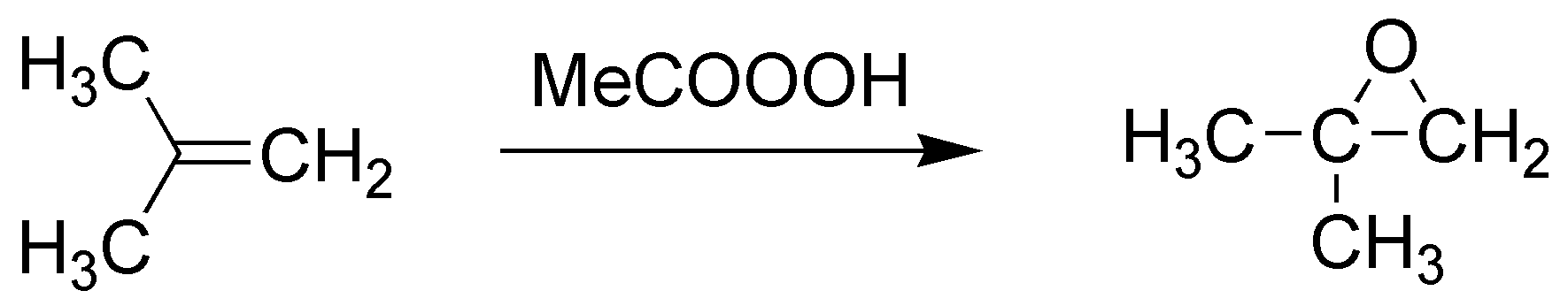
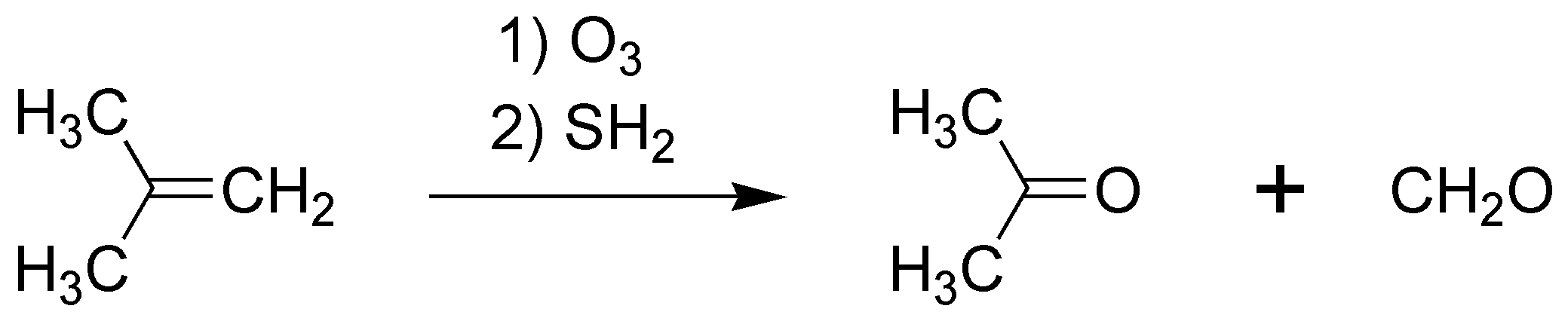
G) La ozonólisis de un alqueno, seguida de una reducción conduce a la rotura del doble enlace produciendo dos compuestos carbonílicos en este caso formaldehído y propanona (acetona).
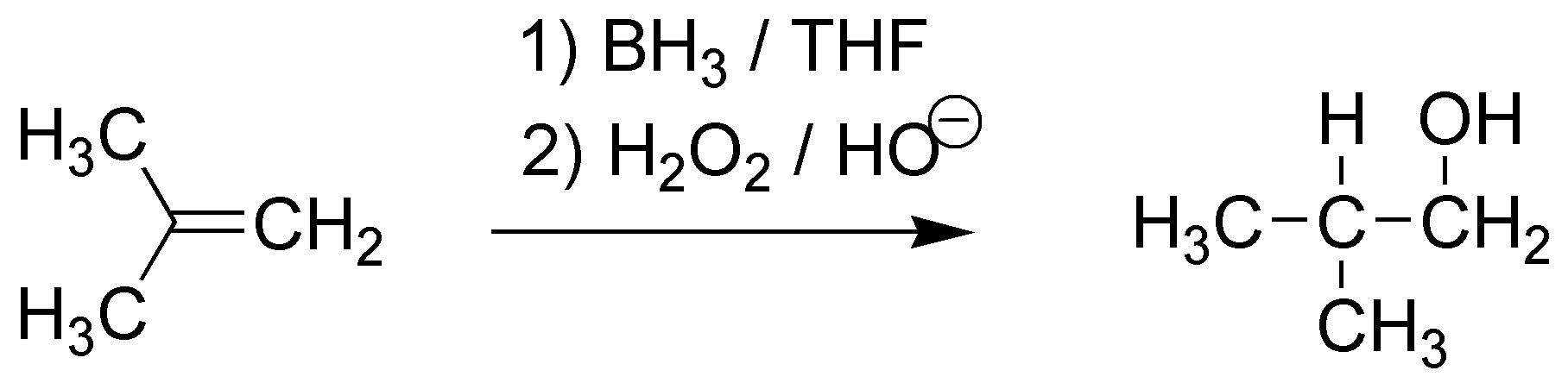
H) El tratamiento de un alqueno con borano seguido de una oxidación en medio básico produce como resultado final la adición de agua anti-Markovnikov al alqueno. Se formará, por tanto el compuesto 2-metil-propan-1-ol.
Solución 7:
Como regla general para este tipo de problemas, siempre debemos comprobar el balance atómico entre el producto inicial y el final. Posteriormente, debemos analizar si es posible realizar la transformación en una sola etapa o no y finalmente debemos observar la selectividad de la misma.
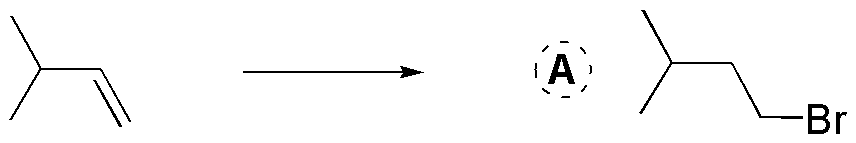
A) El balance atómico nos indica que se ha adicionado HBr. También observamos que se ha adicionado de forma que el bromo se sitúa sobre el carbono menos sustituido. Se trata por tanto de una adición anti-Markovnikov. Por tanto, demos hacer la adición en presencia de peróxidos y luz, y se realizará la reacción mediante un mecanismo radicalario.
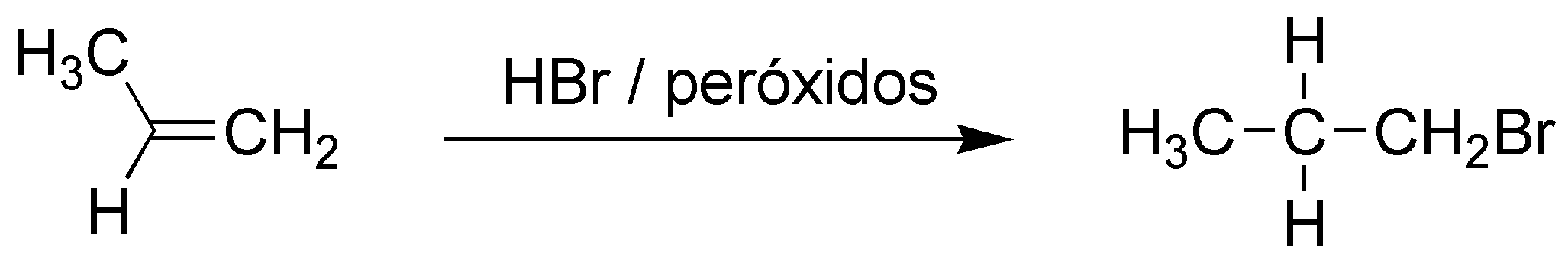
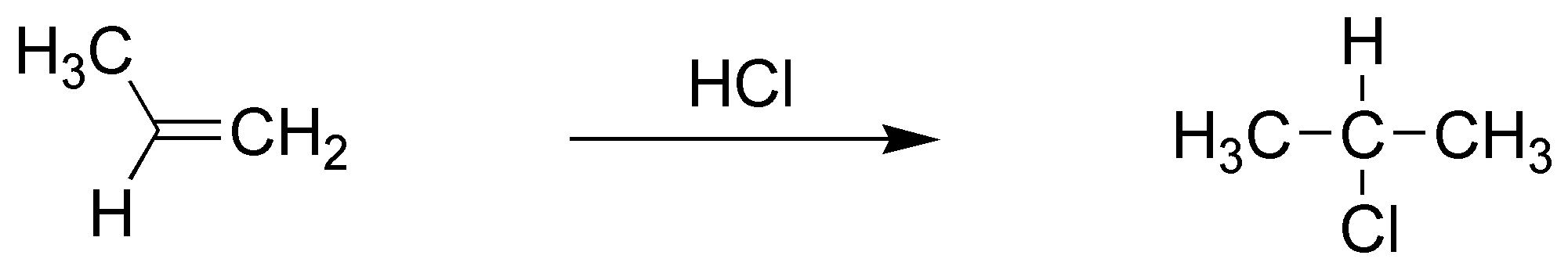
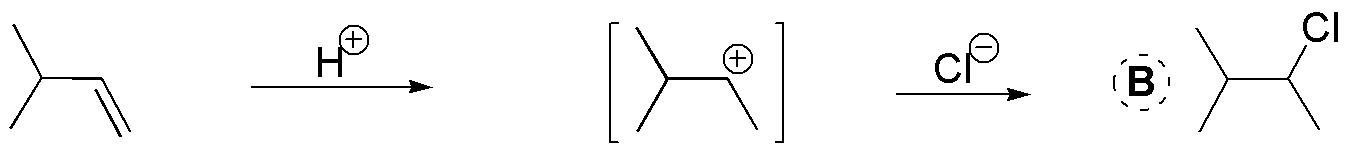
B) El balance atómico nos indica que se ha adicionado HCl. También observamos que se ha adicionado de forma que el cloro se enlaza al carbono más sustituido. Se trata por tanto de una adición tipo Markovnikov de HCl a un alqueno.
C) El balance atómico nos indica que se han adicionado dos grupos hidroxilo (2 OH). Por lo que el reactivo será bien el KMnO4 a pH=7, bien el OsO4 con bisulfito sódico (NaHSO3).
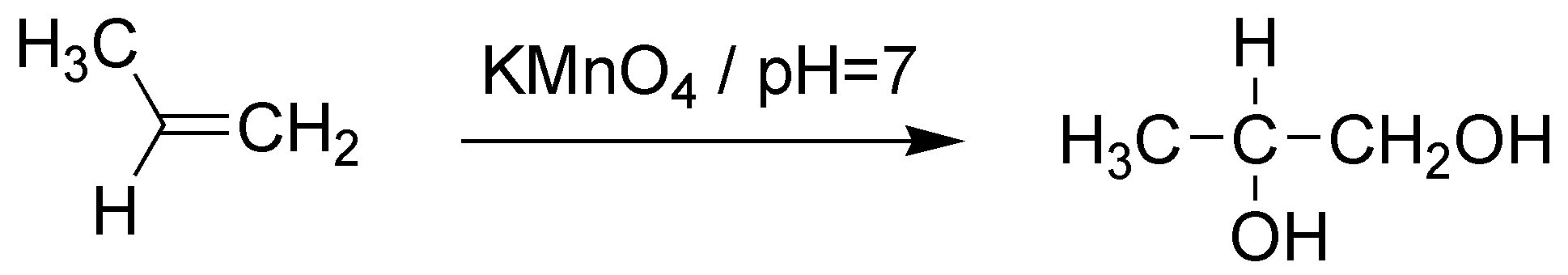
D) El balance atómico nos indica que se ha adicionado una sola molécula de agua. También, observamos que el hidroxilo se sitúa sobre el carbono más sustituido. Tratándose por tanto de una adición tipo Markovnikov de H2O a un alqueno, catalizada por ácido.
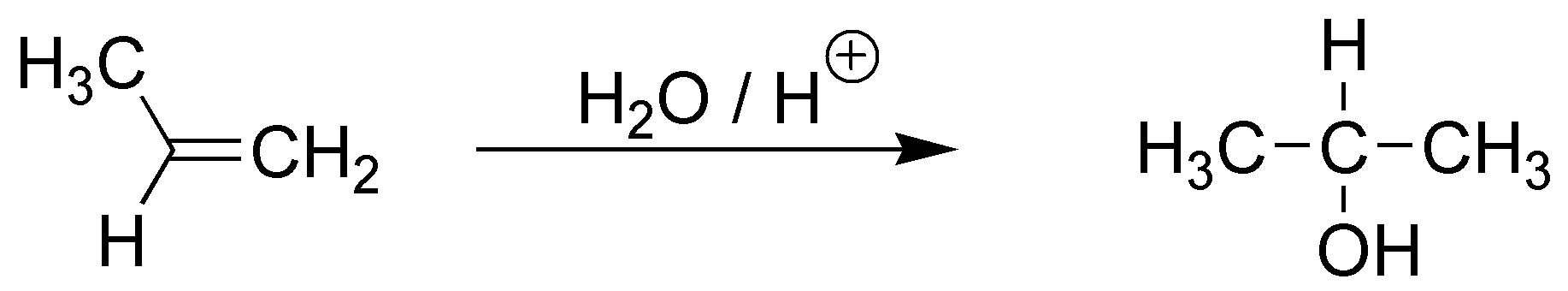
E) El balance atómico nos muestra que la molécula inicial, con 4 átomos de carbono, se ha roto. Ya que el producto final sólo posee dos carbonos. Como además presenta 4 átomos de oxígeno se ha producido una rotura oxidativa. Podemos realizarla con KMnO4 en medio ácido.
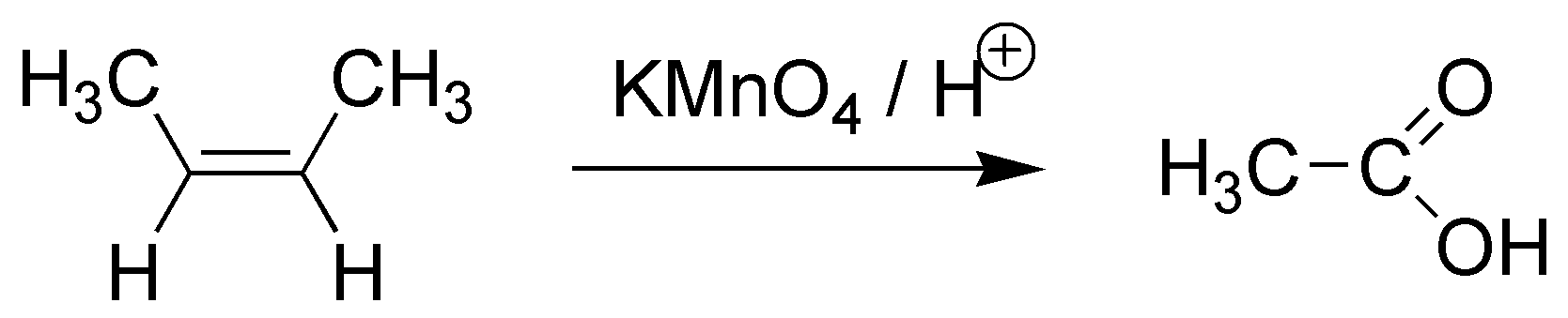
F) El balance atómico nos sugiere que la molécula inicial ha perdido un metileno (CH2) y ha ganado un átomo de oxígeno. Se trata por tanto de una rotura oxidativa que podemos realizarla mediante la correspondiente ozonólisis y posterior reducción del ozónido formado.
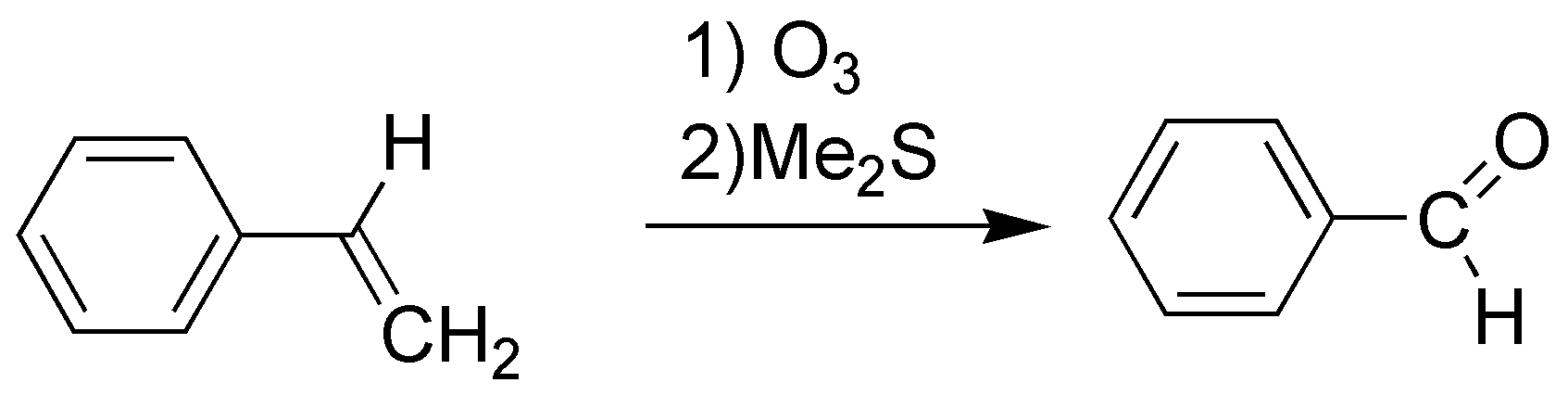
Solución 8:
A) El compuesto A se obtiene por reacción de HBr en presencia de un iniciador de radicales como el peróxido de benzoílo. Se produce una adición anti–Markovnikov.
B) La reacción con HCl conduce a la formación de un haluro de alquilo, mediante una adición Markovnikov. Según el mecanismo propuesto, el H+ actúa como electrófilo, se produce el carbocatión más estable de los posibles (el secundario) y el ión cloruro actúa como nucleófilo, atacando al carbono que tiene carga positiva para dar el cloruro de alquilo secundario.
C) La adición de bromo a alquenos es anti a través de un ión bromonio intermedio, actuando como electrófilo el ión Br+. Posteriormente se produce el ataque del agua como nucleófilo. El ataque se produce sobre el carbono más sustituido que es el que tiene mayor densidad de carga positiva.
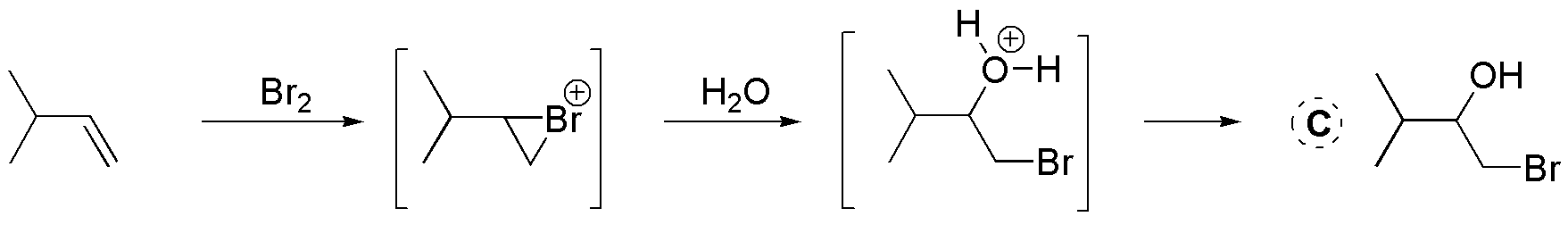
D) El permanganato es un oxidante que puede dar un glicol, en el caso de que el pH sea neutro y se realice la reacción a temperaturas bajas, o bien producir la rotura del doble enlace si el pH del medio es básico y se realiza la reacción en caliente, como en este caso. Dado que en el alqueno de partida la insaturación se encuentra en el extremo de la cadena, se producen dos fragmentos que son CO2 (gas) que se desprende en el crudo de reacción y no se detecta, y la sal potásica del ácido carboxílico correspondiente, ya que la oxidación se suele realizar en medio básico. Para aislar dicho ácido carboxílico es necesario acidificar el crudo de reacción, una vez finalizada la oxidación.
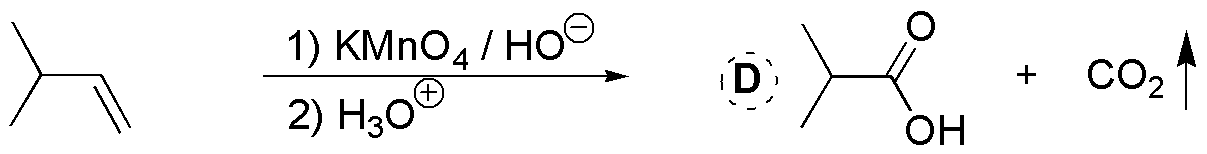
E) Un protón del ácido sulfúrico actúa como electrófilo, generando un intermedio de reacción que es un carbocatión secundario. Puesto que el ión sulfato no tiene carácter nucleófilo, el agua ejerce ese papel atacando al carbono que presenta carga formal positiva. Se obtiene un alcohol secundario. (Nótese que no hay consumo neto de protones, por lo que el ácido actúa como un catalizador.)
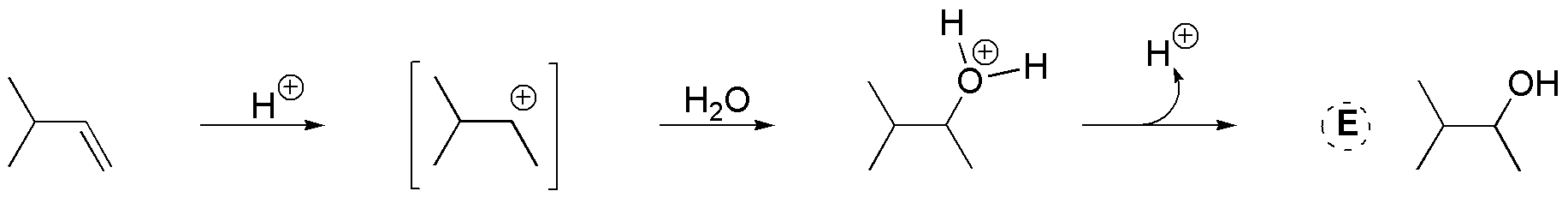
F) El hidrógeno tiene carácter reductor y se adiciona a dobles enlaces estereoespecíficamente mediante una adición sin (por la misma cara del doble enlace) para dar el correspondiente compuesto saturado. En este caso particular, al situarse el doble enlace en el extremo de una cadena carbonada, la adición de hidrógeno no genera ningún nuevo estereocentro.
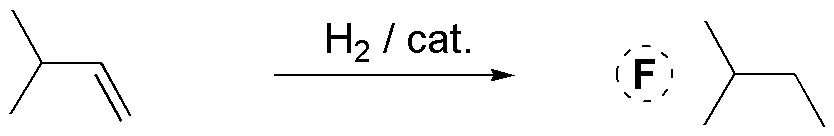
Solución 9:
Compuesto A. La adición de halógenos a alquenos es un proceso anti y por tanto estereospecífico. Según los alquenos de partida pueden generarse estereocentros. Al no especificarse en este caso la estereoquímica del compuesto obtenido, la adición de cloro que conduce a la formación del compuesto A, puede provenir tanto de II como de III.
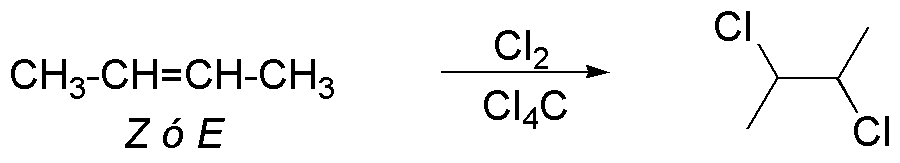
Compuesto B. Es el resultado de la adición de una molécula de agua a II o III por tratamiento del correspondiente alqueno con una disolución acuosa de un ácido con un anión poco nucleófilo (SO4=, PO43-). Independientemente de que el alqueno sea Z o E, el ataque del electrófilo (protón) produce el mismo carbocatión, que es atacado por una molécula de agua que actúa como nucleófilo.
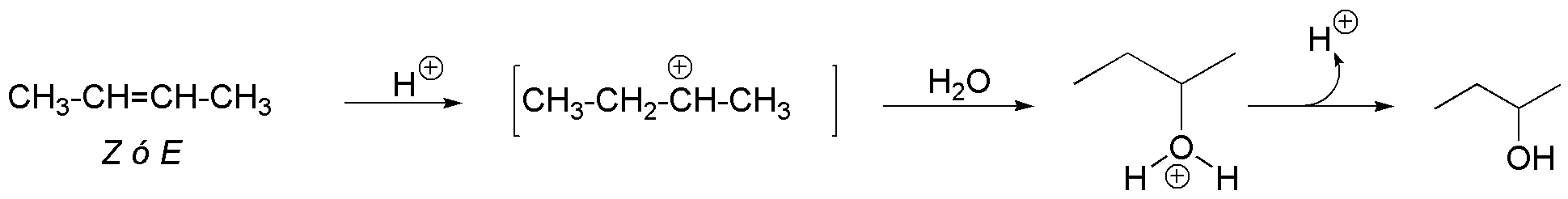
Compuesto C. Un procedimiento similar al descrito en el apartado anterior aplicado a I lleva a la formación de C
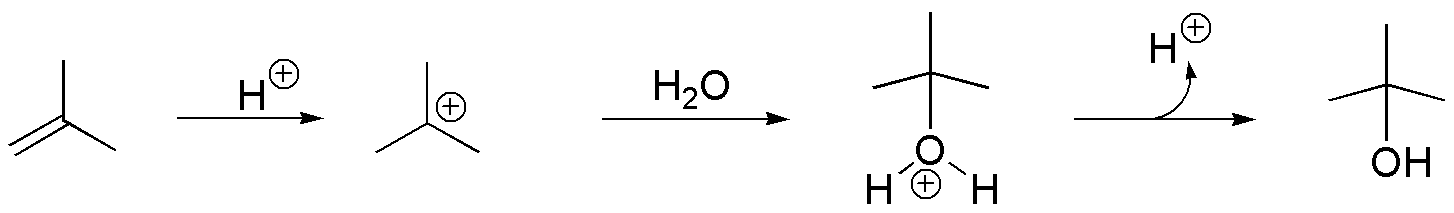
Compuesto D. La adición de HBr tipo anti-Markovnikov sobre I permite la preparación de D. Para ello es necesario el empleo de un iniciador de radicales como peróxido de benzoílo o la iluminación con luz adecuada que genere el radical Br· necesario para que se inicie la reacción.
Compuesto E. La rotura oxidativa de los alquenos con permanganato potásico (en caliente) genera dos fragmentos. Dependiendo del tipo de sustitución en el doble enlace, variará la naturaleza del fragmento. Si a un lado del doble enlace está la agrupación RHC=, se obtiene el ácido carboxílico R-CO2H. Si el doble enlace está al extremo de una cadena (=CH2) se produce CO2, y si uno de los carbonos del doble enlace está unido a dos grupos alquilo (R1R2C=) se obtiene una cetona (R1R2C=O). La estereoquímica del doble enlace (Z o E) no influye en la naturaleza del fragmento.
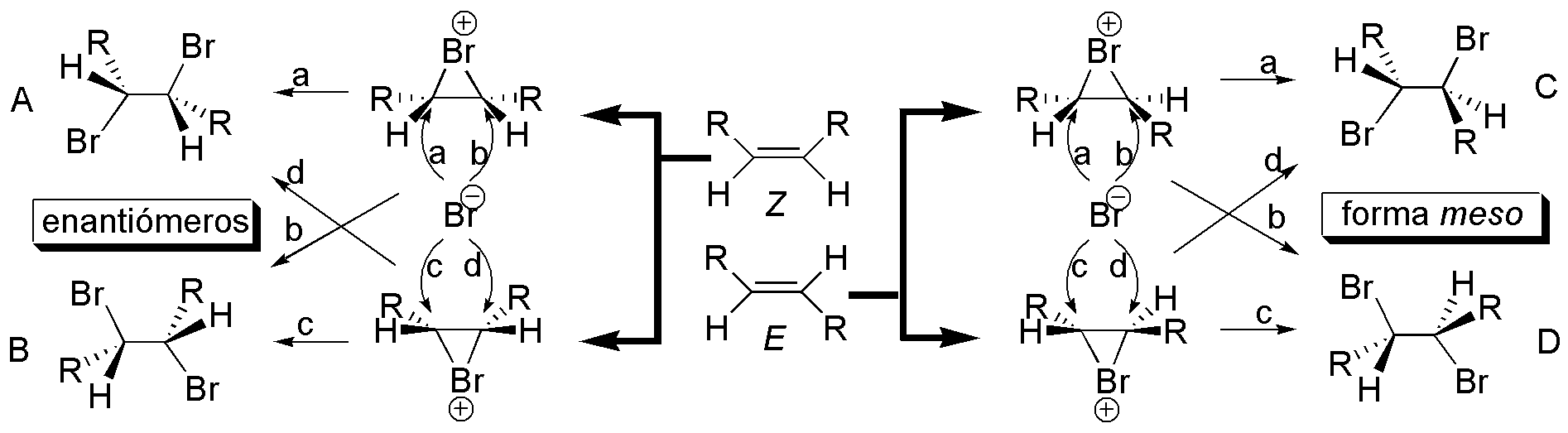
Compuesto F. Con respecto a la estereoquímica, la adición de bromo a un doble enlace es uno de los procesos más complejos dentro de las reacciones de adición.
En la siguiente figura, se describe la adición de bromo a un alqueno genérico del tipo R-CH=CH-R de configuración Z o E. Para el compuesto Z se obtiene una pareja de enantiómeros, mientras que para el E se obtiene un compuesto meso, cuando los dos grupos R unidos al doble enlace son iguales.
Se resumen todas las posibilidades de adición de bromo a alquenos de tipo E o Z. En el compuesto E los átomos de bromo se sitúan en una disposición antiperiplanar, que es como quedan dichos átomos cuando se produce el ataque un ión bromuro sobre el ión bromonio intermedio de la reacción. De esta situación se deduce que la disposición de los grupos metilo en la proyección de Newman es la de partida, es decir, el doble enlace presenta una configuración Z. La estructura representada es uno de los enantiómeros que se obtiene en la adición de bromo sobre la olefina de partida III.
Solución 10:
a) La adición de haluros de hidrógeno a alquenos da siempre el producto de adición Markovnikov.
Falsa: Cuando hay peróxidos, o se ilumina, el mecanismo es radicalario, obteniéndose el producto anti–Markovnikov.
b) La ozonólisis de un alqueno produce dos compuestos carbonílicos.
Verdadera: La ozonólisis de alquenos produce aldehídos o cetonas, incluso si el doble enlace está situado en el extremo de una cadena se forma formaldehído, en todos los casos compuestos carbonílicos.
c) La hidratación de alquenos catalizada por ácidos presenta una estereoquímica sin.
Falsa: El intermedio de reacción es un carbocatión y por tanto plano. El nucleófilo (H2O), puede atacar indistintamente por ambas caras, por lo que no es correcto hablar de ataque sin o anti.
d) La adición de halógenos a alquenos y la formación de halohidrinas son adiciones anti.
Verdadero: En ambos casos se forma un intermedio cíclico halonio. El nucleófilo, X–, para la adición de halógenos y H2O para las halohidrinas ataca por la cara contraria a la del halógeno, por tanto una adición anti.
Solución 11:
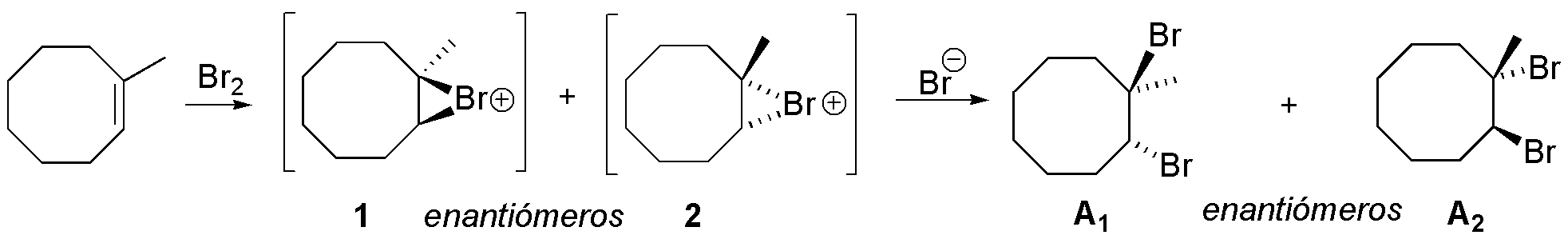
A) La adición de bromo sobre el 1-metilcicloocteno es estereoespecífica, como ocurre con todos los alquenos, ya que se forman únicamente dos de los cuatro posibles estereoisómeros. La estereoquímica relativa de los átomos de bromo que se adicionan es trans, lo cual implica que la adición es anti.
La reacción comienza con la formación de un ión bromonio intermedio, como resultado del ataque de la molécula de bromo. No hay preferencia en la formación del intermedio en cada una de las dos caras del doble enlace, por lo que se obtienen los iones bromonio 1 y 2 de la figura. Seguidamente, se produce el ataque del ión bromuro por el lado opuesto donde se sitúa el ión bromonio y sobre la posición más sustituida, ya que es en ésta donde hay mayor densidad de carga positiva. El producto final de la reacción es, en realidad, una mezcla equimolecular de los enantiómeros A1 y A2 , es decir, un racémico.
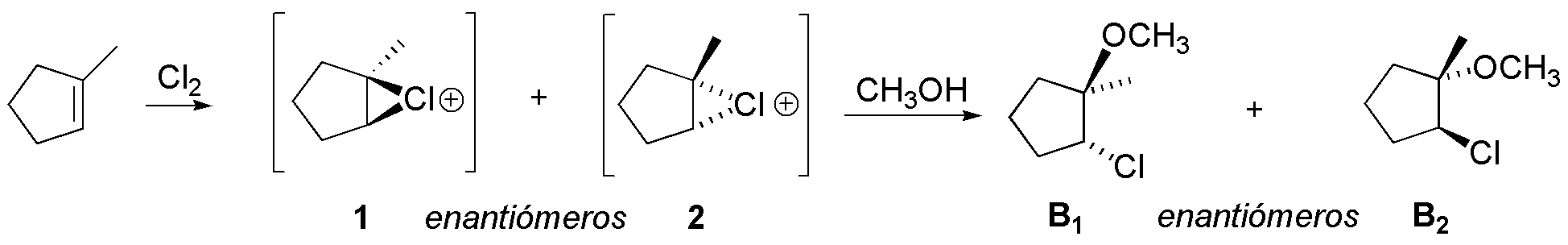
B) La reacción del 1-metilciclopenteno con cloro en presencia de metanol genera en primera instancia, un ión cloronio cíclico, de forma semejante al caso anterior. El ión cloronio intermedio es atacado fundamentalmente por el nucleófilo que hay en mayor proporción (el metanol que actúa como disolvente).
La reacción es regioselectiva, ya que el metanol se une al carbono más sustituido, puesto que éste tiene mayor densidad electrónica por el efecto inductivo del grupo metilo. Como resultado se obtiene B como mezcla de enantiómeros (B1 + B2).
C) Cuando el 2,4-dimetilpent-2-eno reacciona con borano se produce un alquilborano mediante una adición sin situándose el boro sobre el carbono menos sustituido. Del tratamiento con peróxido de hidrógeno en medio básico se obtiene un alcohol, siendo el proceso global una adición anti–Markovnikov.
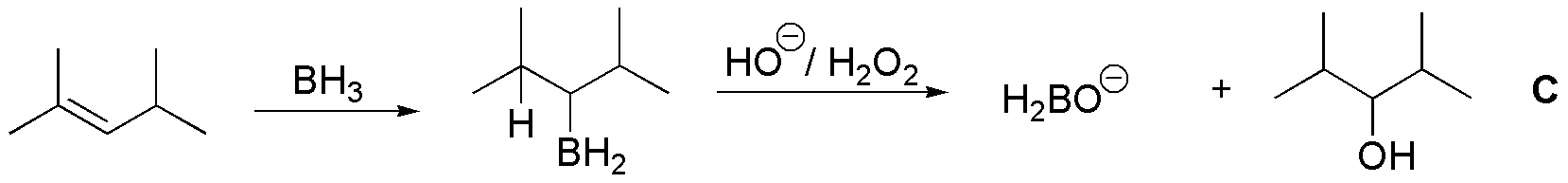
Puesto que el borano puede transferir tres hidrógenos, un mol de borano puede transformar 3 moles de alqueno, obteniéndose como subproducto la sal correspondiente del ácido bórico.
D) El ciclononeno reacciona con OsO4 mediante hidroxilación sin. Se forma un intermedio metalaciclo que se hidroliza con bisulfito sódico dando Osº.
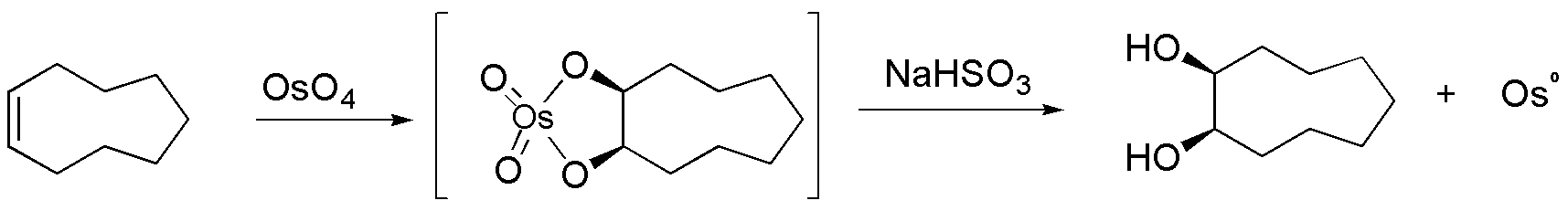
E) Los reactivos empleados en esta reacción son un ácido mineral no nucleófilo como el H3PO4 y KI. El ácido mineral proporciona protones que al adicionarse al alqueno forman el carbocatión más estable. El ión I– tiene carácter nucleófilo y produce yoduro de alquilo.
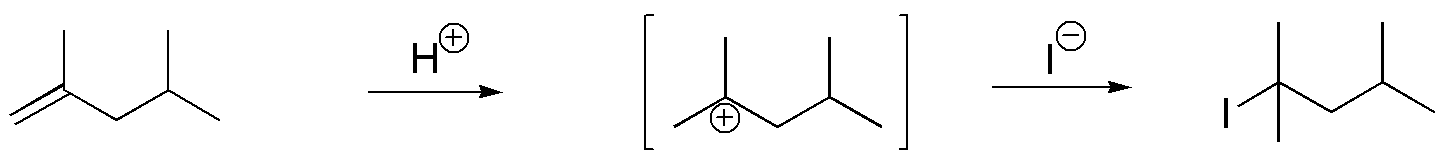
F) Las condiciones de reacción que se describen, corresponden a la reacción de mercuriación-desmercuriación. La reacción es una adición que conduce a la formación del producto Markovnikov, a través de la formación de un denominado mercurial, el cual por reacción con NaBH4 conduce a la formación de un alcohol, evitándose posibles transposiciones.
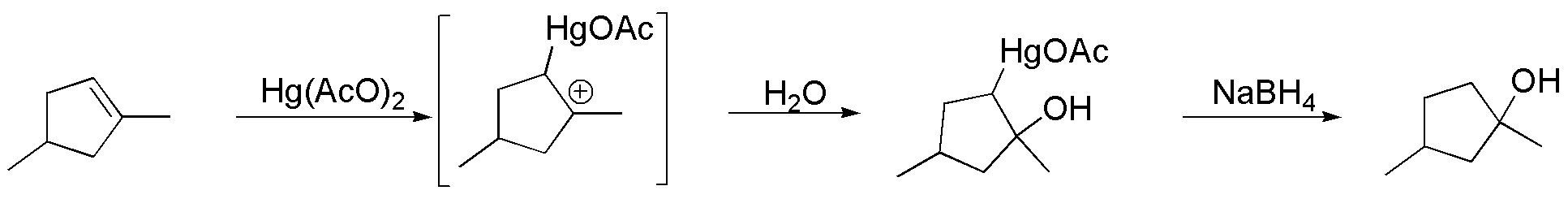
Solución 12:
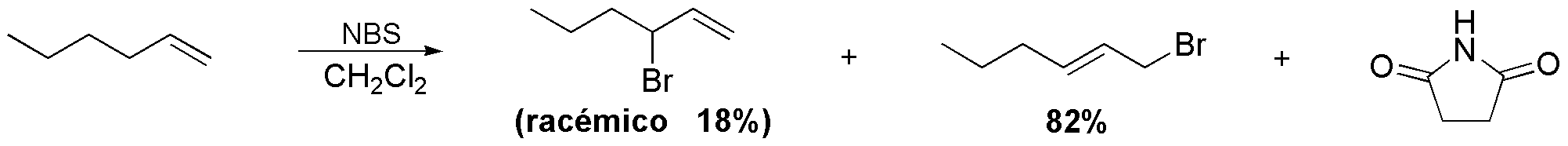
La reacción que se describe es una halogenación alílica usando como reactivo N-bromosuccinimida, que libera radicales Br· por rotura homolítica del enlace N-Br. En principio, cabría esperar que el producto mayoritario fuese el 3-bromohex-1-eno, sin embargo, se obtiene con un 82 % el 1-bromohex-2-eno. La justificación hay que buscarla en el intermedio de reacción. Se forma un radical que es en realidad un híbrido por resonancia entre dos formas límite, por lo que es relativamente estable.
![]()
El radical Br· puede atacar a los carbonos 1 o 3. El producto mayoritario proviene del ataque en posición 1 de la cadena carbonada.
Solución 13:
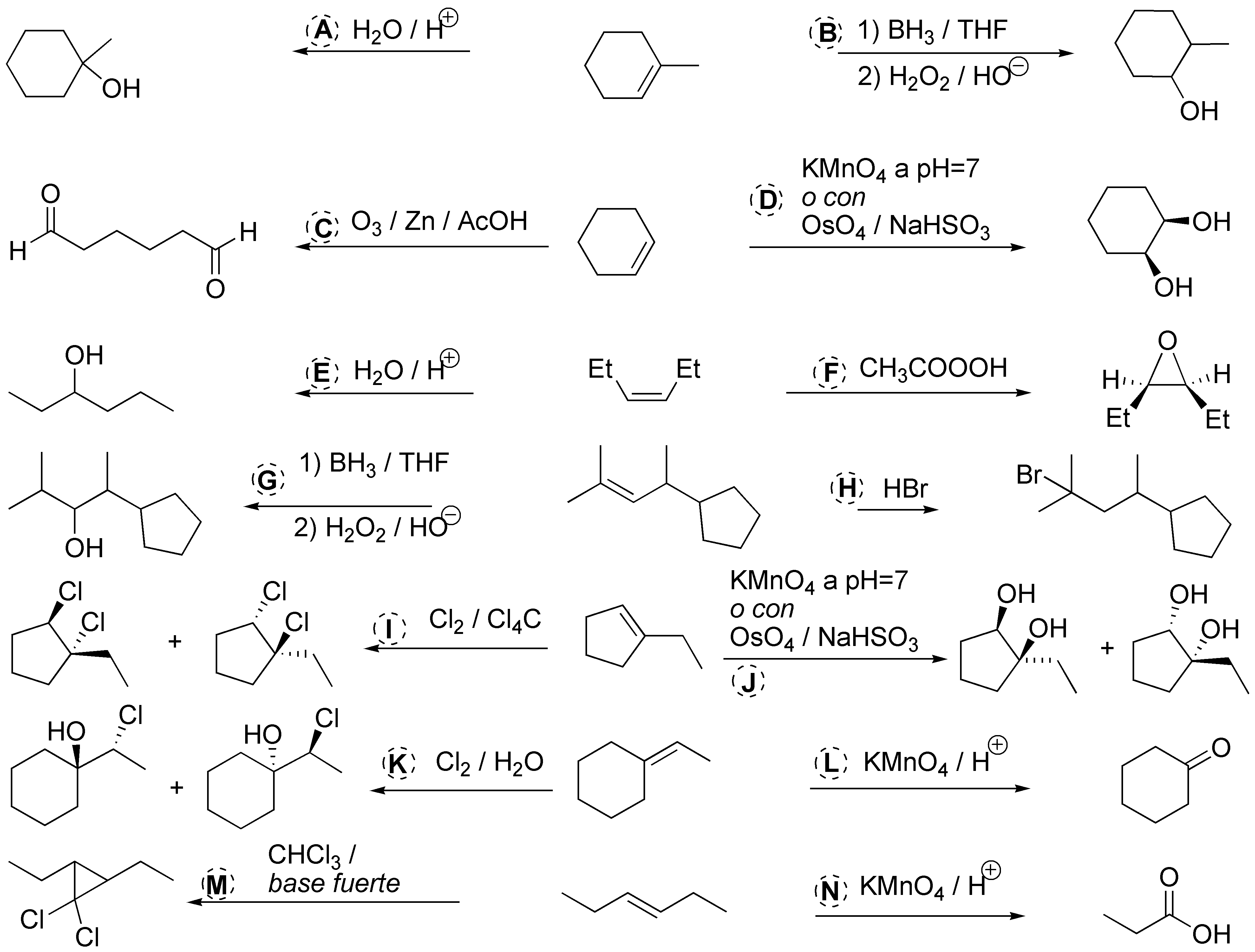
A y B) La adición de agua sobre el 1-metilciclohexano puede hacerse de modo Markovnikov (como en A) o anti-Markovnikov(como en B) por lo que las condiciones para realizar dichas transformaciones serán: para A H2O / H+ y para B) hidroboración (BH3 / THF) y posterior oxidación (H2O2 / OH–).
C) La rotura oxidativa del ciclohexeno a un dialdehído implica la ozonólisis y posterior reducción del ozónido con un reductor como Zn/AcOH.
D) La transformación en un diol (dihidroxilación) puede realizarse mediante el KMnO4 a pH=7 o con OsO4 / NaHSO3.
E) La conversión del 3(Z)-hexeno en 3-hexanol implica la hidratación en medio ácido del mismo.
F) La conversión en un epóxido (oxaciclopropano) implica la oxidación con un perácido, por ejemplo ácido peroxiacético (CH3COOOH).
G) Implica la hidratación del alqueno tipo anti-Markovnikov por lo que debemos utilizar hidroboración/oxidación como en B.
H) La conversión supone la hidrobromación tipo Markovnikov por lo que utilizaríamos HBr en ausencia de iniciadores de radicales.
I) Se ha producido la cloración (Cl2 / Cl4C) del doble enlace.Esta es una adición anti y el producto final aparecerá como una mezcla racémica de los dos posibles enantiómeros.
J) La dihidroxilación se puede realizar como en D: con permanganato a pH neutro o mediante tetróxido de osmio / bisulfito sódico. Se produce por ambas caras del doble enlace
K) Se ha adicionado ClOH. Es una reacción de formación de clorohidrina por lo que se realiza con Cl2 en agua, dando una mezcla de estereoisómeros.
L) Es una degradación oxidativa a cetona puede realizarse con ozono y reductor (Zn / AcOH) o con permanganato en medio ácido.
M) Se ha producido un ciclopropano por lo que se trata de la adición de un carbeno. Se realiza con cloroformo en medio fuertemente básico.
N) Es una degradación oxidativa a ácido carboxílico por lo que se realizará con KMnO4 en medio ácido.
Solución 14:
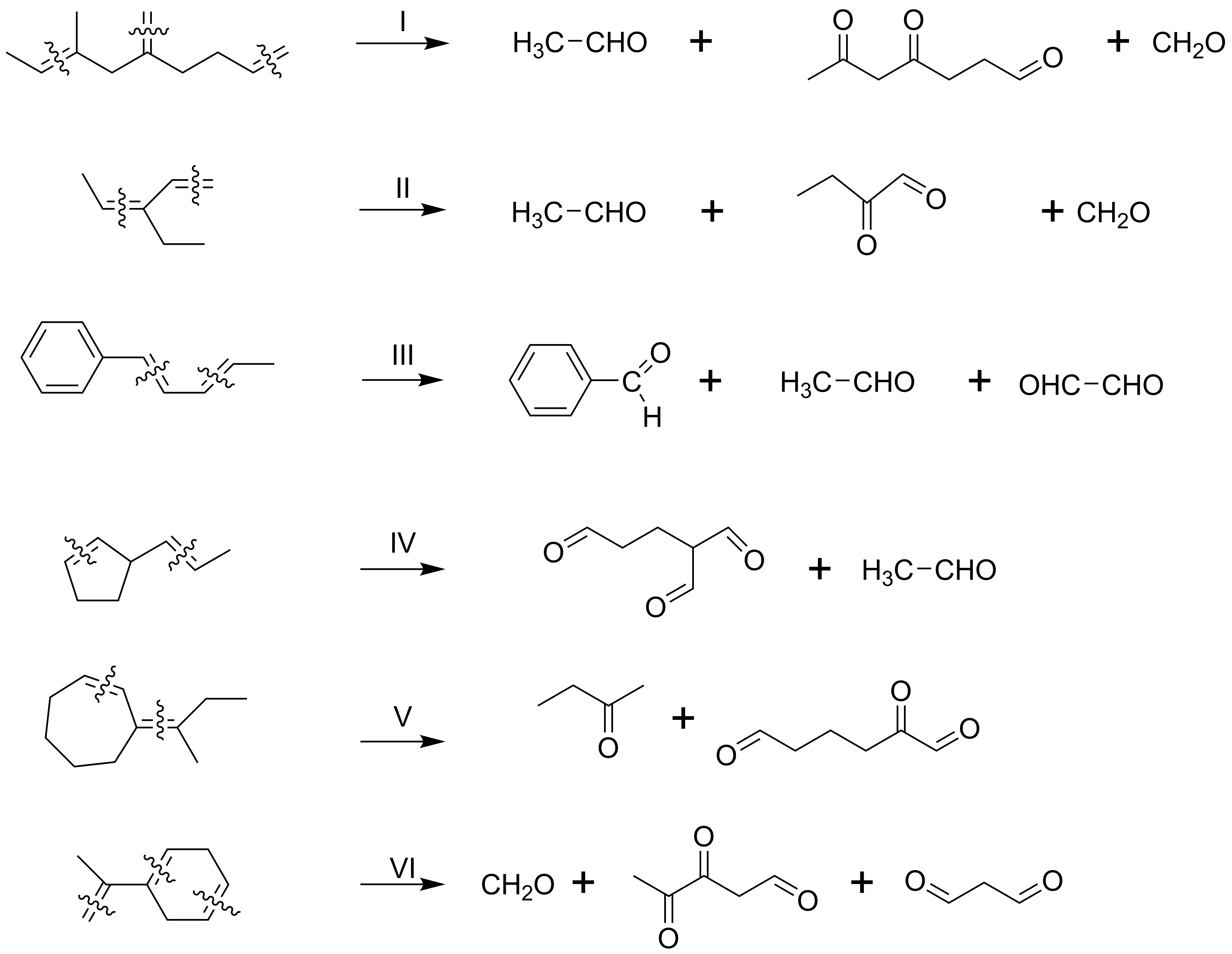
I) La ozonólisis supone la rotura oxidativa de todos los dobles enlaces de la molécula produciendo los correspondientes compuestos carbonílicos se formarían, por tanto formaldehído (2 moles), acetaldehído y 4,6-dioxaheptanal.
II) Daría formaldehído, acetaldehído y 2-oxabutanal.
III) Daría benzaldehído, glioxal (CHO-CHO) y acetaldehído.
IV) Daría acetaldehído y el trialdehído.
V) Daría butanona y 2-oxa-heptanodial.
VI) Daría Formaldehído y metilfenilcetona (acetofenona).
Solución 15:
En todos los casos la reacción comienza por el ataque de un electrófilo (E+) al sistema de dobles enlaces conjugados. Este ataque del electrófilo ocurre en uno de los extremos del dieno conjugado.

El intermedio es un híbrido por resonancia, en el que existe mayor densidad de carga positiva sobre las posiciones 2 y 4 del sistema conjugado, y es justamente ahí donde se produce el ataque del nucleófilo. A la vista de los reactivos empleados el resultado de la reacción para cada caso será el siguiente:
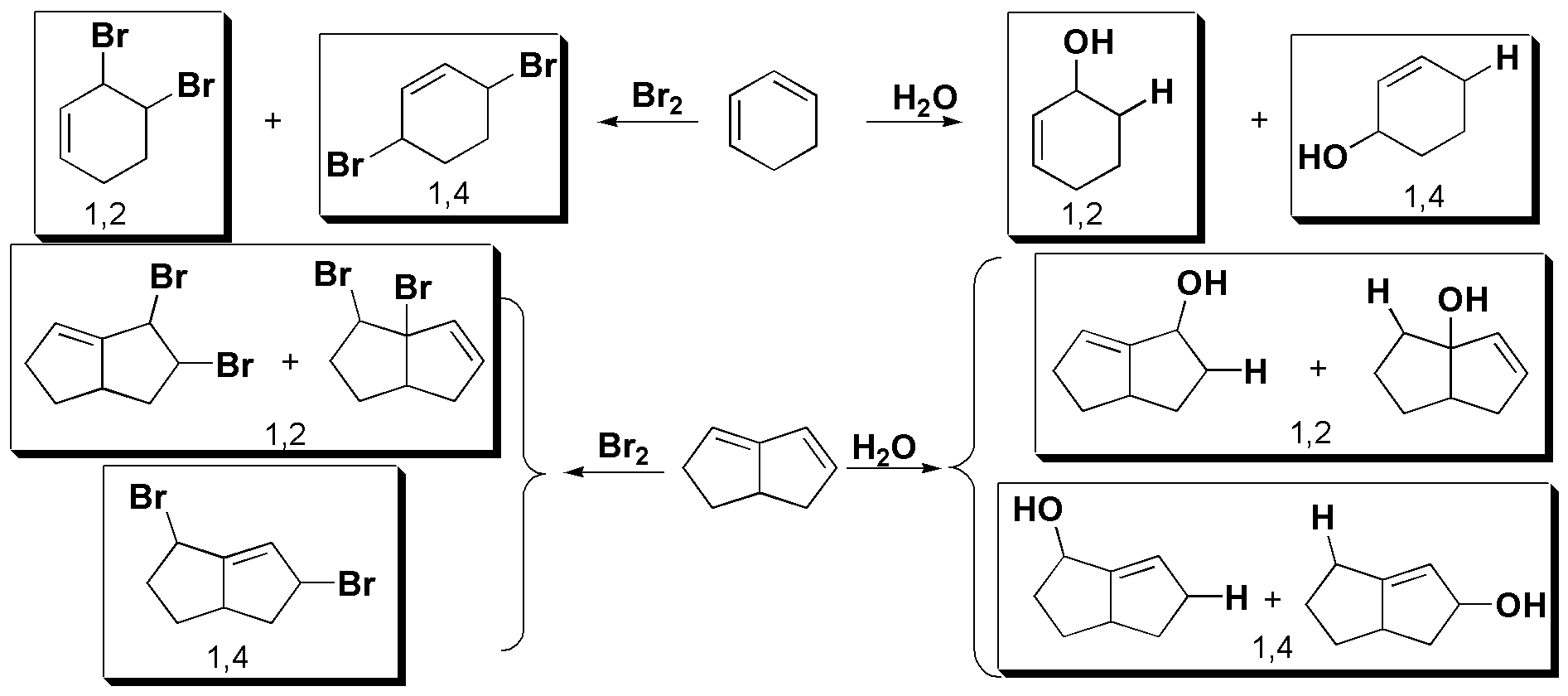
(Nótese que en el caso de dienos simétricos la reacción es más sencilla, mientras que en dienos asimétricos se pueden dar mezclas de productos.)
Solución 16:
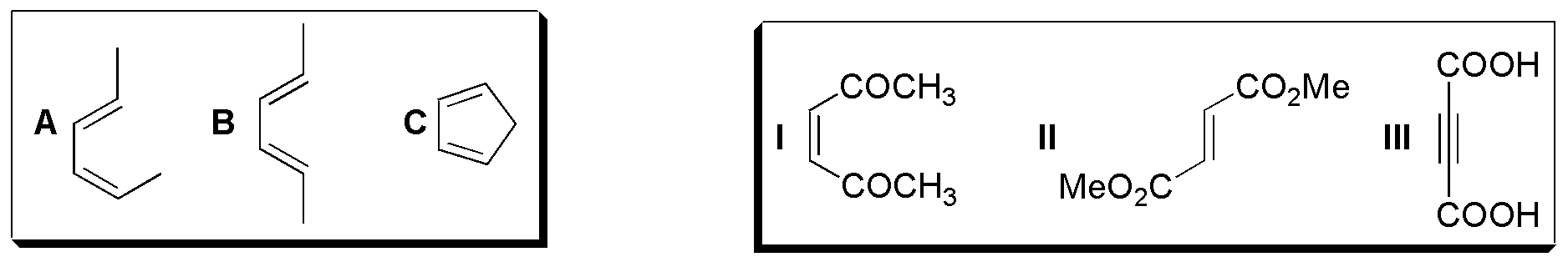
Para la resolución de este ejercicio se deben tener en cuenta las siguientes consideraciones, dado que la reacción es estereoespecífica tanto para el dieno como para el dienófilo:
- Si los sustituyentes en los dobles enlaces del dieno son E y Z como ocurre en el dieno A, éstos aparecen en las caras opuestas del aducto.
- Si los sustituyentes en los dobles enlaces del dieno son ambos Z, como ocurre con B, se sitúan en la misma cara del aducto.
- Los sustituyentes en cis del dienófilo, como ocurre con I, aparecen en el aducto con configuración cis
- Los sustituyentes en trans del dienófilo, como en II, aparecen en el aducto con configuración trans.
- En dienos cíclicos está más favorecido el ataque de tipo endo que el exo.
- Cuando se forman productos quirales se obtienen parejas de enantiómeros ya que en las condiciones en que se realiza una reacción convencional no hay inducción asimétrica.
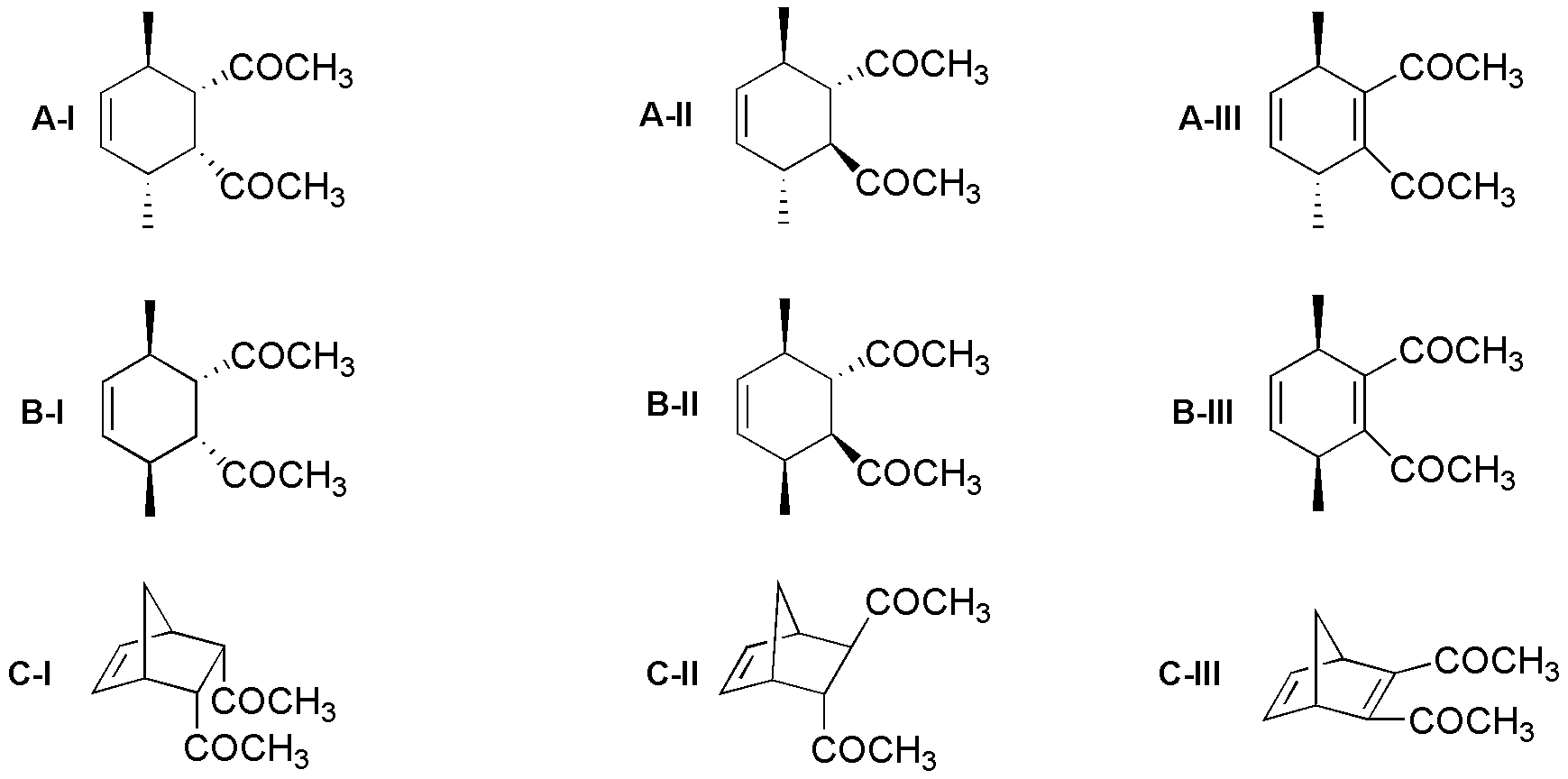
Los compuestos A-I, A-II, A-III, B-II y C-II se obtienen como una mezcla equimolecular de la estructura representada y su imagen especular, es decir, como un racémico.
Solución 17:
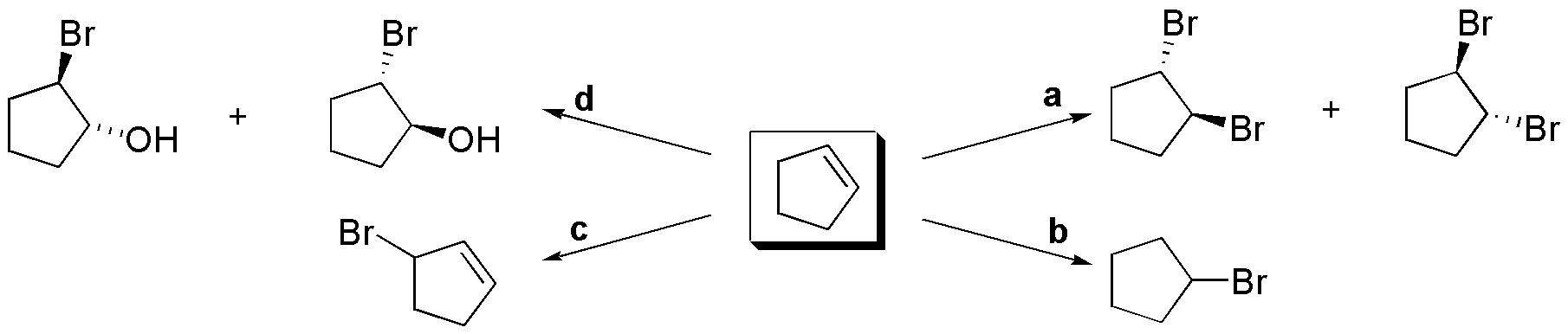
a) La preparación de un haloalcano primario a partir de un alqueno sugiere el uso de una reacción de adición de HX anti-Markovnikov en un doble enlace del tipo =CH2 (terminal). El único alqueno que cumple esta condición es I.
b) Para la obtención de un haloalcano secundario se puede usar como reactivo HX en una reacción de adición tipo Markovnikov(ausencia de peróxidos). Si se usa I, el resultado es un haloalcano terciario, para III, al haber dos dobles enlaces la adición de un mol de HX lleva a la formación de un haloalqueno (queda un doble enlace) y si se usan dos moles, se obtiene una mezcla de dihaloalcanos que son entre sí isómeros constitucionales. La reacción descrita con II produce halociclopentano que es, evidentemente, un haloalcano secundario.
![]()
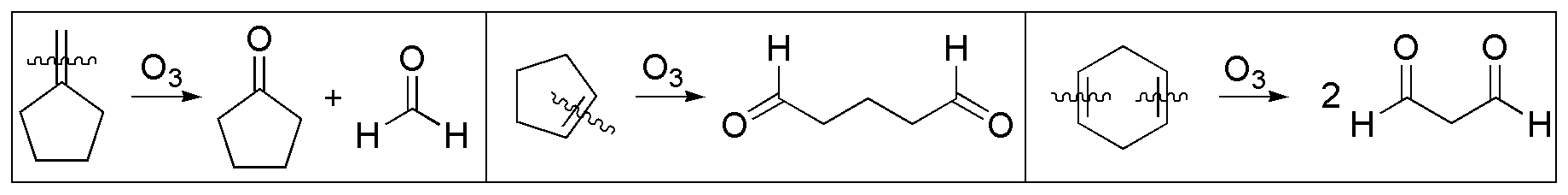
c) y d) La ozonólisis de alquenos conduce a la formación de compuestos carbonílicos. En la figura se indican los productos obtenidos mediante la ozonólisis de los alquenos de partida (I–III). Para la obtención de una cetona cíclica se parte de I y para un dialdehído de II y III.
e) Como se ha comentado en el apartado b), la adición de 1 mol de HX a III conduce a la formación de un haloalqueno.
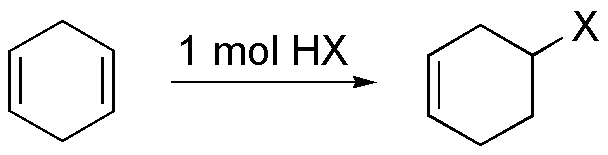
f) Para obtener un alcano a partir de un alqueno, basta con elegir la estructura con igual esqueleto carbonado y por hidrogenación catalítica se adiciona el hidrógeno necesario sobre el doble enlace para generar el compuesto saturado, por tanto, partiendo de II se obtiene ciclopentano.
![]()
g) El tratamiento con permanganato potásico en medio básico y en caliente de un alqueno produce lo que se denomina rotura oxidativa. Si el doble enlace es del tipo -CH=CH- se obtienen dos ácidos carboxílicos en forma de sal potásica, puesto que el pH es básico. Para liberar el ácido carboxílico, hay que acidificar el crudo de reacción. Si el doble enlace es del tipo -CH=CH2 se genera un ácido carboxílico, R-COOH y CO2. Si el alqueno es RR’C=CR»R»’, se obtienen dos cetonas (RR’C=O y O=CR»R»’). El ácido propanodioíco es el resultante de la rotura oxidativa de uno de los alquenos de partida. Las tres posibilidades de rotura se indican en el esquema, siendo sólo compatible con el enunciado si partimos de III.
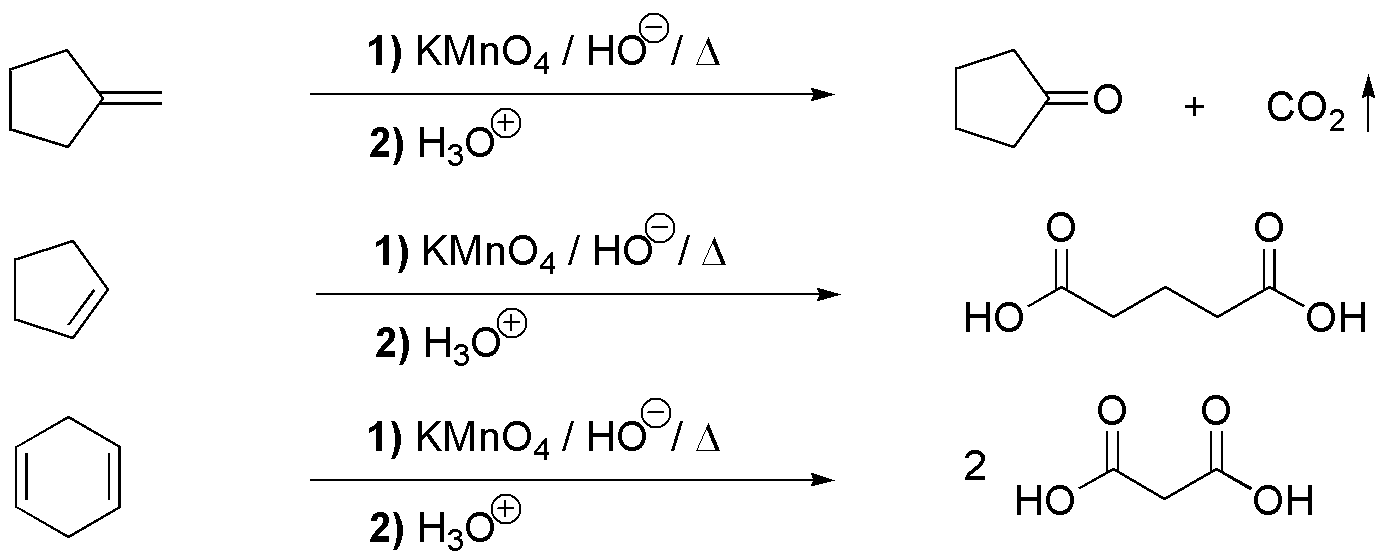
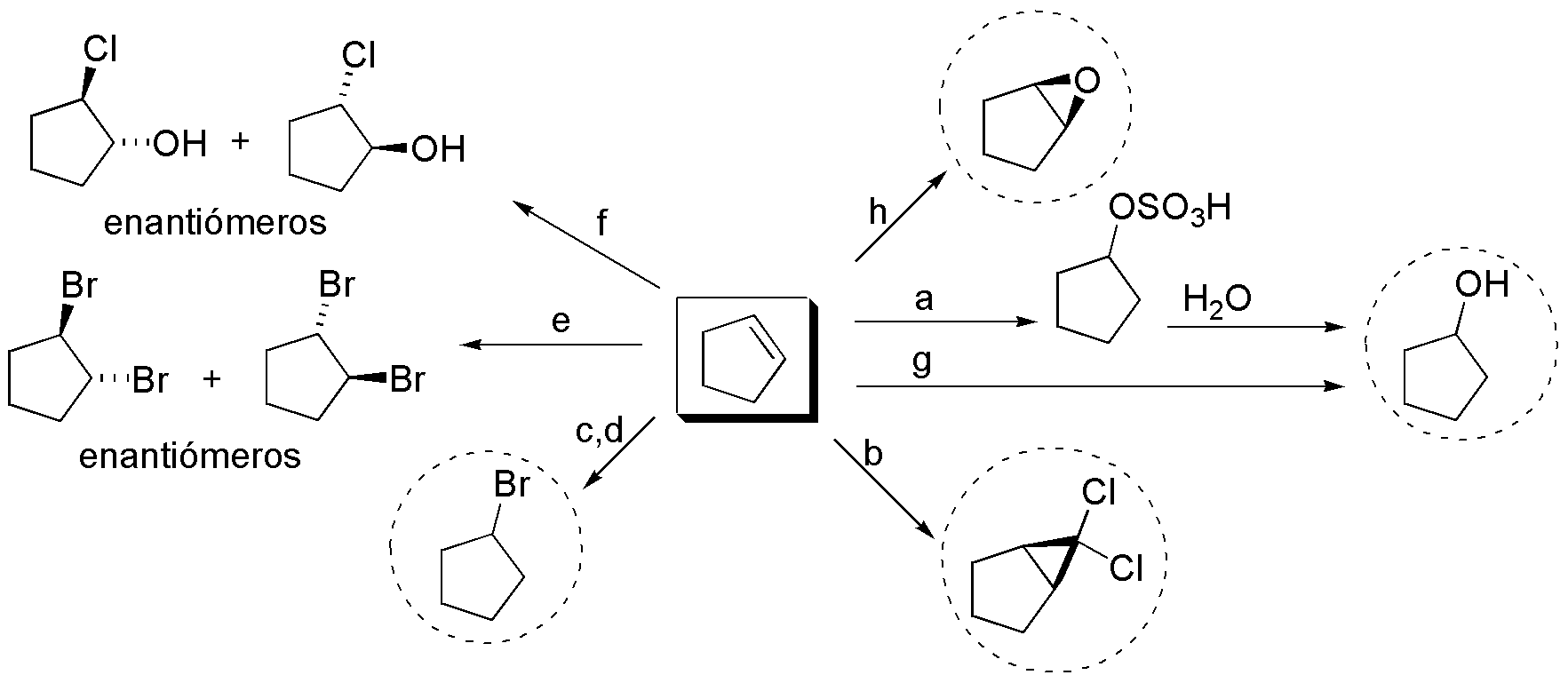
Solución 18:
a) Para esta transformación es necesario Br2 en un disolvente como CH2Cl2 o CCl4. En estas condiciones se produce la adición anti de Br, obteniéndose una pareja de enantiómeros.
b) El producto es el resultado de la adición de HBr al doble enlace. La adición en presencia de iniciadores de radicales o en ausencia de los mismos es indiferente en este caso concreto, puesto que tanto la adición Markovnikov como anti-Markovnikovproducen el mismo compuesto.
c) El tratamiento del ciclopenteno con NBS en CH2Cl2, iluminando con luz adecuada para romper el enlace N-Br y producir los radicales necesarios, permite la sustitución de un hidrógeno en la posición alílica.
d) Para obtener este producto se necesita tratar el ciclopenteno con Br2 en medio acuoso. El ión bromonio intermedio se abre por el ataque del agua, dando una pareja de enantiómeros.
Solución 19:
A partir del 2-metilpropeno se produce un carbocatión terciario que actúa como electrófilo sobre una segunda molécula de alqueno, dando un segundo carbocatión, que de nuevo ataca a una tercera molécula de 2-metilpropeno. La reacción termina con la pérdida de un protón para dar un doble enlace.

Solución 20:
Cuanto mayor sea la sustitución en un doble enlace mayor, es la densidad electrónica debido al efecto inductivo de los radicales alquilo. Eso se traduce en una aumento de la velocidad en el ataque del oxígeno del peroxiácido en la reacción de epoxidación.
Solución 21:
| Reactivo | Reacción | Propiedades |
| HBr / peroxides | adición radicalaria | radicales Br· y H· |
| H2S | ozonólisis | reductor |
| B2H6 | adición electrófila | reductor; transfiere H |
| RCO3H | epoxidación | oxidante |
| O3 | ozonólisis | oxidante |
| HCl | adición electrofílica | H+ (electrófilo); Cl– (nucleófilo) |
| H3PO4 | hidratación de alquenos | H+ (electrófilo) |
| H2O | hidratación de alquenos, formación de halohidrinas | nucleófilo |
| H2 | hidrogenación catalítica | reductor |
| CH2I2 | ciclopropanación | genera carbenos |
Solución 22:
Las moléculas resaltadas en la figura con círculos discontinuos son aquirales.
Solución 23:
Cuando se irradia, calienta o se pone en presencia de cobre un diazocompuesto genera un carbeno que se adiciona a los dobles enlaces generando un ciclopropano:
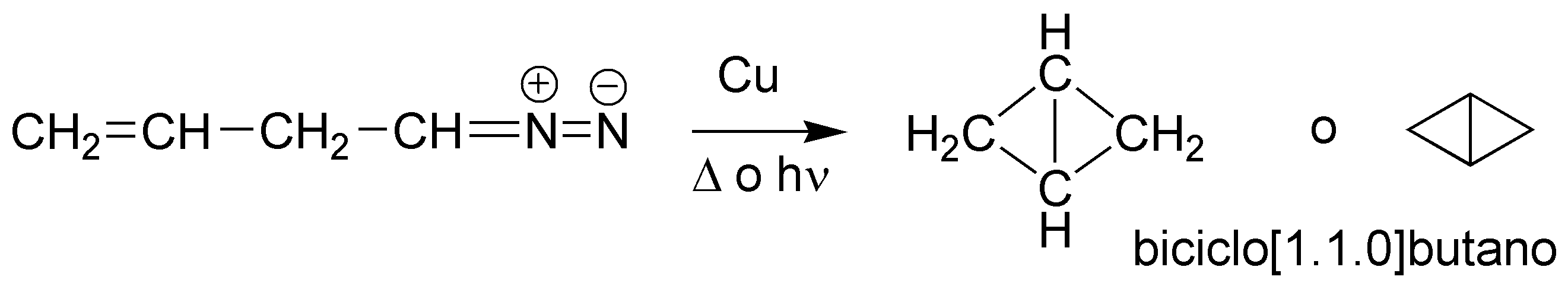
Solución 24:
Se trata de una adición anti y por tanto:
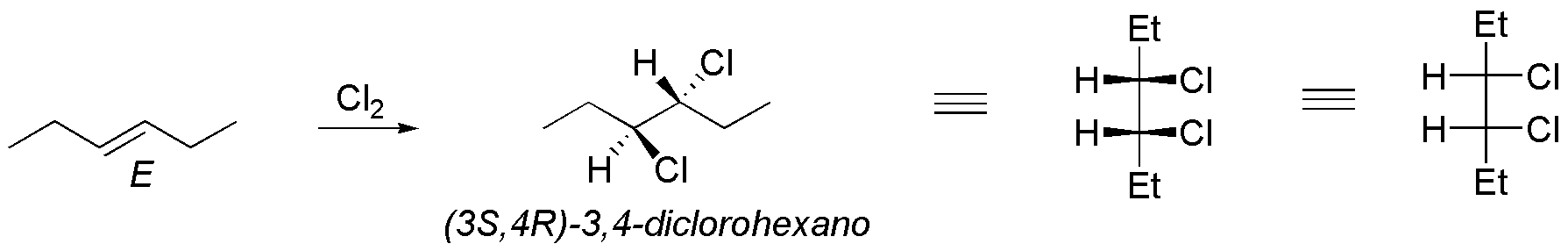
Solución 25:
Las reacciones de hidratación b) y de hidrogenación d) darían el producto que se indica a partir de cualquiera de los dos alquenos de partida Z o E (I o II). La primera reacción es una halogenación y sólo se puede emplear el compuesto (I) como reactivo de partida. Para obtener el producto C mediante epoxidación c) necesitamos el alqueno (II) de partida.
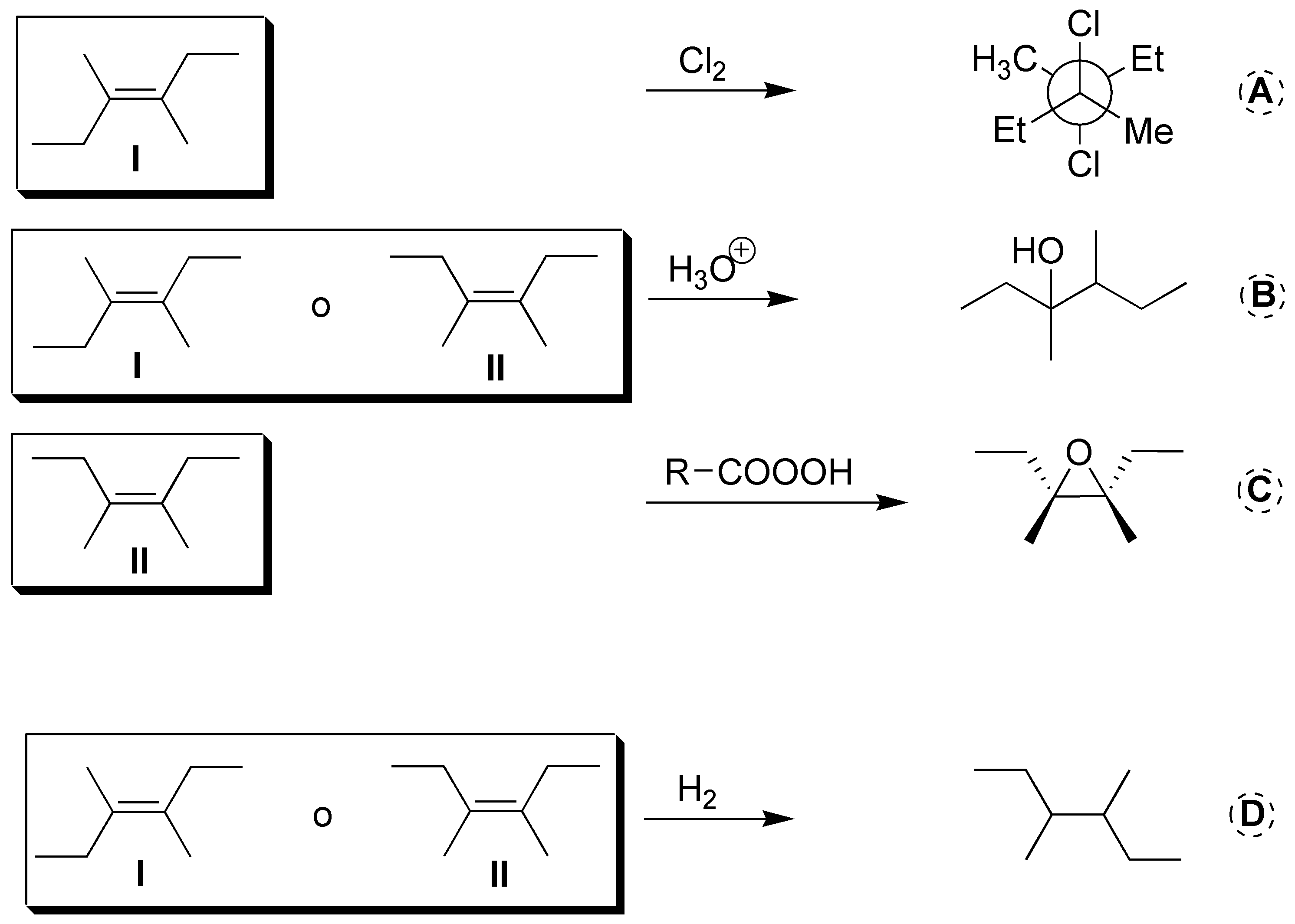
Solución 26:
a) adición Markovnikov: se puede relacionar con las reacciones I) y II), mercuriación / desmercuriación e hidratación de alcoholes, pues el resultado global del mismo es la la introducción del grupo hidroxilo sobre el carbono más sustituido (menos hidrogenado).
b) proceso estereoespecífico: la hidrogenación catalítica (III) es estereoespecífica al tratarse de una adición sin.
c) adición anti: el proceso I) mercuriación / desmercuriación, lo es pues el OH y el átomo de mercurio entran por caras opuestas del alqueno.
d) adición anti-Markovnikov: El proceso IV) hidroboración / oxidación tiene una regioselectividad anti-Markovnikov pues el resultado global del mismo es la la introducción del grupo hidroxilo sobre el carbono menos sustituido (más hidrogenado)
Solución 27:
Se tratará de una adición de estereoquímica anti por lo que en ambos casos se obtendrá el producto indicado como un par de enantiómeros:
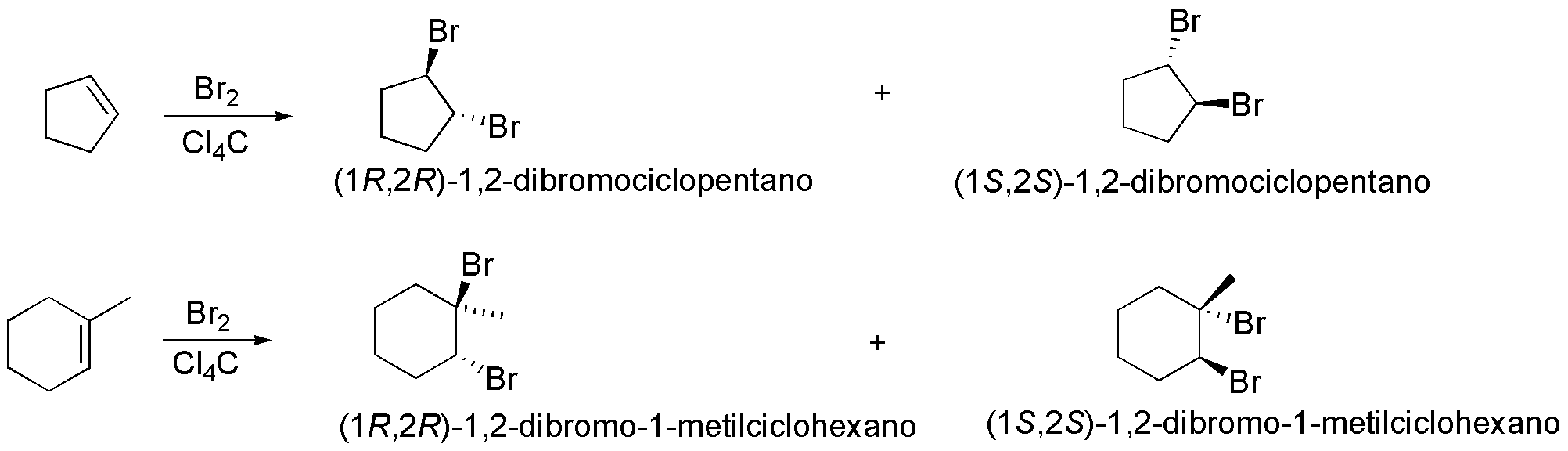
Solución 28:
La adición de halógenos en solución acuosa conduce a las correspondientes halohidrinas, que aparecerán como una mezcla de los 8 posibles estereoisómeros (2 pares de enantiómeros para cada isómero) teniendo en cuenta que no existe regioselectividad en la reacción:
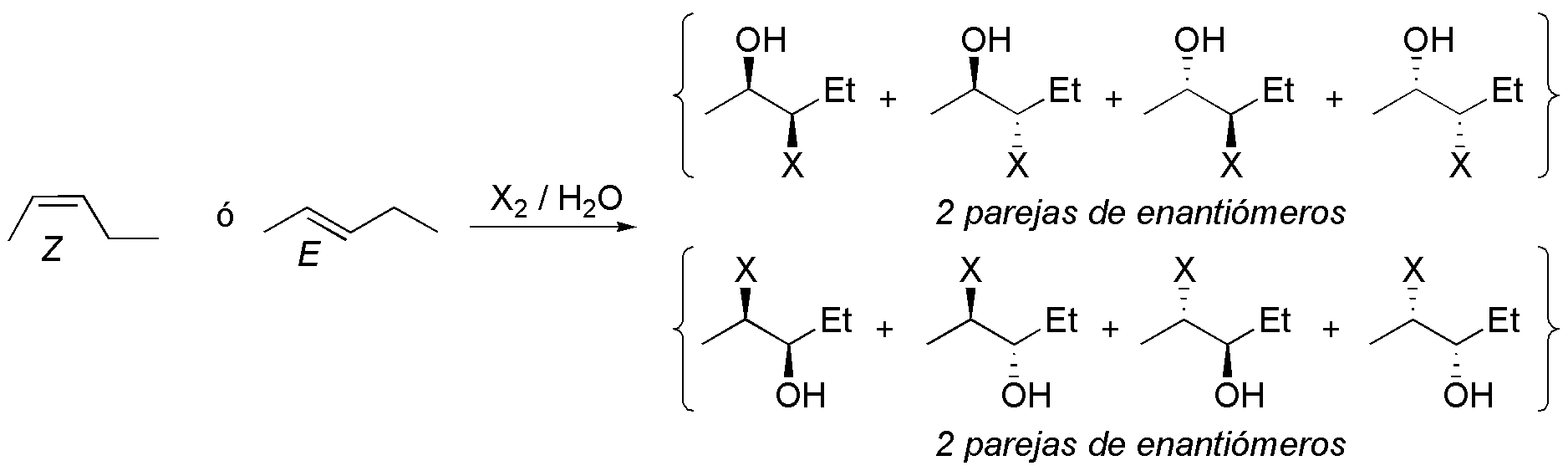
Solución 29:
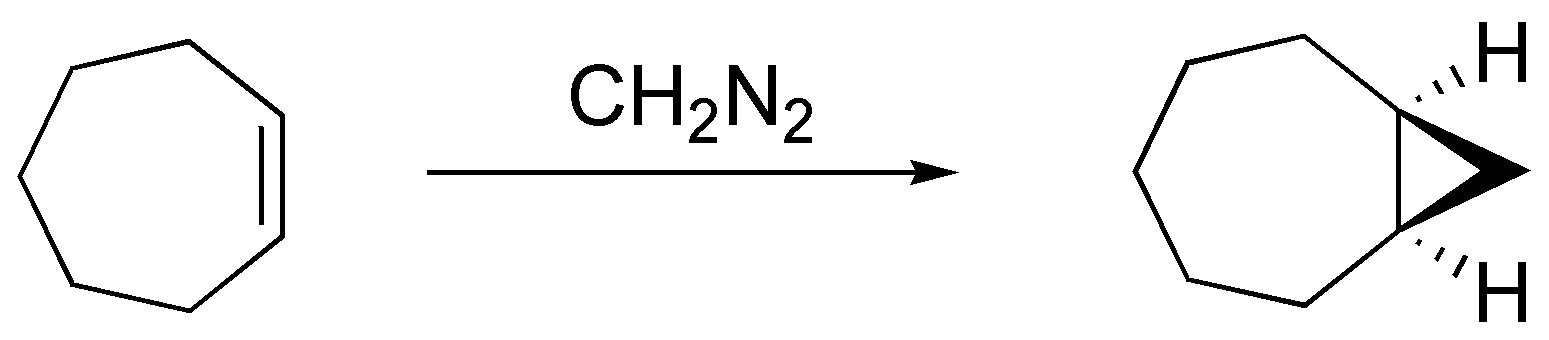
El diazometano cuando reacciona con los alquenos produce ciclopropanos de una manera estereoespecífica. En el caso del ciclohepteno como un único producto al poseer un plano de simetría y en el caso del metilciclohexeno y (E)-but-2-eno como un par de enantiómeros, al no poseerlo:
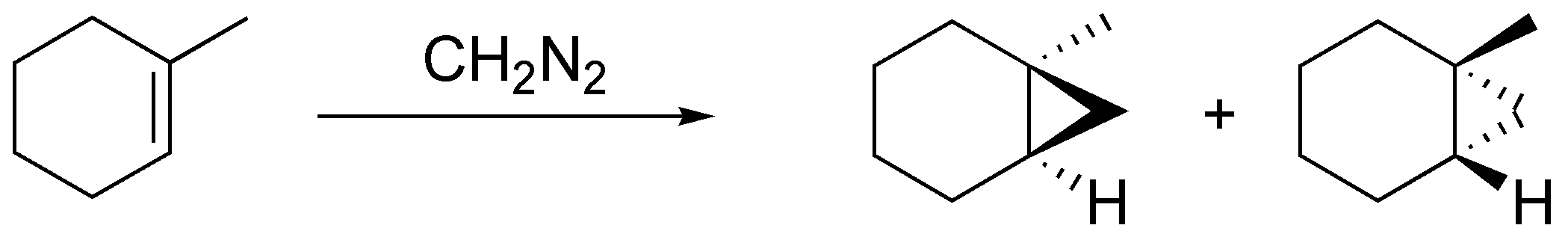

Solución 30:
Los perácido generan con los alquenos epóxidos (oxaciclopropanos) siendo una reacción estereoespecífica:
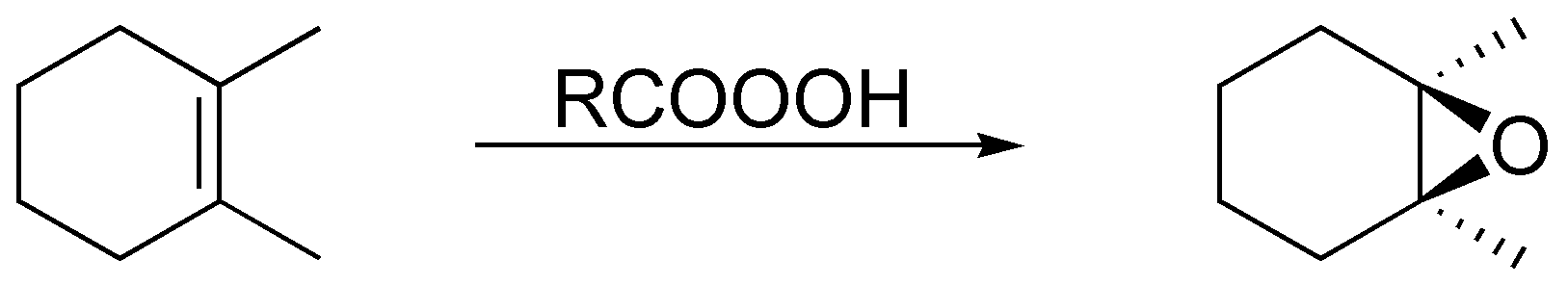

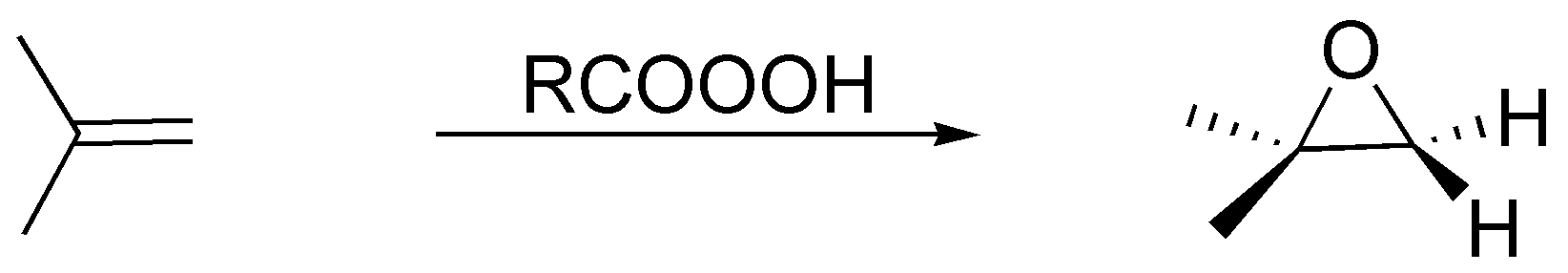
Solución 31:
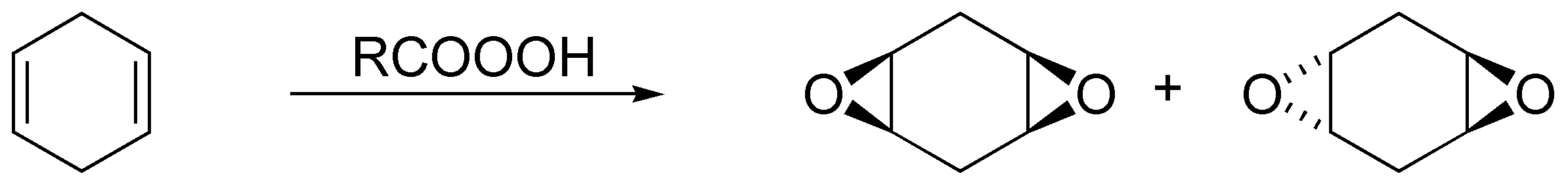
Como podemos observar, la única reacción que produce productos diferentes es la epoxidación (reacción estereoespecífica). La hidrogenación, aunque normalmente también lo es, en este caso produce hexano que no es quiral. La hidrohalogenación es sólo regioselectiva (no en este caso) y produce los correspondientes 2-bromo y 3-bromo hexanos como mezclas racémicas.
Solución 32:
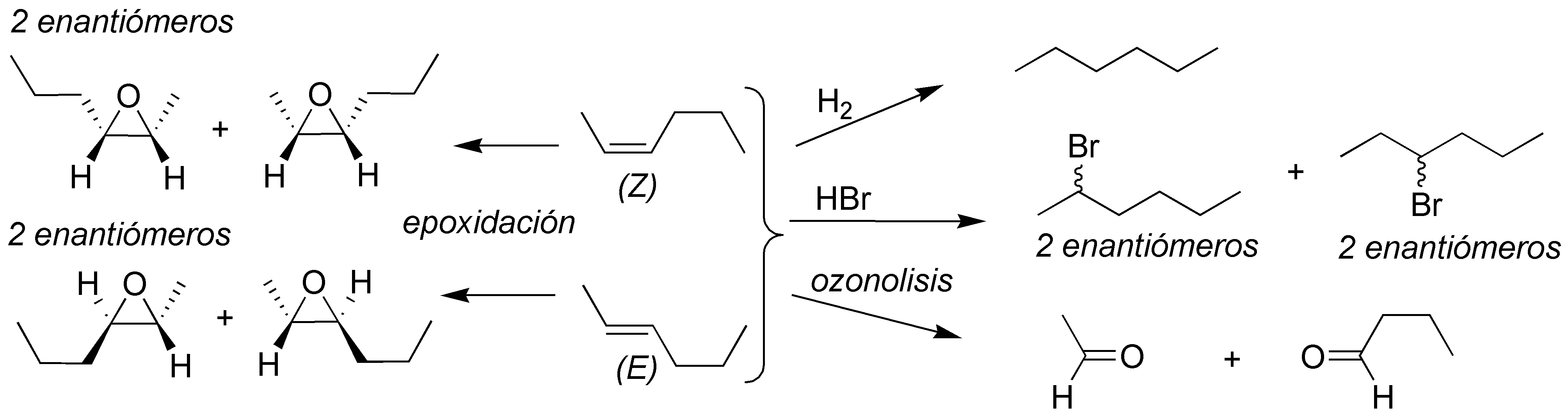
La adición de bromo a un alqueno es una reacción estereoespecífica, con una estereoselectividad anti. Como los alqueno de partida no son ópticamente activo (no son quirales) las reacciones deben producir una mezcla ópticamente inactiva: en el caso Iaparecerán como mezcla de dos pares de enantiómeros y en los restantes como una pareja de enantiómeros:
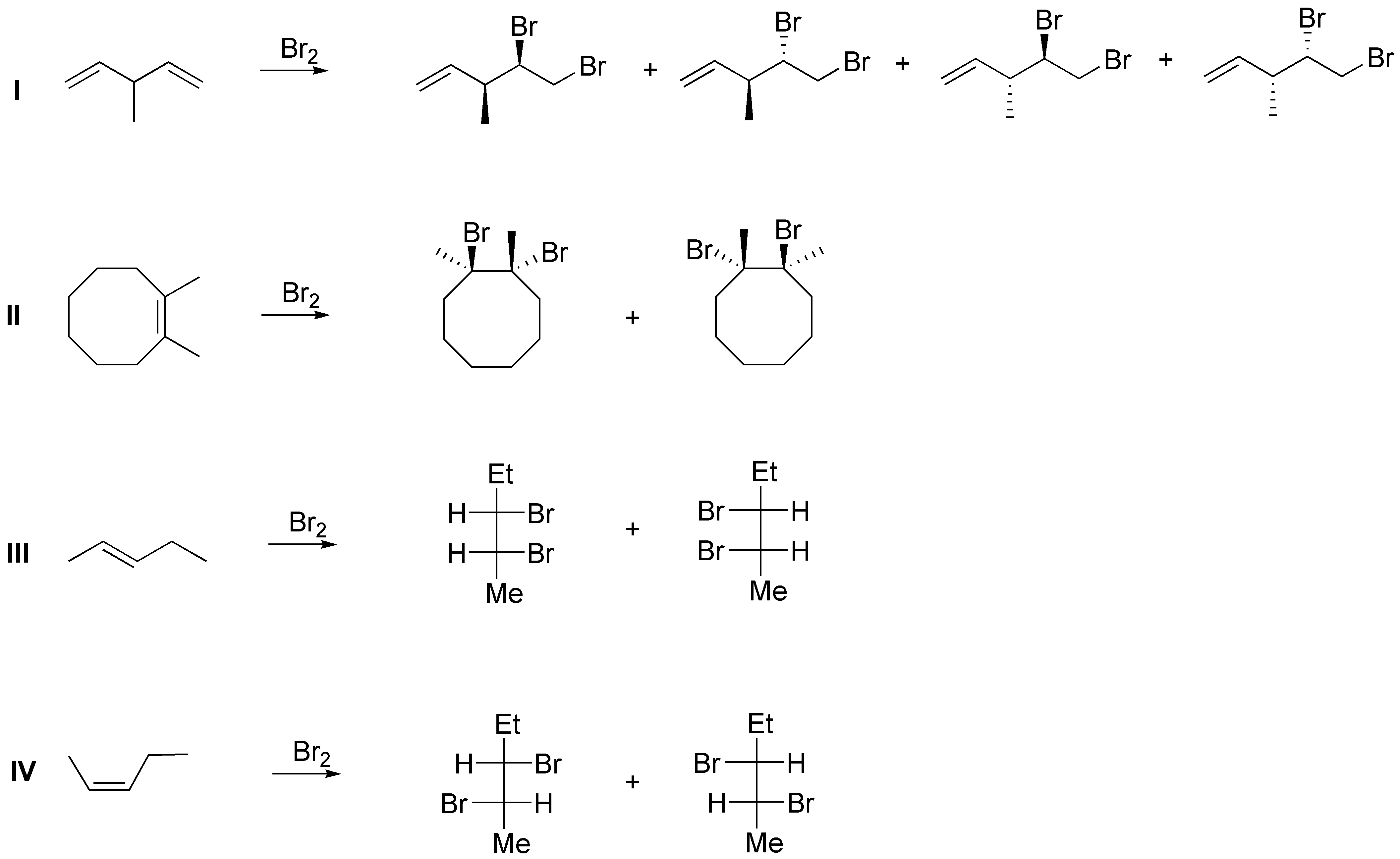
Solución 33:
La reconstrucción del alqueno de partida se consigue sin más que sustituir el grupo carbonilo por un doble enlace, el grupo ácido por un CH= y el CO2 por un CH2=, así tendremos:
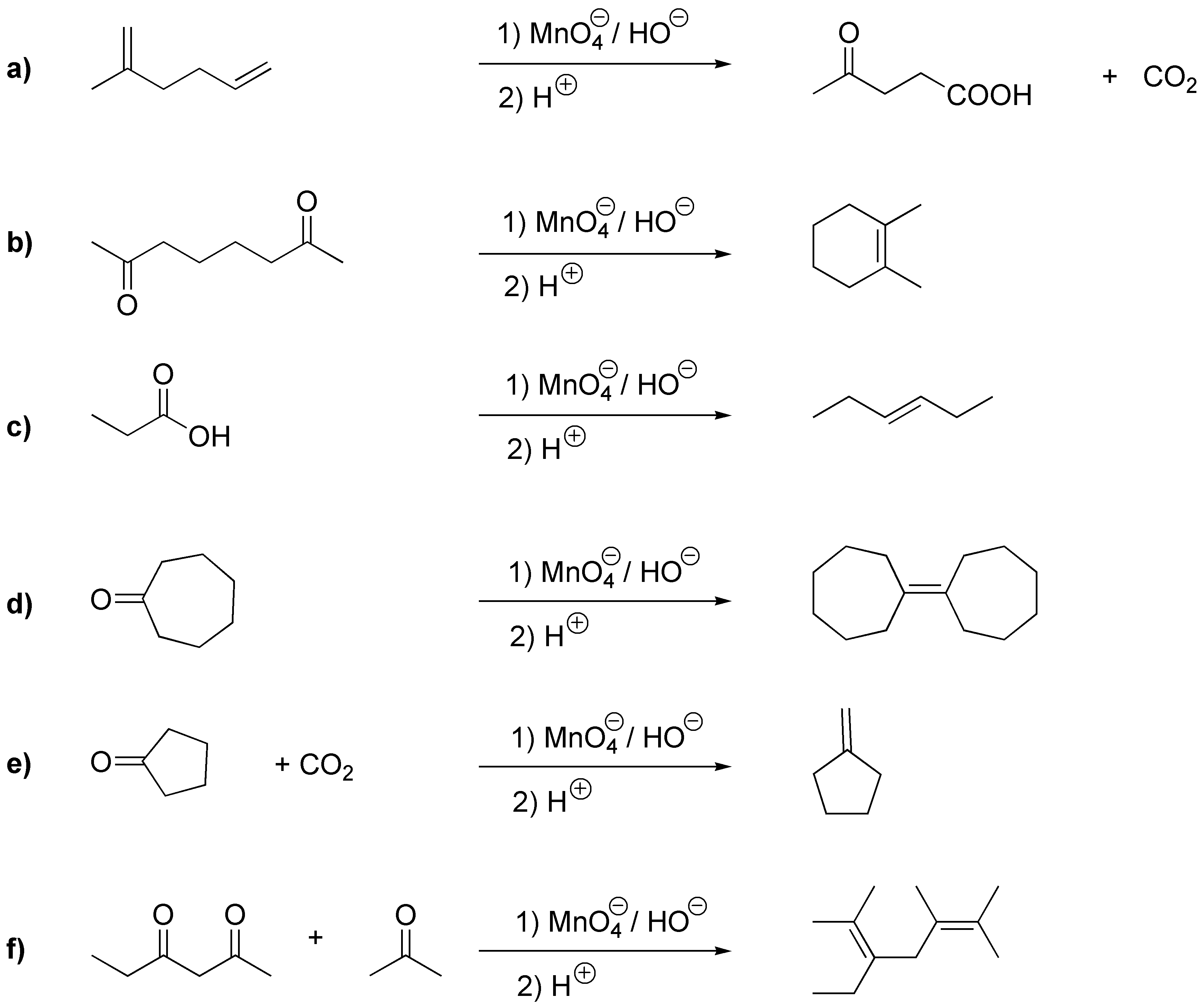
Solución 34:
El producto de partida debe tratarse de un dieno pues adiciona 4 átomos de hidrógeno. Para determinar la situación de los dobles enlace la solución nos la da la ozonólisis: el propanodial es el fragmento intermedio de la estructura y los extremos generarán acetaldehído y acetona. No es posible determinar la estereoquímica del producto (E o Z) pero si se pueden predecir los isómeros obtenidos al reaccionar con HCl.
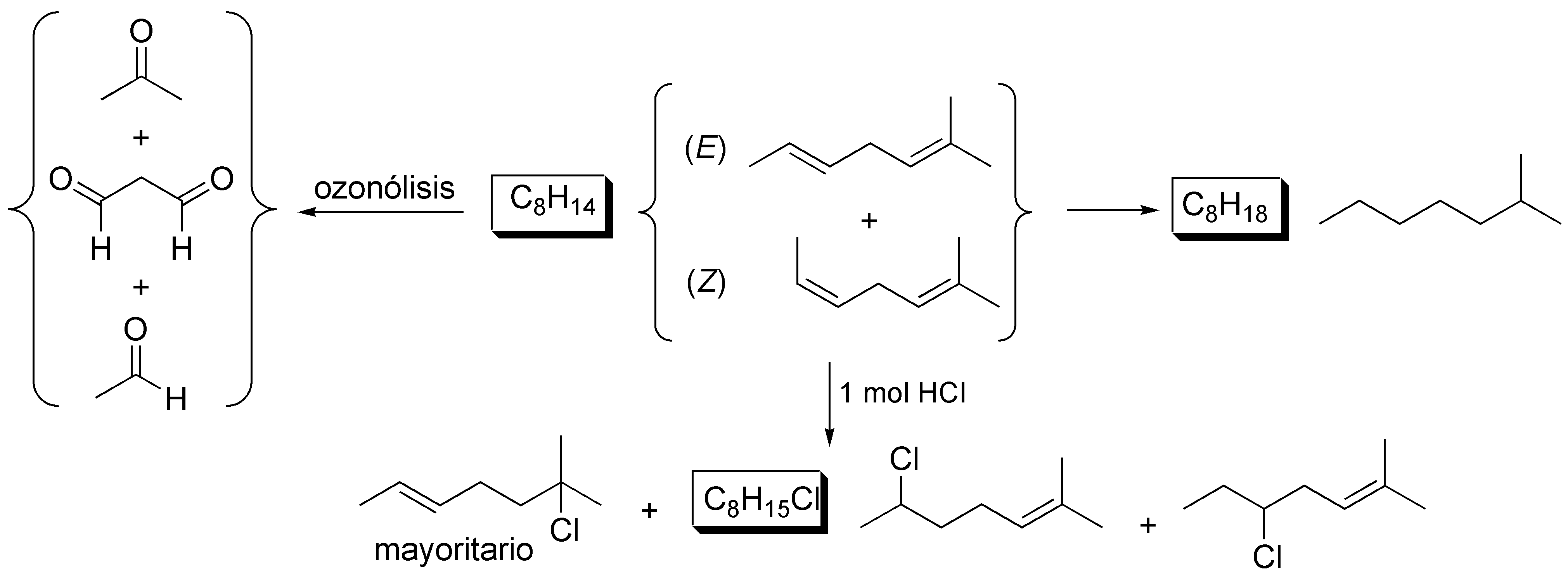
Solución 35:
El tratamiento con un ácido mineral produce un carbocatión que reaccionará con otra molécula del alqueno generando un nuevo carbocatión que pierde un protón dando un alqueno (en principio el más estable termodinámicamente, es decir el más sustituido):
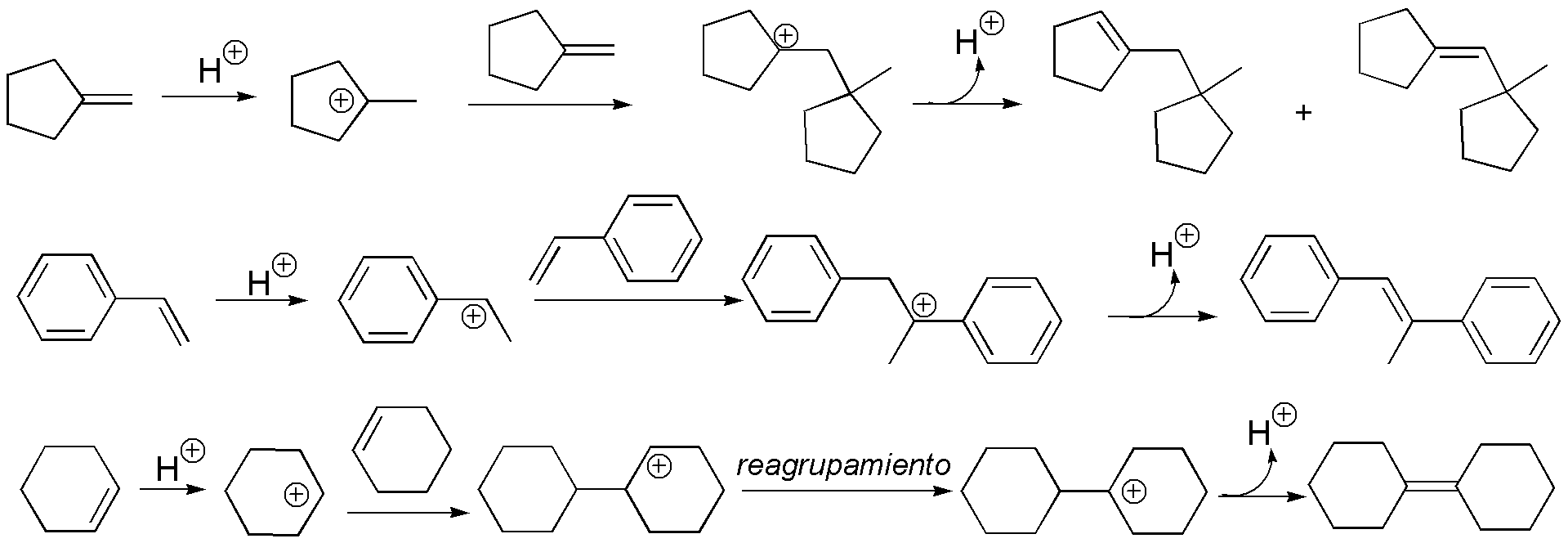
Solución 36:
Para realizar este ejercicio de una forma sistemática es mejor considerar cada alqueno por separado y analizar uno a uno los posibles fragmentos que se pueden obtener a partir de cada uno de ellos por reacción de ozonólisis.
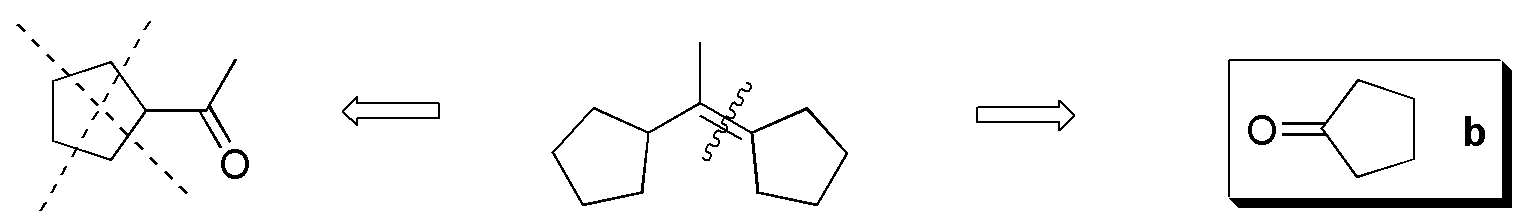
Compuesto I) Se pueden establecer los siguientes fragmentos:
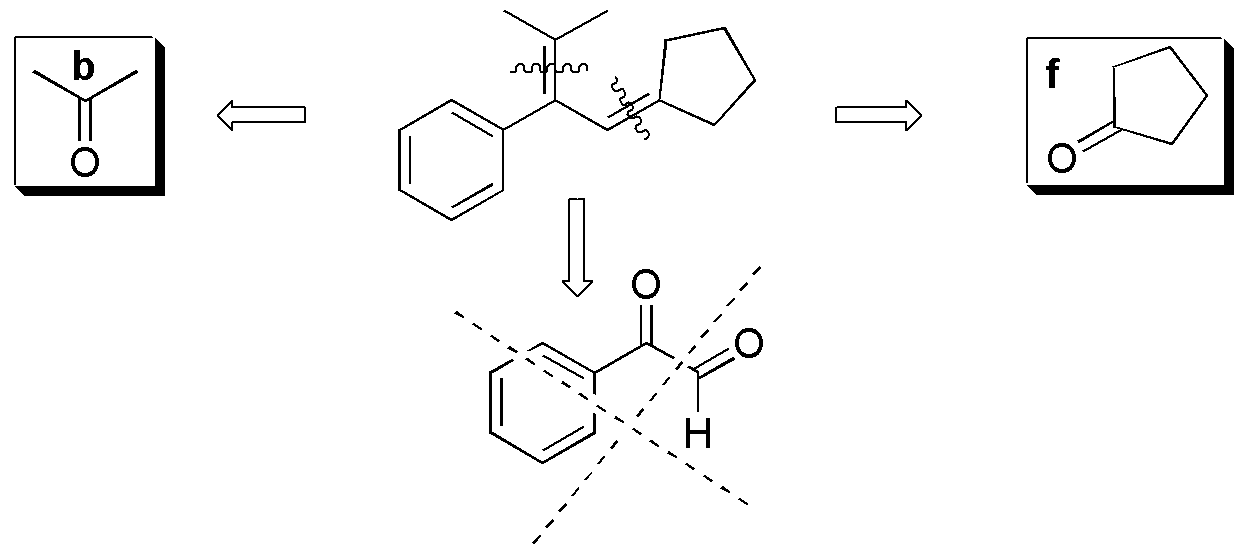
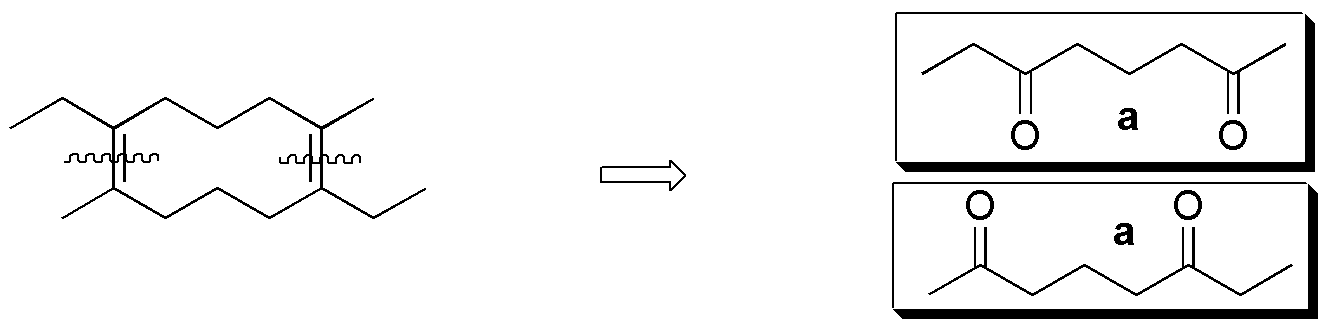
Compuesto II) La ozonólisis de II conduce a la formación de 5-oxo-hexanal. No se obtiene ninguno de los compuestos carbonílicos de la figura (a–f).
Compuesto III) Sin embargo, la ozonólisis de III produce 6-oxo-heptanal.
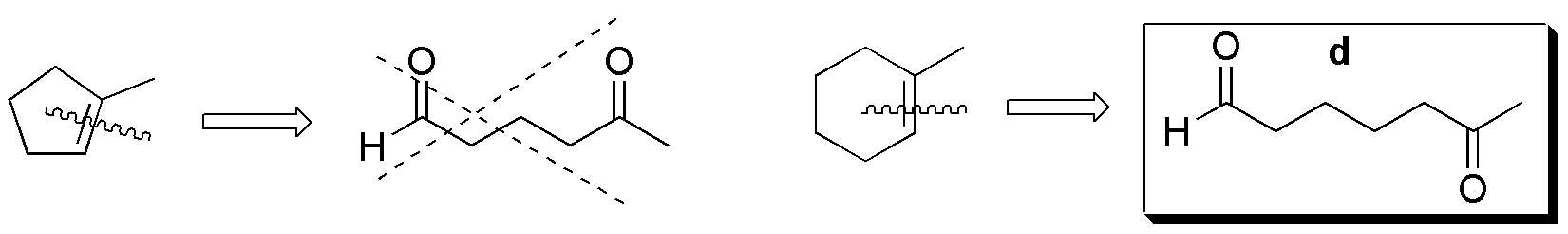
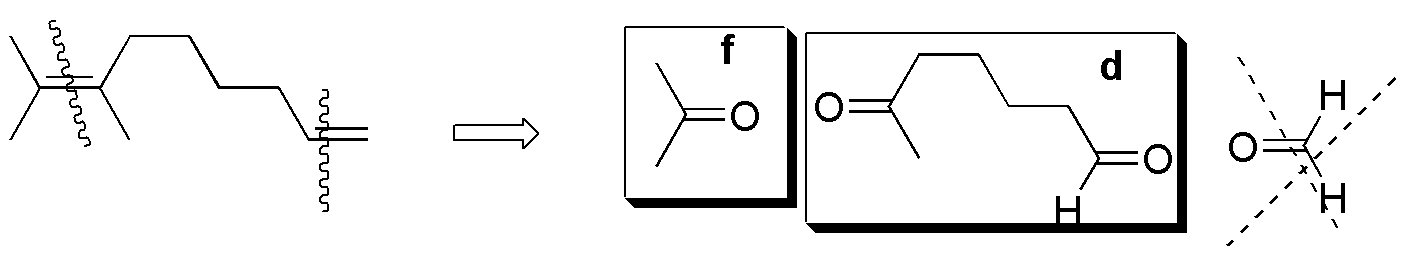
Compuesto IV) Para IV, los posibles fragmentos son:
Compuestos V-VIII) Para el resto de alquenos los resultados se dan en el siguiente esquema:
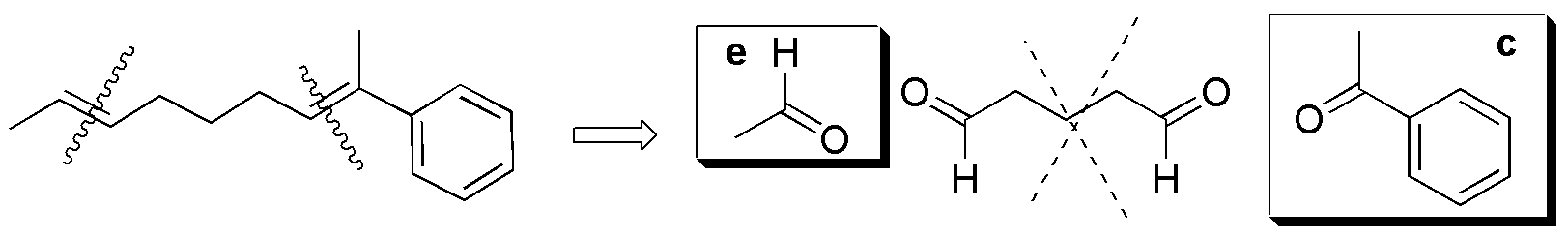
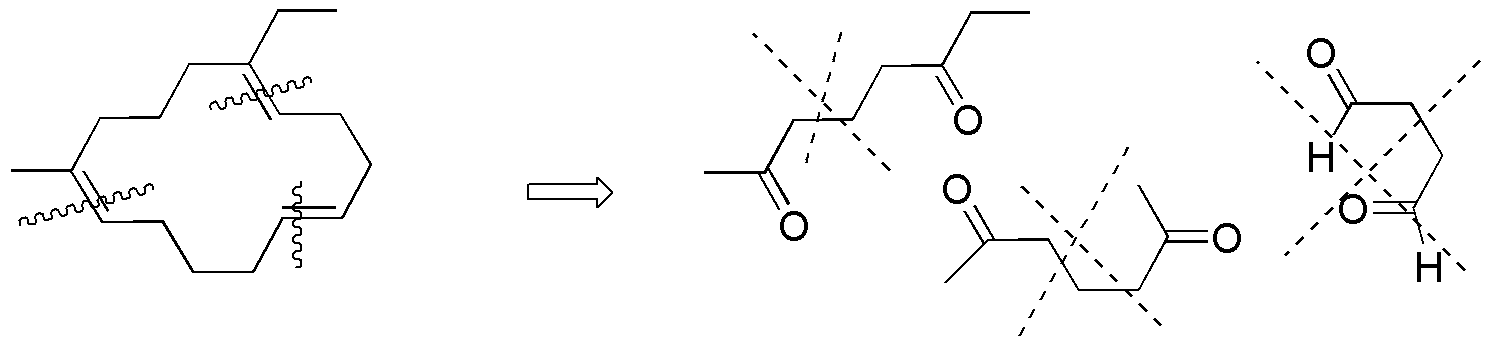
Solución 37:
El OsO4 se adiciona a los alquenos con una estereoquímica sin dando lugar a la formación de un osmiato cíclico, el tratamiento del mismo con H2S produce el correspondiente compuesto dihidroxilado con estereoquímica sin:
Solución 38:
Los dienos conjugados se resaltan con trazo grueso y con discontinuo se indican los que son aptos para la reacción de Diels-Alder.
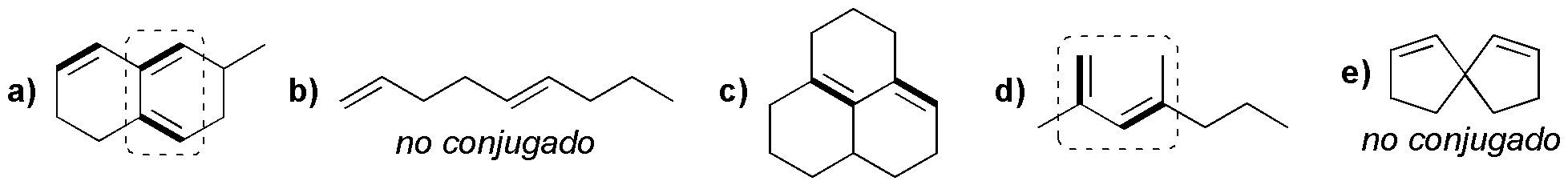
Solución 39:
La reacción de Diels-Alder se da entre un dieno conjugado (rico en electrones) con un alqueno o alquino (pobre en electrones) para dar un ciclohexeno o ciclohexadieno respectivamente:
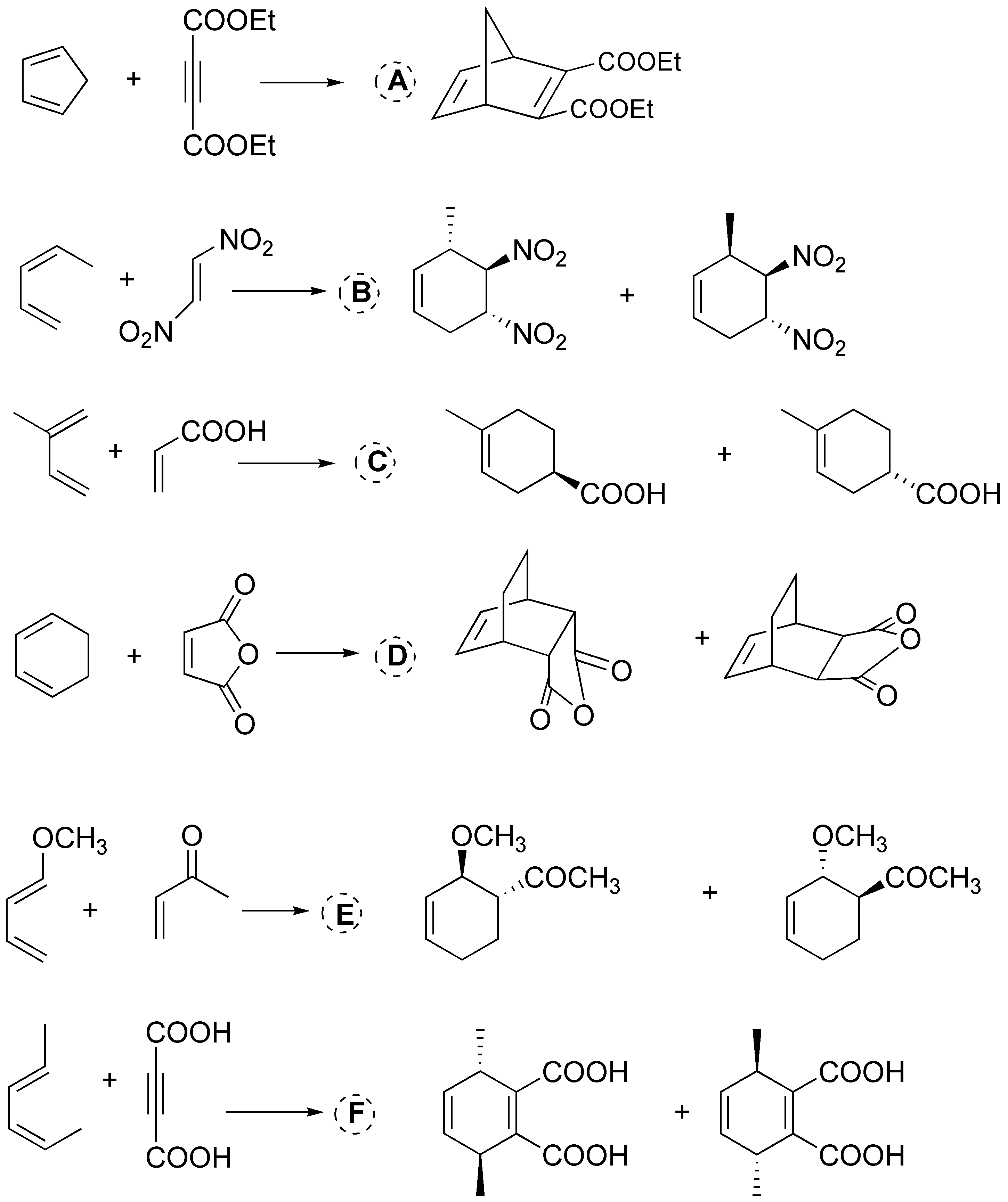
Solución 40:
Se obtienen dos productos de adición-1,4 (Z y E) y dado que el dieno no es simétrico dos productos de adición-1,2.
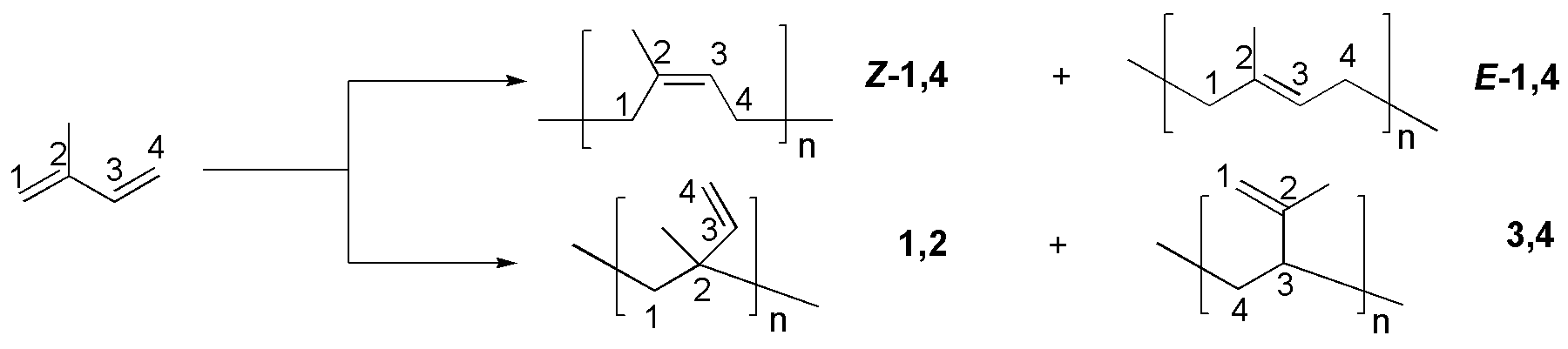
Solución 41:
Algunas reacciones características de dienos: a) La adición de un mol de bromo a un dieno da dos productos como resultado de la adición 1,2- o la 1,4- (control cinético o control termodinámico); b) y c) ilustran las diferencias en la adición a dienos a baja temperatura predomina el producto de control cinético (adición 1,2-) mientras que a más altas termperaturas predomina el producto más estable (control termodinámico); d) la reacción de Diels-Alder con un alquino producirá el ácido ciclohexa-1,4-dien carboxílico y e) la hidrogenación da un alcano.
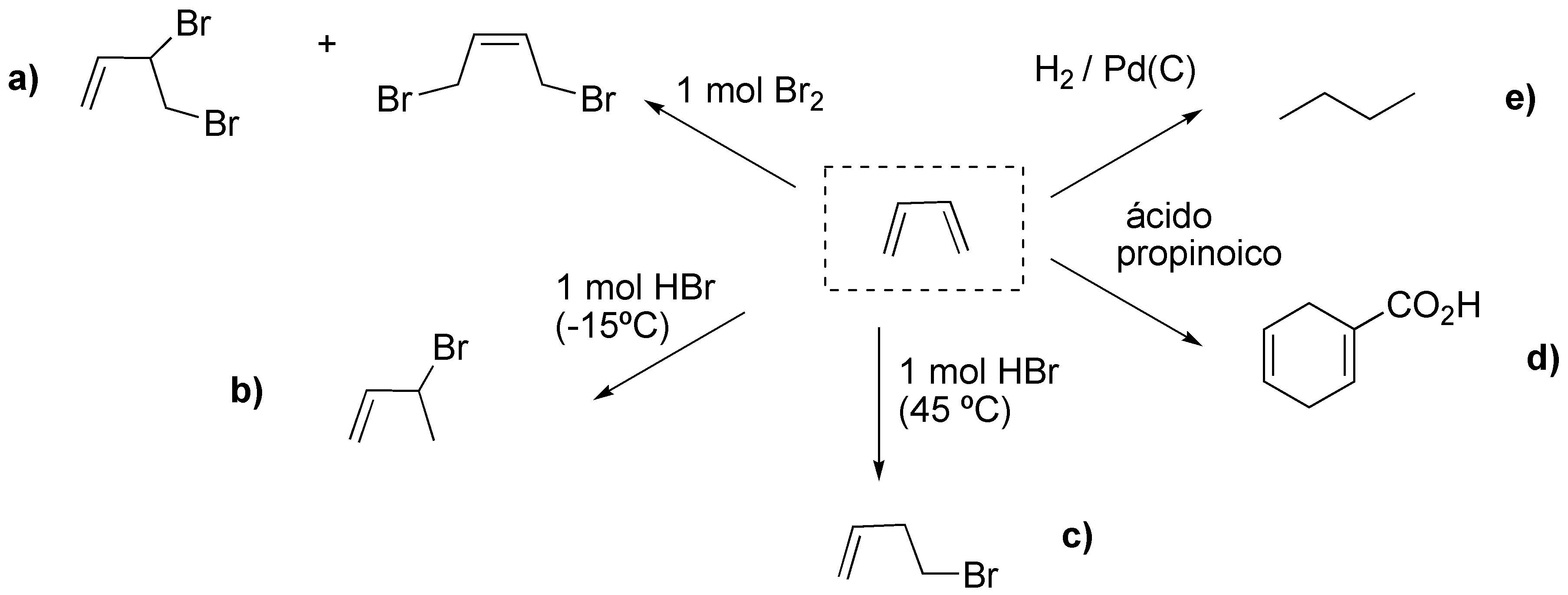
Solución 42:
Algunas reacciones características de dienos:
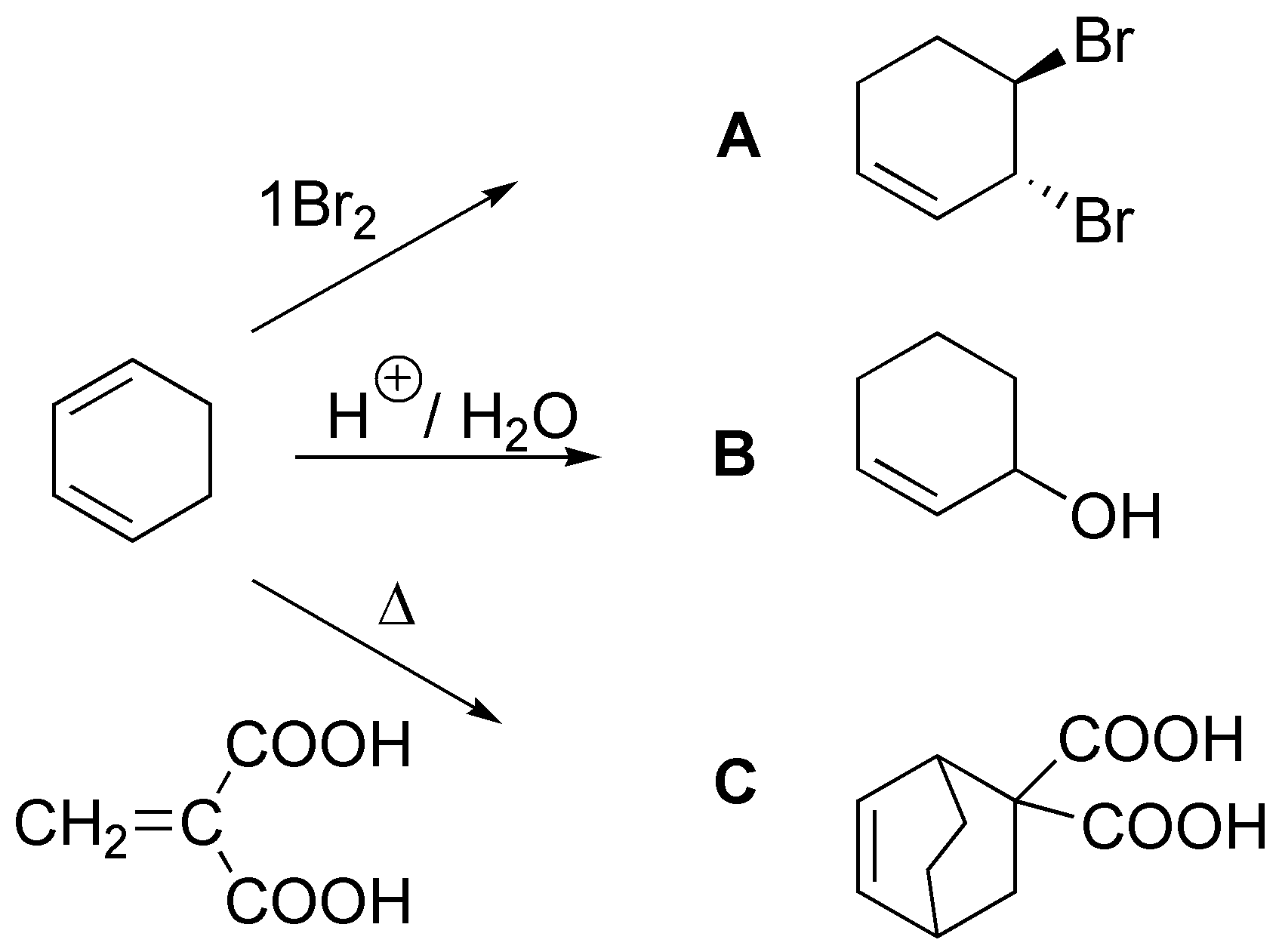
Solución 43:
La hidrogenación catalítica de un alqueno es una reacción normalmente estereoespecífica con estereoquímica sin (dos estereoisómeros diferentes producen estereoisómeros diferentes) pero en estos casos no lo es pues producen productos aquirales.
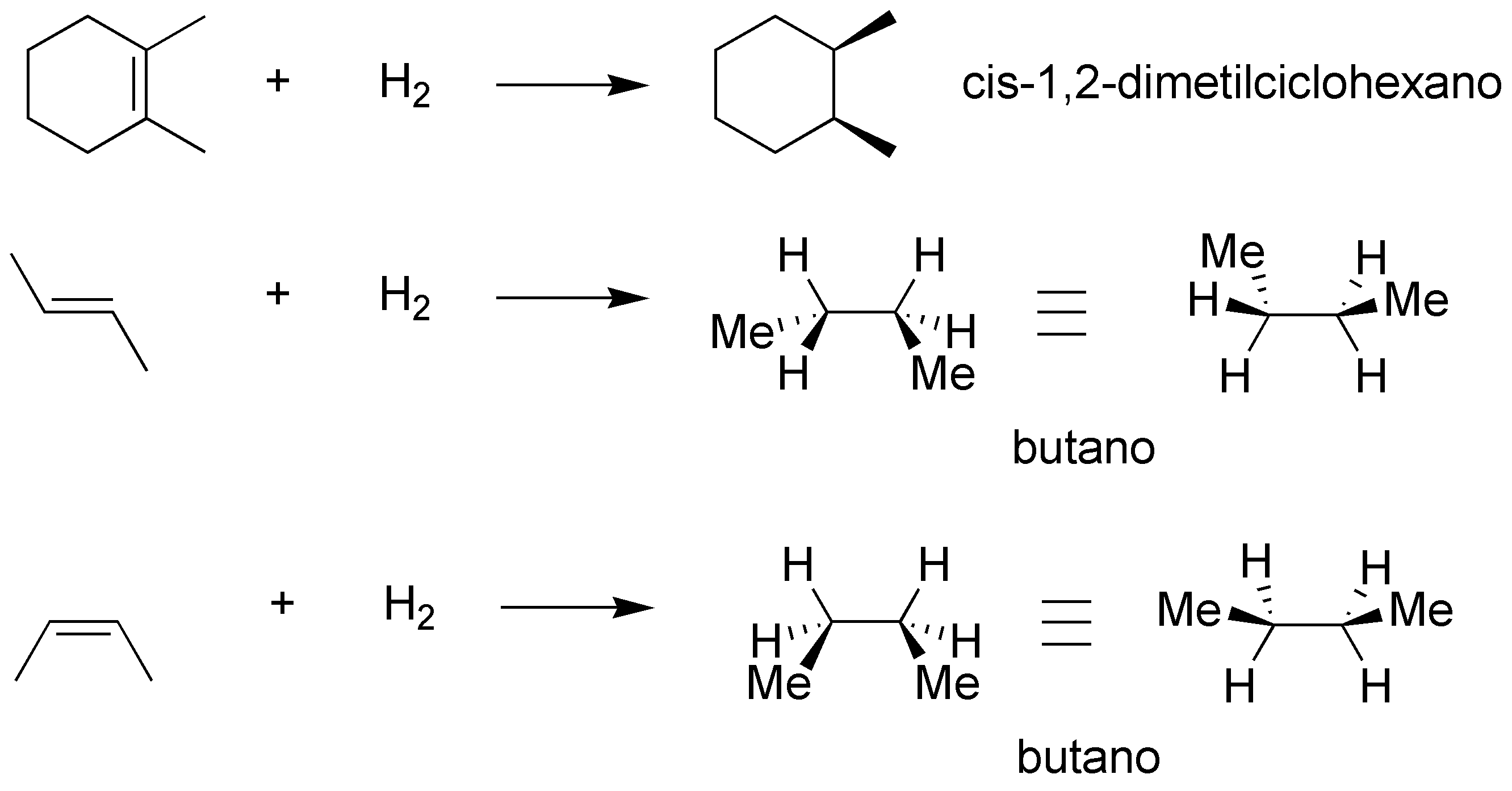
Solución 44:
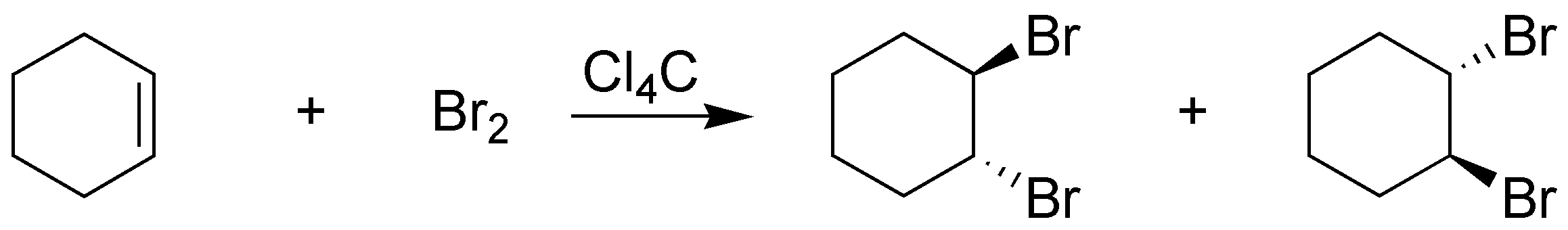
La adición de halógenos es una adición anti, con lo que se producirá trans-1,2-dibromociclohexano como una mezcla de enantiómeros:
Solución 45:
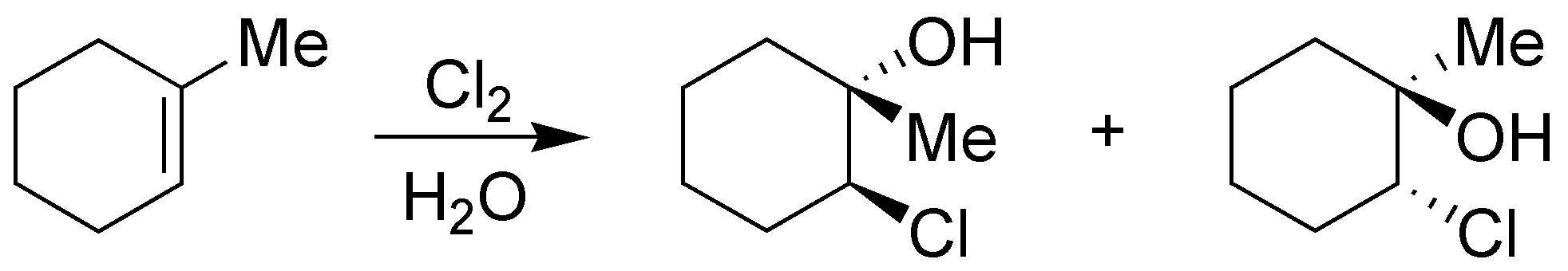
La adición de cloro en presencia de agua daría lugar a la formación de una clorohidrina (cloroalcohol) y tiene una estereoquímica anti.
Solución 46:
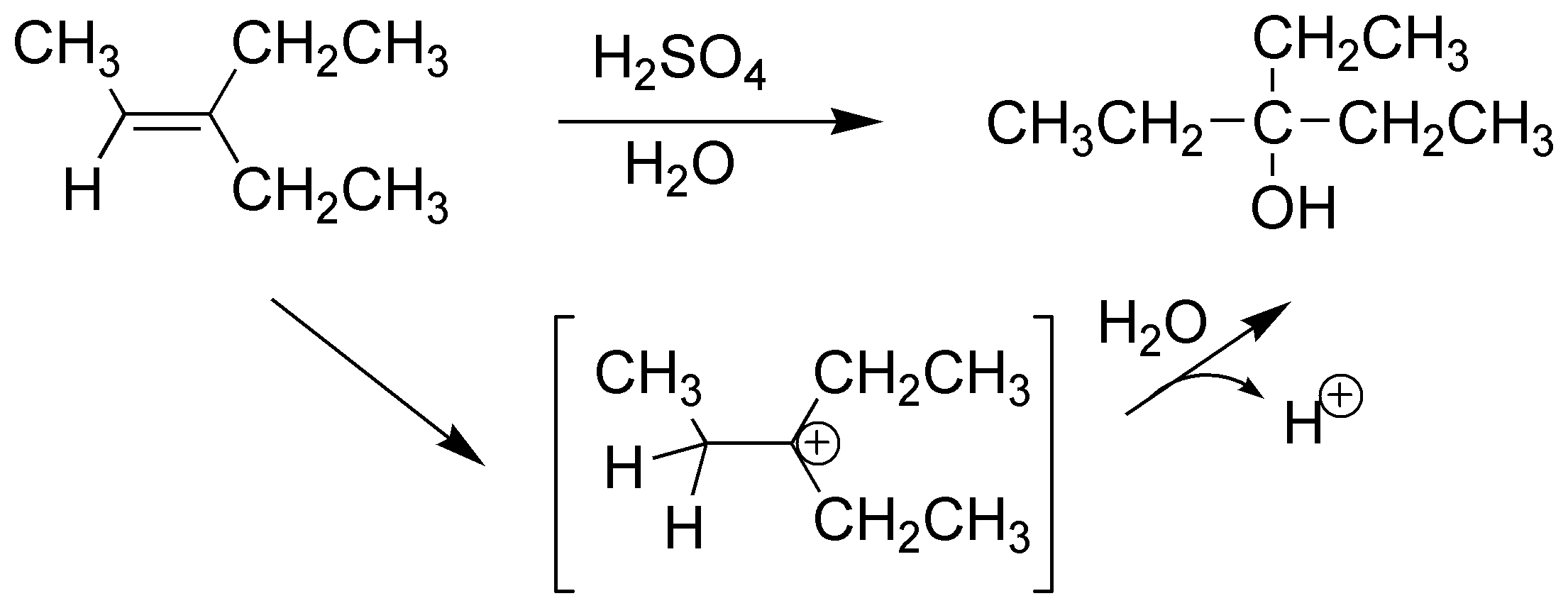
La reacción comienza con la adición de un protón al alqueno generando un carbocatión que es atrapado por el agua dando un ión hidronio que pierde un protón dando el correspondiente alcohol:
Solución 47:
Los alquenos con diazometano dan lugar a la formación de ciclopropanos por adición del diradical carbeno, mientras que la epoxidación produce epóxidos (oxaciclopropanos), siendo ambas reacciones estereoespecíficas:
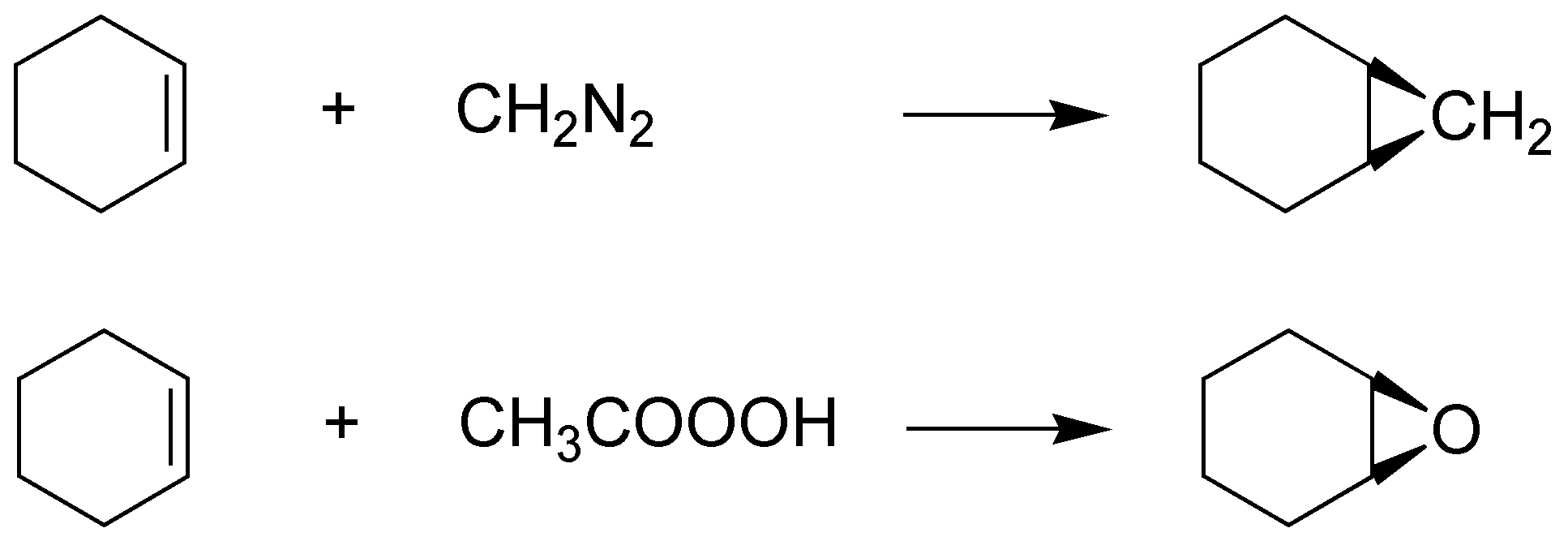
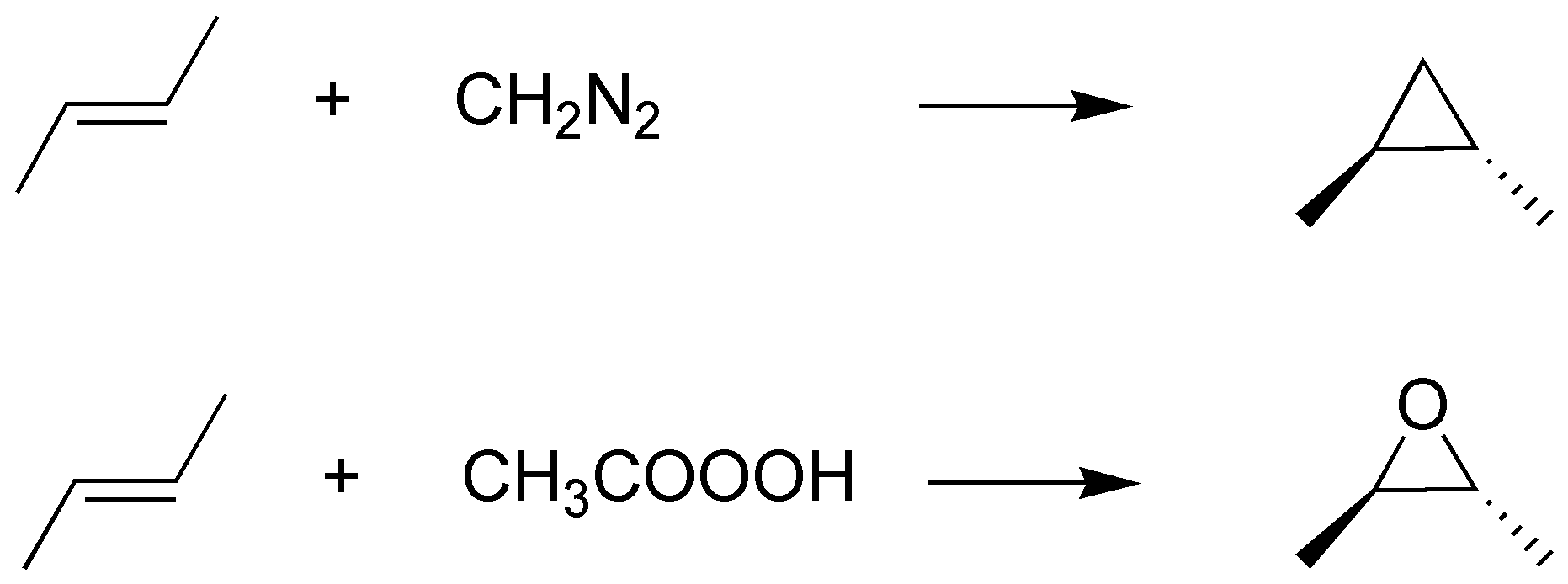
Solución 48:
Se produce un reagrupamiento con migración del grupo metilo.
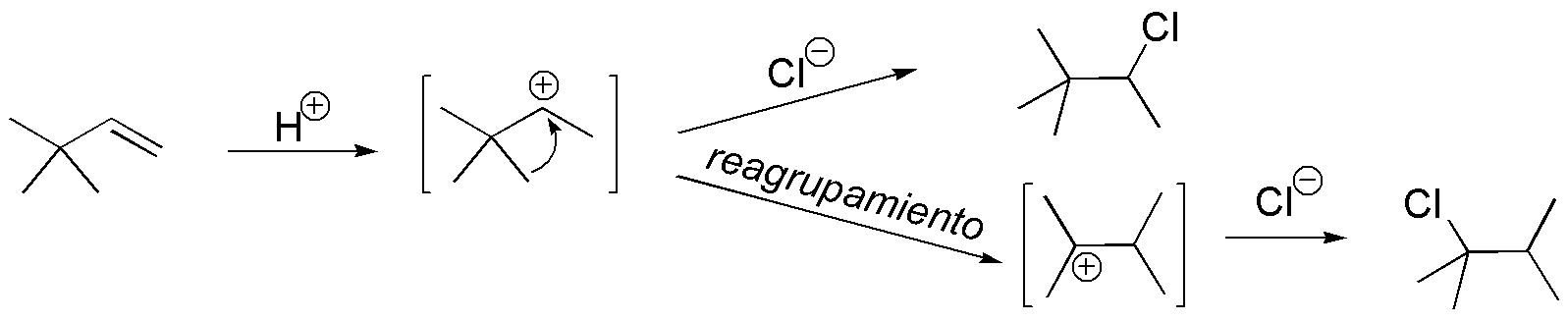
Solución 49:
Como resultado de la reacción de Diels-Alder se obtienen ciclohexenos (si el dienófilo es un alqueno) o 1,4-ciclohexadienos (si el dienófilo es un alquino), la reacción es estereoselectiva (estereoselectividad endo) y estereoespecífica (se conserva la estereoquímica del alqueno de partida):
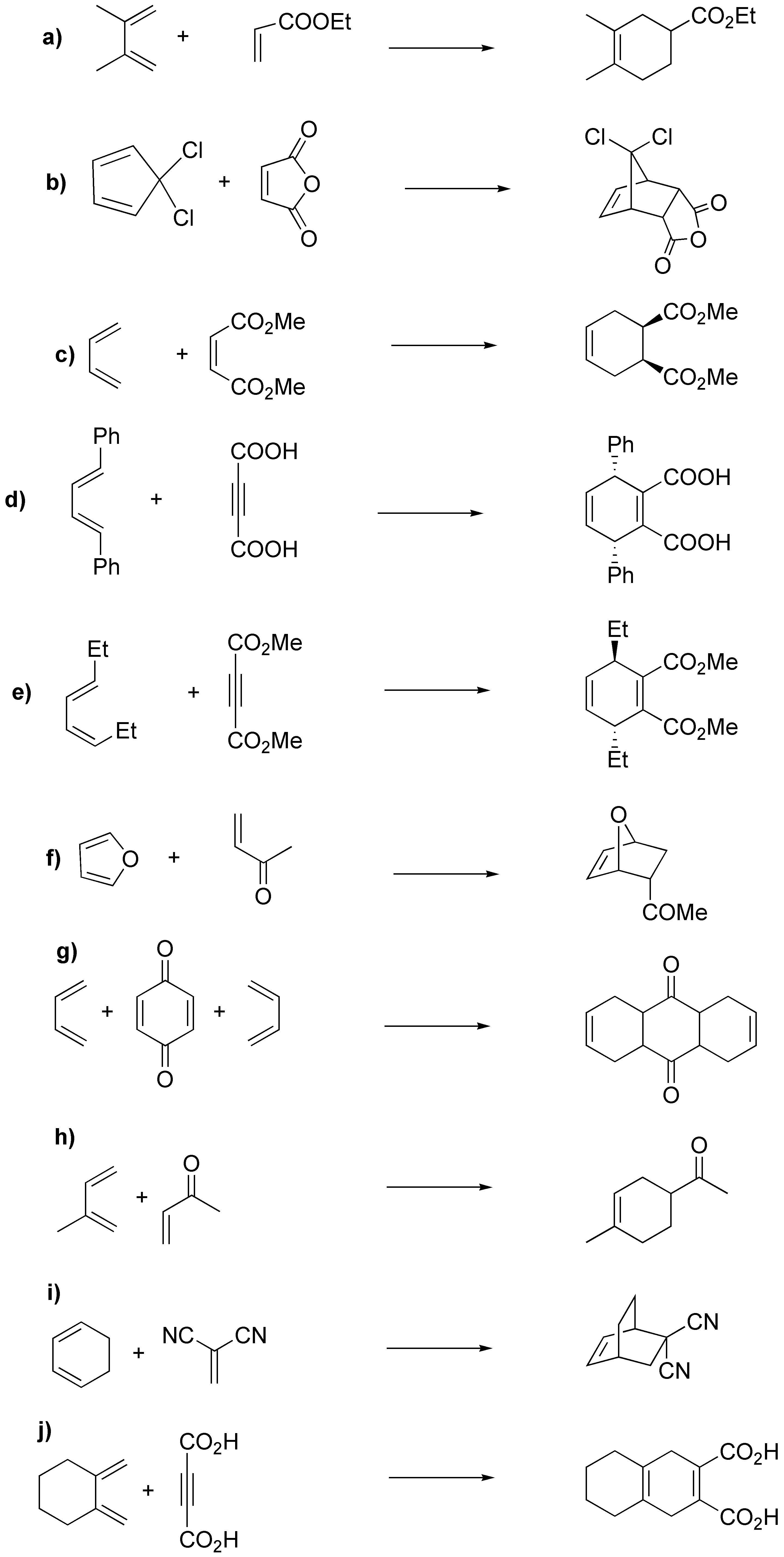
Solución 50:
Como puede observarse en la figura los sistemas diénicos y dienófilos están identificados y presentados para dar la correspondiente reacción de Diels-Alder intramolecular:
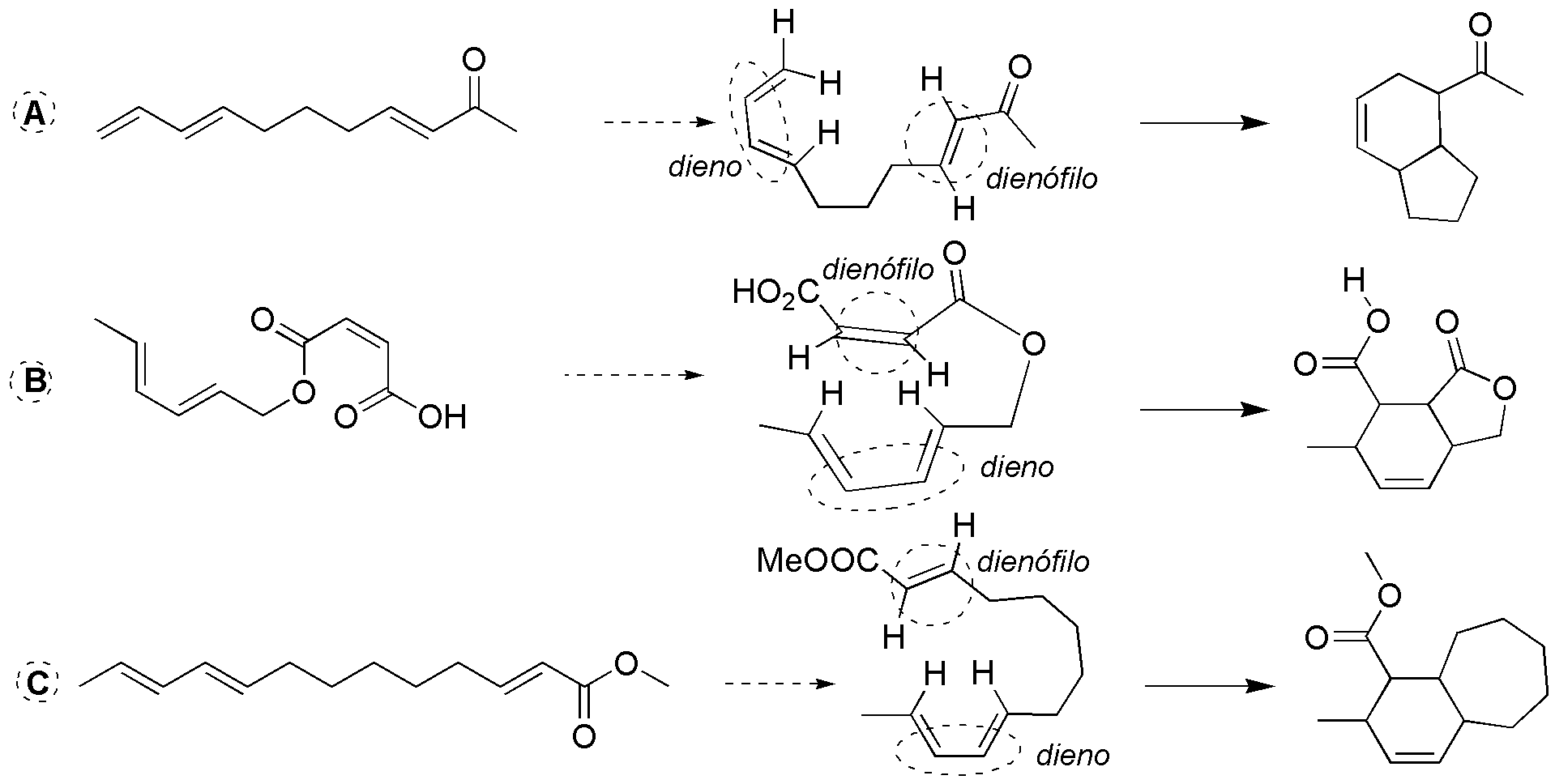
Solución 51:
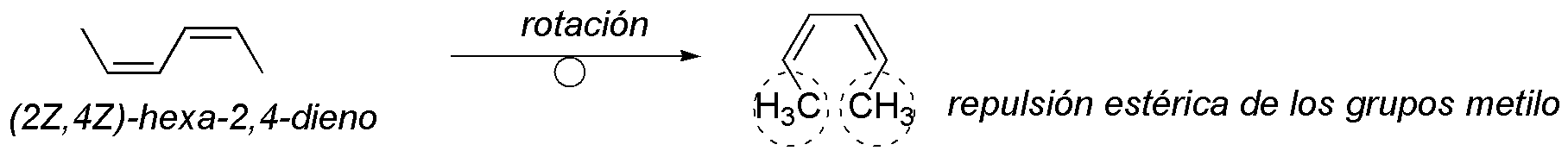
Como puede observarse en la figura la conformación que debe adquirir el dieno está poco favorecida por la repulsión estérica de los metilos unidos al sistema de dobles enlaces conjugados, por lo que el (Z,Z)-hexa-2,4-dieno será poco reactivo frente a la Diels-Alder.