Written by J.A. Dobado | Last Updated on 1 año
Ir a la página con el listado de problemas.
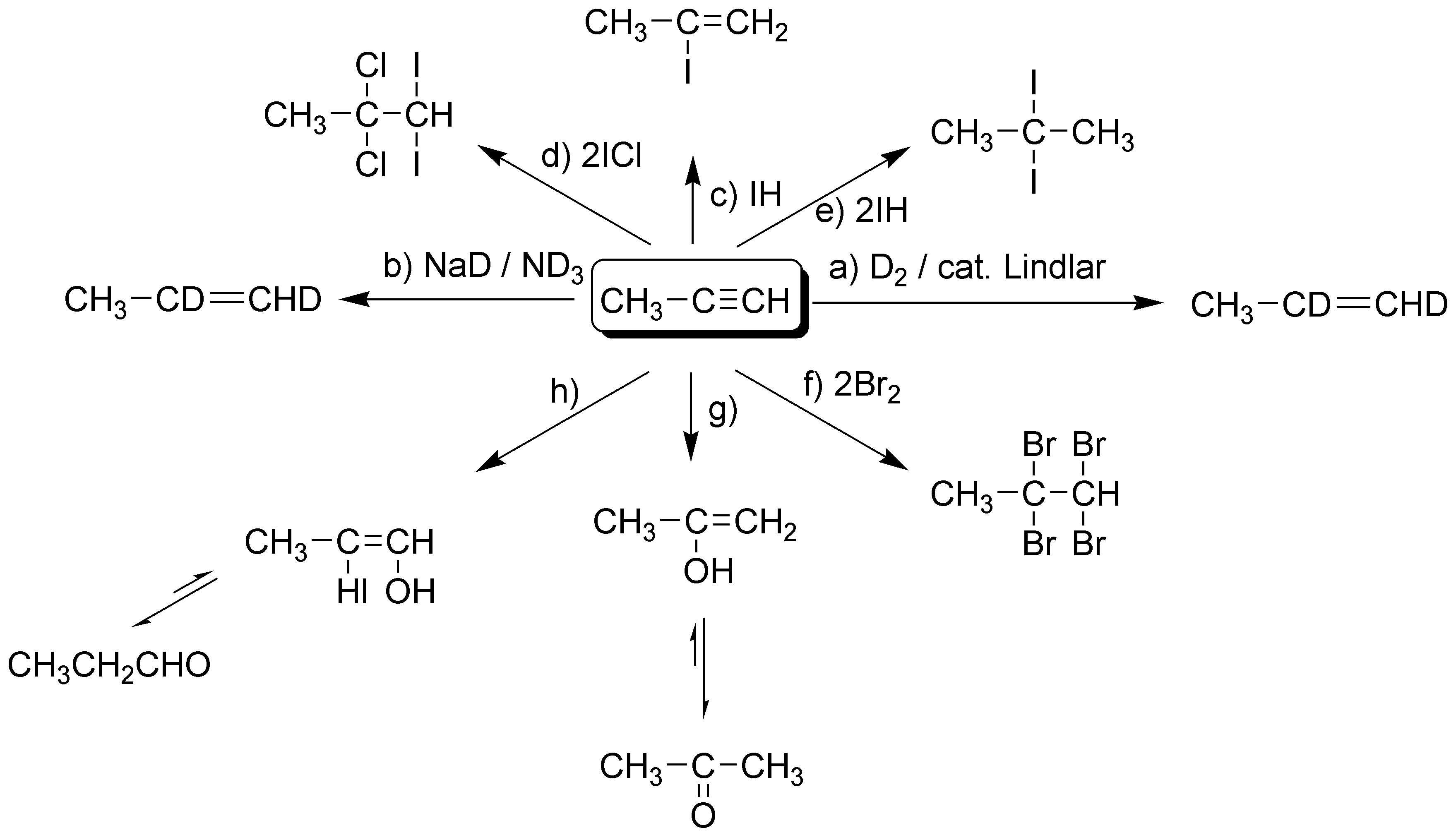
Alquinos – soluciones a los problemas
Solución 1:
Al tratarse de una hidrogenación catalizada por el catalizador de Lindlar se producirá un alqueno cuya estereoquímica será Z pues los dos hidrógenos entran por el mismo lado de la molécula (adición sin).
Solución 2:
En este caso se trata de una hidrogenación mediante un proceso de transferencia de electrones y se produce el alqueno con estereoquímica E.
Solución 3:
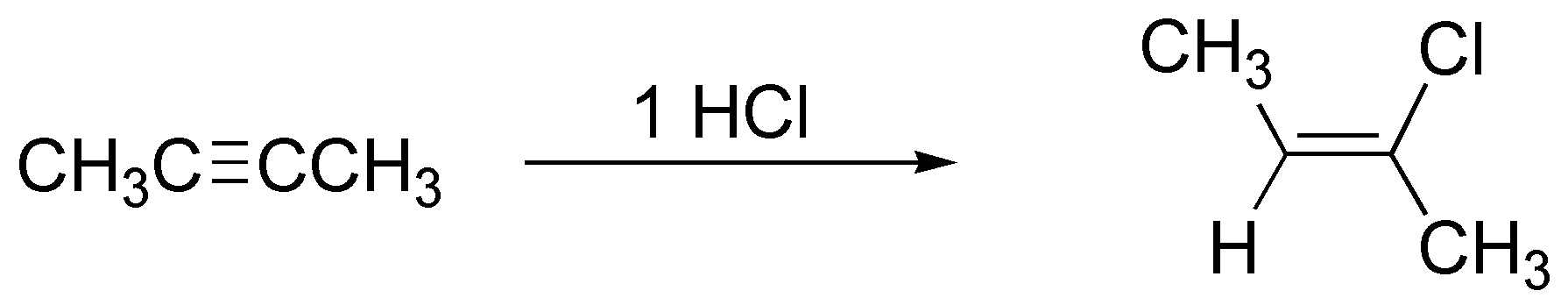
Al adicionarse un solo mol de HCl y puesto que el producto inicial (2-butino) es simétrico se producirá un 2-cloropropeno. Al tratarse de una adición trans la estereoquímica del mismo será la indicada.
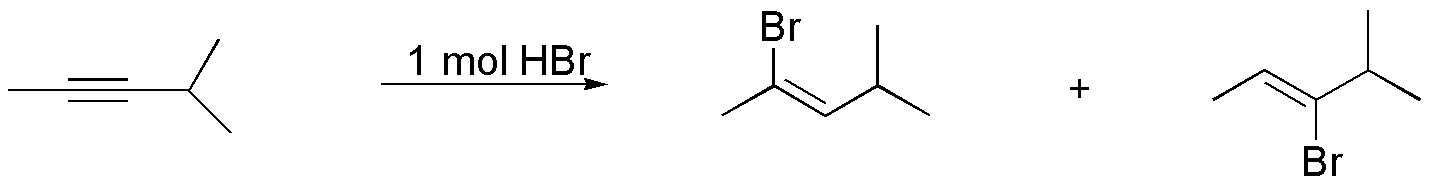
Solución 4:
Si se usa un exceso de HCl en la adición del segundo mol se cumple la regla de Markovnikov y los dos cloros se situarán sobre el mismo átomo de carbono.
![]()
Solución 5:
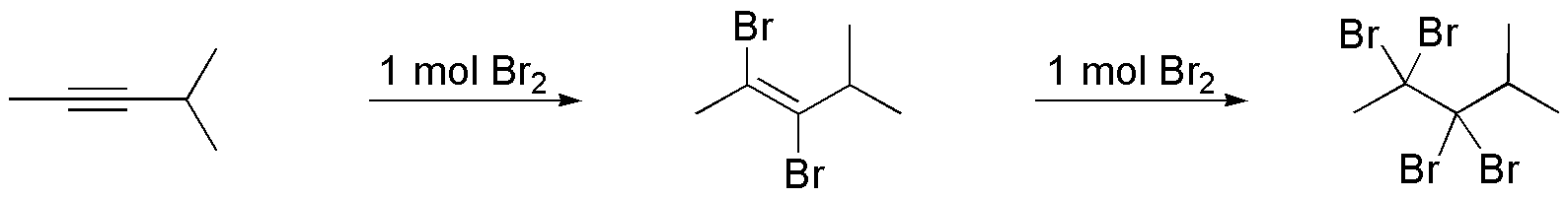
Se cumple la regla de Markovnikov y los dos hidrógenos irán sobre el carbono más hidrogenado (menos sustituido) produciendo 2,2-dibromo-3,3-dimetilbutano.
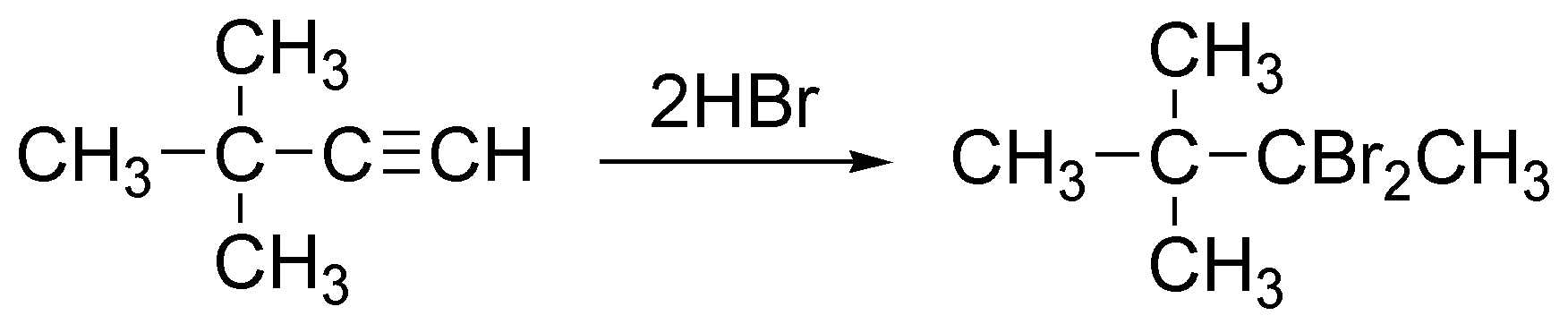
Solución 6:
Se tratará en este caso de una adición anti-Markovnikov produciéndose 1,1-dibromo-3,3-dimetilbutano y el mecanismo es radicalario como se indica en el esquema:
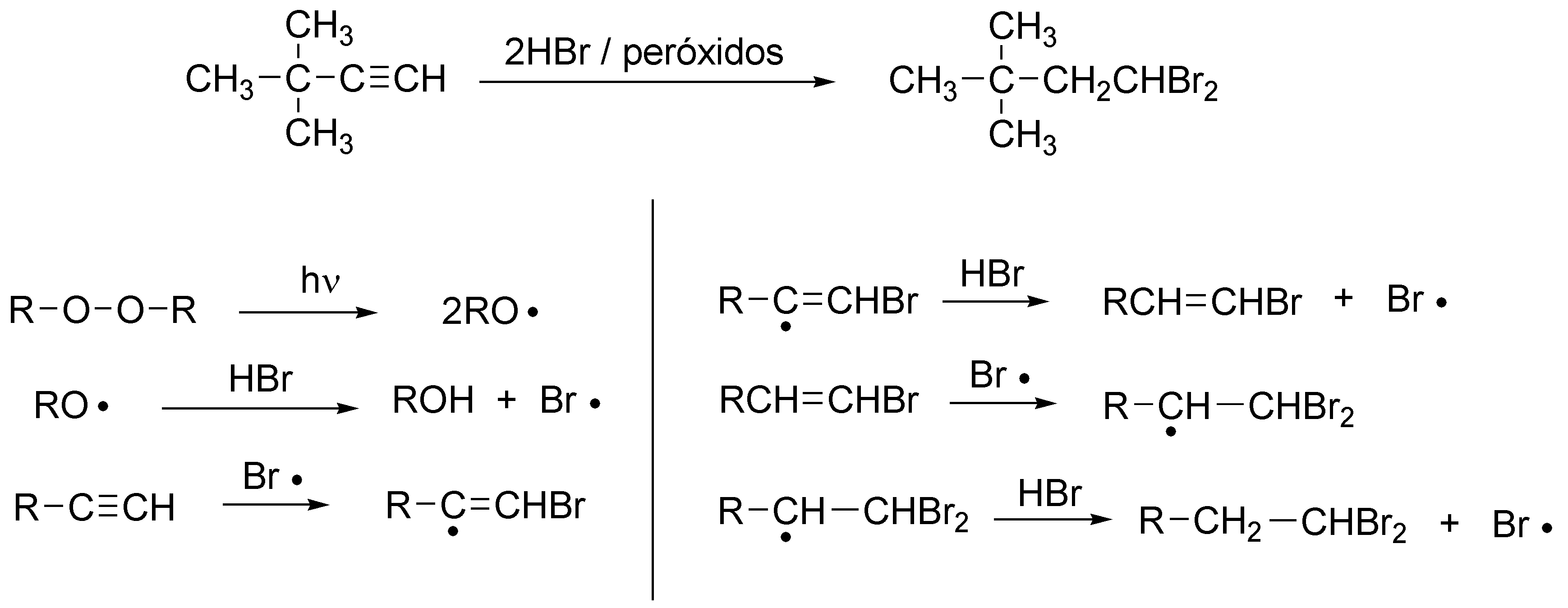
Solución 7:
La adición de un mol de cloro a un alquino conduce a un dicloroalqueno con estereoquímica trans. La de 2 moles conduce a un tetracloroalcano.
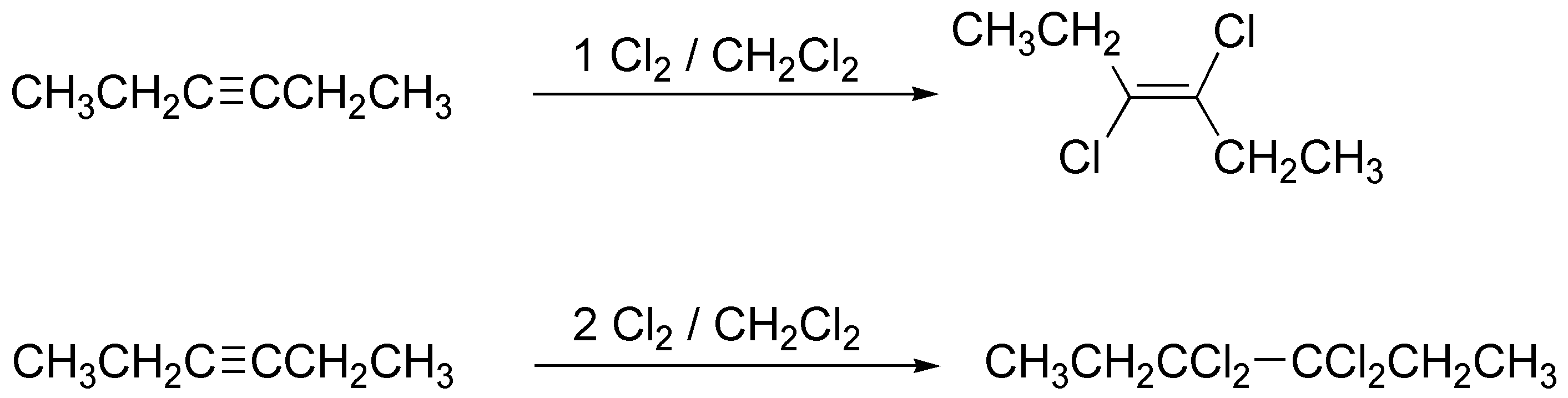
Solución 8:
La adición de agua a un alquino produce un enol, que por tautomería da una cetona. Cuando se trata de un alqueno se produce un alcohol.
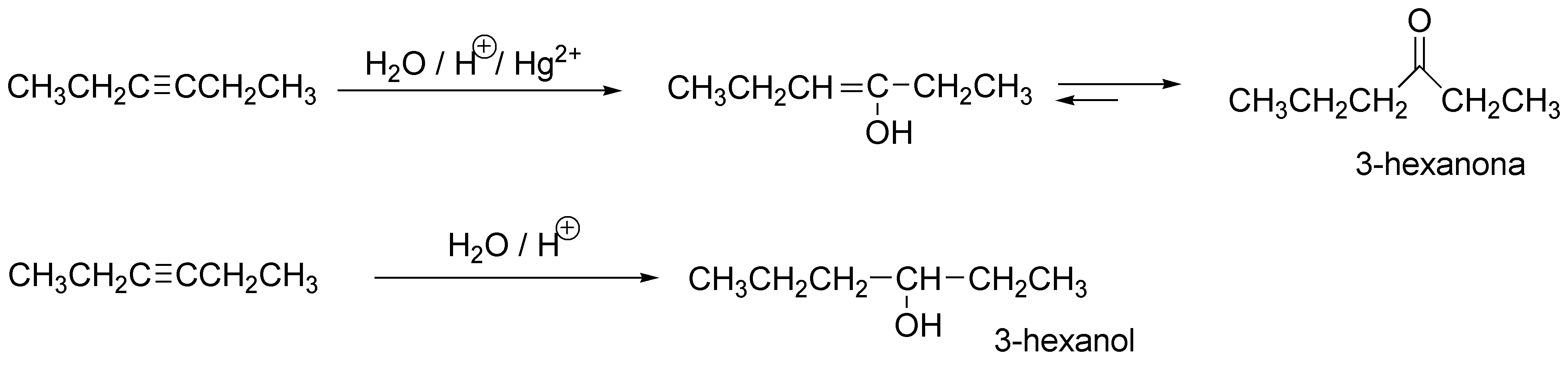
Solución 9:
La adición de agua a un alquino comienza con la adición de un protón con regioselectividad Markovnikov, dando un carbocatión alquenilo que atrapa una mólecula de agua transformádose en un enol, que por tautomería da la correspondiente metilcetona.
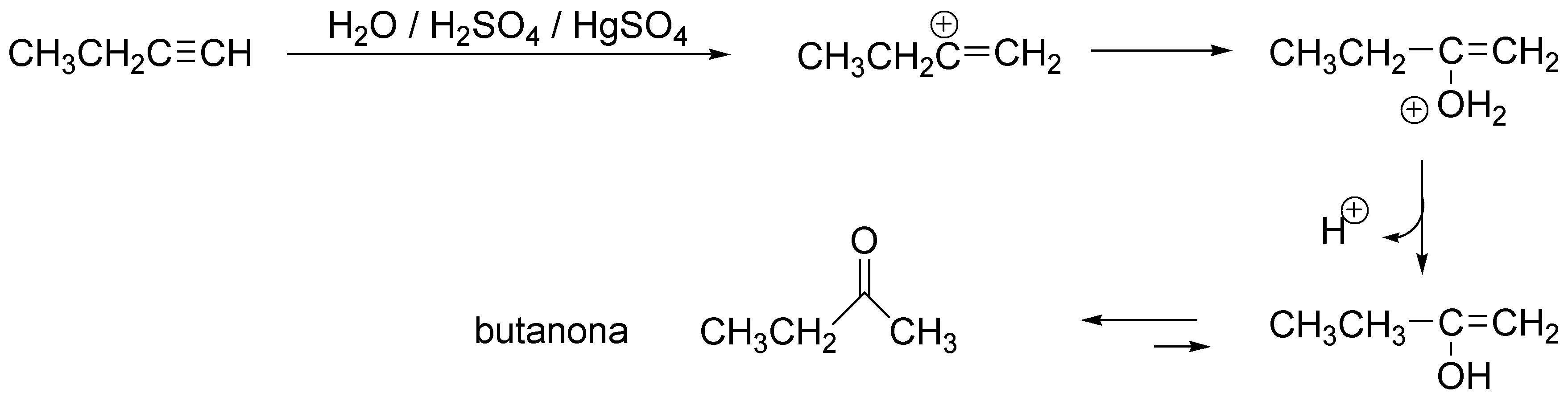
Solución 10:
El resultado final es la adición de agua al triple enlace terminal pero con una regioselectividad anti-Markovnikov, con lo que el enol formado, por tautomería daría un aldehído.
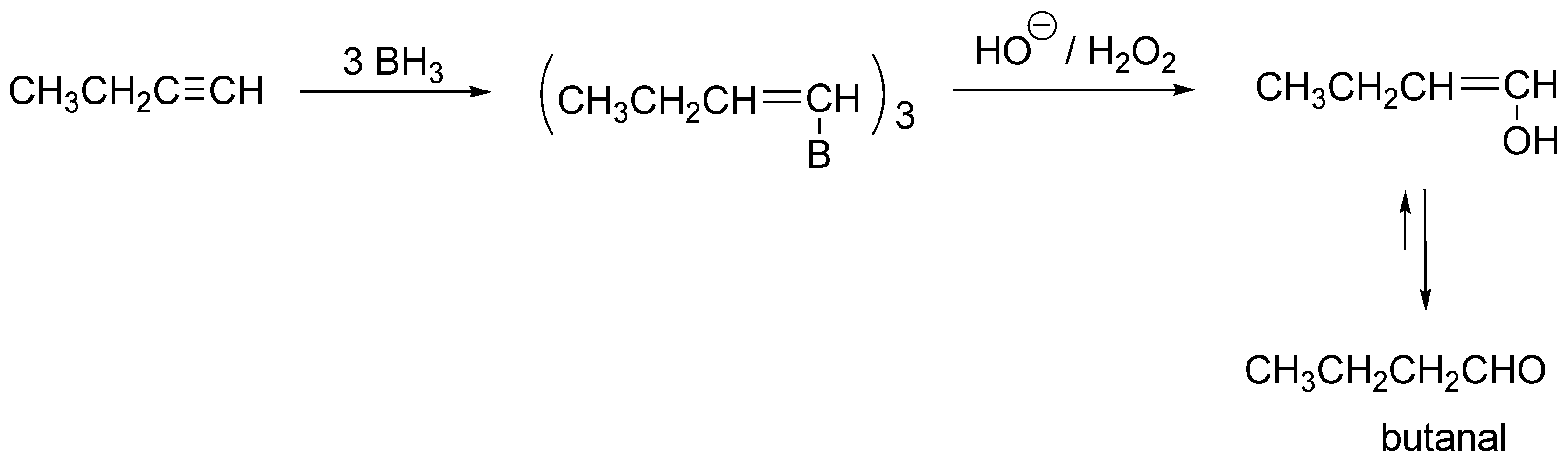
Solución 11:
a) La adición de un mol de halógeno sobre un alquino conduce a la formación de un dihaluro de vinilo. Estos compuestos son muy inestables, por lo que pueden sufrir un segunda adición de halógeno, incluso si no se ha consumido el mol de reactivo.
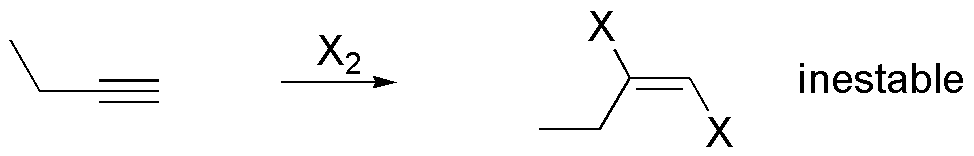
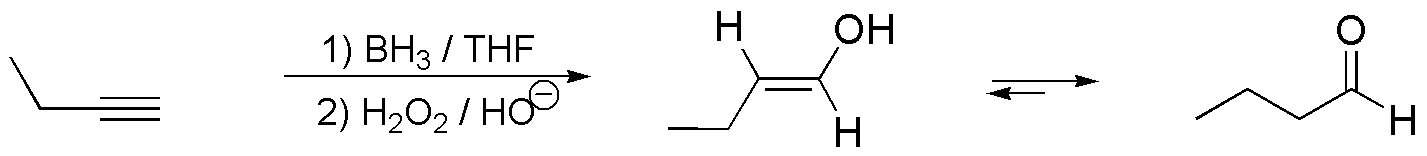
b) La reacción de hidroboración/oxidación sobre but-1-ino produce la adición de una molécula de agua con una regioquímica del tipo anti-Markovnikov, produciendo un enol, que rápidamente evoluciona hacia un compuesto carbonílico, en este caso un aldehído, ya que el átomo de oxígeno se encuentra sobre el carbono terminal de la cadena.
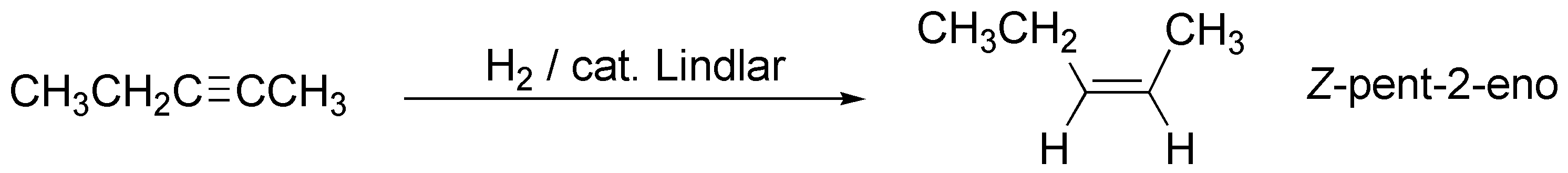
c) La hidrogenación catalítica del but-1-ino conduce a la formación del correspondiente alcano de igual número de carbonos, por adición de dos moles de hidrógeno sobre el triple enlace.
![]()
d) La reducción con metales (Li o Na) en amoníaco líquido de un alquino lleva a la reducción parcial del mismo generando un alqueno. Si existe la posibilidad, se forma el de configuración Z. En este caso, al ser un alquino terminal, se obtiene el mismo producto con este procedimiento o mediante hidrogenación con el catalizador de Lindlar.
![]()
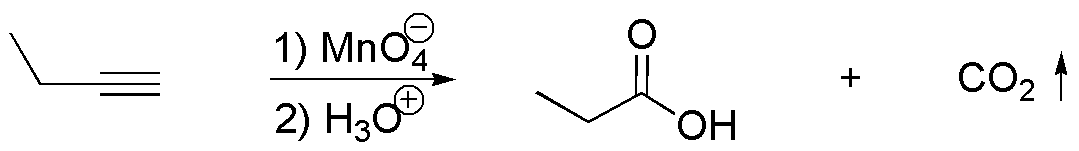
e) Con permanganato potásico se produce la rotura oxidativa de un alquino, para dar la sal potásica del ácido carboxílico correspondiente, que se libera acidificando. Si el alquino es terminal, se genera CO2.
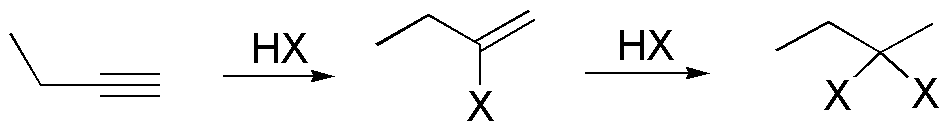
f) Los haluros de alquilo se adicionan a los alquinos siguiendo la regla de Markovnikov de forma secuencial. En una primera etapa se produce un haluro de vinilo, que seguidamente se transforma en un dihaluro de alquilo geminal.
Solución 12:
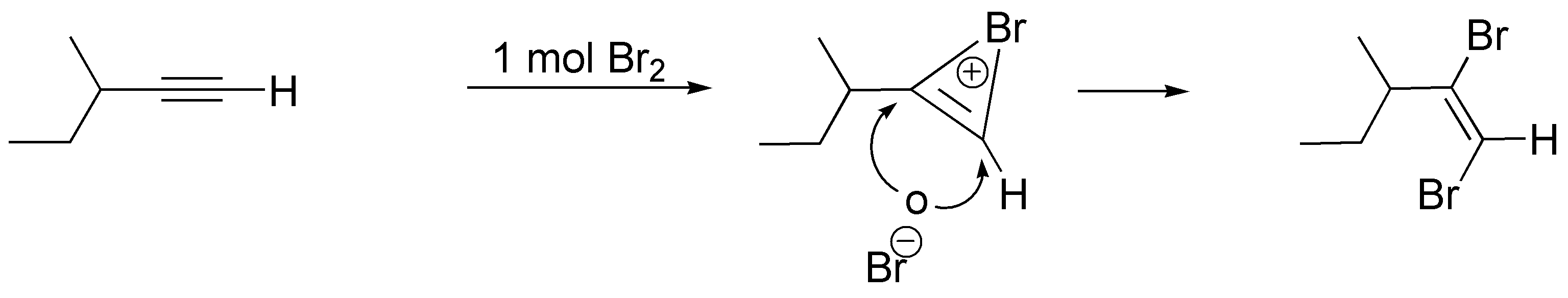
a) El resultado de la adición de un mol de X2 sobre el but-2-ino es la formación de un (E)-2,3-dihalobut-2-eno. Nótese que la estereoquímica relativa de los átomos de halógeno es trans, debido a que el ataque del segundo halógeno se realiza por la cara contraria donde se produce el ión halonio cíclico intermedio de la reacción.
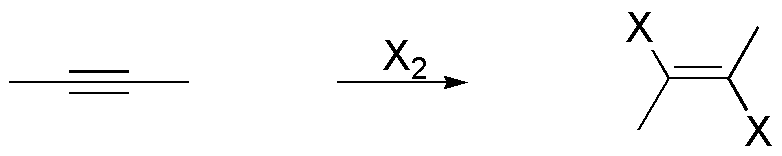
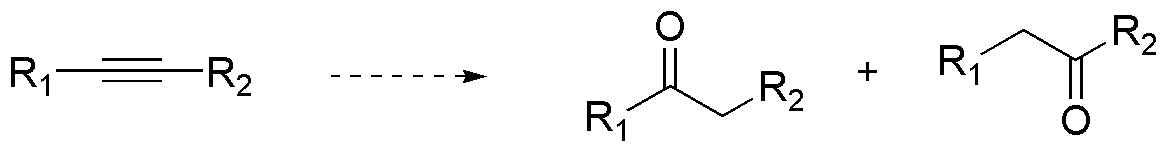
b) La reacción de hidroboración/oxidación de alquinos disustituidos conduce a la formación de cetonas. Si el triple enlace está unido a dos sustituyentes diferentes, se obtendría una mezcla de dos cetonas, dado que no hay preferencia entre uno y otro carbono del triple enlace por parte del borano. Al ser simétrico el alquino, ambas cetonas son equivalentes, con lo cual el producto de la reacción es único.
c) Si no se especifica otro particular, la hidrogenación catalítica convencional de un alquino produce el hidrocarburo saturado de igual número de átomos de carbono. Sólo en el caso de que se utilice un catalizador modificado como el de Lindlar, se produce la hidrogenación parcial de triple enlace generando, además un alqueno de configuración Z.
![]()
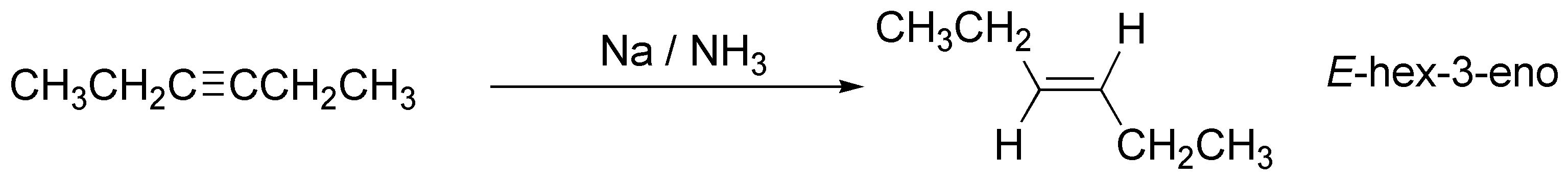
d) La reducción de un alquino por tratamiento con un metal (Na o Li) en amoníaco líquido genera un alqueno con configuración E.
El metal transfiere un electrón al alquino para dar un anión-radical, que capta un protón del amoníaco, según un proceso ácido-base. En este punto intervienen un segundo átomo de metal que transfiere de nuevo un electrón. De esta manera se produce un anión. Por último, el anión captura un protón del disolvente, para dar el alqueno.
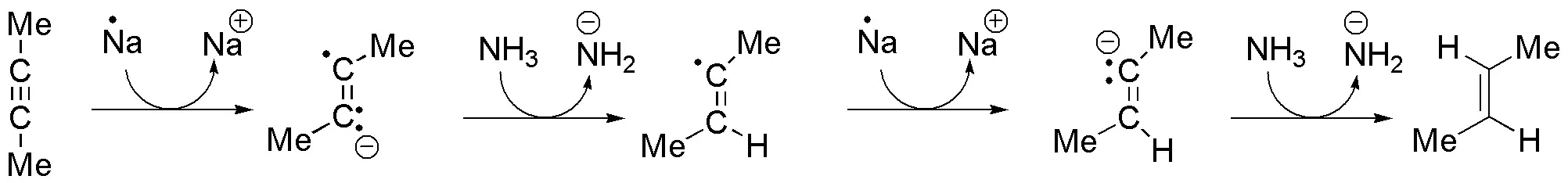
La reacción es estereoespecífica, dado que sólo se obtiene uno de los posibles isómeros. La clave del proceso es la mayor estabilidad del anión-radical de configuración trans que el de configuración cis.
e) La rotura oxidativa con permanganato potásico del but-2-ino genera dos fragmentos iguales. Una vez que se acidifique se obtienen 2 moles de ácido acético por mol de sustrato.
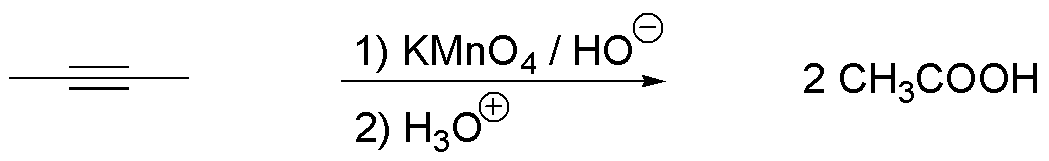
f) La adición de haluros de hidrógeno a alquinos conduce a la formación de dihaluros geminales siguiendo un mecanismo iónico en dos pasos. En una primera etapa se produce un haluro de vinilo a través de un carbocatión vinílico intermedio, formado por ataque de un protón sobre el alquino de partida. Seguidamente, se adiciona una segunda molécula de HX, formándose un carbocatión sobre el que se produce el ataque del segundo ión X–. Por tanto, ambos halógenos se unen a un mismo carbono. Dado que esta molécula es simétrica, se obtiene un único producto.
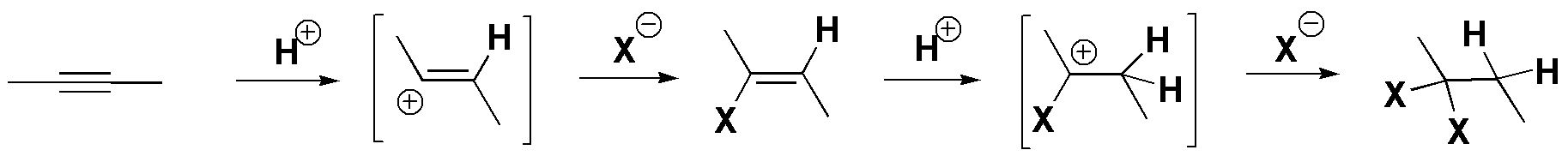
Solución 13:
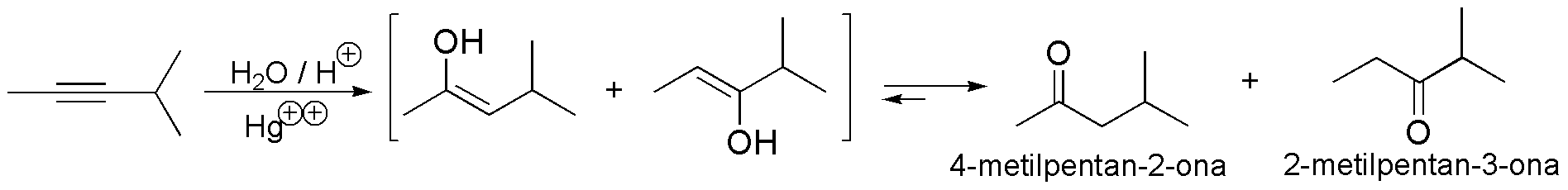
Compuesto A) La adición de agua a un triple enlace, catalizada por ácidos y en presencia de sales mercúricas, conduce a la formación de cetonas, a través de un enol. En este caso se obtendrá una mezcla de isómeros.
Compuesto B) La ozonólisis del 4-metilpent-2-ino produce dos ácidos carboxílicos, ya que el alquino de partida no es un compuesto simétrico: ácido acético y ácido 2-metilpropanoíco (isobutírico).
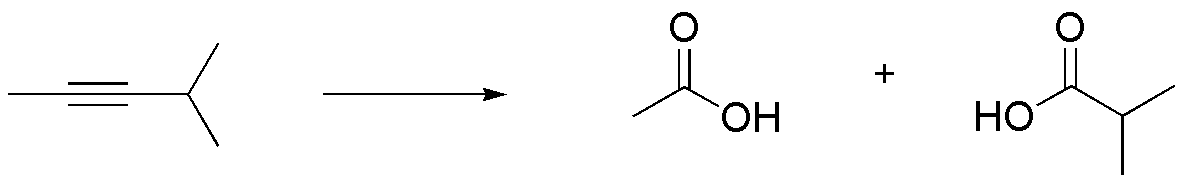
Compuesto C) Los metales alcalinos (Li o Na) en amoníaco líquido producen alquenos de configuración trans. Esta reacción aplicada al 4-metilpent-2-ino conduce a la formación del (E)-4-metilpent-2-eno.
![]()
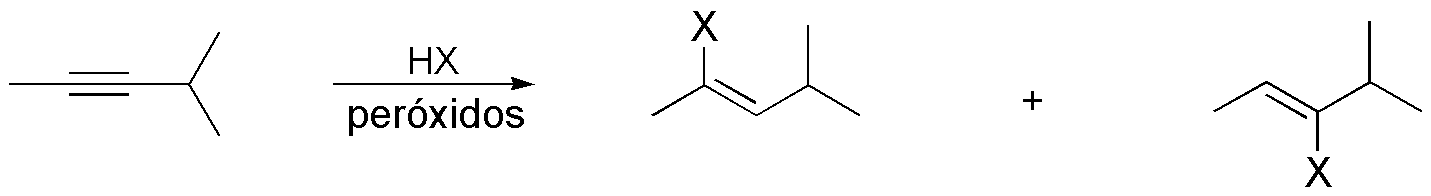
Compuesto D) La adición de HX a un alquino en presencia de radicales sigue un mecanismo de tipo anti-Markovnikov por lo que el halógeno se adiciona sobre el carbono menos sustituido. La adición del nucleófilo en alquenos disustituidos no muestra dicha preferencia, por lo que se obtendrá una mezcla de productos.
Compuesto E) Los alquinos tratados con hidrógeno en presencia de un catalizador metálico en condiciones convencionales, adicionan dos moles de hidrógeno para dar un alcano.
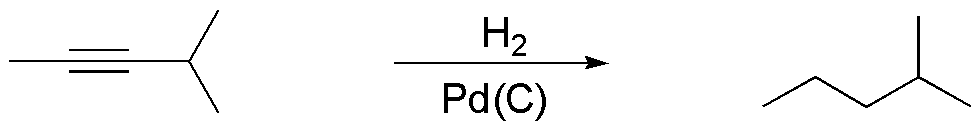
Compuesto F) La oxidación con permanganato del 4-metilpent-2-ino en condiciones controladas (pH y temperatura) lleva a la formación de una dicetona, en la que los grupos carbonilo se generan sobre los carbonos que forman parte del triple enlace.
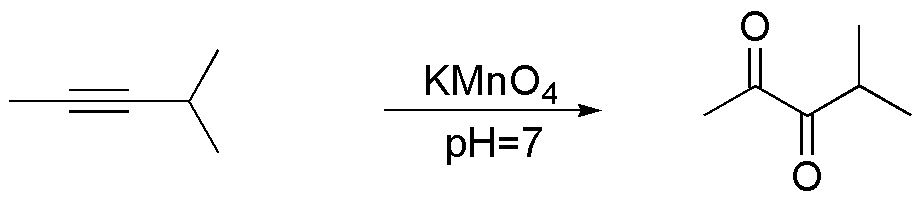
Compuesto G) La adición de bromo sobre un alquino sustituido produce un derivado tetrabromado según el esquema de reacción siguiente:
Compuesto H) La adición de 1 mol de HBr en alquinos en ausencia de peróxidos sigue la regla de Markovnikov. En un alquino disustituido no hay preferencia por el ataque del protón sobre alguno de los carbonos que soporta el triple enlace, por lo que se producirá una mezcla de productos.
Solución 14:
Se puede obtener el producto a) bien por ozonólisis o por oxidación con permanganato potásico en medio ácido de cualquiera de los alquinos propuestos.
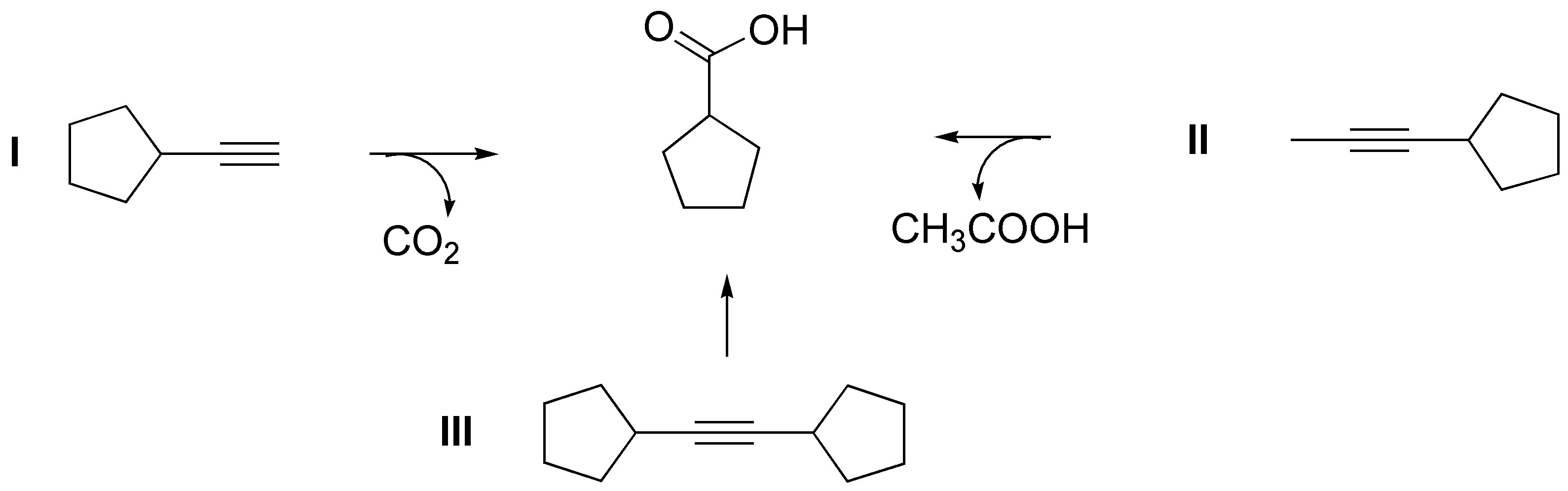
Se puede preparar el producto b) a partir de III por dos procedimientos: adición da agua catalizada por ácido en presencia de sales mercúricas o por reacción de borano seguido de oxidación con peróxido de hidrógeno en medio básico. Ambas reacciones presentan una regioquímica inversa, apreciable en alquinos terminales, pero dado que el alquino es simétrico, ambas reacciones conducen a la formación del mismo producto.
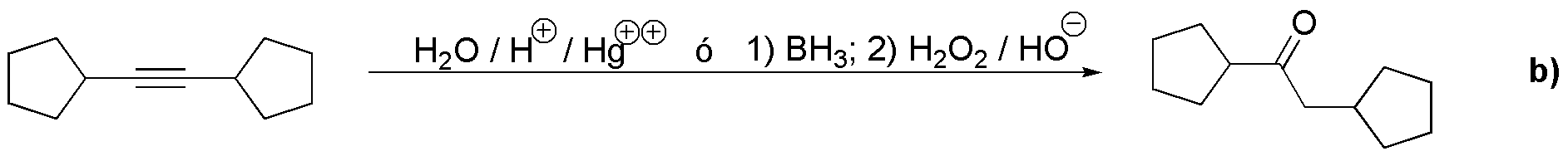
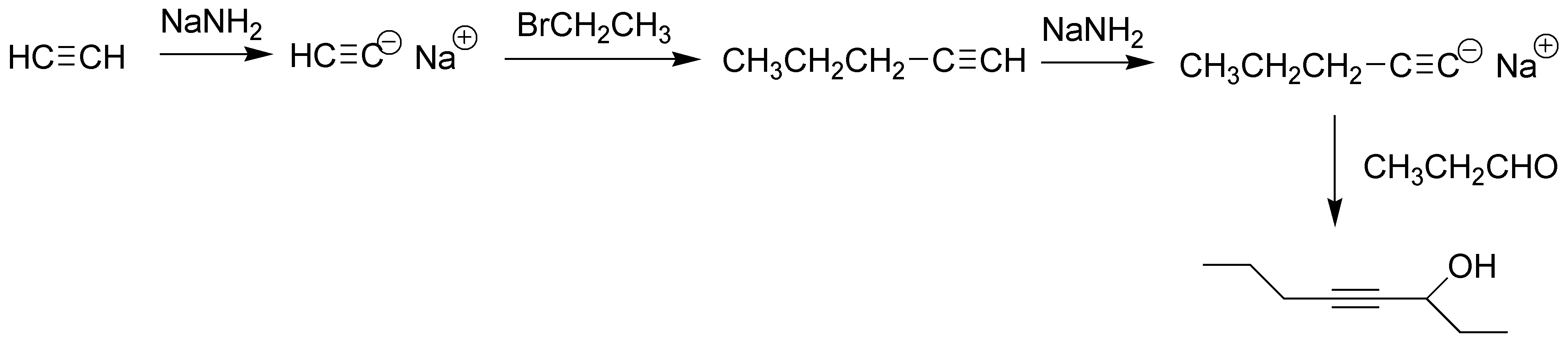
El producto c) se puede obtener mediante una secuencia de reacciones a partir del alquino I. Los alquinos terminales tratados con una base como amiduro sódico, dan el correspondiente acetiluro. Dichos acetiluros tratados con un haluro de alquilo primario o secundario permiten obtener alquinos sustituidos. Para el caso que nos ocupa la secuencia de reacciones sería la siguiente:
![]()
La preparación del producto d) requiere, de nuevo, una secuencia de reacciones. Partiendo de I, se construye un alquino con el número de carbonos necesarios para la obtención de D a través de un acetiluro, seguido de una reacción de sustitución sobre bromuro de etilo, y seguidamente se procede a la transformación del triple enlace en un doble enlace con estereoquímica trans. Para ello se trata el alquino intermedio con Nao en NH3 líquido.

El producto e) proviene de la reacción de hidratación de I mediante un proceso de hidroboración/oxidación. En esta reacción se produce un enol con el hidroxilo en posición primaria (anti-Markovnikov), que rápidamente evoluciona hacia el compuesto carbonílico que en esta ocasión es un aldehído.

El producto f) se prepara a partir de I mediante la adición electrófila de agua catalizada por ácidos en presencia de sales de Hg(II). La reacción presenta una orientación (Markovnikov) contraria a la del caso anterior. Igualmente, se obtiene un enol que evoluciona hacia una cetona por un proceso de equilibrio desplazado hacia la formación del compuesto carbonílico, ya que el grupo OH, se encuentra sobre un carbono secundario.

El producto g) se obtiene de la reacción de hidrogenación parcial de III, realizada con hidrógeno, en presencia del catalizador de Lindlar que hace que la estereoquímica del doble enlace sea de tipo cis.
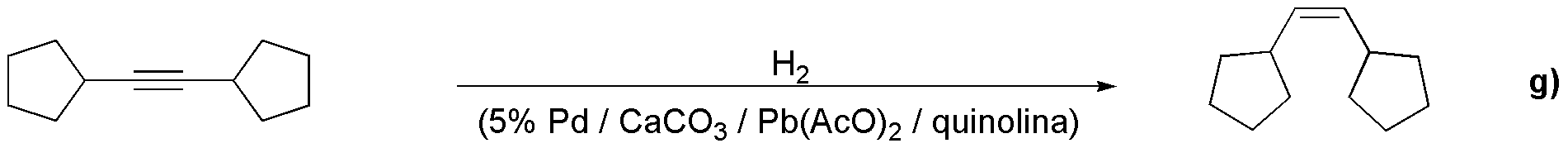
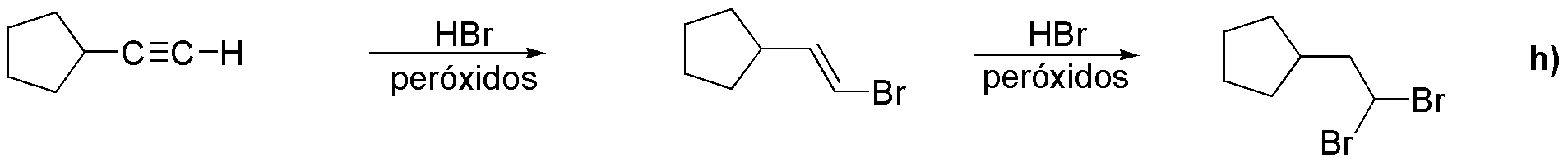
El producto h) se prepara a partir del alquino terminal I, por adición de HBr en presencia de peróxidos. La reacción es una adición tipo anti-Markovnikov.
Solución 15:
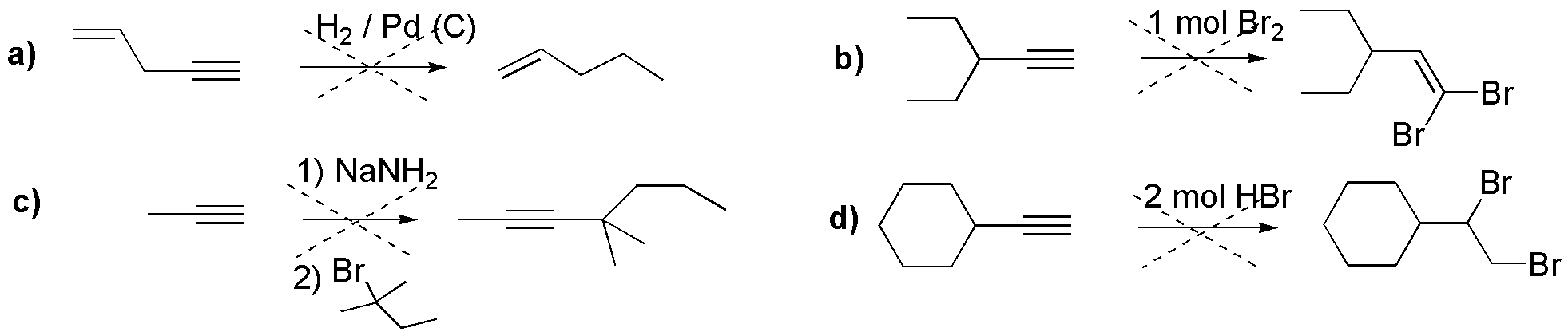
a) En la reacción que se describe, se produce la hidrogenación catalítica del triple enlace, pero no se ha tenido en cuenta que en estas condiciones se produce simultáneamente la adición de hidrógeno sobre el doble enlace, con lo que el producto obtenido es el correspondiente hidrocarburo saturado.
![]()
b) La adición de 1 mol de bromo sobre un triple enlace produce un derivado dibromado vecinal y no geminal (sobre el mismo carbono). Eso es debido a que el intermedio de la reacción es un ión bromonio cíclico, que es atacado por Br–, por la cara contraria, con la consiguiente apertura del ión bromonio cíclico, de forma que los átomos de bromo quedan unidos a carbonos diferentes. El mecanismo que se postula hace imposible que ambos átomos de bromo queden unidos al mismo carbono.
c) Se representa la formación de un alquino disustituido partiendo de uno monosustituido. El procedimiento convencional consiste en la formación de un acetiluro por tratamiento con una base como amiduro sódico, seguido de la reacción con un haluro de alquilo. Para que esta reacción sea viable, el haluro de alquilo que se usa en la segunda parte debe ser primario o secundario. En este caso no habrá reacción de sustitución y si posiblemente de eliminación en el haluro.
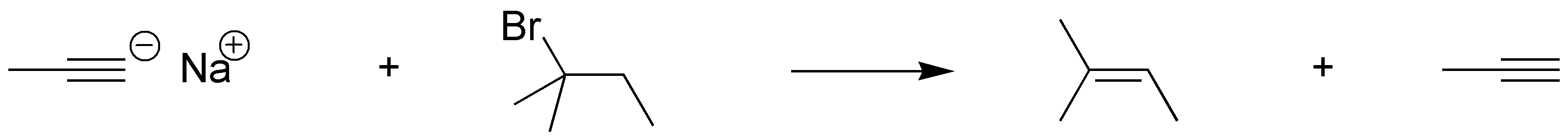
d) La adición de HBr a alquinos en ausencia de peróxidos es un proceso que sigue un mecanismo tipo Markovnikov, y en el que de forma secuencial se adicionan dos moles de HBr. En un primer paso se forma un haluro de vinilo y en una segunda etapa la adición de otro mol de HBr conduce a la formación de un dihaluro de alquilo. Según el mecanismo que se postula para la reacción, el intermedio de reacción para ambos procesos es un carbocatión. En ambos casos, el carbocatión más estable se dará sobre el carbono secundario, con lo cual, el nucleófilo (Br–) atacará la posición secundaria. El producto obtenido es un derivado dibromado geminal (sobre el mismo carbono).
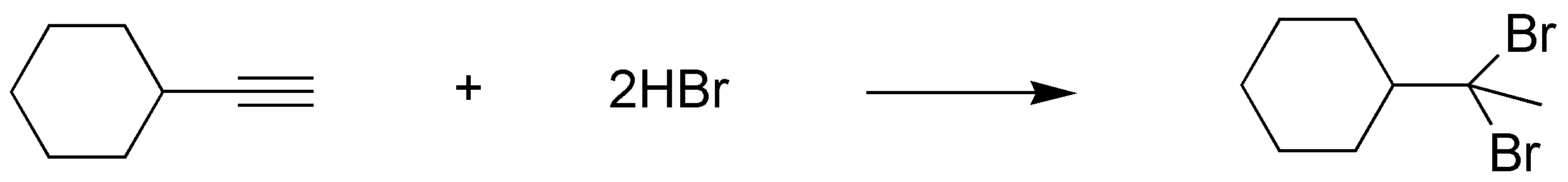
Solución 16:
La adición de bromo a un alquino generará el catión bromonio cíclico que en presencia de agua dará el bromo enol correspondiente que tautomeriza a la correspondiente bromocetona:

Solución 17:
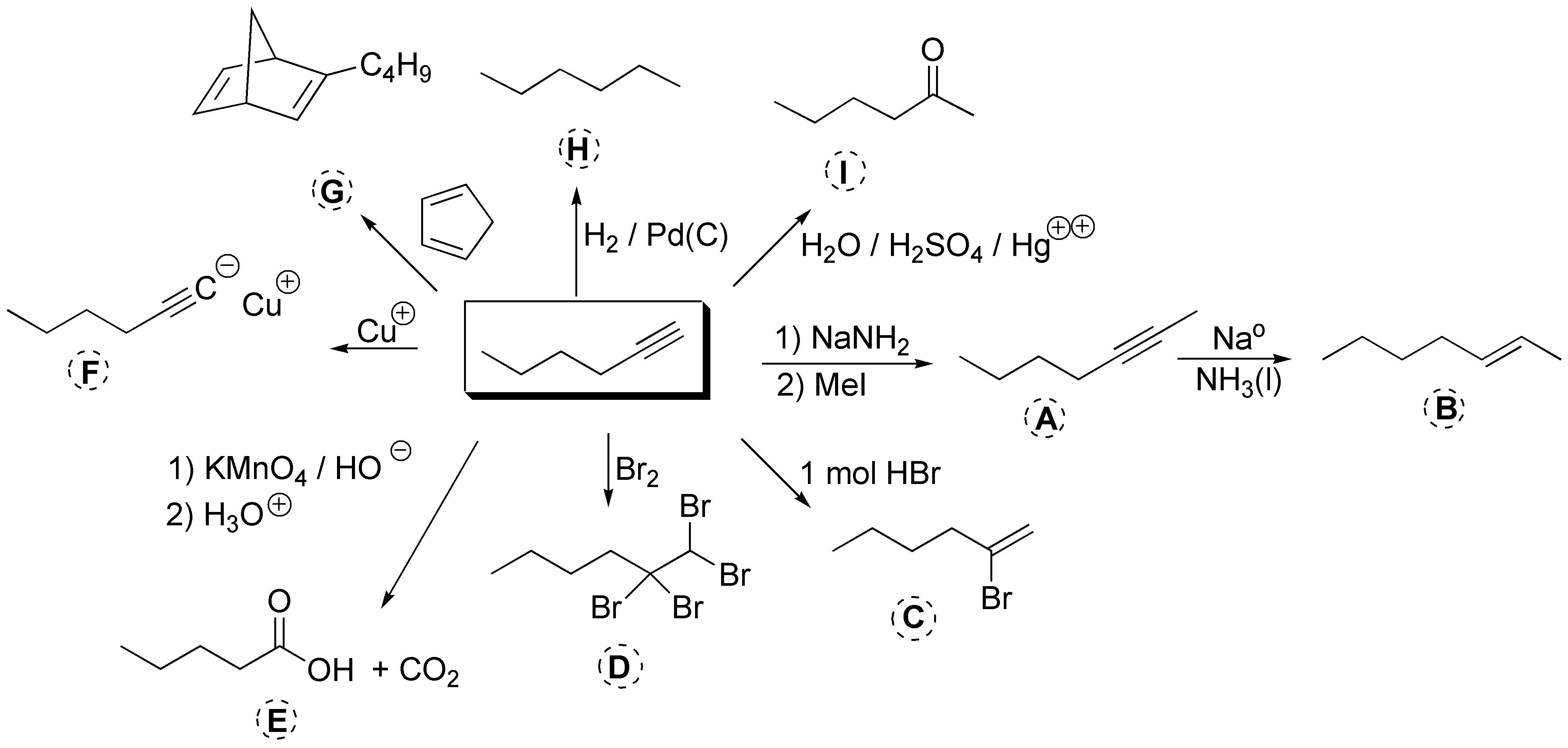
En el siguiente esquema, se ilustran las principales reacciones de los alquinos terminales: a) la elongación de la cadena previa formación del acetiluro; b) Hidrogenación parcial a alqueno con estereoquímica E (trans); c) La adición tipo Markovnikov de un mol de HBr; d) la bromación; e) La rotura oxidativa con permanganato; f) la formación de acetiluros con sales de cobre; g) La reacción de Diels-Alder para dar ciclohexadienos; h) la hidrogenación hasta alcano e i) la hidratación catalizada por sales mercúricas que produce metilcetonas.
Solución 18:
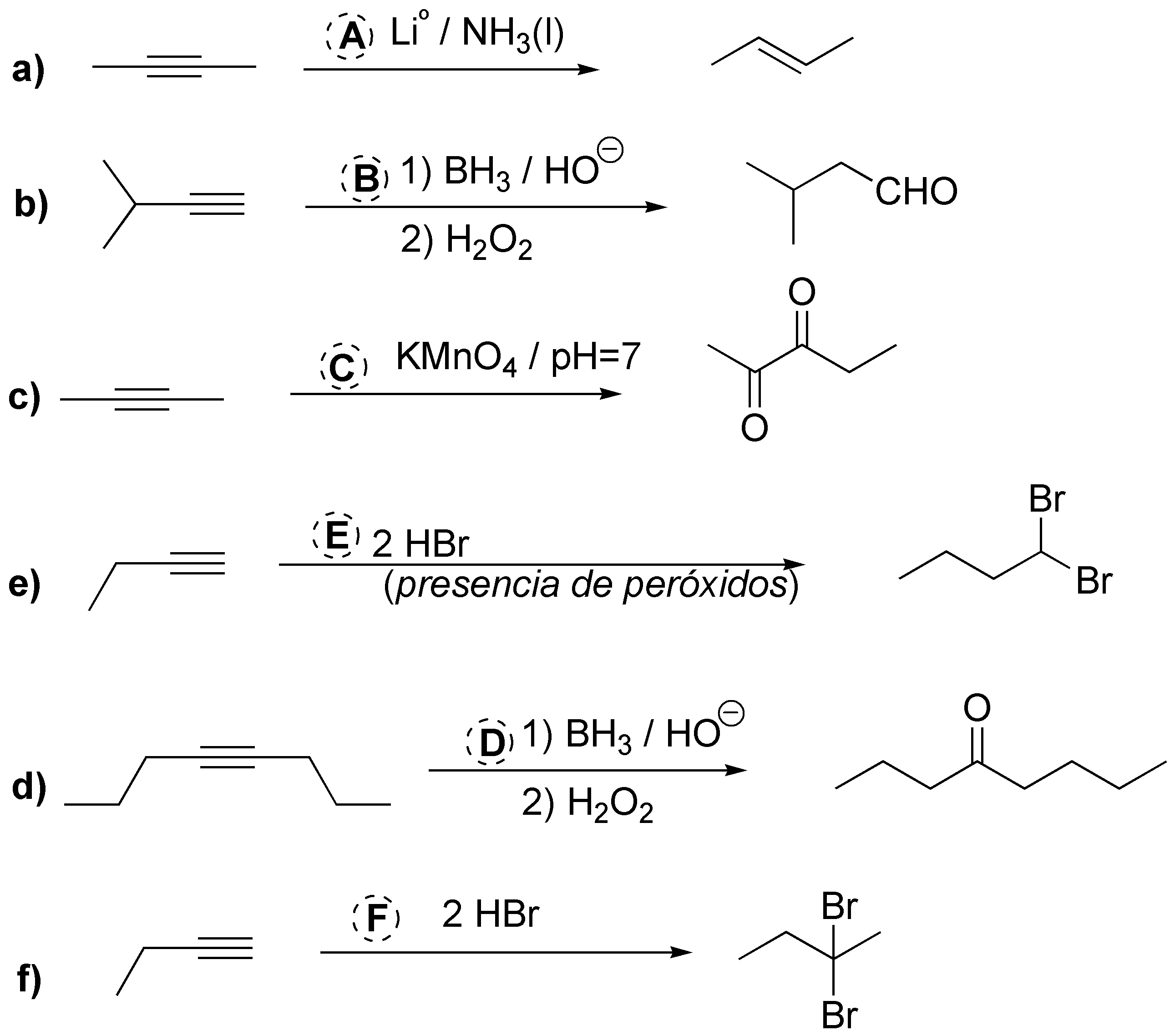
A) La conversión desde alquino hasta E-alqueno se realiza con Lio / NH3(l).
B) La conversión desde alquino hasta aldehído se consigue mediante una hidratación con regioselectividad anti-Markovnikov y se realizará con BH3 / HO– seguido de H2O2.
C) La oxidación hasta dicetona (equivalente a la dihidroxilación de alquenos) puede realizarse con KMnO4 / pH=7.
D) La conversión desde alquino hasta cetona se realizara mediante la hidratación, es decir, BH3 / HO– seguido de H2O2 o H2O / H2SO4 / HgSO4.
E) La conversión alquino a dibromo terminal (regioselectividad anti-Markovnikov) se realizará con 2 moles HBr en presencia de peróxidos.
F) La conversión alquino a dibromo se realizara con la adición de 2 moles HBr (regioselectividad Markovnikov).
Solución 19:
El orden de acidez refleja la estabilización del carbanión que se forma. La acidez de los protones de la serie alcanos-alquenos-alquinos aumenta en este orden, conforme el carbono que soporta el hidrógeno se hace más electronegativo.
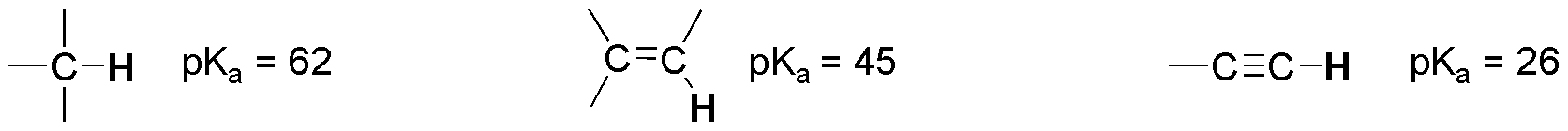
Solución 20:
Al igual que los alquenos, los alquinos sufren rotura oxidativa cuando se tratan con ozono.
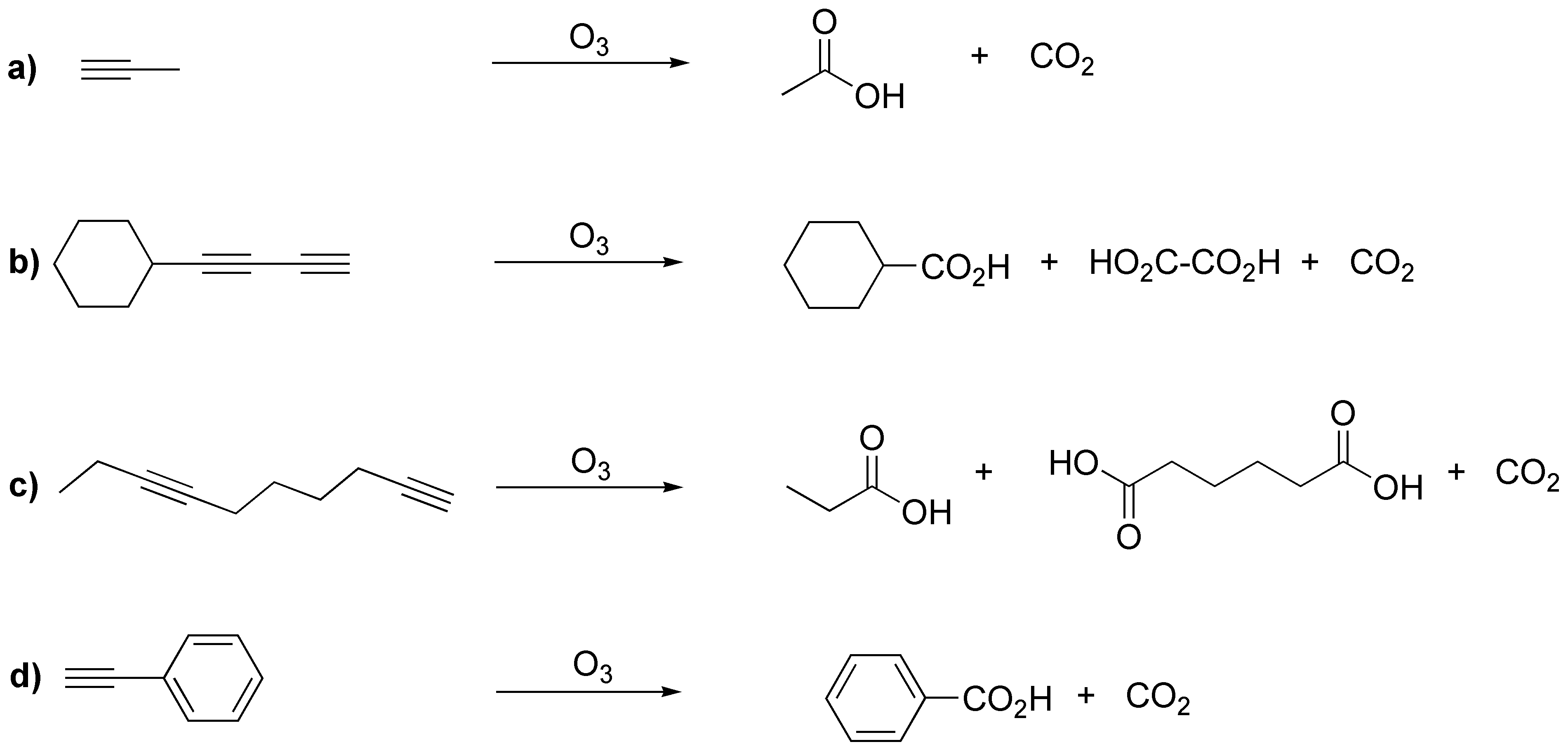
Solución 21:
A) Será el derivado hexabromado como resultado de la adición de bromo al doble y al triple enlace; B) la adición de HBr sigue la regla de Markovnikov; C) la hidrogenación de un alquino con metal alcalino en amoníaco líquido produce el alqueno con estereoquímica E (trans); D) el amiduro sódico produce el acetiluro que reacciona con yodoalcano dando el alquino disustituido; E) la hidratación de los alquinos disutituidos producirá dos enoles diferentes que tautomerizan a las dos cetonas posibles; F) la dihidratación del dialquino producirá la correspondiente dicetona.
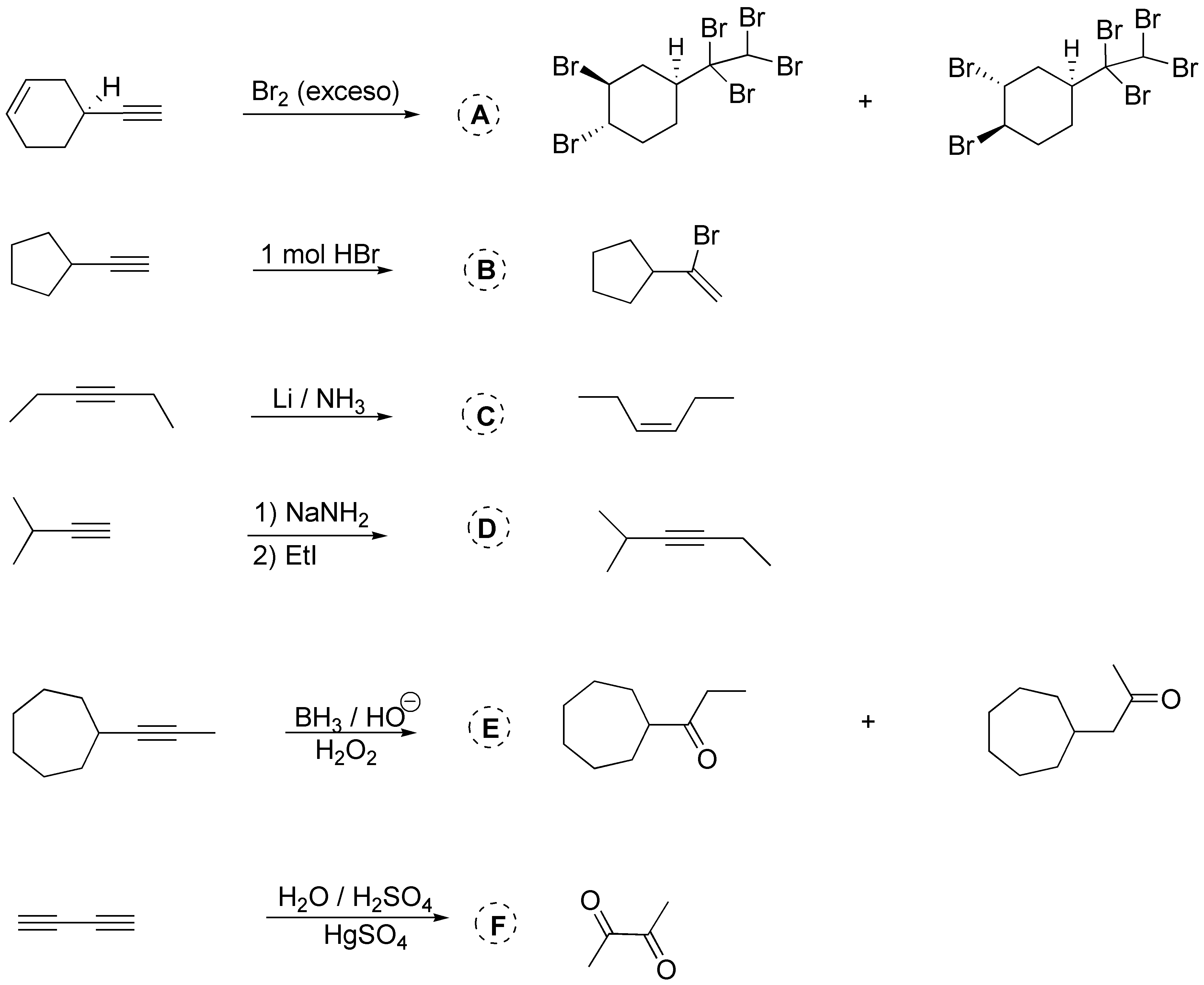
Solución 22:
El pKa de los alquinos terminales es 26, por tanto sólo se podría utilizar H– y NH2–, pues proceden de ácidos más débiles que los alquinos (mayores valores del pKa).
| Forma ácida | Base | pKa |
| H2O | HO– | 15.7 |
| H2 | H– | 35.0 |
| MeOH | MeO– | 15.1 |
| NH3 | NH2– | 36.0 |
| H2CO3 | HCO3– | 6.3 |
Solución 23:
A) Para realizar la conversión desde alquino hasta aldehído, debemos realizar una hidratación anti-Markovnikov con borano y posterior oxidación con H2O2 en medio básico; B) El alqueno trans se obtendrá por hidrogenación usando litio en amoníaco líquido; C) La degradación hasta ácido carboxílico se realizará mediante ozonólisis o con permanganato; D) la hidratación de alquinos terminales produce enoles que tautomerizan a metilcetonas; E) la obtención del dibromo geminal se consigue mediante adición Markovnikov de HBr; F) la obtención del tetrabromo derivado supone la adición de dos moles de bromo.
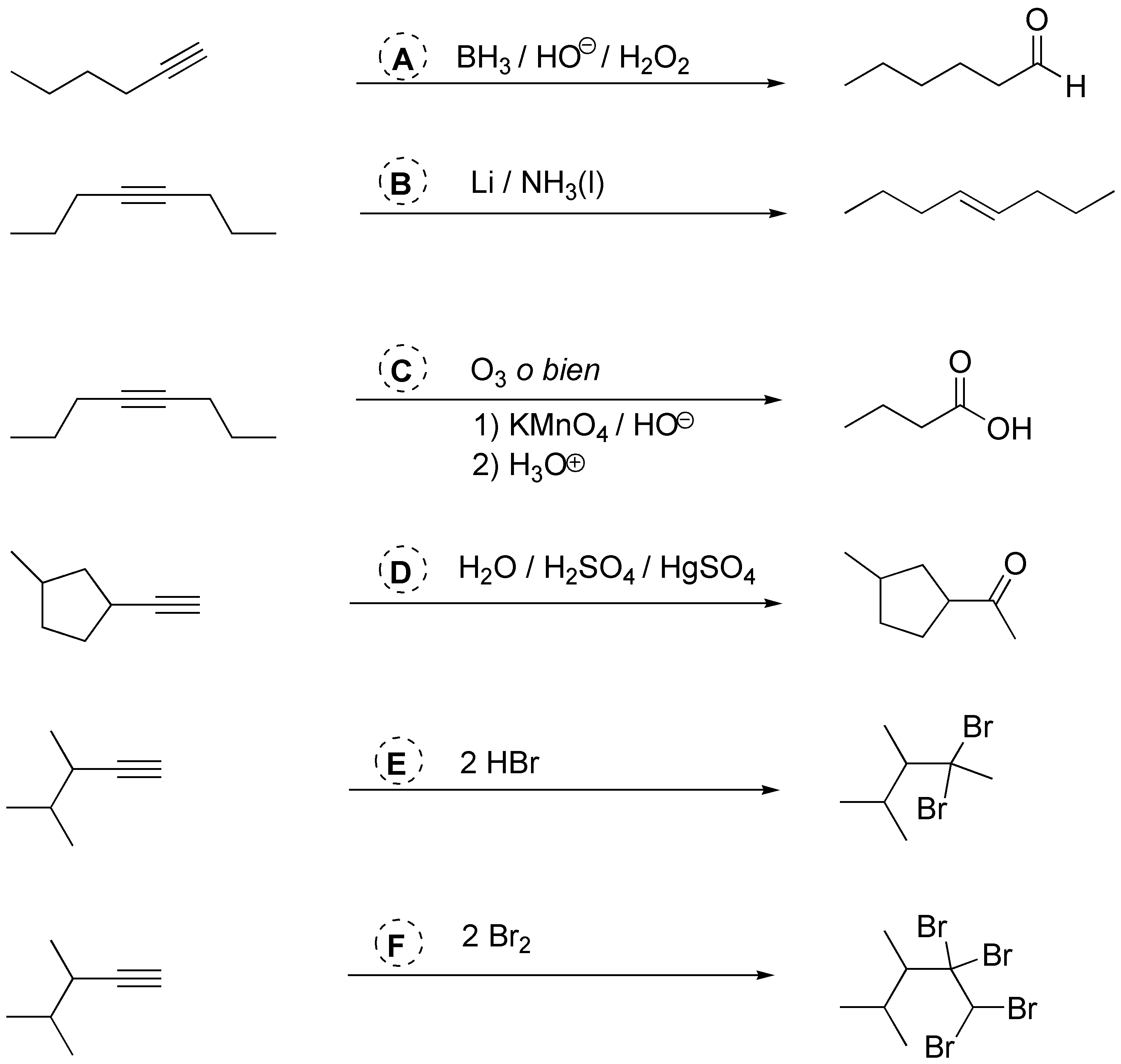
Solución 24:
En el esquema se indican las condiciones de reacción para a partir de acetileno (etino) conseguir los productos deseados:
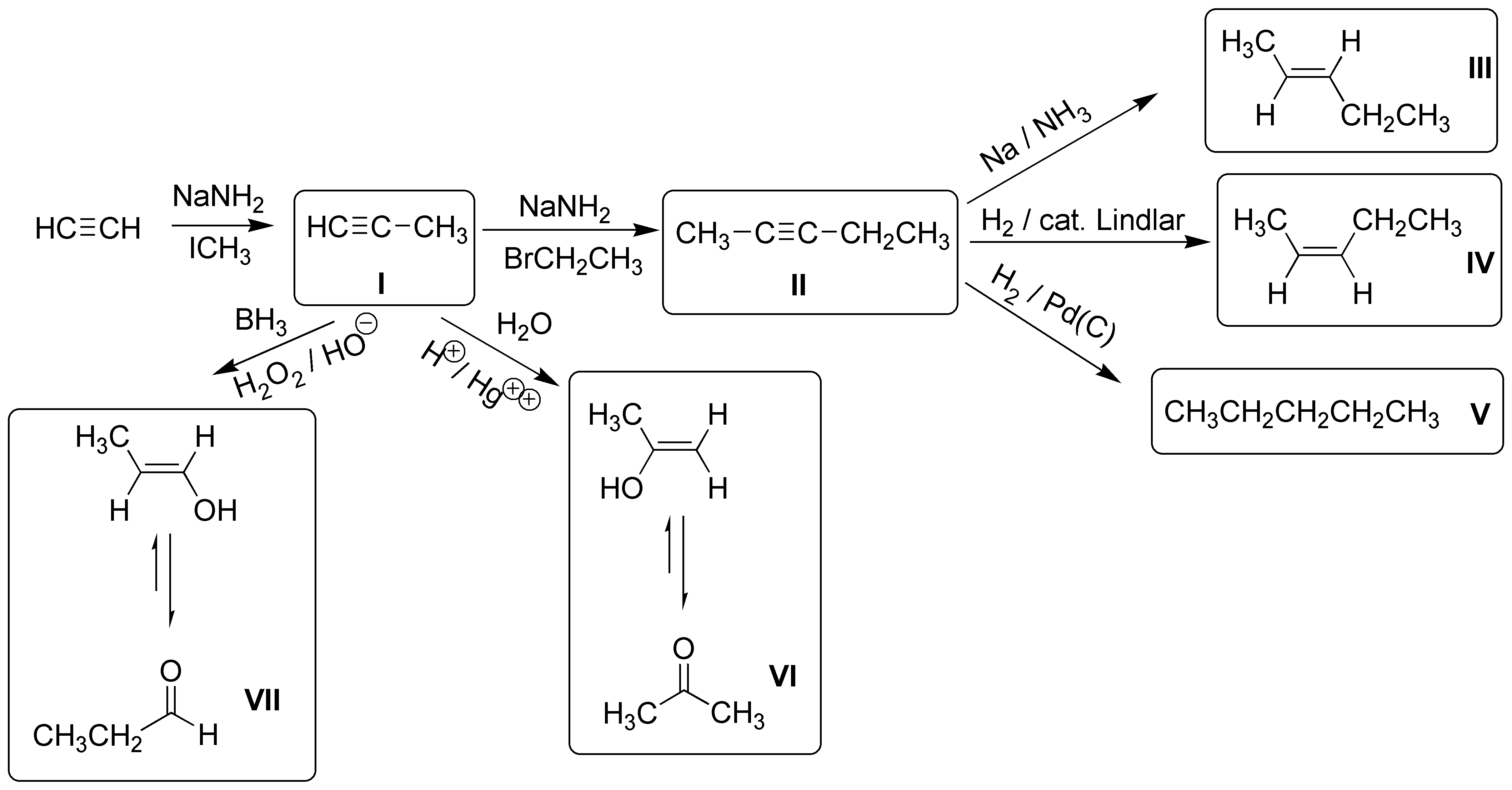
Solución 25:
La clave de la síntesis son dos reacciones: el alargamiento de la cadena de alquino y la adición nucleofílica de un acetiluro a un compuesto carbonílico (propalan).
Solución 26:
La hidratación de un alquino produce un enol que tautomeriza al correspondiente compuesto carbonílico (aldehído o cetona):
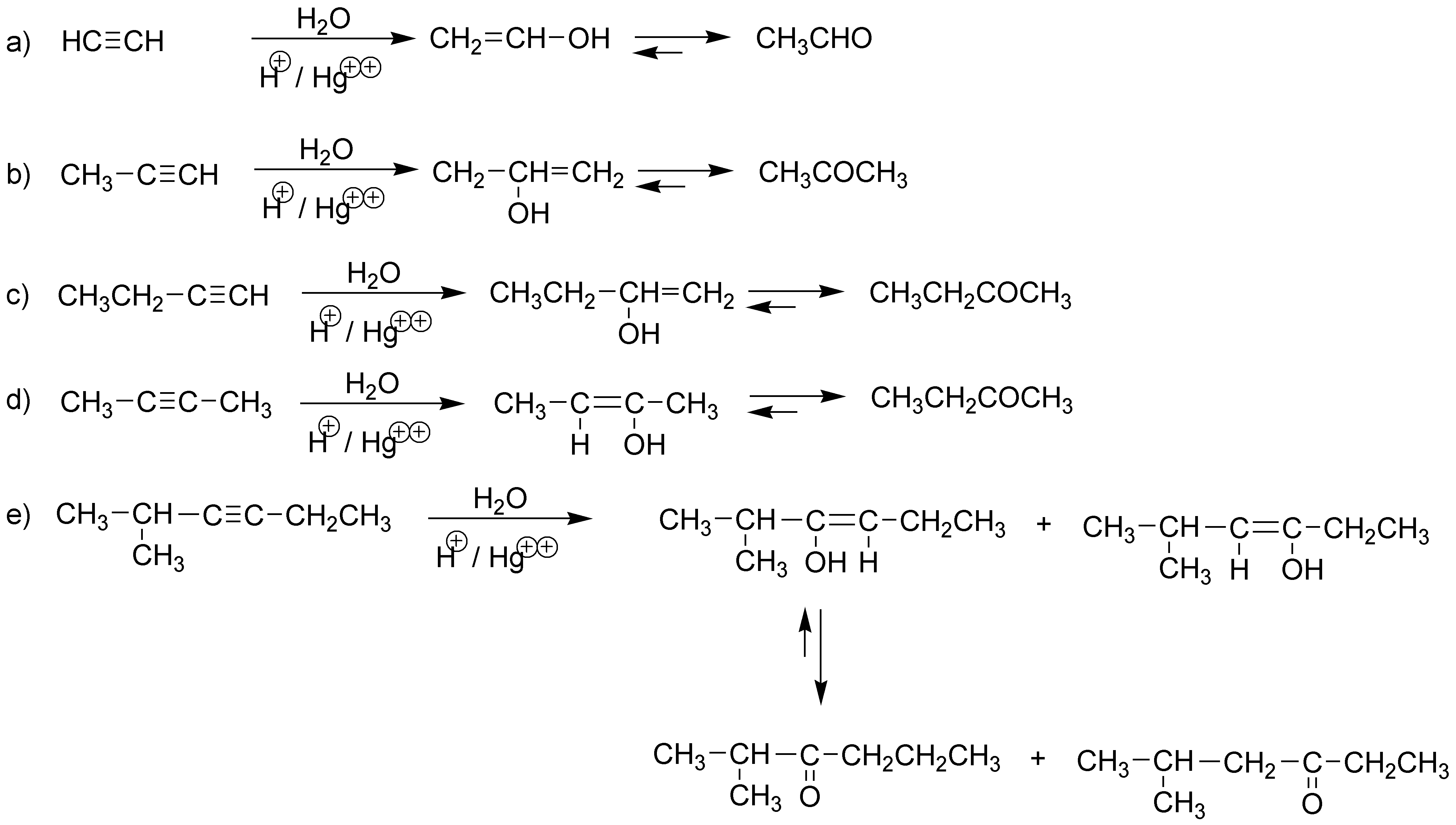
Solución 27: