Written by J.A. Dobado | Last Updated on 1 año
El análisis de hidrocarburos aromáticos da resultados negativos en los ensayos con bromo en CCl4 y con permanganato alcalino, y además arden con una llama oscura característica.
La mayor parte de los hidrocarburos aromáticos alquilados son líquidos, pero los que poseen mas de un anillo (fusionado o no) son sólidos.
- Solubilidad en H2SO4: Los hidrocarburos aromáticos sencillos son insolubles en H2SO4 pero solubles en H2SO4 fumante. Cuando existen dos o más sustituyentes alquilo tales hidrocarburos se sulfonan con facilidad disolviéndose en H2SO4 concentrado.Los hidrocarburos aromáticos condensados, como naftaleno y antraceno, reaccionan lentamente con H2SO4 concentrado.
- Espectro IR: Presentan las bandas de absorción características del anillo aromático.
Ensayo de nitración
El análisis de hidrocarburos aromáticos con el ensayo de nitración, produce generalmente un aumento de la temperatura al tratarlos en frío con una mezcla de H2SO4/HNO3 concentrado. Podemos utilizar esta reacción a nivel preparativo.
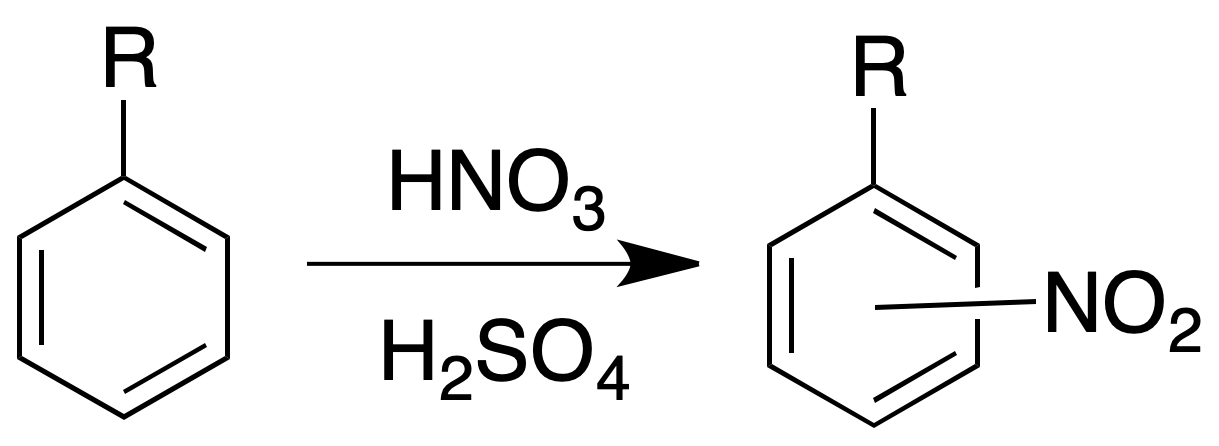
Procedimiento: Añadimos 500 mg de producto a unos 3 ml de H2SO4 concentrado. Se adiciona igual volumen de HNO3 concentrado gota a gota sobre la disolución anterior, agitando después de cada adición. Se calienta de 5 a 10 min en un baño de agua a 60 ºC.
Sacar el tubo del baño y agitarlo frecuentemente. Enfriar y verter sobre agua con hielo. Filtrar el precipitado, lavarlo con agua y recristalizarlo de EtOH/H2O.
Formación de ácido arilbenzoico
Procedimiento: En un matraz con reflujo colocar 400 mg de anhídrido ftálico, 10 ml de sulfuro de carbono, 800 mg de cloruro de aluminio anhidro y 400 mg del hidrocarburo aromático. Calentar la mezcla unos 30 min en un baño de agua y a continuación enfriar en el grifo.
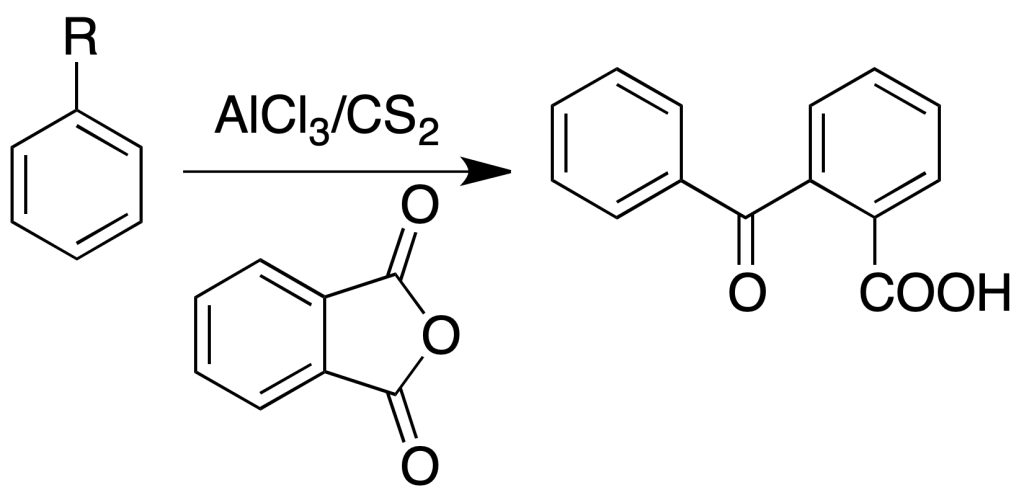
Decantar la capa de sulfuro de carbono lentamente. Añadir enfriando 5 ml de HCl concentrado y después 5 ml de agua. Agitar con fuerza la mezcla. Recoger el sólido y lavarlo con agua fría. Si no cristaliza, se extrae el aceite con hidróxido amónico diluído y después se neutraliza con HCl (conc).
