Written by J.A. Dobado | Last Updated on 1 año
¿Qué es la colchicina?
La colchicina es un alcaloide que se encuentra en el azafrán silvestre (Colchicum autumnale). Su uso en medicina se describió por primera vez en el Papiro de Ebers (papiro médico Egipcio hace aproximadamente 3500 años de antigüedad), como remedio antiinflamatorio y contra la artritis (ataques de gota).
Índice
La colchicina es un sólido en forma de agujas o polvo amarillo pálido que se oscurece con la exposición a la luz. Es inodoro o casi inodoro. De fórmula molecular C22H25NO6 y masa molecular de 399.4 g/mol. Su punto de fusión es de 142-150 °C.
La solubilidad en agua a temperatura ambiente (25 ºC) es de 4.5 g en 100 ml de agua. Además, 1 g de colchicina se disuelve en 220 ml éter, en 100 ml benceno. Es muy soluble en alcohol or chloroform y prácticamente insoluble en éter de petróleo (hexano).
Estructura
Presenta tres anillos fusionados (2 de 7 miembros y uno de 6), con un centro quiral al grupo acetamida en uno de los anillos heptagonales de tropona. Además, como sustituyentes adicionales presenta 4 grupos metoxilo (CH3O–), 3 en el anillo benzofusionado y 1 en el de tropolona. El nombre sistemático de la IUPAC es el N-[(7S)-5,6,7,9-tetrahidro-1,2,3,10-tetrametoxi-9-oxobenzo[a]heptalen-7-il]-acetamida.
 |
| Estructura 3D |
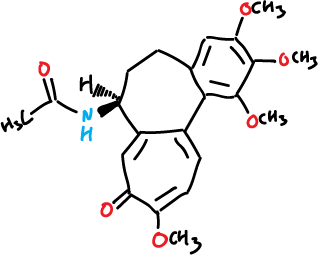
Aunque sólo presenta un carbono quiral en la posición C7, debido a la orientación relativa de los anillos, se pueden dar 4 estereoisómeros distintos que se indican a continuación, siendo la obtenida de forma natural en el azafrán silvestre la corresponde al isómero (−)-(aS, 7S)-colchicina. La molécula presenta atropoisomería asignándose a esta asimetría dos etiquetas aS o aR, donde a designa una quiralidad axial, para este tipo de esteroisómeros. El enlace C—C entre el anillo A (anillo bencénico) y el anillo C (de 7 miembros insaturado) actúa de eje quiral.
Además, la barrera de energía de interconversión es de aproximadamente 22–24 kcal·mol−1 entre las formas aR y aS, siendo esta última forma la del alkaloide que se encuentra en la naturaleza.
Biosíntesis
La biosíntesis en las plantas de la colchicina se lleva a cabo con los aminoácidos tirosina y fenilalanina como precursores.
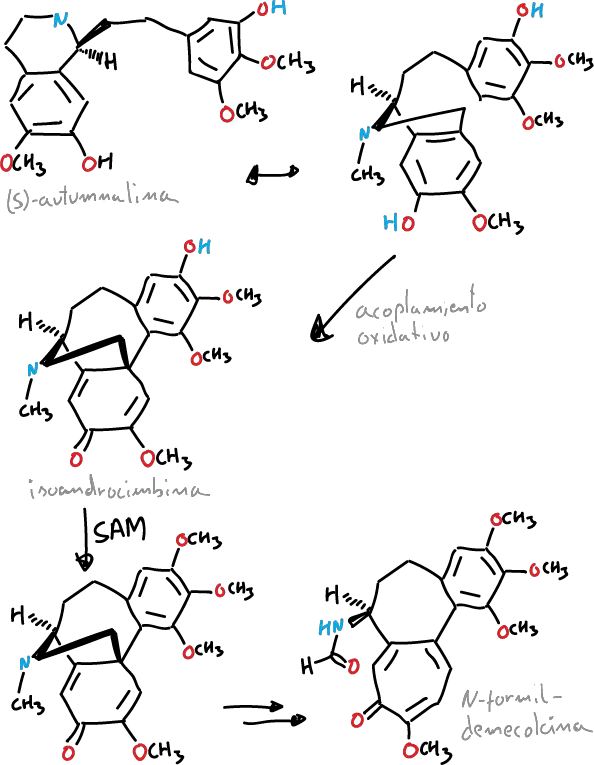
Se ha descrito que el anillo de tropolona de la colchicina se forma a partir de la expansión del anillo de tirosina. Se obtiene biosintéticamente a partir de (S)-autumnalina. Esa ruta biosintética ocurre mediante de una reacción de acoplamiento fenólico que conlleva el intermedio isoandrocimbina.
Posteriormente, dicho intermedio sufre O-metilación dirigida por S-adenosilmetionina. La biosíntesis continúa con dos etapas de oxidación seguidas por la rotura del anillo de ciclopropano que conducen a la formación del anillo de tropolona contenido por N-formildemecolcina.
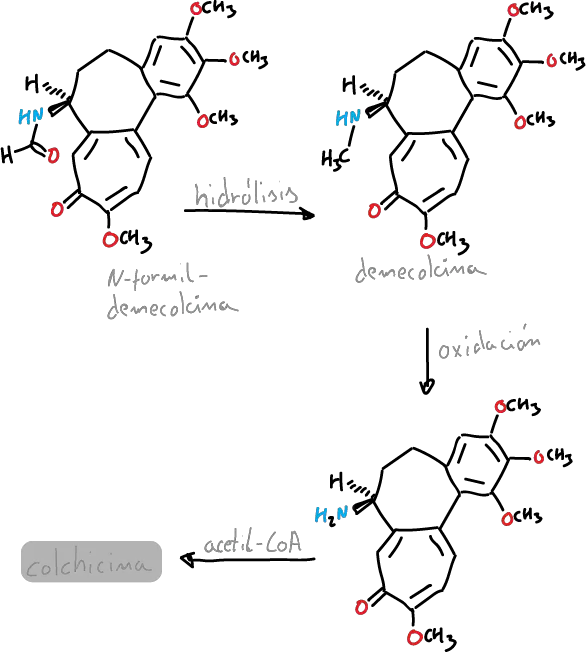
Así, la N-formildemecolcina se hidroliza para generar la molécula demecolcina. Esta también se desmetila oxidativavemente generando desacetilcolchicina. Finalmente, la molécula de colchicina se forma después de la adición de acetil-coenzima A a desacetilcolchicina.
La colchicina se puede purificar a partir del azafrán silvestre (Colchicum autumnale), encontrándose en una concentración máxima en verano que varían del 0.1% en la flor hasta el 0.8% en las semillas y el bulbo.
Sin embargo, no está disponible en cantidades suficientes para su uso comercial. Gloriosa superba es otra planta que también contiene colchicina, y se obtiene, alternativamente, a partir de sus tubérculos secos.
