Índice
¿Qué es la configuración electrónica?
La configuración electrónica es el resumen de dónde están situados los electrones alrededor de un núcleo. Cada átomo neutro tiene un número de electrones igual a su número de protones. Por tanto, esos electrones están localizados en orbitales en una disposición alrededor del núcleo. La notación indica que indica su energía y el tipo del orbital en el que se encuentran. Los tipos de orbitales y cuántos electrones puede alojar cada uno se resume de la siguiente manera hasta el nivel n=4.
| Nivel (n) | sub-nivel | Nº orbitales por cada tipo | Nº orbitales por cada nivel | Nº max. de e– (2n2) |
| 1 | s | 1 | 1 | 2 |
| 2 | s | 1 | 4 | 8 |
| p | 3 | |||
| 3 | s | 1 | 9 | 18 |
| p | 3 | |||
| d | 5 | |||
| 4 | s | 1 | 16 | 32 |
| p | 3 | |||
| d | 5 | |||
| f | 7 |
Entonces, según la tabla anterior, necesita 2 electrones para llenar un orbital s, 6 electrones para llenar un orbital p, 10 electrones para llenar un orbital d y 14 electrones para llenar el orbital f.
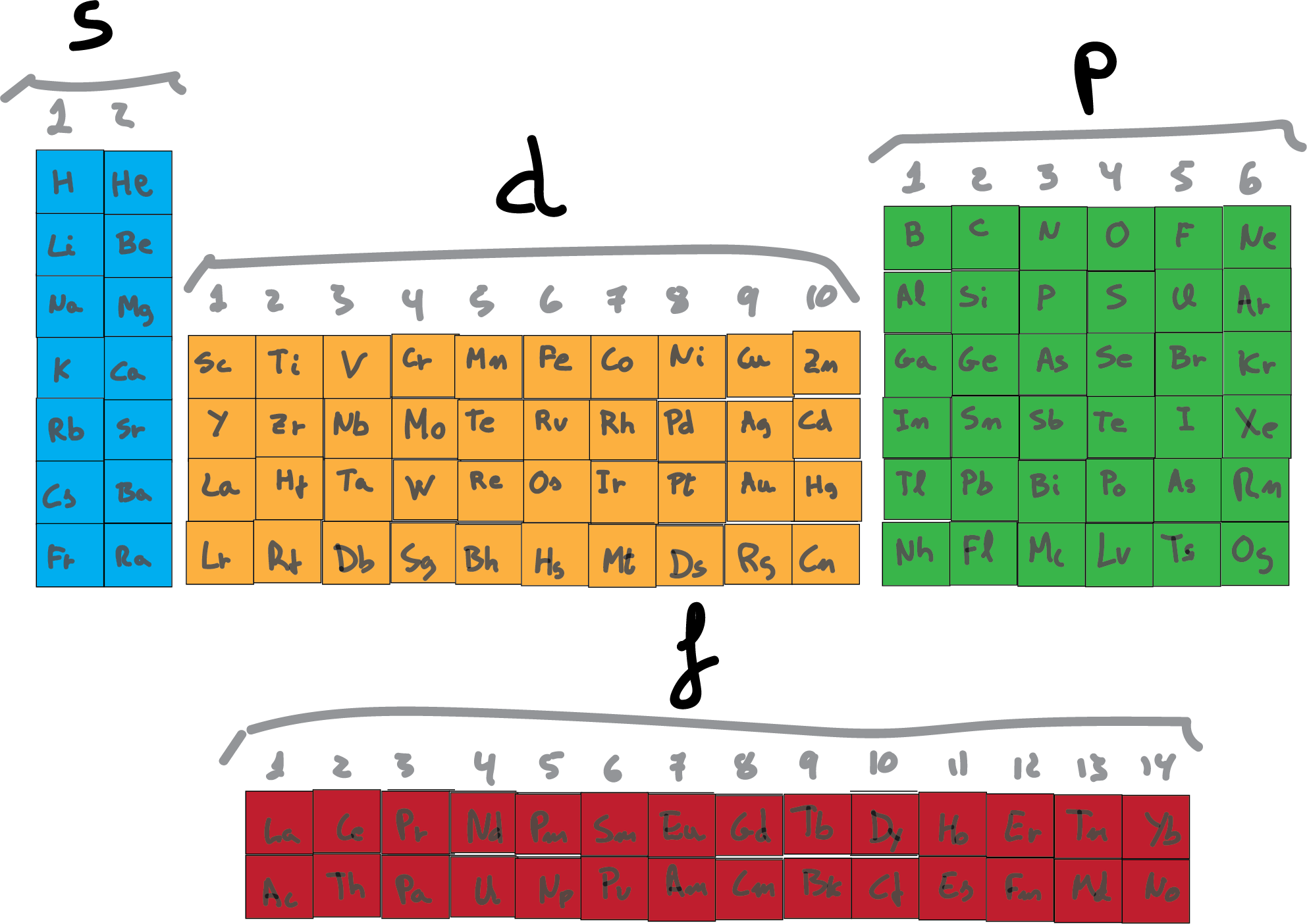
Sin embargo, para poder determinar la configuración electrónica de cada elemento en la tabla periódica necesitaremos conocer el orden de llenado de dichos orbitales.
Orden de llenado
El orden en que los electrones se colocan en los orbitales se basa en el la energía de estos. Así se van llenando por orden de esta energía según el principio de Aufbau. Los orbitales de menor energía se llenan primero, y viene determinado de la siguiente manera:
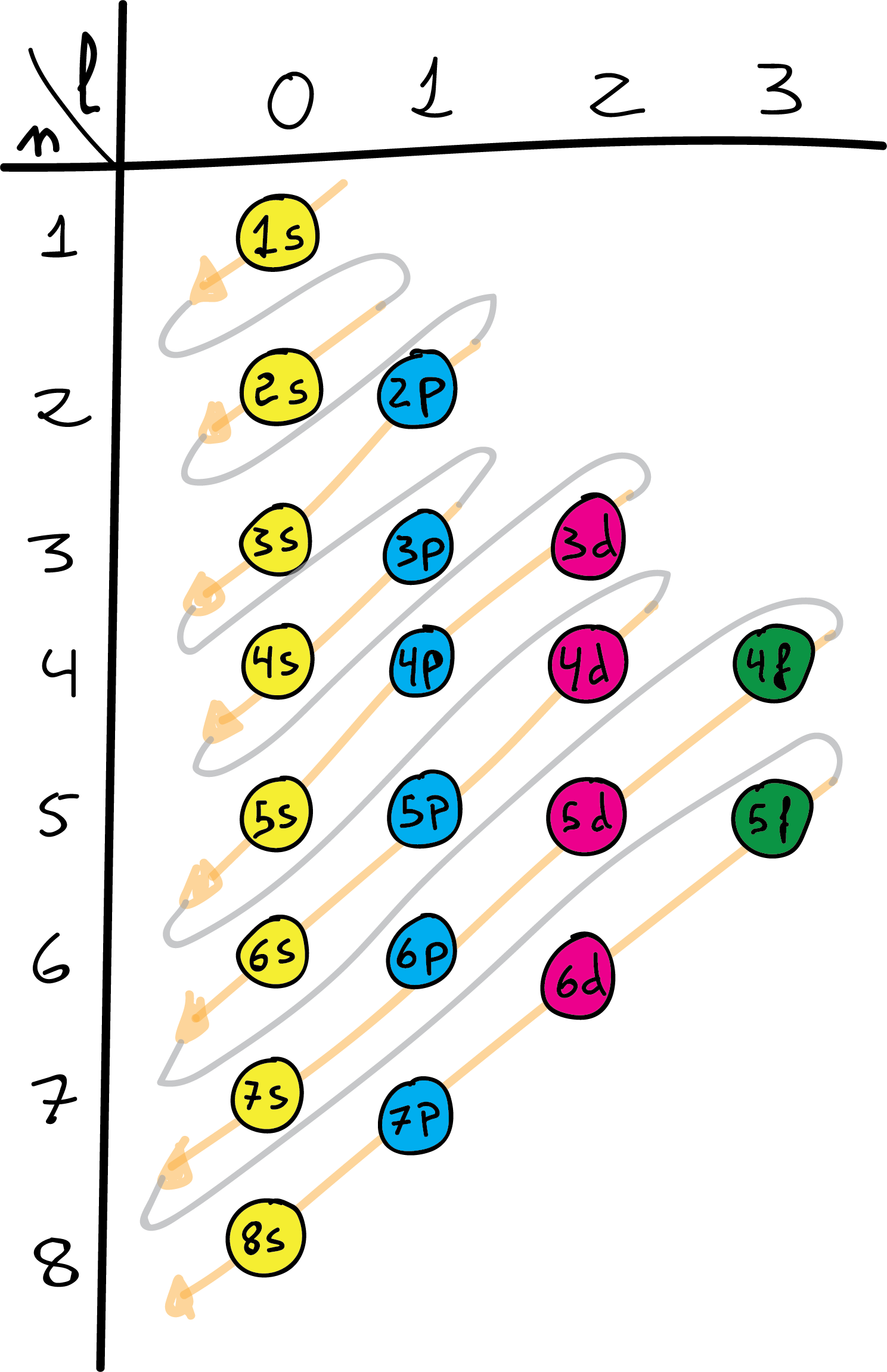
1s2→2s2→2p6→3s2→3p6→4s2→3d10→4p6→5s2→4d10→5p6→6s2→4f 14→5d10→6p6→7s2→5f 14→6d10→7p6 (6f 14 7d10 7f 14) → 8s2 …
El orden de llenado de las tres últimas capas descritas, no se ha podido determinar. Esto es debido principalmente a que no se dispone de la cantidad necesaria de los elementos correspondientes para hacer medidas experimentales de propiedades fisicoquímicas.
Hay que tener en cuenta que este orden es orientativo y para ciertos elementos varía ya que hay configuraciones que son mas estables cuando los orbitales están llenos, semillenos, o vacíos.
Para escribir la configuración electrónica, se comienzan con el número de capa (n) seguido del tipo de orbital y finalmente el superíndice indica cuántos electrones hay en el orbital. Por ejemplo, para el átomo de carbono que tiene 6 electrónes sería:
carbono: 1s2 2s2 2p4
Se suele abreviar la notación, usando el gas noble anterior en orden de número atómico entre corchetes. Para el carbono sería:
carbono: [He] 2s22p4
Tabla de la configuración electrónica
En la siguiente tabla se muestra la configuración electrónica de los elementos, ordenados por su número atómico (Z).
| Z | Símbolo | Configuración |
|---|---|---|
| 1 | H | 1s1 |
| 2 | He | 1s2 |
| 3 | Li | [He] 2s1 |
| 4 | Be | [He] 2s2 |
| 5 | B | [He] 2s2 2p1 |
| 6 | C | [He] 2s2 2p2 |
| 7 | N | [He] 2s2 2p3 |
| 8 | O | [He] 2s2 2p4 |
| 9 | F | [He] 2s2 2p5 |
| 10 | Ne | [He] 2s2 2p6 |
| 11 | Na | [Ne] 3s1 |
| 12 | Mg | [Ne] 3s2 |
| 13 | Al | [Ne] 3s2 3p1 |
| 14 | Si | [Ne] 3s2 3p2 |
| 15 | P | [Ne] 3s2 3p3 |
| 16 | S | [Ne] 3s2 3p4 |
| 17 | Cl | [Ne] 3s2 3p5 |
| 18 | Ar | [Ne] 3s2 3p6 |
| 19 | K | [Ar] 4s1 |
| 20 | Ca | [Ar] 4s2 |
| 21 | Sc | [Ar] 3d1 4s2 |
| 22 | Ti | [Ar] 3d2 4s2 |
| 23 | V | [Ar] 3d3 4s2 |
| 24 | Cr | [Ar] 3d5 4s1 |
| 25 | Mn | [Ar] 3d5 4s2 |
| 26 | Fe | [Ar] 3d6 4s2 |
| 27 | Co | [Ar] 3d7 4s2 |
| 28 | Ni | [Ar] 3d8 4s2 |
| 29 | Cu | [Ar] 3d10 4s1 |
| 30 | Zn | [Ar] 3d10 4s2 |
| 31 | Ga | [Ar] 3d10 4s2 4p1 |
| 32 | Ge | [Ar] 3d10 4s2 4p2 |
| 33 | As | [Ar] 3d10 4s2 4p3 |
| 34 | Se | [Ar] 3d10 4s2 4p4 |
| 35 | Br | [Ar] 3d10 4s2 4p5 |
| 36 | Kr | [Ar] 3d10 4s2 4p6 |
| 37 | Rb | [Kr] 5s1 |
| 38 | Sr | [Kr] 5s2 |
| 39 | Y | [Kr] 4d1 5s2 |
| 40 | Zr | [Kr] 4d2 5s2 |
| 41 | Nb | [Kr] 4d4 5s1 |
| 42 | Mo | [Kr] 4d5 5s1 |
| 43 | Tc | [Kr] 4d5 5s2 |
| 44 | Ru | [Kr] 4d7 5s1 |
| 45 | Rh | [Kr] 4d8 5s1 |
| 46 | Pd | [Kr] 4d10 |
| 47 | Ag | [Kr] 4d10 5s1 |
| 48 | Cd | [Kr] 4d10 5s2 |
| 49 | In | [Kr] 4d10 5s2 5p1 |
| 50 | Sn | [Kr] 4d10 5s2 5p2 |
| 51 | Sb | [Kr] 4d10 5s2 5p3 |
| 52 | Te | [Kr] 4d10 5s2 5p4 |
| 53 | I | [Kr] 4d10 5s2 5p5 |
| 54 | Xe | [Kr] 4d10 5s2 5p6 |
| 55 | Cs | [Xe] 6s1 |
| 56 | Ba | [Xe] 6s2 |
| 57 | La | [Xe] 5d1 6s2 |
| 58 | Ce | [Xe] 4f 1 5d1 6s2 |
| 59 | Pr | [Xe] 4f 3 6s2 |
| 60 | Nd | [Xe] 4f 4 6s2 |
| 61 | Pm | [Xe] 4f 5 6s2 |
| 62 | Sm | [Xe] 4f 6 6s2 |
| 63 | Eu | [Xe] 4f 7 6s2 |
| 64 | Gd | [Xe] 4f 7 5d1 6s2 |
| 65 | Tb | [Xe] 4f 9 6s2 |
| 66 | Dy | [Xe] 4f 10 6s2 |
| 67 | Ho | [Xe] 4f 11 6s2 |
| 68 | Er | [Xe] 4f 12 6s2 |
| 69 | Tm | [Xe] 4f 13 6s2 |
| 70 | Yb | [Xe] 4f 14 6s2 |
| 71 | Lu | [Xe] 4f 14 5d1 6s2 |
| 72 | Hf | [Xe] 4f 14 5d2 6s2 |
| 73 | Ta | [Xe] 4f 14 5d3 6s2 |
| 74 | W | [Xe] 4f 14 5d4 6s2 |
| 75 | Re | [Xe] 4f 14 5d5 6s2 |
| 76 | Os | [Xe] 4f 14 5d6 6s2 |
| 77 | Ir | [Xe] 4f 14 5d7 6s2 |
| 78 | Pt | [Xe] 4f 14 5d9 6s1 |
| 79 | Au | [Xe] 4f 14 5d10 6s1 |
| 80 | Hg | [Xe] 4f 14 5d10 6s2 |
| 81 | Tl | [Xe] 4f 14 5d10 6s2 6p1 |
| 82 | Pb | [Xe] 4f 14 5d10 6s2 6p2 |
| 83 | Bi | [Xe] 4f 14 5d10 6s2 6p3 |
| 84 | Po | [Xe] 4f 14 5d10 6s2 6p4 |
| 85 | At | [Xe] 4f 14 5d10 6s2 6p5 |
| 86 | Rn | [Xe] 4f 14 5d10 6s2 6p6 |
| 87 | Fr | [Rn] 7s1 |
| 88 | Ra | [Rn] 7s2 |
| 89 | Ac | [Rn] 6d1 7s2 |
| 90 | Th | [Rn] 6d2 7s2 |
| 91 | Pa | [Rn] 5f 2 6d1 7s2 |
| 92 | U | [Rn] 5f 3 6d1 7s2 |
| 93 | Np | [Rn] 5f 4 6d1 7s2 |
| 94 | Pu | [Rn] 5f 6 7s2 |
| 95 | Am | [Rn] 5f 7 7s2 |
| 96 | Cm | [Rn] 5f 7 6d1 s2 |
| 97 | Bk | [Rn] 5f 9 s2 |
| 98 | Cf | [Rn] 5f 10 s2 |
| 99 | Es | [Rn] 5f 11 s2 |
| 100 | Fm | [Rn] 5f 12 s2 |
| 101 | Md | [Rn] 5f 13 s2 |
| 102 | No | [Rn] 5f 14 s2 |
| 103 | Lr | [Rn] 5f 14 7s2 7p1 |
| 104 | Rf | [Rn] 5f 14 6d2 7s2 |
| 105 | Db | [Rn] 7s2 5f 14 6d3 |
| 106 | Sg | [Rn] 7s2 5f 14 6d4 |
| 107 | Bh | [Rn] 7s2 5f 14 6d5 |
| 108 | Hs | [Rn] 7s2 5f 14 6d6 |
| 109 | Mt | [Rn] 7s2 5f 14 6d7 |
| 110 | Ds | [Rn] 7s25f 14 6d8 |
| 111 | Rg | [Rn] 5f 14 6d10 7s1 |
| 112 | Cn | [Rn] 5f 14 6d10 7s2 |
| 113 | Nh | [Rn] 5f 14 6d10 7s2 7p1 |
| 114 | Fl | [Rn] 5f 14 6d10 7s2 7p2 |
| 115 | Mc | [Rn] 5f 14 6d10 7s2 7p3 |
| 116 | Lv | [Rn] 5f 14 6d10 7s2 7p4 |
| 117 | Ts | [Rn] 5f 14 6d10 7s2 7p5 |
| 118 | Og | [Rn] 5f 14 6d10 7s2 7p6 |
Preguntas frecuentes
- ¿Qué es la configuración electrónica?
La configuración electrónica es una descripción de la estructura electrónica de un átomo. Los orbitales se llenan de electrones en todas las capas siguiendo tres reglas: el principio de Aufbau, el principio de exclusión de Pauli y la regla de Hund.
- ¿Cuál es la configuración electrónica del átomo de cromo (Cr Z = 24)?
La configuración electrónica esperada para el cromo es 1s2 2s2 2p6 3s2 3p6 3d4 4s2. Sin embargo, los orbitales semillenos y totalmente llenos presentan una estabilidad adicional y, por tanto, la configuración electrónica correcta del átomo de cromo [Z = 24] es [Ar] 3d5 4s1.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
