Índice
Usos frecuentes de la CCF
- Determinar componentes de una mezcla y comparar identidades.
- Monitorizar reacciones y seguir columnas de cromatografía.
- Optimizar eluyentes para cromatografía en columna (CC).
¿Qué es la cromatografía de capa fina (CCF)?
La cromatografía de capa fina (CCF) es una variante de la cromatografía líquido–sólido[1]. La muestra se deposita sobre una capa adsorbente y se desarrolla por capilaridad con un eluyente. Las diferencias de interacción (van der Waals, enlaces de hidrógeno, efectos inductivos) entre solutos, fase estacionaria y disolvente generan separaciones.
Adsorbentes
- Gel de sílice (SiO2): ~80 % de las separaciones.
- Alúmina (Al2O3) (ácida, neutra o básica).
- Tierra silícea (Kieselguhr), celulosa (nativa o microcristalina), poliamida.
Se suministran sobre soportes inertes (vidrio, aluminio, poliéster) y se caracterizan por tamaño y diámetro de poro, área superficial, homogeneidad y pureza.
Determinación del Rf
El factor de retención se define como la razón entre la distancia recorrida por el soluto y la del frente de eluyente.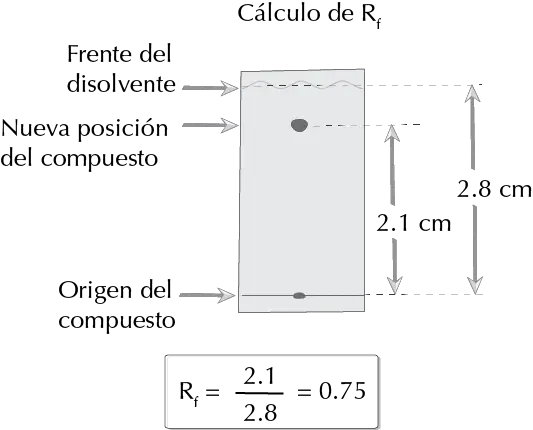
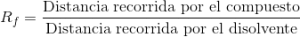
Materiales y procedimientos
Placa cromatográfica
Láminas de vidrio, plástico o aluminio (tamaños típicos 20×20, 10×20, 5×2 cm). Muchas incorporan indicador de fluorescencia F254 o F366[2].
Aplicación de muestra
Analítica: aplicación en punto con capilar. Preparativa: aplicación en banda con pipeta Pasteur. Marca con lápiz una línea de origen ~0,5 cm desde el borde inferior sin dañar la capa.
Elección del eluyente
Busca un Rf medio ~0,3–0,5. Ajusta la polaridad:
- Compuestos poco polares: hexano (o mezclas apolares).
- Polaridad media: hexano/AcOEt o hexano/éter dietílico (proporciones variables).
- Compuestos polares: CH2Cl2/MeOH (mezclas).
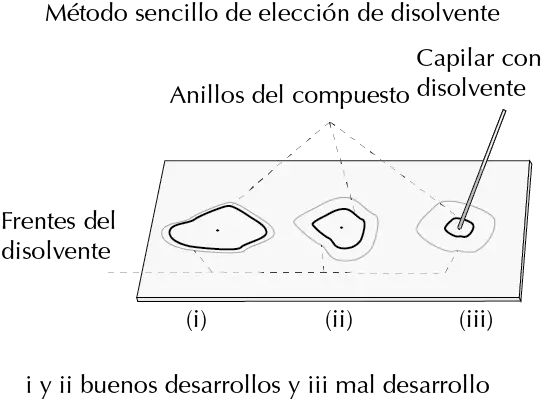
Tanque de elución (cubeta)
Recipiente cerrado con atmósfera saturada de eluyente (tipos: fondo plano, doble compartimento, frascos con tapa o vaso con vidrio de reloj). Coloca una tira de papel de filtro para favorecer la saturación. El nivel del eluyente nunca debe cubrir la línea de origen.
Detección / revelado
UV (254 nm) en placas con indicador: manchas oscuras sobre fondo verde claro (o brillantes azuladas para ciertos cromóforos).
Reveladores químicos (pulverización o inmersión; usar cabina/vitrina):
- H2SO4/EtOH 50 % (universal; calentar tras pulverizar).
- KMnO4 3 g / K2CO3 10 g / H2O 300 mL (universal; manchas amarillas/pardas; incompatible con aminas en eluyente).
- Ácido fosfomolíbdico 10 g / EtOH 100 mL (amplio espectro).
- Ninhidrina 0,1 g / AcOH 2 mL / acetona 100 mL (aminoácidos y compuestos nitrogenados).
- Yodo (exposición a vapores; marca rápidamente con lápiz: las manchas se desvanecen).

Procedimiento para una CCF analítica
- Disuelve una pequeña porción de muestra.
- Si usas cromatofolio 20×20 cm, corta placas (≈ un tercio de altura) según muestras.
- Dibuja línea de origen a ~0,5 cm del borde inferior y marca puntos de siembra.
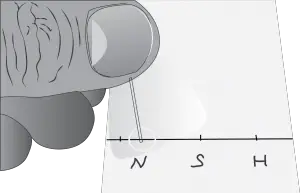
- Siembra con capilar. Seca si es necesario para evitar difusión antes del desarrollo.

- Desarrolla en tanque hasta el borde superior, retira y revela (UV o químico).
Referencias y notas
- [1] Izmailov y Shraiber (1938) usaron láminas de vidrio con alúmina para extractos vegetales: antecedente de la CCF. Egon Stahl (1956) estandarizó procedimientos y popularizó la técnica.
- [2] El subíndice indica la longitud de onda de excitación del indicador fluorescente.
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
