Written by José | Last Updated on 2 meses
Objetivo
Obtener la concentración de vitamina C en un zumo de frutas utilizando dos métodos de titulación redox, con yodo (KIO3) y con I2.
Índice

Antecedentes
La vitamina C, también conocida como ácido ascórbico, es una vitamina soluble en agua que es esencial para la salud humana. Juega un papel crucial en muchos procesos biológicos, como la síntesis de colágeno, la curación de heridas y la función del sistema inmunológico. La concentración de vitamina C en un jugo de frutas se puede determinar utilizando una titulación redox con yodo (I2), o alternativamente con iodato de potasio (KIO3). Este procedimiento se puede utilizar para determinar la concentración de vitamina C en otras muestras de jugo de frutas y en tabletas de vitamina C. Se produce la siguiente reacción:
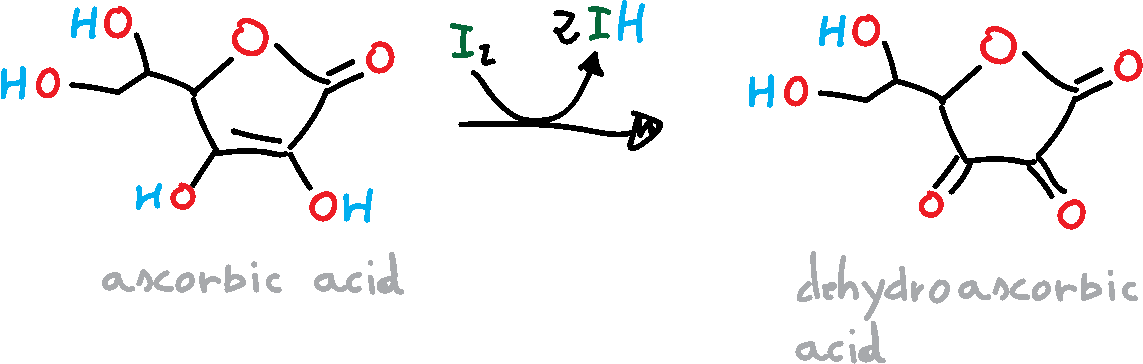 »
»
En la reacción anterior, el ácido ascórbico se oxida a ácido deshidroascórbico, e yodo se reduce a iones yoduro. Mientras haya ácido ascórbico presente, el yodo será reducido a iones yoduro, y tan pronto como no haya más ácido ascórbico, el yodo oxidará el almidón que se ha añadido como indicador. El almidón forma con el yodo un complejo azul-negro de almidón-yodo, indicando el punto final de la titulación.
El método que utiliza una solución estandarizada de yodo (I2) es más sencillo que el método alternativo que utiliza iodato de potasio (KIO3), sin embargo, debido a que el KIO3 es más estable como estándar primario que el I2, el método con KIO3 resulta más fiable.
Materiales y métodos
- 0.5 g de ácido ascórbico (estándar)
- 5 mL de solución de yoduro de potasio (KI)
- 5 mL de solución de yodato de potasio (KIO3)
- Solución de yodo (I2) estandarizada (0,01 M)
- Jugo de fruta (por ejemplo, naranja, toronja o limón)
- Matraz volumétrico de 100 o 200 mL
- Matraz cónico de 250 mL (Erlenmeyer)
- Pipeta de 10 o 20 mL
- Cilindros medidores de 10 y 100 mL
- Bureta y soporte
- Botella de cuentagotas
- Solución de almidón (indicador)
- Beaker
Procedimiento experimental utilizando I2
Preparar una solución estándar de ácido ascórbico disolviendo 0,5 g de ácido ascórbico en un matraz volumétrico de 100 mL con agua destilada. A continuación, preparar una muestra fresca de jugo de frutas mezclando frutas frescas con agua y colando la mezcla.
Pipetear 5 mL de jugo de frutas en un beaker. Llenar la bureta con la solución de yodo (I2) estandarizada. Luego, agregar unas gotas de solución de almidón al jugo de frutas en el beaker y, después de eso, agregar la solución de yodo estandarizada al beaker gota a gota, agitando continuamente.
Continuar la titulación hasta que la solución se vuelva azul-negra, indicando el punto final. Registrar el volumen de la solución de yodo estandarizada utilizada en la titulación. Repetir el procedimiento tres veces y calcular el volumen promedio de la solución de yodo estandarizada utilizada en la titulación.
Solución indicadora de almidón (0,5%): pesar 0,25 g de almidón soluble y agregarlo a 50 mL de agua casi hirviendo en un Erlenmeyer de 100 mL. Agitar para disolver y enfriar a temperatura ambiente antes de utilizar.
Solución de yodo (0.005 mol/L). Pese 2 g de yoduro de potasio (KI) en un vaso de precipitados de 100 mL. Pese 1.3 g de yodo (I2) y agréguelo al mismo vaso. Agregue algunos mL de agua destilada y agite durante unos minutos hasta que se disuelva el I2. La solución de yodo se transfiere a un matraz volumétrico de 1 L, asegurándose de enjuagar todas las gotas de solución en el matraz volumétrico usando agua destilada. Llene la solución hasta la marca de 1 L con agua destilada.
Análisis de datos
La concentración de ácido ascórbico en el jugo de frutas se puede calcular utilizando la siguiente ecuación:
C = (V * M) / (V0 * MW)
Donde:
- C = concentración de ácido ascórbico (mg/L)
- V = volumen de la solución estándar de yodo utilizada en la titulación (mL)
- M = molaridad de la solución estándar de yodo (mol/L)
- V0 = volumen de la muestra de jugo de fruta (mL)
- MW = peso molecular del ácido ascórbico (176.13 g/mol)
Procedimiento experimental utilizando KIO3
Primero, prepare una solución estándar de ácido ascórbico disolviendo 0.5 g de ácido ascórbico en un matraz volumétrico de 100 mL con agua destilada. Luego, prepare una muestra fresca de jugo de fruta mezclando frutas frescas con agua y colando la mezcla.
Pipetee 5 mL de jugo de fruta en un vaso, agregue 5 mL de solución de KI al vaso y agite (agitación magnética). Luego, agregue 5 mL de solución de KIO3 al vaso mientras continúa agitando.
Llene la bureta con la solución estándar de ácido ascórbico y agregue la solución estándar de ácido ascórbico al vaso gota a gota, agitando continuamente.
Continúa la titulación hasta que la solución se vuelva azul-negra, lo que indica el punto final. Además, agrega unas gotas de indicador de almidón a la solución y agita. Continúa la titulación hasta que la solución se vuelva azul-negra y la aparición de un complejo azul-negro indique el punto final. Finalmente, registra el volumen de la solución estándar de ácido ascórbico utilizado en la titulación. Repite el procedimiento tres veces (para obtener un valor promedio de la concentración) y calcula el volumen promedio de la solución estándar de ácido ascórbico utilizado en la titulación.
Solución de indicador de almidón (0.5%): pesa 0.25 g de almidón soluble y agrégalo a 50 mL de agua casi hirviendo en un matraz Erlenmeyer de 100 mL. Agita para disolver y enfría a temperatura ambiente antes de usar.
Propiedades físico-químicas
La siguiente tabla recoge los datos de peso molecular (Mw), punto de fusión (P.F.) punto de ebullición (P.E.) y densidad de los reactivos y compuestos utilizados en este experimento de laboratorio.
| Name | Mw (g/mol) | M.p. (ºC) | B.p. (ºC) | Density (g/ml) |
| Ácido ascórbico | 176.12 | 190-192 | 552.7 | 1.694 |
| Yodo I2 | 253.81 | 113 | 184 | 4.930 |
| Fécula de patata | - | - | - | 1.500 |
GHS pictogramas
Los pictogramas de peligro forman parte del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (GHS) y se recogen en la siguiente tabla para los compuestos químicos utilizados en este experimento.
| Name | GHS |
| Ácido ascórbico | No peligroso |
| Yodo I2 |   |
| Fécula de patata | No peligroso |
Identificador Químico Internacional
Los identificadores IUPAC InChI key de los principales compuestos utilizados en este experimento se proporcionan para facilitar la nomenclatura y formulación de los compuestos químicos y la búsqueda de información en Internet de los mismos.
| Ácido ascórbico | CIWBSHSKHKDKBQ-JLAZNSOCSA-N |
| Yodo I2 | PNDPGZBMCMUPRI-UHFFFAOYSA-N |
| Fécula de patata |
Referencias
- Isac-García, J.; Dobado, J. A.; Calvo-Flores, F. G.; and Martínez-García, H. (2015). Experimental Organic Chemistry Laboratory Manual. Elsevier Science & Technology. ISBN: 978-0-12-803893-2
Volver a la página de prácticas de Operaciones Básicas de Laboratorio.

