Índice
Introducción
La determinación estructural de una sustancia orgánica siempre comenzará con la compra, síntesis o aislamiento de «un producto puro» y se deberían considerar las siguientes aspectos:
Separación, aislamiento y purificación
Deberíamos, por tanto, comenzar (en el planteamiento más general) por recordar los métodos físicos de «separación, aislamiento y purificación» de los compuestos orgánicos:
- Cristalización.
- Destilación en sus distintas modalidades: simple, fraccionada, a vacío, con arrastre de vapor.
- Sublimación.
- Extracción.
- Cromatografía, también en sus diversas modalidades: de reparto, de absorción, de gases, de exclusión o de intercambio iónico.
- Electroforesis, etc..
Caracterización física
Una vez aislado (o purificado) el producto orgánico deberíamos caracterizarlo tanto por sus propiedades físicas como por métodos químicos, así en la caracterización física, deberíamos/podríamos determinar:
- Propiedades organolépticas: olor, color, sabor
- Punto de fusión (si el producto es sólido)
- Punto de congelación
- Punto de ebullición si es líquido
- Densidad
- Peso Molecular
- Índice de refracción
- Rotación óptica (si el producto es de origen natural), etc.
Caracterización química
En la caracterización química, podríamos considerar:
- Análisis elemental cualitativo y cuantitativo.
- Clasificación por solubilidad
- Determinación de acidez o basicidad.
- Identificación de grupos funcionales.
- Preparación de derivados.
Una vez realizada dicha caracterización químico-física deberíamos comparar los datos obtenidos con los que se recogen en la bibliografía (Tablas de datos o bibliografía especializada).
En principal problema de esta rutina de determinación es el tiempo necesario para su realización que normalmente es grande y es por ello que actualmente se realiza la determinación estructural mediante técnicas espectroscópicas, muchas de las cuales nos permiten incluso evitar el tedioso paso de la purificación y aislamiento del producto, siendo su principal limitación el elevado costo del instrumental y el mantenimiento del mismo, así como precisar de personal especializado en la interpretación de los datos obtenidos.
Considerando el desarrollo cronológico de las distintas técnicas espectroscópicas su primera función consistía en tratar de acortar el tiempo de la determinación estructural, posteriormente se convierten en base de datos para la caracterización de los productos orgánicos y finalmente se han convertido en el instrumento más rápido y preciso para la determinación estructural que posee el químico orgánico.
Desde este último punto de vista vamos a orientar este tutorial.
Conceptos básicos
A continuación, se repasa brevemente una serie de definiciones, conceptos y fórmulas que consideramos útiles a la hora de identificar un compuesto orgánico a partir de sus datos espectroscópicos (IR, MS, 13C-RMN y 1H-RMN).
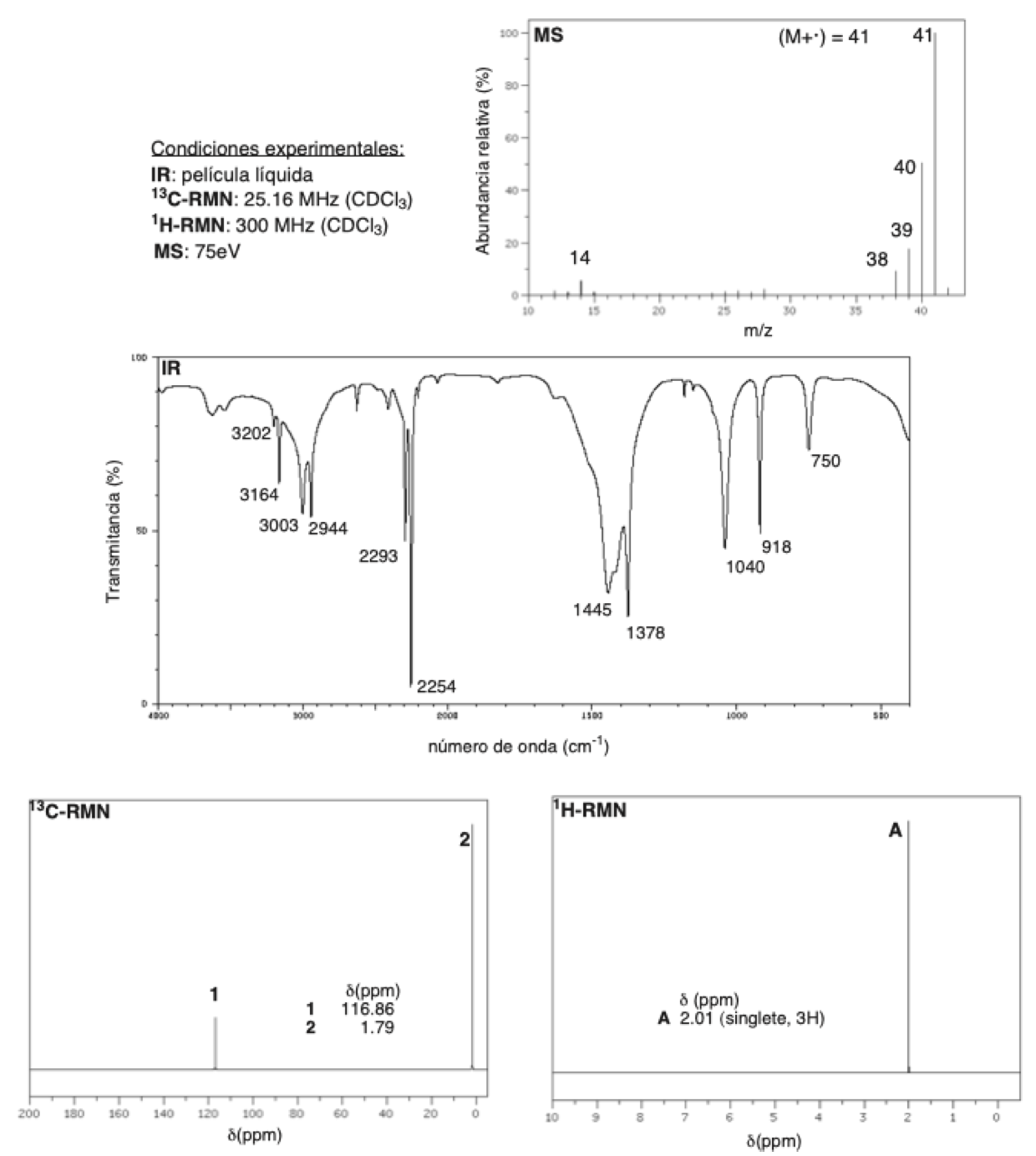
Por brevedad, se ha omitido intencionadamente la espectroscopía UV/vis porque consideramos que aporta muy poca información estructural comparada por ejemplo con RMN o IR.
Para profundizar más en cada una de las técnicas, instamos al lector a consultar algunos de los muchos libros o monografías que hay al respecto.
El espectro electromagnético
Toda radiación viene caracterizada por una longitud de onda (λ), una frecuencia (ν) o una energía (E), siendo la relación existente entre ellas:
E = h·ν = h·c/λ
La primera cuestión a plantearnos es que le ocurre a la materia cuando es sometida a una determinada radiación. Tal y como podemos imaginar, dicho efecto dependerá de la energía de dicha radiación. En la Tabla 1 se indican los efectos inmediatos sobre la materia, destacando de mayor a menor energía:
| Radiación | Efecto |
| Rayos-X y cósmicos | Ionizaciones de las moléculas |
| UV-Visible | Transiciones electrónicas entre los orbitales atómicos y moleculares |
| Infrarrojo (IR) | Deformación de los enlaces químicos |
| Microondas | Rotaciones de los enlaces químicos |
| Radiofrecuencias | Transiciones de espín electrónico o nuclear en los átomos de la molécula |
Cuando la radiación incide sobre una sustancia no toda ella se ve afectada por la misma. Por ejemplo, al átomo o conjunto de átomos que absorben radiación se le denomina cromóforo y en cada técnica espectroscópica será distinto dentro de una misma molécula. Auxocromos son un tipo de cromóforos que no absorben radiación, pero hacen que se modifique alguna de las características de la absorción.
Técnicas espectroscópicas
La segunda cuestión es como podemos utilizar dichos efectos sobre las sustancias para obtener información sobre la estructura de la materia y como utilizar dicha información.
De una manera muy esquemática se pueden indicar como características más importantes de los métodos espectroscópicos las siguientes:
| Técnica espectroscópica | Información obtenida |
| Rayos-X | Estructura total de la molécula incluida la estereoquímica de la misma a partir de las posiciones relativas de los átomos |
| UV/vis | Existencia de cromóforos y/o conjugación en la molécula a partir de las absorciones observadas |
| IR | Grupos funcionales a partir de las absorciones observadas |
| (MS)a | Formula molecular y subestructuras a partir de los iones observados |
| RMN | Grupos funcionales, subestructuras, conectividades, estereoquímica, etc., a partir de datos de desplazamiento químico, áreas de los picos y constantes de acoplamiento observadas |
| aEspectrometría de masas no es una técnica espectroscópica en el sentido que estamos viendo pues no existe irradiación electromagnética de la sustancia y no se produce absorción de dicha radiación. | |
La cuestión de que técnica utilizar o en que orden, sin son varias, para lograr la completa determinación estructural de una sustancia dependerá en gran medida de los objetivos perseguidos.
De una manera general podemos indicar como objetivos sucesivos los siguientes:
- Fórmula molecular.
- Identidad de los grupos funcionales.
- Conectividades de los carbonos.
- Posicionamiento de los substituyentes y/o los grupos funcionales sobre el esqueleto carbonado (obtención de subestructuras).
- Propiedades estereoquímicas incluyendo tanto los aspectos estáticos como dinámicos.
Objetivos de la determinación estructural
Expresado de otra manera, podemos indicar como objetivos de la determinación estructural la elucidación de la Estereoquímica de la molécula, entendiendo por tal la disposición espacial de los átomos que la forman, y que implica el conocimiento sucesivo de:
- Composición: átomos presentes y su proporción en la molécula, lo que se traduce en la obtención de una formula molecular.
- Constitución: Uniones existentes entre los átomos, lo que se traduce en la determinación de los grupos funcionales y subestructuras presentes en la misma.
- Configuración: disposición espacial de los átomos en la molécula. y
- Conformación: disposición espacial de la molécula que surge debido a la posibilidad de rotación o giro de los enlaces simples en la misma.
Antes de abordar el tema de la resolución de una determinación estructural concreta a partir de los datos espectroscópicos de la misma te recomendamos que pases a los apartados de las principales características de cada una de las técnicas espectroscópicas.
Número de insaturación
Espectroscopía IR
El espectro de IR se suele dividir en cuatro regiones para una mejor interpretación. Aunque ocurren algunas excepciones, como la deformación de enlace del N-H a 1550-1620 cm-1.
Región 4000-2500 cm-1
Ocurren las absorciones de enlaces sencillos unidos a H (C-H, O-H, N-H).
En esta región, aparecen las deformaciones de O-H libres 3600 cm-1 y para los enlaces de hidrógeno aparecen en el rango 3100-3200 cm-1.
Región 2500-2000 cm-1
Se dan las absorciones de enlaces triples (C≡C y C≡N) y dobles enlaces acumulados.
| Grupo | Absorción (cm-1) |
| -C≡C- | 2100-2300 |
| -C≡N | ≈ 2250 |
| -N=C=O | ≈ 2270 |
| -N=C=S | ≈ 2150 |
| >C=C=C< | ≈ 1950 |
Región 2000-1500 cm-1
Los enlaces dobles (C=C, C=O, C=N) generalmente absorben en esta región. Por ejemplo, el hexeno presenta un pico de absorción agudo debido a la vibración del C=C a 1640 cm-1.
Otros grupos que absorben en esta región son los C=N y los C=O. En el Apéndice se adjunta la Tabla-A7.1 de rangos de frecuencias característicos del carbonilo (C=O), con lo que se puede identificar al grupo funcional que pertenece, p.ej. éter, éster, ácido carboxílico, cetona, etc.
Región 1500-400 cm-1
Esta región se caracteriza por la absorción de otras deformaciones de enlaces (rotaciones, ángulos, etc.).
Las absorciones debidas a deformaciones como rotaciones, tijeras y de enlace dependen de la combinación de enlaces en la molécula. Esta parte del espectro es única y característica para cada compuesto y a menudo se la denomina la región de huella dactilar.
Raramente se usa para identificar grupos funcionales particulares, pero se pueden hacer algunas generalizaciones:
- El enlace C-O absorbe a 1300-1020 cm-1 aunque la absorción aquí no es exclusiva del enlace C-O.
- Por otro lado esta región de huella dactilar puede servir para identificar moléculas particulares, ya que ningún otro compuesto tendrá igual esta región (con el mismo patrón de absorción). Hay bases de datos de espectros que incluyen esta región.
Espectroscopía de RMN de 1H y 13C
Desplazamiento químico (δ)
Es el lugar del espectro donde aparece una determinada señal. Además, la simetría hace que algunos hidrógenos aparezcan al mismo desplazamiento químico. La frecuencia a la que aparecen (Hz) se divide por la frecuencia principal del instrumento (MHz) y se obtiene así una escala universal, la escala δ o ppm (partes por millón). Hay que tener en cuenta las siguientes consideraciones:
- Protones químicamente equivalentes presentan el mismo desplazamiento químico.
- Los carbonos unidos a grupos electronegativos están “desapantallados” y tienden a desplazar las señales de RMN de protones adyacentes a “campo más bajo” (valores altos de ppm).
- Los protones unidos a oxígeno o nitrógeno tienen desplazamientos químicos muy variables y además sensibles a la concentración, disolvente, temperatura, etc.
- Los sistemas π de alquenos, compuestos aromáticos y carbonilos desapantallan fuertemente a los protones enlazados desplazándolos a «campo bajo» (valores más altos de ppm).
- El cero del espectro se toma arbitrariamente como la señal singlete que da el tetrametilsilano (TMS; (CH3)4Si).
- Los compuestos orgánicos dan señales de RMN de protón en un rango de 0-10 ppm habitualmente y los carbonos en un rango de 0-220 ppm.
Integral
El área de cada señal responde al número de hidrógenos que son responsables de ella.
Desdoblamiento de señales en el 1H-RMN (multiplicidad)
Los hidrógenos próximos entre sí se influencian y provocan que las señales puedan ser complejas (dobletes, tripletes, cuartetes, quintetes, etc…, multipletes). Esta multiplicidad es debida al fenómeno conocido como “acoplamiento de espín” que se origina por la interacción del campo magnético del protón con los electrones del enlace. En esencia, cada protón presenta una de las dos posibles orientaciones de espín bajo el campo magnético aplicado. Por tanto, el campo magnético que “siente” un protón adyacente puede tener dos valores posibles. El resultado es que n protones desdoblarán a un proton adyacente en (n+1) picos. Las intensidades de esos picos son simplemente el resultado de las posibles orientaciones de espín, los protones de un CH2 pueden tener los posibles espines:
↑↑ (↑↓ ↓↑) ↓↓
1:2:1
Los espines centrales están degenerados, por lo tanto, un protón adyacente a un CH2 experimenta un desdoblamiento 1:2:1.
| Nº de H responsables del desdoblamiento | Multiplicidad (Intensidad relativa del multiplete) |
| 1 | doblete (2) 1:1 |
| 2 | triplete (3) 1:2:1 |
| 3 | cuartete (4) 1:3:3:1 |
| 4 | quintete (5) 1:4:6:4:1 |
| 5 | sextete (6) 1:5:10:10:5:1 |
| 6 | septete (7) 1:6:15:20:15:6:1 |
| … | … |
Espectrometría de masas
Resumiremos los aspectos clave de la EM para la determinación estructural en este apartado. La EM da el resultado de la ionización del compuesto orgánico, mostrando la estabilidad relativa de los iones formados en dicha ionización y la forma en que estos se fragmentan.
Los iones presentes con mayor intensidad corresponden siempre a los que son más estables desde el punto de vista fisicoquímico.
Por ejemplo, un catión bencílico o alílico es más estable que un carbocatión 3º > 2º >1º. Así, cuanto mayor deslocalización electrónica o más formas resonantes presente, la estructura más estable será el ión.
Regla del nitrógeno
Si un ión molecular (M+·) es impar, el compuesto contiene un número impar de nitrógenos.
Reagrupamiento McLafferty
Las olefinas y otros compuestos insaturados con un hidrógeno H en posición γ respecto al enlace etilénico, pueden quedar sometidas a un proceso que implica la rotura del enlace alílico y la transferencia del hidrógeno H en γ al doble enlace alílico, a través de un estado de transición cíclico de 6 miembros.
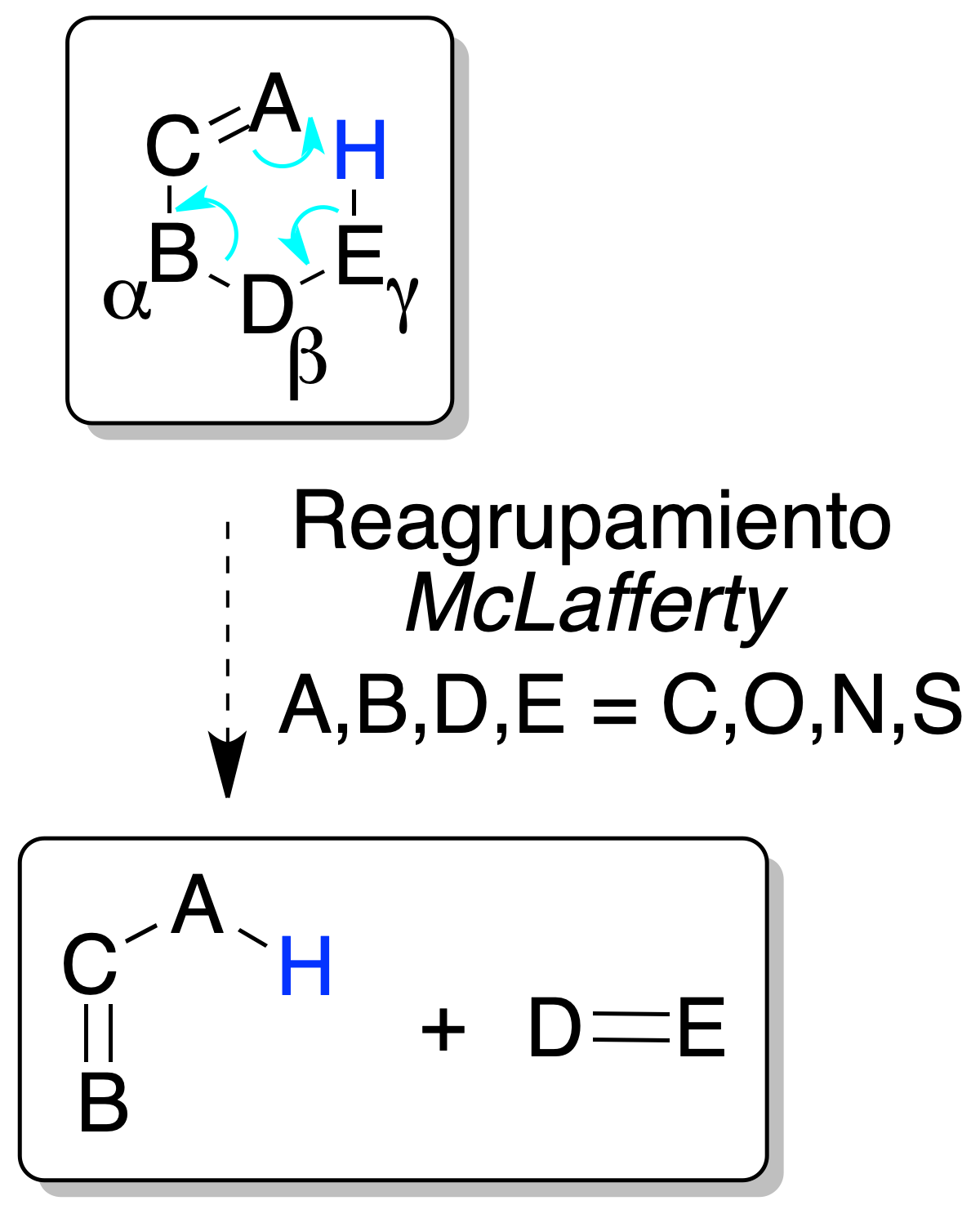
La carga del catión permanece dentro de uno u otro de los fragmentos: de los dos iones predomina el de la olefina más sustituida (más estable)
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
