Es el método más riguroso para determinar si una reacción pericíclica está permitida o no, y fue desarrollado por Woodward-Hoffmann.
En una reacción, si hay un elemento de simetría que se conserva a lo largo de toda la coordenada de reacción, se debe de poder correlacionar los orbitales de los reactivos con los orbitales de los productos, de manera que esta correlación se dará conservando la simetría del elemento que se conserva a lo largo de la coordenada de la reacción. Cuando esta correlación correlaciones orbitales enlazantes en los reactivos con orbitales enlazantes en los productos, la reacción estará permitida por simetría, pero cuando esa correlación establezca entre orbitales enlazantes y antienlazantes, entonces la reacción estará prohibida por simetría. Esto es así porque en los niveles enlazantes y antienlazantes hay una diferencia de energía muy grande, para poder pasar de un nivel enlazante a uno antienlazante hay que pasar una barrera de energía muy grande, y por tanto si se correlacionan dos orbitales que son ambos enlazantes, esa correlación se produce sin una barrera de energía, si la correlación se establece entre orbitales enlazantes y antienlazantes, tiene que producirse con una barrera de energía importante, por lo tanto los primeros estarán permitidos por simetría mientras que los segundos estarán prohibidos.
Para poder hacer los diagramas de correlación lo primero que hay que estudiar son los diagramas que intervienen en la reacción, tanto en los reactivos como en los productos, y una vez que hemos localizado los orbitales, hemos de buscar el elemento o los elementos de simetría que se conservan a lo largo de toda la coordenada de reacción. Una vez que tenemos estos elementos de simetría, se procede a clasificar los orbitales de los reactivos y productos con respecto a esos elementos de simetría. Entonces, los orbitales en los reactivos se tienen que transformar en los de los productos conservando la simetría.
Supongamos la reacción electrocíclica del butadieno a ciclobuteno. En esta reacción tenemos los orbitales que interacciónena en los reactivos que son los del sistema butadiénico que son los únicos que intervienen, en los productos tenemos el sistema p de 2 electrones y el sistema s también de dos electrones que se forman a lo largo de la reacción. Normalmente, para establecer los diagramas de correlación hay que representar los orbitales ordenados por energía. De los orbitales de los productos el de más baja energía será el s enlazante y el de más alta energía será el s* y el de más alta energía será el s* y en medio tendremos los dos orbitales p.

Ahora tenemos que considerar la reacción. Esta reacción se puede producir a través de un mecanismo electrocíclico con dos posibles alternativas, una conrotatoria y otra disrotatoria, y de lo que se trata es de predecir con que estereoquímica se dará esa reacción. Para lo cual hay que reconocer los elementos de simetría de manera que se conserven a lo largo de toda la coordenada de reacción. Para ello vamos a fijarnos en el sistema ciclobutánico. Para lo cual suponemos un substituyente a en disposición cis hacia arriba. Para analizar el elemento que se conserva, se parte de los reactivos y vemos como evoluciona la reacción. Supongamos una reacción electrocíclica conrotatoria en una etapa ligeramente posterior ambos habrán girado un poco en la misma dirección, de manera que al llegar al final uno de los substituyentes estará hacia dentro y otro hacia fuera. El único elemento de simetría que se conserva a lo largo de la reacción es un eje C2. Puesto que el plano de simetría deja de conservarse en el momento que comienza la reacción.
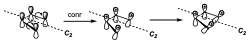
Una de las consideraciones a tener en cuenta es que los orbitales que interaccionan a lo largo de la coordenada de reacción se reducen a la máxima simetría, es decir si hay substituyentes se eliminan.
Una vez que tenemos localizado el elemento de simetría que se conserva a lo largo de la reacción, se clasifican los distintos orbitales en S (simétrico) o A (antisimétrico). El primero es antisimétrico, puesto que si giramos 180º los signos + quedan hacia abajo. Ahora, se ve cuales de los distintos niveles están ocupados y cuales no. Cuando estudiamos la energía que resulta de estos OM, los últimos orbitales enlazantes tienen energías muy parecidas y todas negativas, mientras que el primer orbital antienlazante tiene una energía muy diferente, al del último enlazante y además positiva (aunque no se represente en el dibujo).
Ahora hay que realizar la correlación entre orbitales, un determinado orbital al ir evolucionando tiene que correlacionarse en los productos con un orbital de la misma simetría. De manera que vemos que los dos niveles enlazantes correlacionan a lo largo de la coordenada de reacción con los dos antienlazantes. Por tanto esta correlación que se establece a lo largo de la coordenada de reacción se produce sin una barrera energética importante y por tanto la reacción estará permitida por simetría.

Supongamos ahora la reacción disrotatoria. En este caso el elemento de simetría que se conserva es el plano.
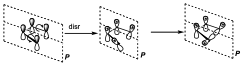
Ahora la correlación se puede establecer tal y como se indica arriba. Ahora el diagrama de correlación es distinto. Vemos que el segundo orbital enlazante en los reactivos correlaciona con el primer orbital antienlazante en los productos, por lo tanto a lo largo de la coordenada de reacción situaría dos electrones en un nivel antienlazante, y para poder hacer eso tiene que sobrepasar una barrera energética importante, por tanto la reacción estará prohibida por simetría.
Entonces vamos a hacer algunas consideraciones para poder hacer diagramas de correlación.
- Lo primero que haremos es localizar los orbitales que intervienen en la reacción, en los reactivos y productos. Después hay que considerar los elementos de simetría del sistema que se conservan a lo largo de la coordenada de reacción. Estos elementos de simetría se tienen que buscar de tal manera que bisecten los enlaces que se forman o se rompen a lo largo de la coordenada de reacción (es la norma general para localizar estos elementos de simetría).
- Una vez localizados estos elementos de simetría se clasifican los orbitales de los reactivos y productos con respecto a esos elementos de simetría.
- Después se correlacionan los orbitales de los productos y reactivos de manera que conserven la simetría a lo largo de la coordenada de reacción. De manera que a la hora de trazar las líneas de correlación hay que considerar que líneas de correlación que unan orbitales de la misma simetría no pueden cruzarse.
- Los orbitales que intervienen se tienen que reducir a su máxima simetría, si hay substituyentes que no intervienen en la reacción se eliminan para considerar la simetría de los orbitales interaccionantes.
- Cuando la correlación es entre orbitales del mismo tipo, es decir, orbitales enlazantes en los reactivos que correlacionan con orbitales enlazantes en los productos, etc. la reacción transcurre sin una barrera de energía y por tanto estará permitida. Cuando esto no se cumpla, la reacción estará prohibida por simetría. En el estado fundamental una reacción estará permitida por simetría sólo cuando todos los pares de electrones en orbitales enlazantes en los reactivos son transferidos mediante una correlación a orbitales enlazantes en los productos sin una barrera de energía.
Con respecto al punto 3 supongamos que intentamos realizar una correlación de este tipo:

Esta correlación no se da, porque la línea que une dos orbitales simétricos con la otra que uno otros dos simétricos se cruzan. Esta es un representación al fin y al cabo de la coordenada de reacción donde se ve como se correlacionan esos orbitales. Conforme avanza la reacción esos orbitales de los reactivos que son simétricos se acercan en energía de manera que llega un momento que tienen energías muy parecidas, y son dos orbitales que tienen la misma simetría y uno es ocupado y otro desocupado, entonces al acercarse en energía podrían interaccionar entre si de manera que producen dos orbitales con diferentes energías de nuevo, y así sucesivamente, luego el proceso no puede llevarse a cabo por esa interacción entre orbitales de la misma molécula.
Como hemos visto en el estado excitado las cosas cambian, de manera que lo que está prohibido en el estado fundamental, ahora estará permitido. Vamos a ver como los diagramas de correlación explican perfectamente este hecho.
Si volvemos a poner el diagrama de correlación en el estado fundamental para el caso disrotatorio, vemos que existe una doble barrera de energía de manera que la reacción no puede ir bien ni en el sentido directo ni en el inverso.

Si ahora ponemos el mismo esquema con la misma simetría donde uno de los electrones ha pasado a un nivel excitado, o sea, estamos representando el primer estado excitado.

Hay que considerar que los estados tripletes no van a dar lugar a reacciones pericíclicas puesto que son birradicales y por tanto actuaran mediante reacciones radicalarias. Ahora la correlación se establece lo mismo que antes, pero de manera que el primer estado excitado de los reactivos se correlaciona con el primer estado excitado de los productos y por tanto si hay un aumento de energía para llevar el electrón a un nivel de más energía, en el otro paso se produce una liberación de la misma cantidad de energía. Y por tanto esta reacción pasa de estar prohibida a estar permitida, es decir la reacción electrocíclica con cuatro electrones disrotatoria está permitida en el estado excitado.
Vamos a ver ahora ejemplos de reacciones de cicloadición. El ejemplo más sencillo de reacciones de cicloadición p2s+p2s para dar lugar al ciclobutano. En la topología supra–supra las dos moléculas de etileno se acercan de forma paralela para que se establezca la interacción entre los orbitales, de manera que en esa reacción hay dos elementos de simetría que se conservan a lo largo de toda la reacción. Tenemos el plano que está en el punto medio de las dos moléculas de etileno. Y el otro es el plano perpendicular a ese.
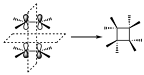
Una vez que tenemos los elementos, veamos los orbitales que intervienen en la reacción, tanto en los reactivos con en los productos. Por una parte tenemos los dos sistemas p de dos electrones y por otra parte los dos orbitales s de dos electrones del sistema ciclobutano. El orbital p1 y p2 con respecto al plano P1 y con respecto al P2 puede que no tengan la simetría correcta. Si nos fijamos son simétricos para P2 pero con respecto a P1 el orbital p1 se transforma en p2(antisimétrico). Igualmente ocurrirá con los orbitales s que se han formado, tendrán simetría correcta con respecto a P1pero no con respecto a P2, donde uno se transforma en el otro, por tanto habrá que hacer una combinación lineal de ambos para que vuelvan a tener la correcta simetría.
Entonces, con respecto a p1 tenemos el orbital enlazante y el antienlazante, con respecto a p2 volvemos a tener el orbital enlazante y el antienlazante. Por tanto, tenemos que generar orbitales de simetría correcta a partir de los que no la tienen, se producirá interacciones entre los orbitales que tengan energías parecidas, por una parte tendremos la interacción del enlazante con el enlazante y por otro lado la del antienlazante con el antienlazante. Como son orbitales de la misma simetría van a generarse dos nuevos orbitales, el proceso no rebaja energía puesto que los orbitales que se obtienen se hacen a partir de orbitales ocupados, pero esto nos genera orbitales que tienen simetría correcta. De manera que el orbital ys = p1e + p 2e será la contribución enlazante de ambos.
yd = p1e – p 2e . Lo mismo podemos decir con respecto a los antienlazantes: ys* = p1a* + p2a*; yd* = p1a* – p2a*

Nos interesa saber que forma van a tener esos orbitales para después poder clasificarlos con respecto a los elementos de simetría. ys será la contribución enlazante de ambos orbitales p1 y p2
Es un orbital de tipo enlazante puesto que sitúa densidad neta entre los nuevos enlaces que se están estableciendo y también sitúa densidad neta entre los átomos de carbono que estaban unidos anteriormente.
Con respecto a yd
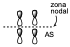
Será una contribución antienlazante del orbital enlazante de p1 con el orbital enlazante de p2 ya que en la zona de formación de los nuevos enlaces hay un nodo, pero es un orbital enlazante puesto que en la zona donde están los dos átomos de carbono sitúa una densidad electrónica neta y por tanto es un orbital enlazante aunque sea una contribución antienlazante al nuevo enlace.
Ambos orbitales están ocupados.
Con respecto a ys
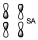
Es una contribución enlazante de ambos pero ambos son antienlazantes, por tanto en su conjunto el orbital será antienlazante. Hay que considerar que esos dos osrbitales se están acercando, pero están lejanos, y en la zona media hay una contribución nula al enlace, por tanto es un orbital antienlazante. Pero es la contribución enlazante de dos orbitales antienlazantes. Esto implica un orbital que está favorecido en energía con respecto a los anteriores pero no deja de ser un orbital antienlazante.
Por último tenemos yd*
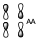
Que será una contribución antienlazane de dos orbitales antienlazantes.
Esos dos niveles están desocupados.
Después tenemos que hacer las mismas consideraciones con respecto a los orbitales s que se forman, de manera que la combinación de estos orbitales darán lugar a 4 nuevos orbitales de simetría correcta (ss, sd, ss*, sd*) que tendrán la siguiente forma:
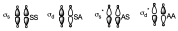
Lo hemos puesto de la misma forma pero obviamente la forma de los orbitales antienlazantes es distinta a la de los enlazantes.
Una vez que tenemos los orbitales y en los productos con simetría correcta, hay que clasificarlos con respecto a los elementos de simetría P1 y P2, de tal manera que el primer símbolo es con respecto a P1 y el segundo con respecto a P2. De esta forma tendremos:

Por tanto la correlación hay que hacerla como ahí se indica, donde vemos que los orbitales yd en los reactivos se correlaciona con el orbital ss* en los productos, de tal manera que dos electrones de niveles enlazantes, lo cual quiere decir que esa reacción debe de tener una barrera energética impuesta por la simetría muy importante y la reacción estará prohibida.
Vamos a ver ahora la reacción de Diels-Alder.
Es una reacción p2s+p4s, en este caso sólo existe un elemento de simetría que se conserva a lo largo de la reacción, que es el P1 que es un plano vertical perpendicular al plano del papel.
Con respecto a este plano, ambos componentes de los reactivos, el orbital p de dos electrones y el p de 4 electrones tienen simetría correcta. Los orbitales de los reactivos y de los productos serán:

Todos estos orbitales tienen simetría correcta, con respecto a ese plano cualquier punto de un orbital se transforma en otro del mismo orbital, puede o no cambiar de signo y en consecuencia ser simétrico o antisimétrico.
En los productos tenemos dos enlaces s formados por interacción de orbitales p de los reactivos, y vemos que los orbitales de esos enlaces por si solos no tienen simetría correcta con respecto al plano por lo tanto deben de interaccionar para dar 4 orbitales de simetría correcta, puesto que los dos son equivalentes uno se transforma en el otro. Por la interacción de los dos orbitales enlazantes de se tienen que formar dos orbitales s enlazantes, uno con una contribución enlazante y otro con una contribución antienlazante. Por otro lado por la interacción de los dos orbitales antienlazantes, se tienen que formar dos orbitales s antienlazantes uno con una contribución enlazante y otro con una contribución antienlazante.
En principio podemos pensar que la correlación es muy sencilla y de la forma en que los tres niveles enlazantes se transforman en niveles enlazantes en los productos
Esto puede ser así y la reacción estará permitida por simetría, lo que ocurre es que la correlación de orbitales no es la que hemos puesto ahí, puesto que el orbital de más baja energía de los reactivos no se transforma en el s de más baja energía de los productos, sino que ese orbital en realidad debe de transformarse por interacción con el sistema p en el tercero, debido a que al interaccionar con el sistema p de dos electrones esos dos extremos se anulan y lo único que quedaría sería el orbital p de dos electrones de en medio. Y del tercero de los reactivos con el primero de los productos puesto que ese orbital p al interaccionar con el orbital p de 4 electrones debe de formar los dos orbitales s. Esa debería ser la correlación y no la anterior, lo que ocurre es que se produce un cruce entre líneas de la misma simetría, eso es imposible y entonces lo que hay es un intento de correlación de este tipo

Es decir el tercero intenta correlacionar con el primero de los productos, pero como se produce la interacción con la otra línea de correlación, termina correlacionando con el tercero. Esto explica la pequeña barrera energética que existe en las reacciones de Diels-Alder. Tanto de una forma como de la otra la correlación se establece entre niveles enlazantes de los reactivos y niveles enlazantes en los productos y por tanto la reacción estará permitida por simetría.
Con respecto a las correlaciones en cicloadiciones antarafacial, p2s+ p2a, se tenía que producir una interacción como se representa en el diagrama:

El elemento de simetría que se conserva es el eje C2, que bisecta a ambos sistemas, de manera que ahora los orbitales que intervienen en los reactivos y en los productos, son los dos orbitales p en los reactivos, dos enlazantes y dos antienlazantes, ambos tienen simetría correcta con respecto al eje C2. Con respecto a os productos tenemos los dos orbitales s que se forman que no tienen simetría correcta con respecto al eje C2 puesto que uno se transforma en el otro pero no en si mismos, pero se puede establecer la interacción entre ambos puesto que son equivalentes para dar 4 orbitales de simetría correcta.

Con respecto al elemento de simetría, esos 4 orbitales s ya si son simétricos. De manera que se puede establecer la interacción como tenemos ahí representado, y entonces vemos como una interacción supra–antara de 4 electrones que implica un anillo anti-Hückel, está permitida por simetría puesto que se correlacionan los dos niveles enlazantes en los reactivos con los dos enlazantes en los productos e igual para los antienlazantes.
Después de haber visto los diagramas de correlación y los de interacción para tratar de describir cuando una reacción pericíclica se dará o no y sobre todo que estereoquímica tendrá cuando se de. Si nos fijamos en los diagramas de interacción los construíamos a partir de los orbitales que después utilizábamos en los diagramas de correlación y lo que hacíamos cuando construíamos los diagramas de interacción era tomar esos orbitales y ver la topología de la reacción para tratar de predecir si esos diagramas de interacción eran aromático o antiaromáticos, viendo sobre todo en la topología de la reacción si se producía una topología supra o antara que era lo que fundamentalmente provocaba los anillos de tipo Hückel o anti-Hückel y por tanto el carácter aromático o antiaromático.
Todo esto llevó a Woodward y Hoffmann a pensar que de los diagramas de interacción se podía extraer información valiosa, ya que se construían a partir de los orbitales que después se utilizaban en los diagramas de correlación, y entonces posiblemente se podría extraer información con respecto a esos diagramas de interacción, pero considerando en lugar de los orbitales que itervienen en la reacción como tal, considerar componentes del diagrama de interacción.
Supongamos por ejemplo una reacción electrocíclica, al construir el diagrama de interacción consideramos el orbital p y s de tal forma que considerábamos el diagrama de interacción considerando la interacción que había dentro de cada orbital antes de que se produzca la interacción y después de que se produce entre los orbitales que intervienen, de manera que decíamos que era suprafacial cuando intervenían esos orbitales por extremos con el mismo signo, mientras que era antarafacial cuando lo hacían con orbitales de distinto signo. La apertura disrotatoria provocaba una interacción supra–supra.
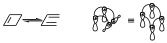
De manera que ese es el diagrama de interacción. La apertura conrotatoria implica que uno de los componentes actúe de una forma suprafacial lo que provoca un diagrama de interacción con una topología diferente.
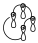
Da igual el diagrama de interacción que tengamos, puesto que podemos dividir en componentes, de manera que un componente de un diagrama de interacción se define como partes del diagrama de interacción que conectan lóbulos del mismo signo y además tienen un número de electrones par, que pueden ser los orbitales que intervienen en la reacción o pueden ser parte de esos orbitales. Además si nos fijamos en el diagrama de interacción para la reacción de apertura o cierre electrocíclica de un sistema con 6 electrones, para la apertura disrotatoria sería:
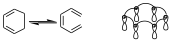
Si ponemos los signos es un diagrama en el que todos los lóbulos del mismo signo están unidos, y vemos que sobre ese diagrama podemos definir distintos componentes, de manera que podremos tener un componente de dos y otro de cuatro, pero también podremos tener 3 componentes de 2. Ese es un anillo Hückel con 6 electrones, y por tanto aromático, y está permitido.
Si estudiamos de esta manera muchas reacciones construyendo sus diagramas de interacción y los dividimos en componentes y tenemos en cuenta si actúan supra o antarafacialmente y el número de electrones, se pueden sacar conclusiones que son las que sacarán Woodward y Hoffmann para establecer lo que ellos denominaron las reglas generalizadas, que son unas reglas empíricas que nos permiten decir cuando una reacción pericíclica está permitida o no de una forma rápida. Estas reglas son:
Una reacción pericíclica es térmicamente permitida si el número total de componentes 4n+2 electrones que actúen suprafacialmente más el número de componentes con 4n electrones que actúe antarafacialmente es impar.
Esta regla se puede simplificar más, puesto que todos los componentes se pueden reducir a componentes de dos electrones, entonces la regla se puede cambiar por la que dice: una reacción estará térmicamente permitida cuando el número de componentes con dos electrones que actúe de manera suprafacial es impar.
En el caso anterior por ejemplo tenemos 3 componentes de dos electrones y todos suprafacialmente, por lo tanto la reacción está permitida. Sin embargo la primera que es un diagrama de interacción con dos componentes suprafacial la reacción estará prohibida. Si uno de los componentes actúa antarafacialmente entonces nos queda un único componente suprafacial y la reacción para a estar permitida.D
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
