Written by J.A. Dobado | Last Updated on 1 año
Ir a la página con el listado de problemas.
Enolatos – soluciones a los problemas
Solución 1:
Los dos primeros ejercicios corresponden a una condensación aldólica y de Claisen, respectivamente, dando lugar al mismo compuesto. En caso de que la temperatura fuese alta o que hubiese trazas de ácido, se produciría la eliminación de una molécula de agua y formación de un doble enlace conjugado con el grupo carbonilo. En el último ejercicio de este problema se produce una ciclación intramolecular, especialmente favorecida por la formación de una anillo de cinco miembros.
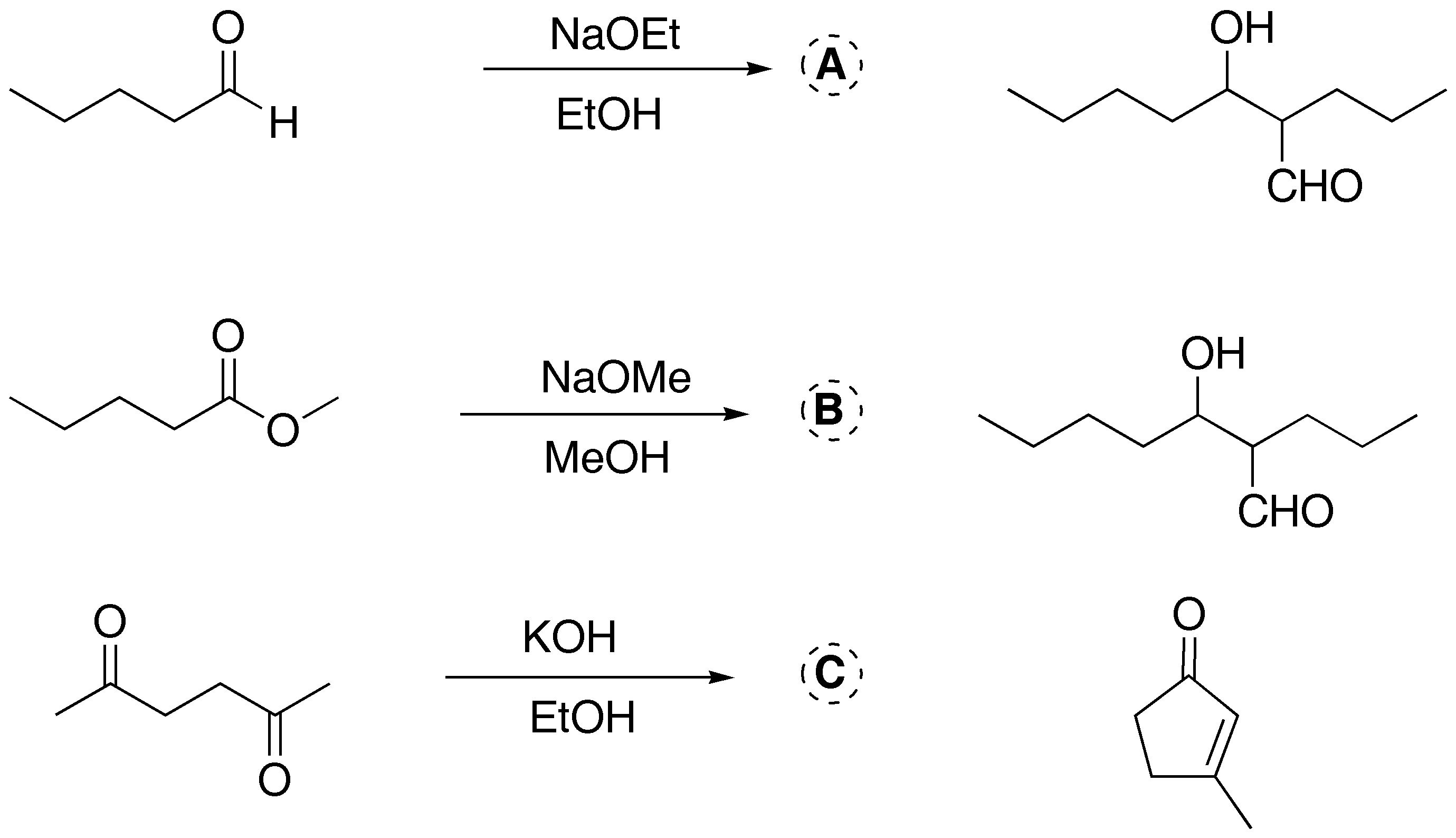
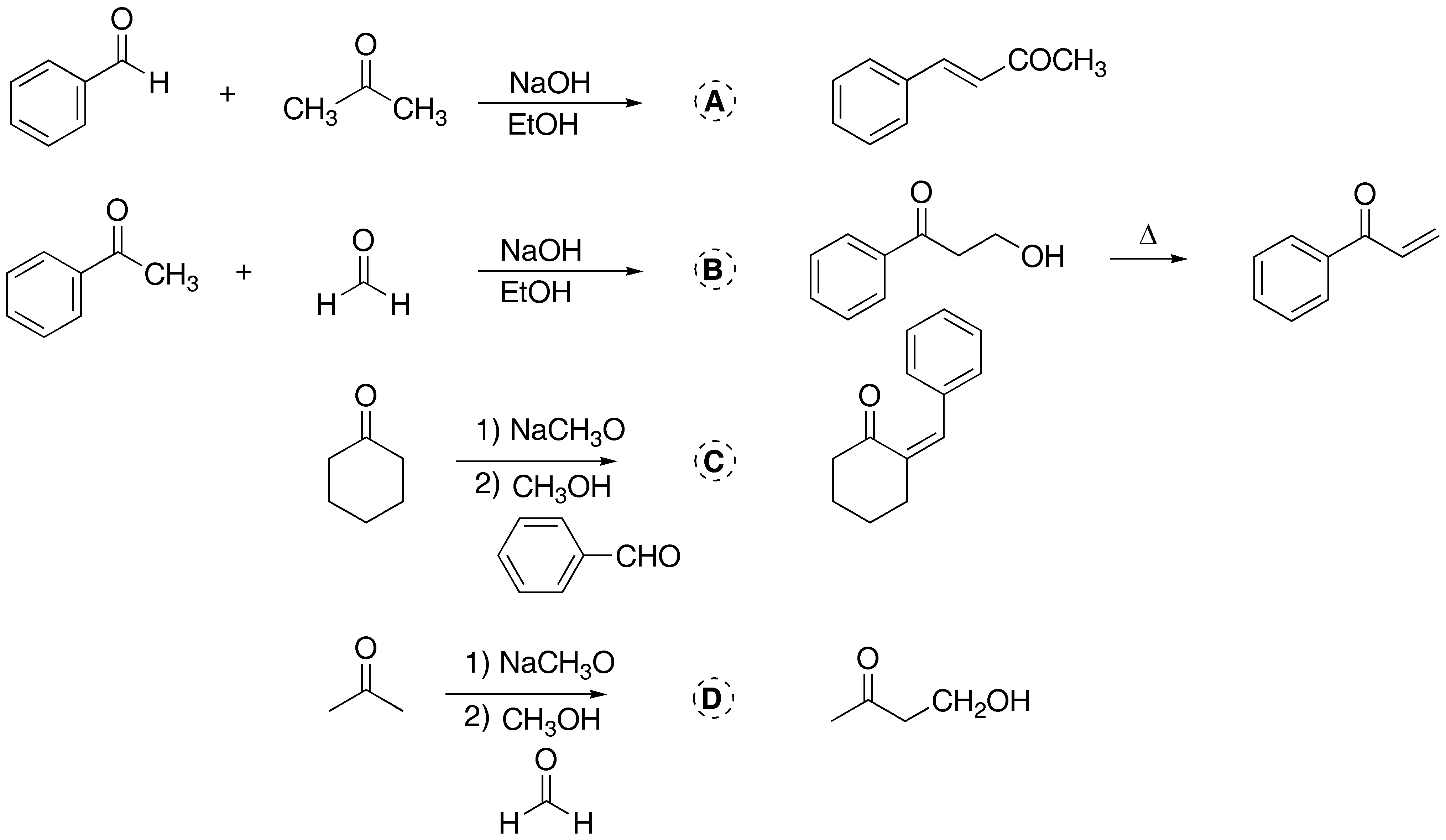
Solución 2:
a) El tratamiento de la ciclopentanona con metóxido sódico genera un carbanión que reacciona con acetato de etilo. Debido a que las dos posiciones adyacentes al grupo carbonilo son equivalentes, se obtiene un único producto.
b) Es una típica condensación de Claisen, que daría un compuesto dicarbonílico. El tratamiento con LiAlH4 conduce a la formación de un diol. Es necesario añadir un ácido para destruir los alcóxidos que se forman en el curso de la reacción, debido a la basicidad tan pronunciada del hidruro.
c) La ciclopentanona tratada con un exceso de base puede dar un carbanión a ambos lados del grupo carbonilo. Por reacción con dos moles de benzaldehído se obtiene el producto final de la reacción.
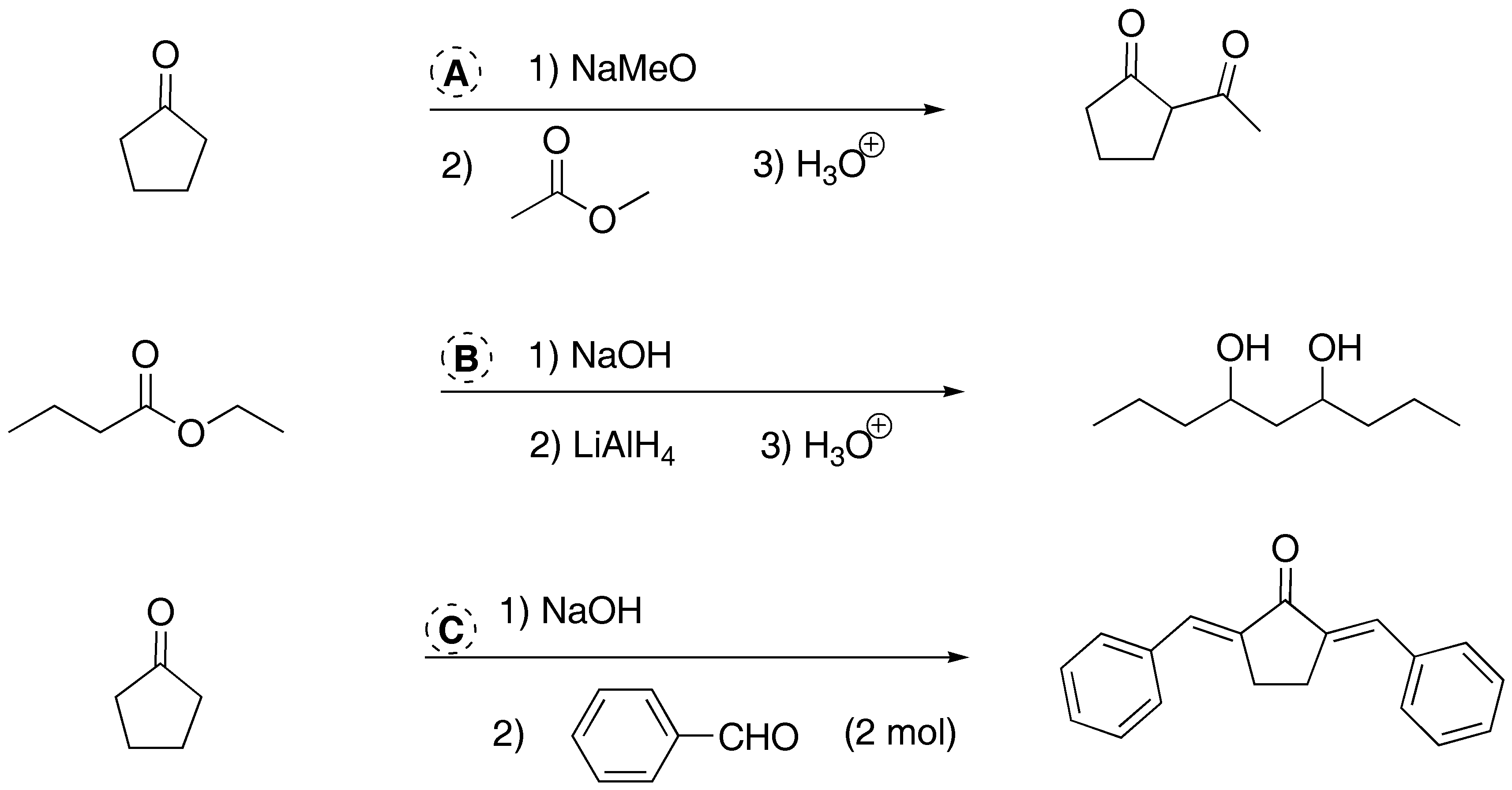
Solución 3:
a) El tratamiento con una base del diéster conduce a la formación de un compuesto cíclico. Se trata de una condensación de Dieckmann (Claisen intramolecular).
b) La ciclohexanona forma un carbanión que reacciona con el α-haloéster. El alcóxido intermedio desplaza al cloro mediante un proceso de SNi para dar el α,β-epoxi éster.
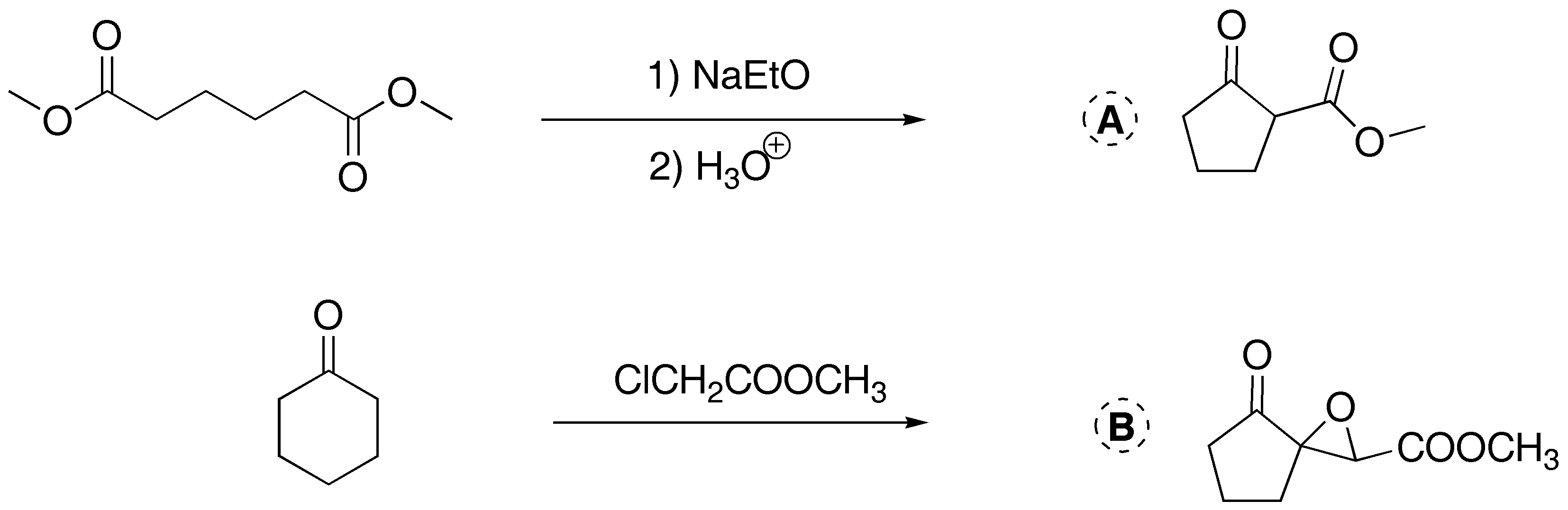
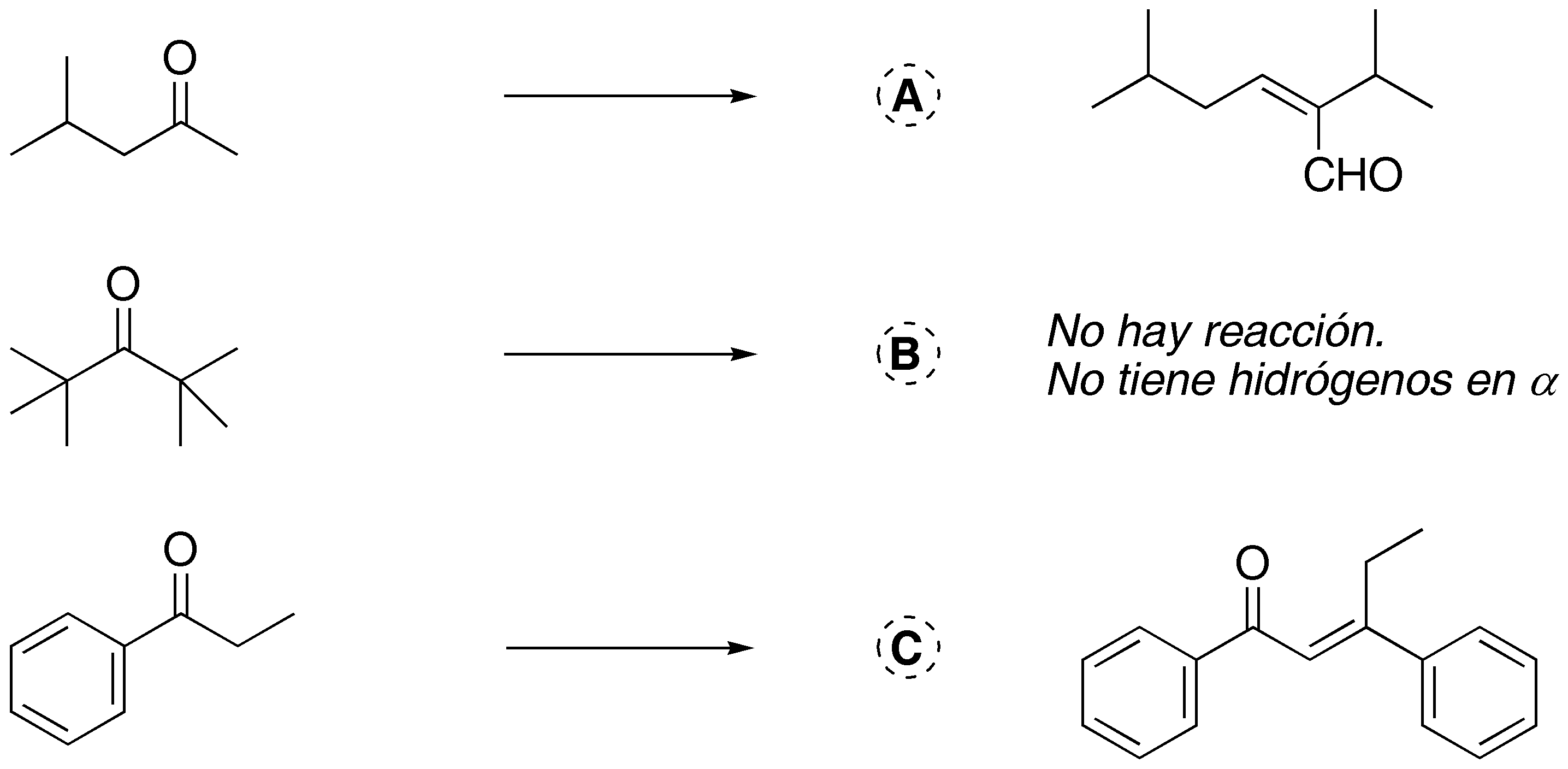
Solución 4:
Las reacciones A y C son condensaciones de tipo aldólico. Para que se den es necesario el uso de una base tal como potasa alcohólica, una mezcla de hidróxido potásico y etanol, o etóxido o metóxido sódico. En el caso de B no hay reacción de condensación ya que no presenta hidrógenos en α con respecto al grupo carbonilo.
Solución 5:
Solución 6:
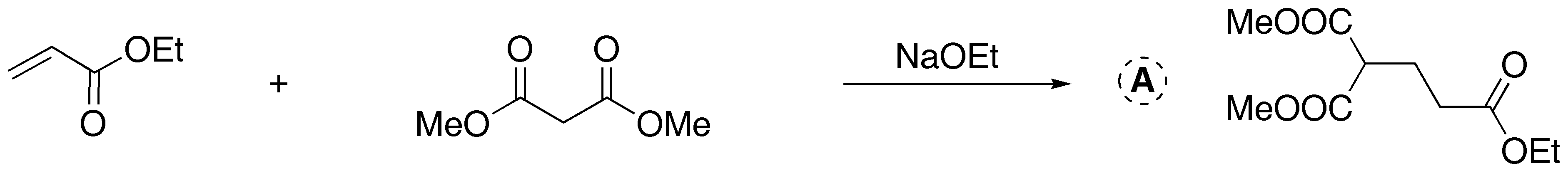
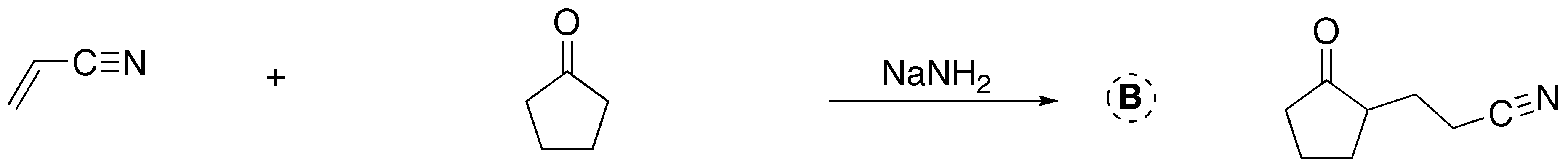
![]()
Solución 7:
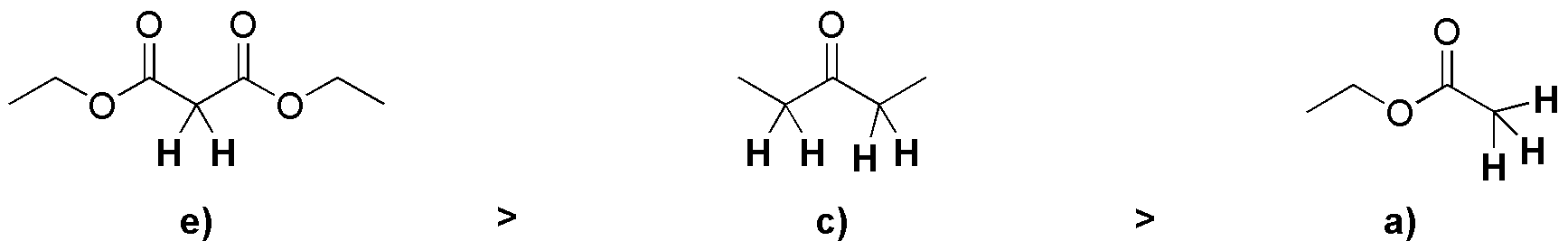
Primero descartamos los compuesto sin hidrógenos-α, estos son b) y d). Después, ordenamos los restantes compuestos en orden decreciente de acidez, resultando que en primer lugar está el éster dicarbonílico, seguido de la cetona, y por último el éster. Los dos primeros e) y c) al ser más ácidos forman enolatos bien con una base como HO–. Sin embargo los ésteres como a) al ser mucho menos ácidos, se debe emplear bases de tipo alcóxido (EtO–) parar formar el correspondiente enolato.
Solución 8:
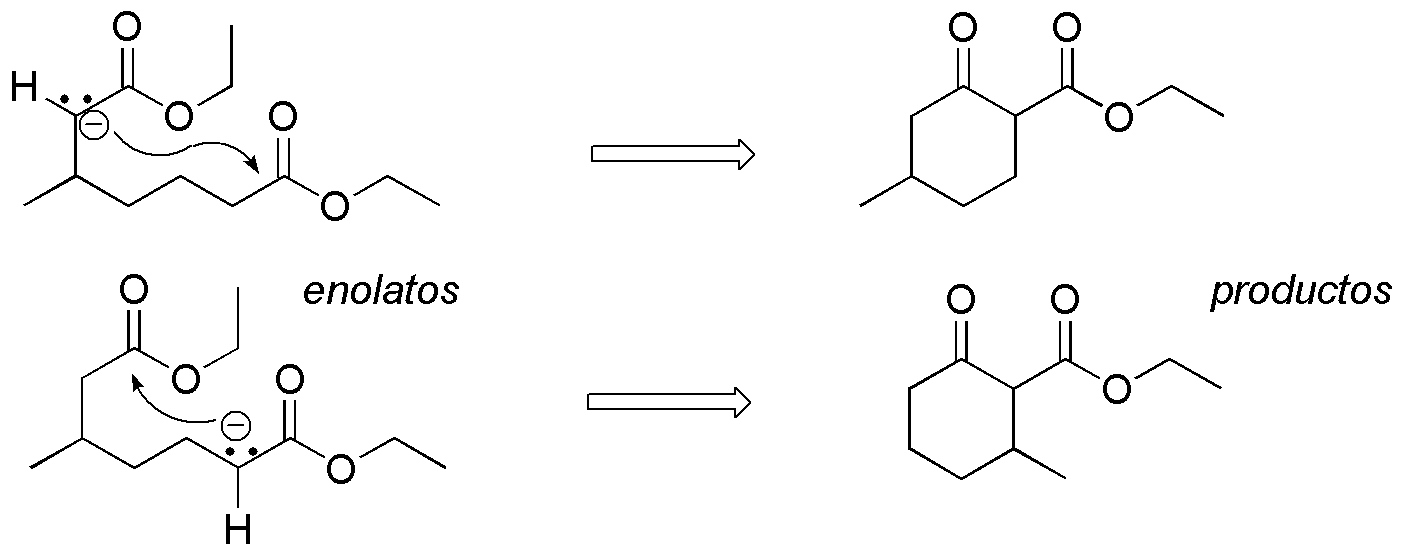
Dado que el compuesto dicarboxílico de partida no es simétrico, existe la posibilidad de que se formen dos enolatos diferentes. Por tanto, el resultado de la reacción será una mezcla de dos productos de ciclación que provienen del ataque del carbono con carga negativa sobre el carboxilo del otro extremo de la cadena, generándose en ambos casos un anillo de seis miembros con el sustituyente del metilo en distinta posición.
Solución 9:
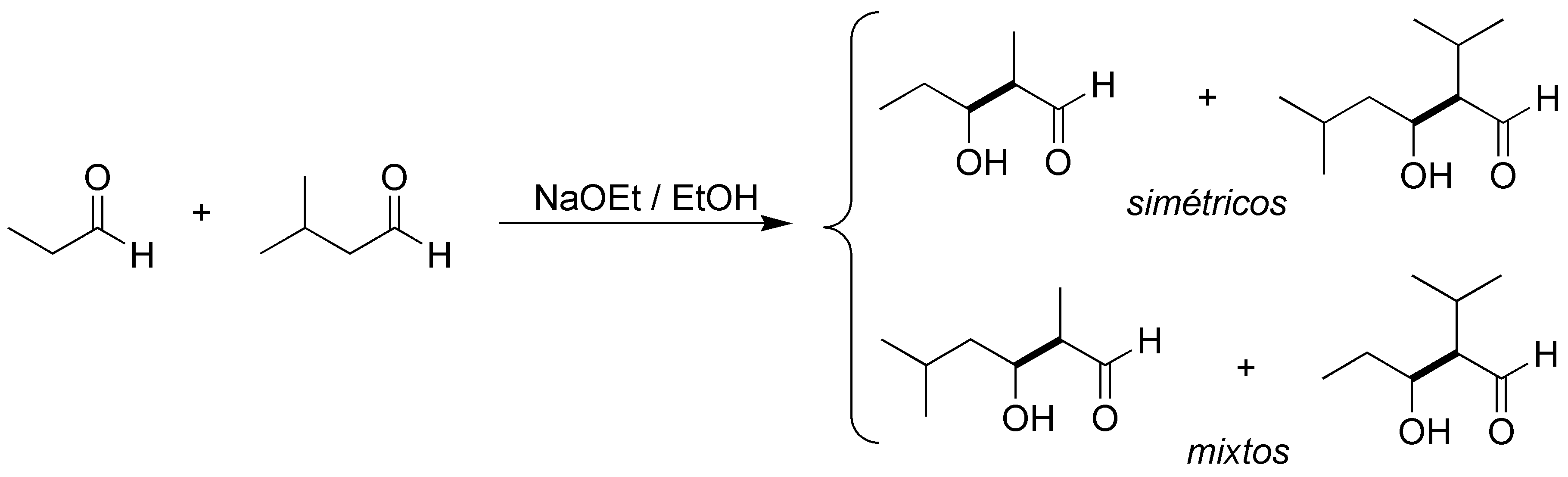
En medio básico, se forman dos iones enolatos que reaccionan respectivamente con los dos aldehídos de partida. Se ha resaltado en trazo grueso los enlaces C-C que se forman al reaccionar los aldehídos.
Solución 10:
A diferencia del problema anterior, en las tres reacciones sólo hay un aldehído con hidrógenos-α. Tanto el formaldehído en a), el pivalaldehído en b), y el benzaldehído en c) no presentan hidrógenos-α, por lo que no son enolizables. Por tanto, se forman dos aldoles, uno como resultado de la condensación entre los dos aldehídos diferentes de partida y el otro de la condensación del aldehído enolizable con otro aldehído igual de partida. En el caso c), como el grupo fenilo retira electrones al carbonilo, lo convierte en un carbonilo más reactivo obteniéndose mayoritariamente el producto de condensación de los dos reactivos.
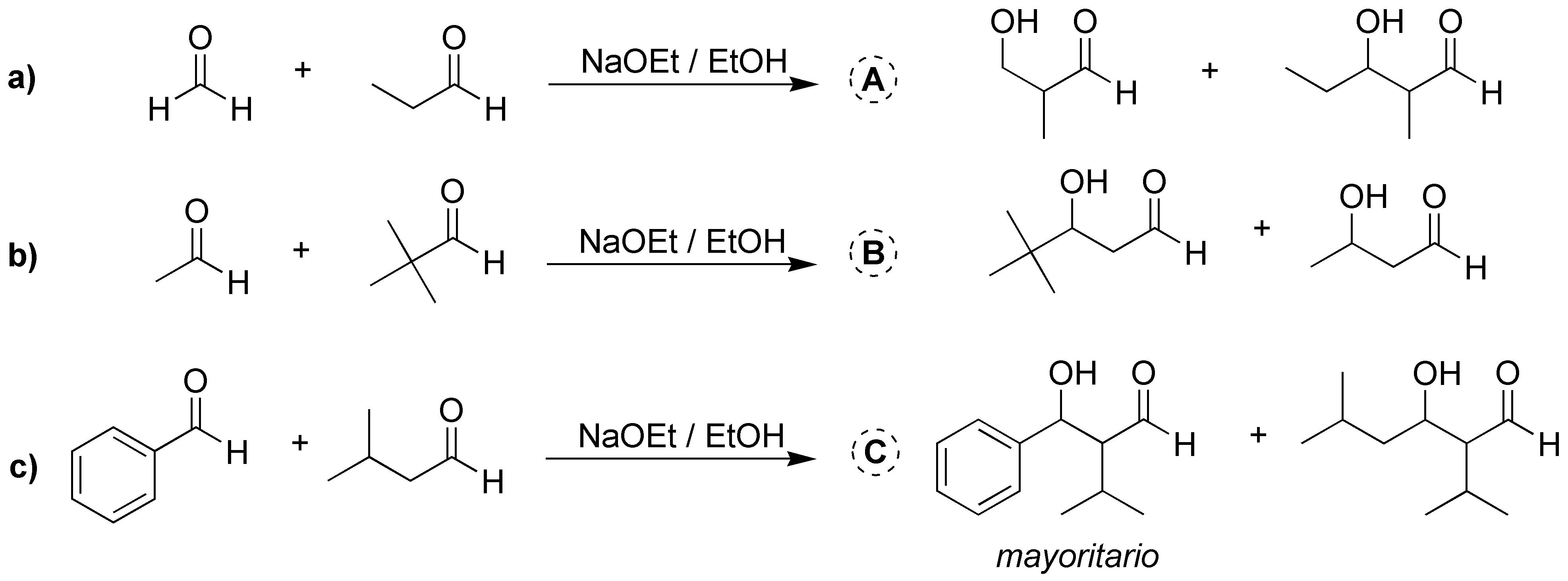
Solución 11:
En esta condensación aldólica cruzada se obtiene un sólo producto mayoritariamente. Esto es debido a que el acetoacetato de etilo es un compuesto 1,3-dicarbonílico con los hidrógenos situados entre los dos grupos carbonilos del carbono-α más ácidos que los de la ciclohexanona. Por tanto, se convierte en el enolato mucho más fácilmente que la ciclohexanona que sólo tiene un carbono carbonílico, dando el producto que se indica en la figura.
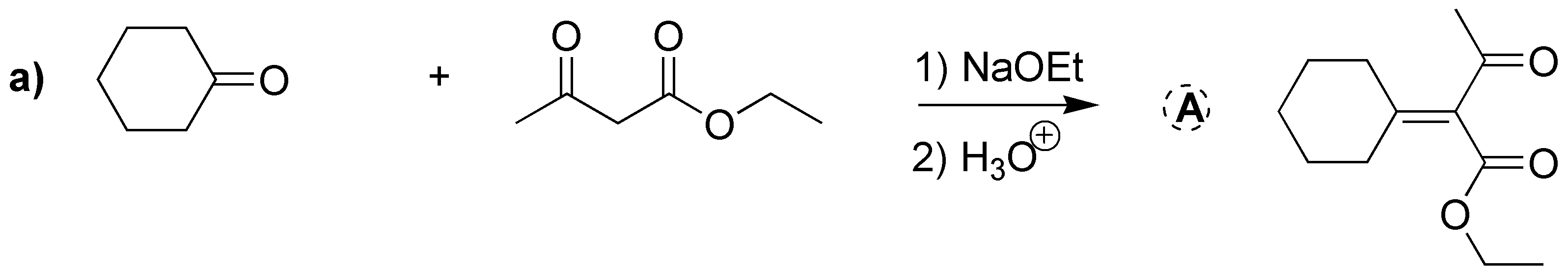
Solución 12:
Ambas transformaciones son reacciones de Claisen intramoleculares, en este caso particular se denomina condensación de Dieckmann. Los dos ésteres empleados son simétricos, por lo que se forma un único enolato que ataca al carbono del éster en el extremo de la cadena. Dado que el diéster de la reacción a) presenta siete átomos de carbono el ciclo resultante es de seis miembros, mientras que en el caso b) son seis átomos en la cadena que soporta los dos grupos -COOCH3, lo cual origina un ciclo de cinco miembros.
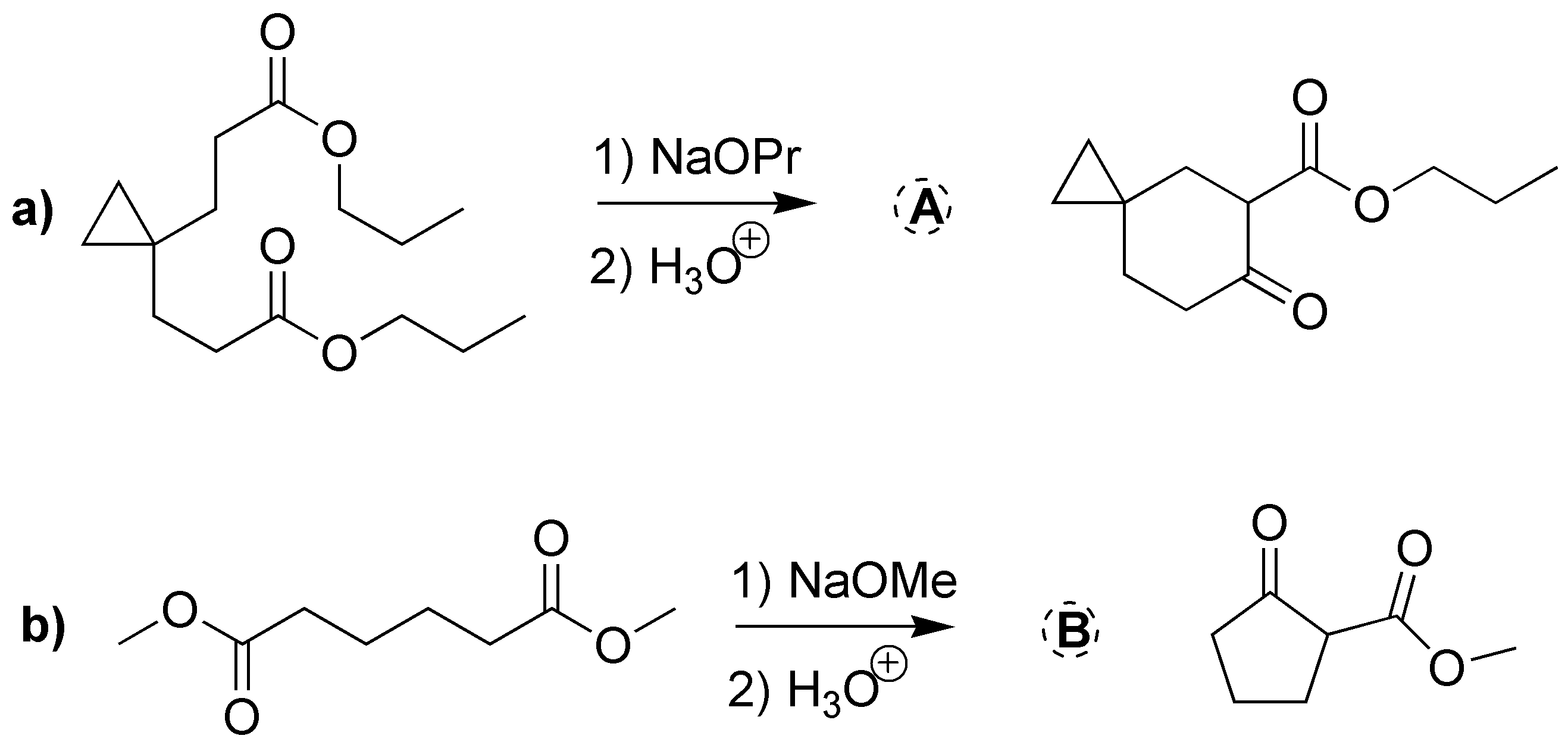
Solución 13:
En este caso se trata de cuatro reacciones de condensación tipo Claisen. En todos los casos (a–d) se parte de un único éster, por lo que se deben consumir dos moles de producto de partida. Un mol se gasta en la producción del enolato y sobre el segundo se da el ataque del carbono nucleófilo de éste.
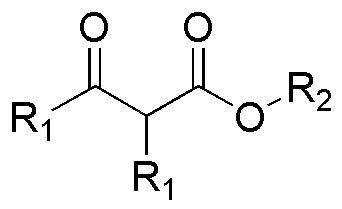
De los ésteres a y c se deduce la formación de los compuestos A y C indicados en la figura, mientras que en las transformaciones d y b se puede deducir la estructura de los ésteres de partida determinando la naturaleza de R1 y R2.
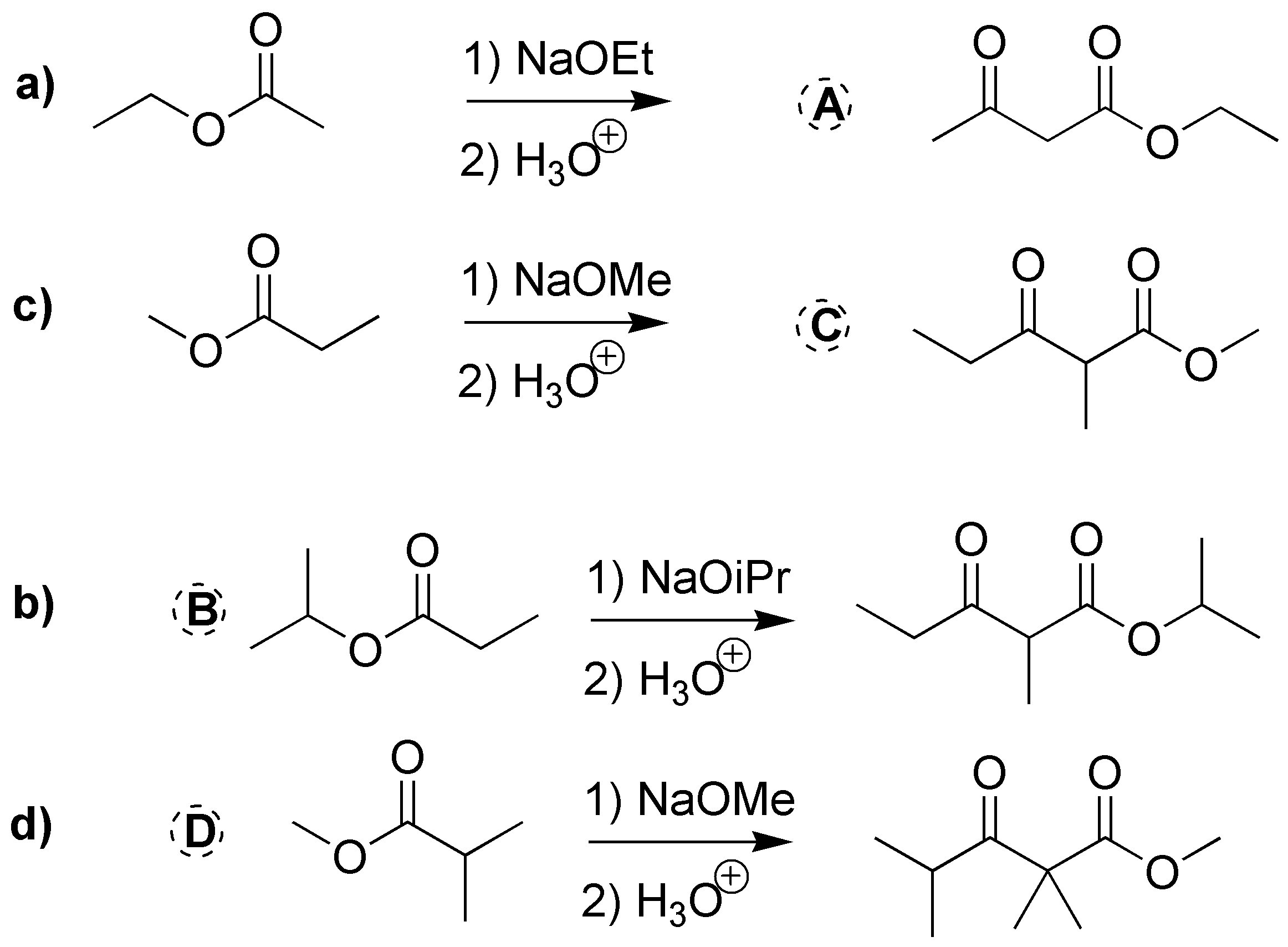
Solución 14:
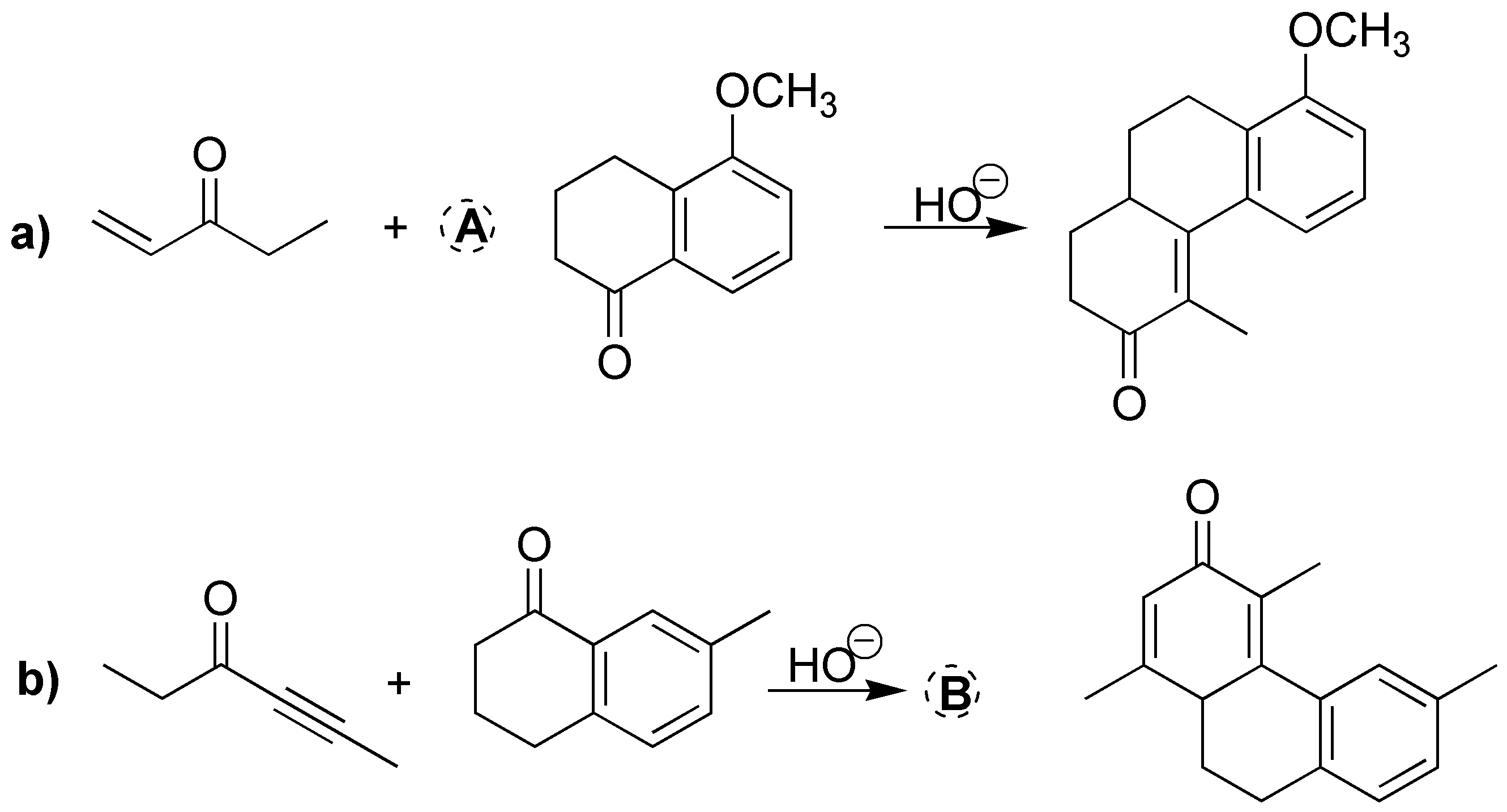
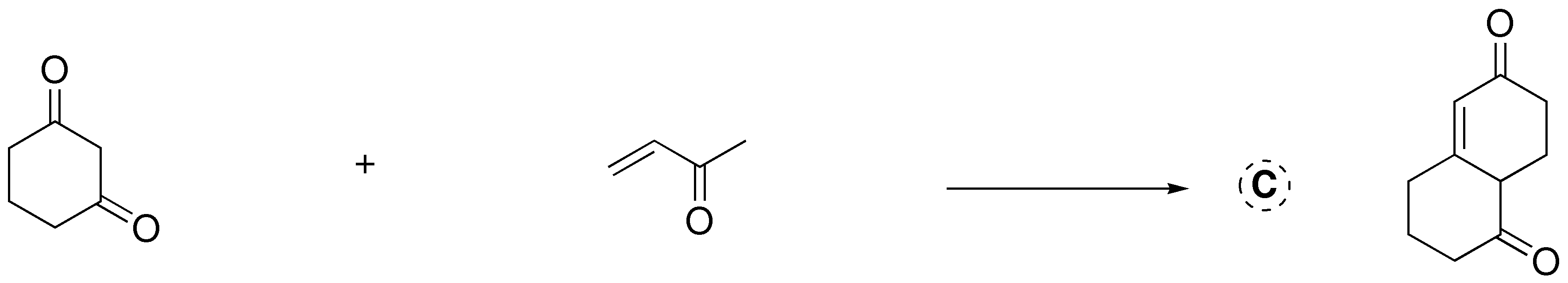
Esta es una reacción de formación de anillos de Robinson. En primer lugar, se forma el carbanión de la ciclohexano-1,3-diona en el carbono situado entre los dos grupos carbonílicos, ya que es el más ácido (compuesto 1,3-dicarbonílico) y está favorecido con respecto al carbono-α de la but-3-en-2-ona. Este carbanión ataca al carbono terminal del doble enlace C=C, para dar el intermedio de Michael que se indica en la figura. Posteriormente, este intermedio sufre otra pérdida de un protón en el carbono-α del metilo para dar una condensación aldólica intramolecular, ya que está favorecida por generar anillos de 6 miembros.
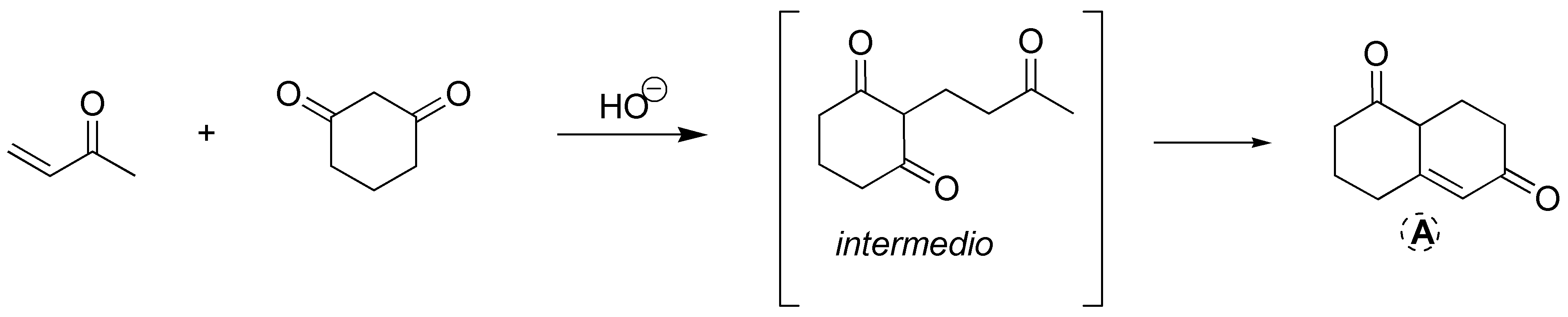
Solución 15:
Las cuatro son reacciones de formación de anillos de Robinson. En medio básico, los reactivos que se indican en el esquema pierden el protón situado en el carbono-α la ciclohexanona. Este carbanión se adiciona a los dobles y triples enlaces carbono-carbono del otro reactivo indicado en el esquema. Posteriormente, se produce la condensación aldólica y el paso de deshidratación que da lugar a un doble enlace.
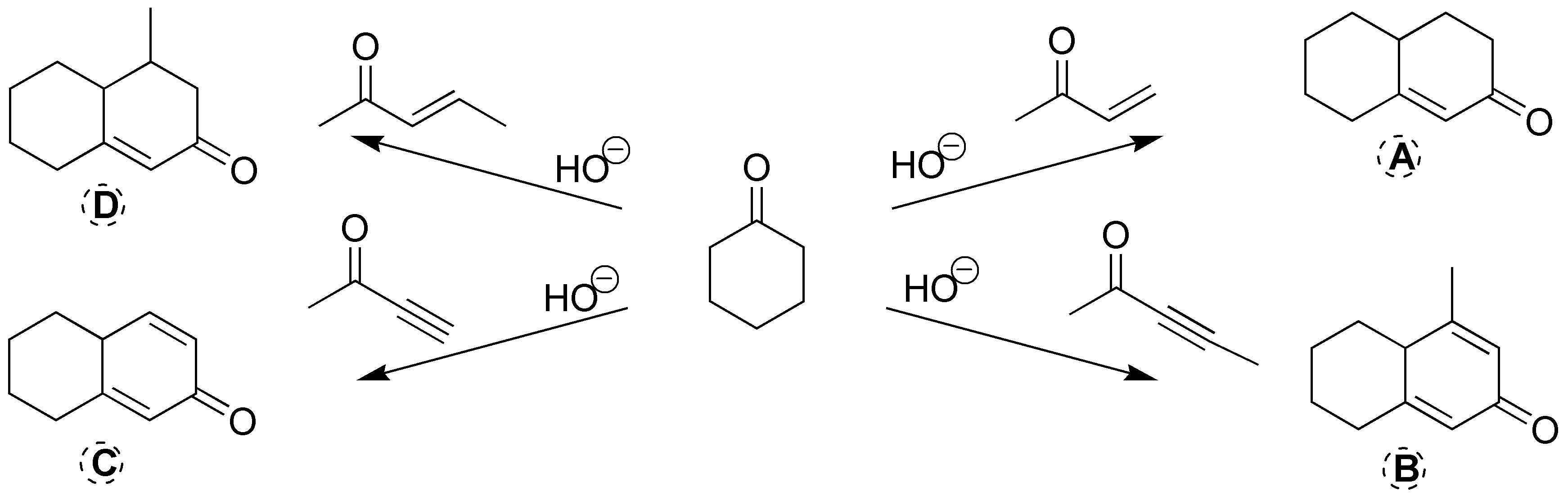
Solución 16:
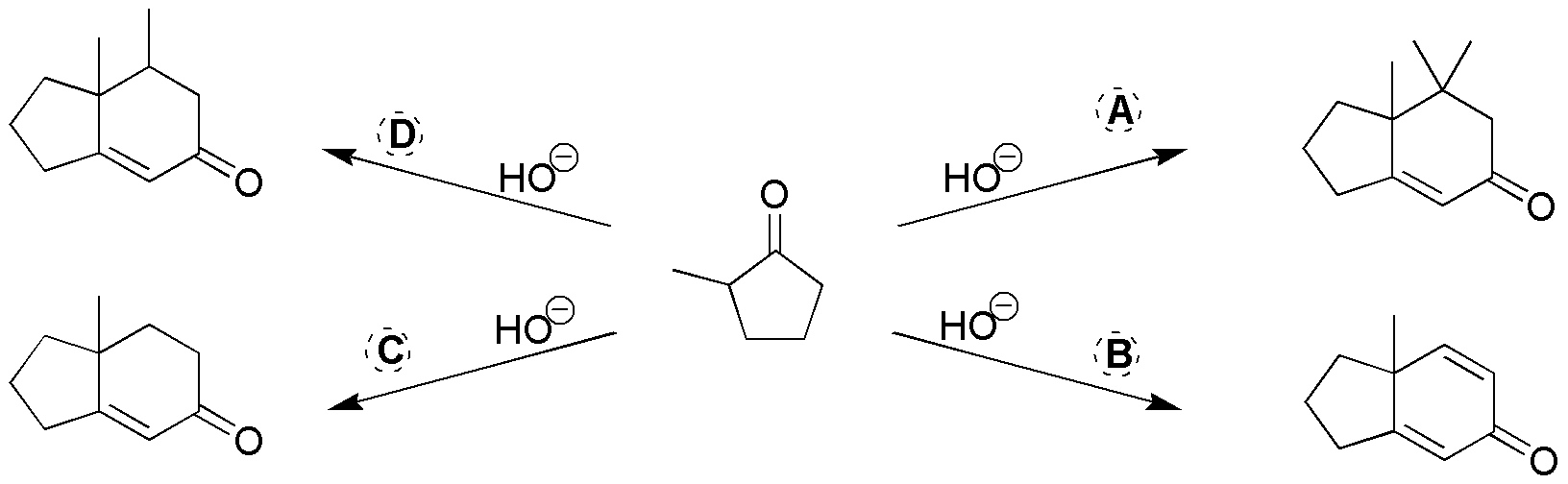
Son reacciones de formación de anillos de Robinson. En primer lugar tomamos como referencia la 2-metilciclopentanona en los productos finales. Posteriormente, se localizan aquellos nuevos enlaces C-C que se generan en las correspondientes reacciones (indicados en la siguiente figura). De esta manera, se visualizan los puntos de unión entre el producto de partida (2-metilciclopentanona) y los reactivos (A–D) que se han utilizado.
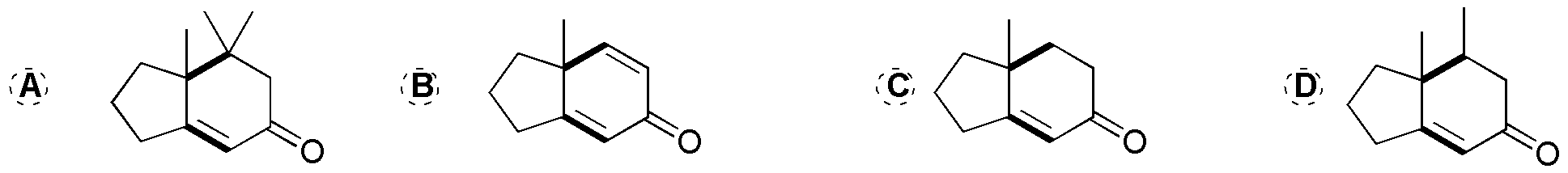
Uno de estos puntos de unión señalados es un doble enlace que proviene del grupo carbonilo del producto de partida y del carbono en posición a del reactivo empleado (A–D).
El otro punto de unión corresponde al ataque (adición de Michael sobre la insaturación del reactivo). Si esta insaturación es un doble enlace en el producto final se obtiene un enlace C-C sencillo mientras que si en el reactivo tenemos un triple enlace C-C (caso B) en el producto se genera un doble enlace C-C. Para más claridad se resaltan en la siguiente figura en negrita el fragmento del reactivo que se incorpora al producto final.
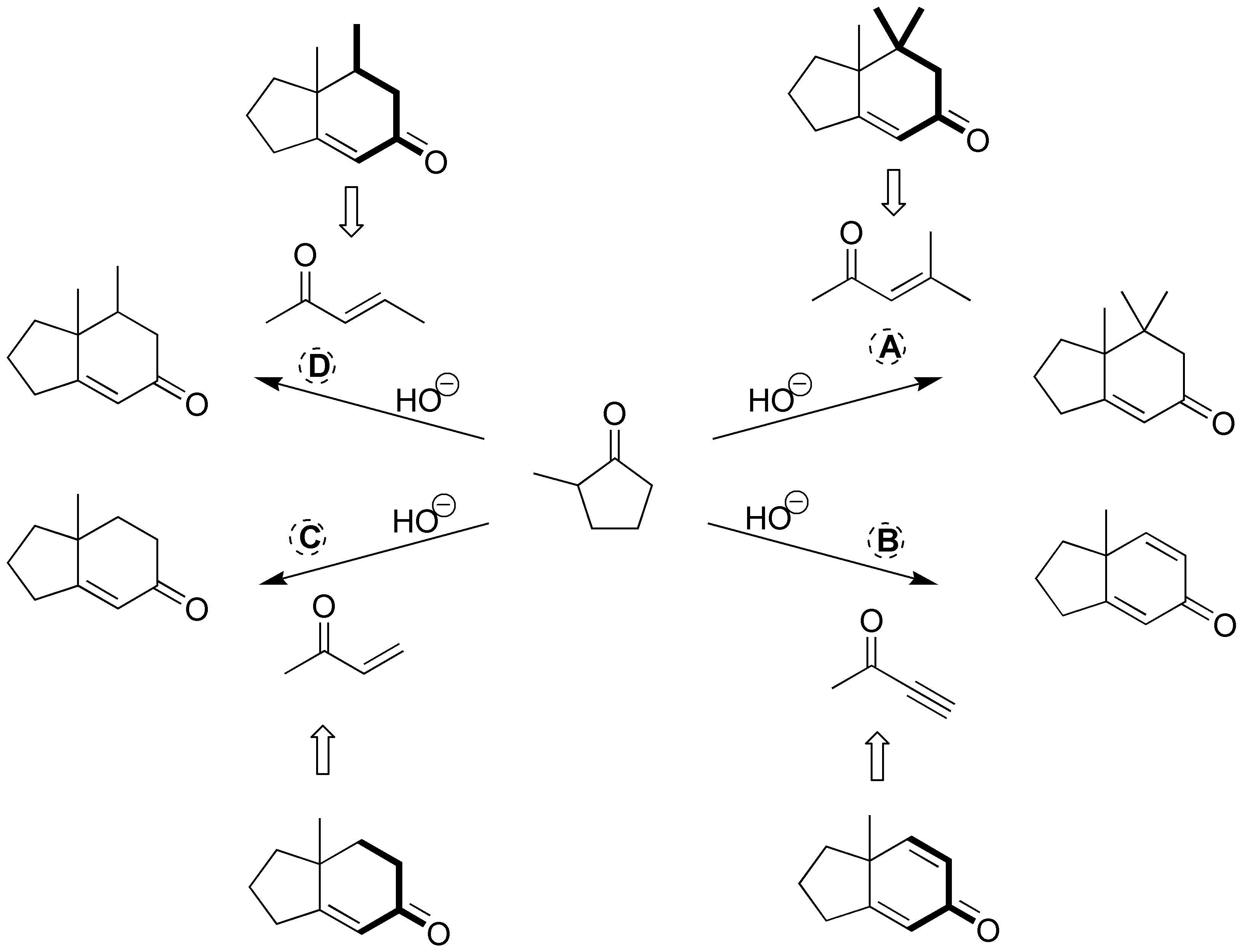
Solución 17:
Los compuestos b), d) y i) no presentan hidrógenos-α.
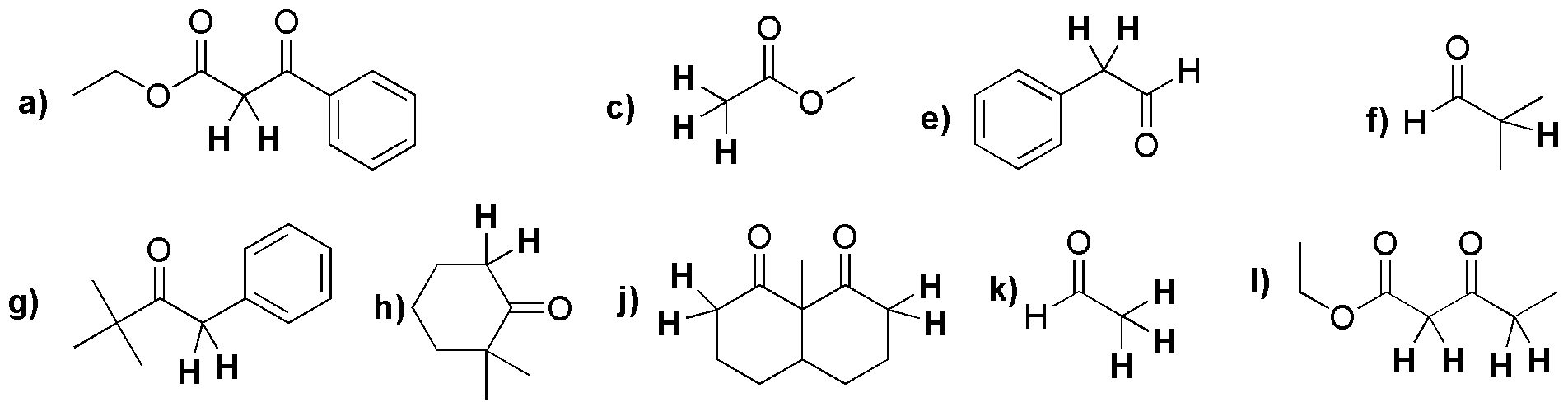
Solución 18:
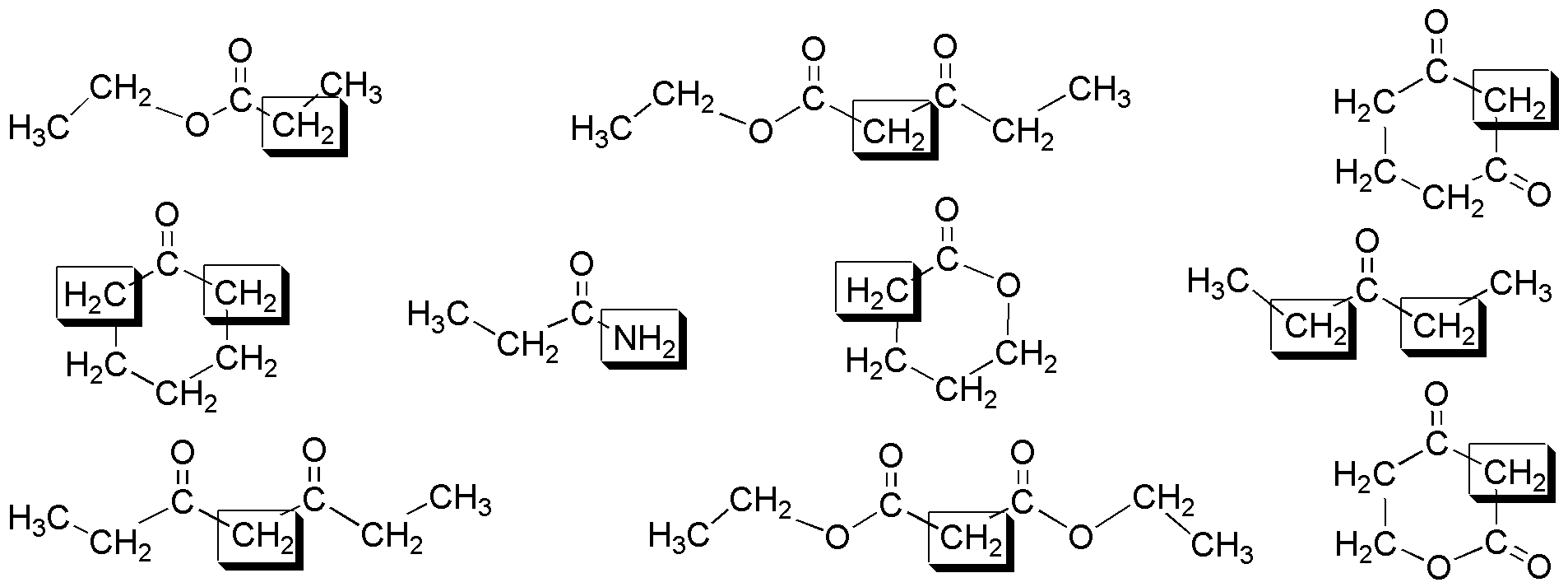
Solución 19:
Se trata de una condensación de Claisen intramolecular (ciclación de Dieckmann) en la que el enolato del éster inferior atacará al éster superior formando el anillo de ciclopentanona:
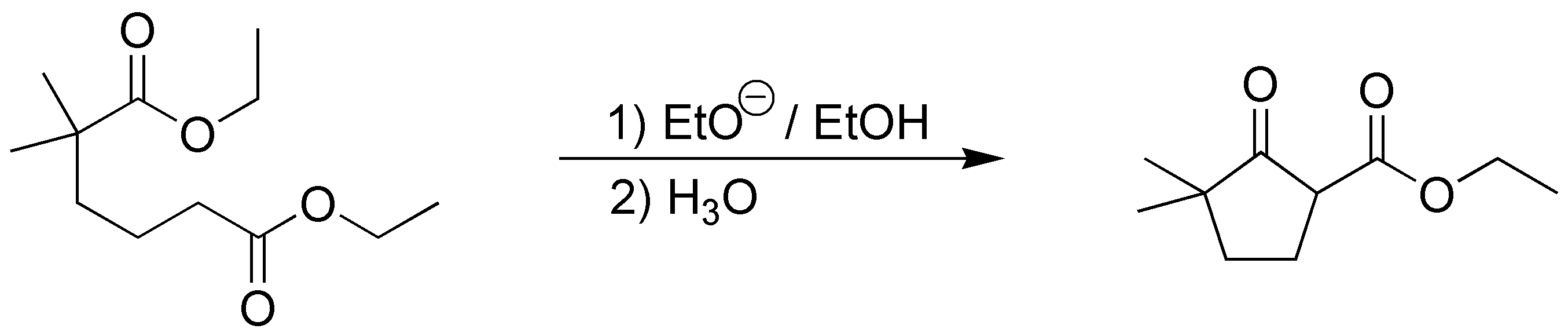
Solución 20:
Al existir la posibilidad de formación de enolato de los dos aldehídos, existirán 4 posibilidades de condensación aldólica: dos simétricas y dos cruzadas:
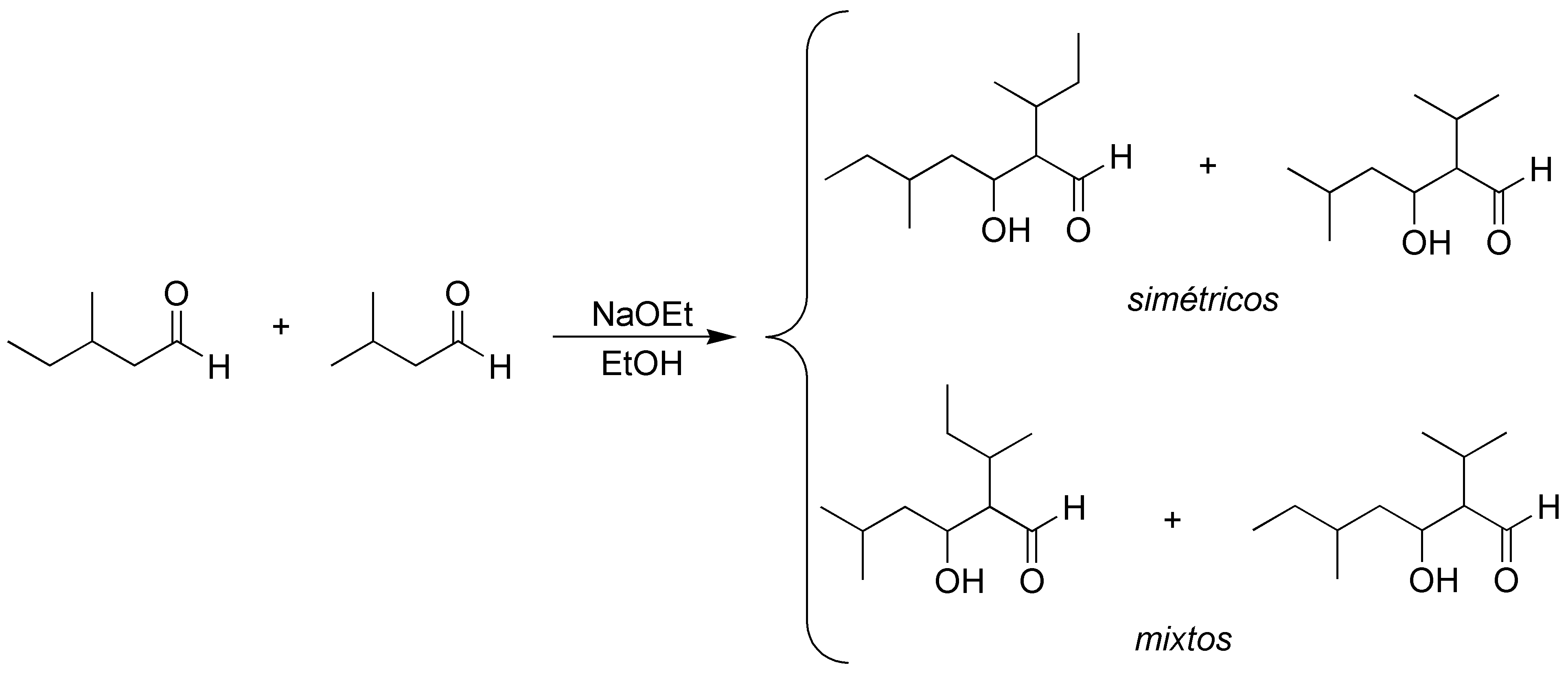
Solución 21:
Se trata de una condensación aldólica cruzada. Como el benzaldehído no posee hidrógenos-α se formará el enolato de la ciclohexanona que atacará al benzaldehído dando el correspondiente aldol.
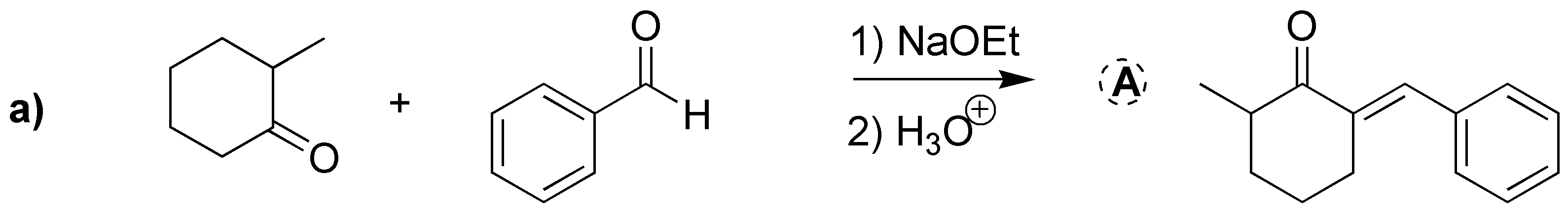
Solución 22:
Se tratan de dos condensaciones de Claisen intramolecular (ciclación de Dieckmann):
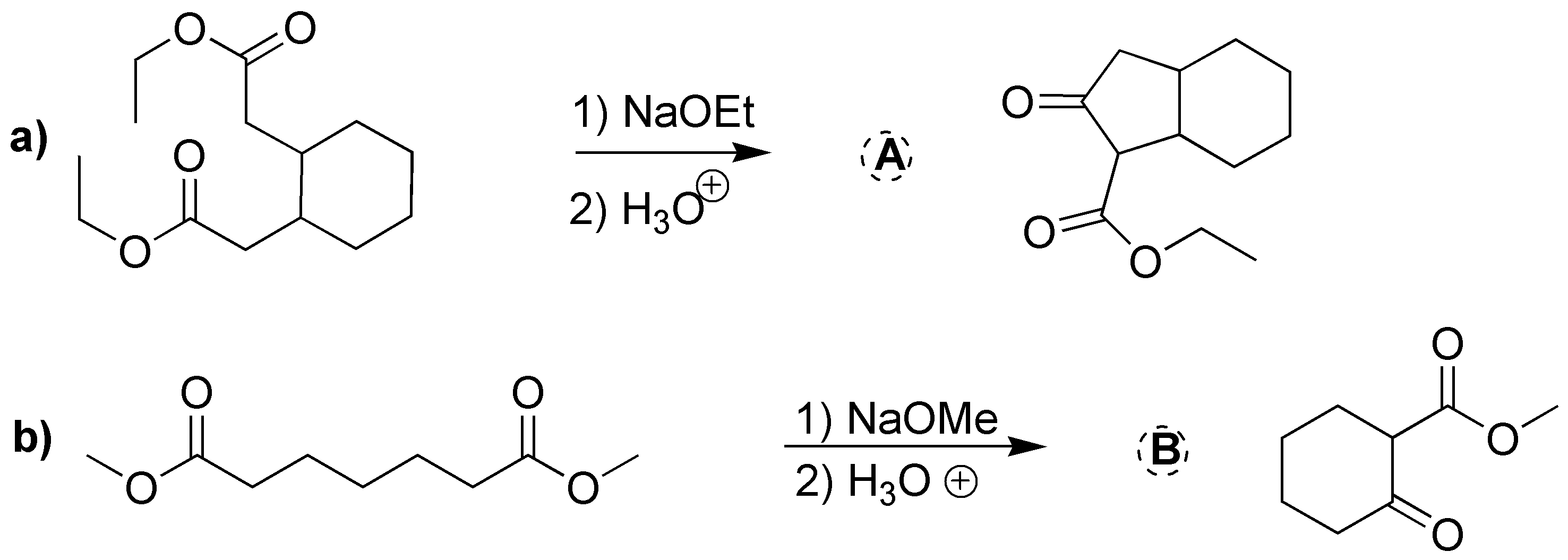
Solución 23:
a) y b) corresponden a dos cetoésteres, por lo que procederán mediante dos condensaciones de Claisen: a) del 2-metilpropanoato de isopropilo y b) del propanoato de metilo. c) y d) también se trata de dos condensaciones de Claisen que deben dar dos cetoésteres: c) el 2,2,4-trimetil-3-oxo-pentanoato de etilo y d) acetilacetato de propilo (3-oxo-butanoato de propilo).
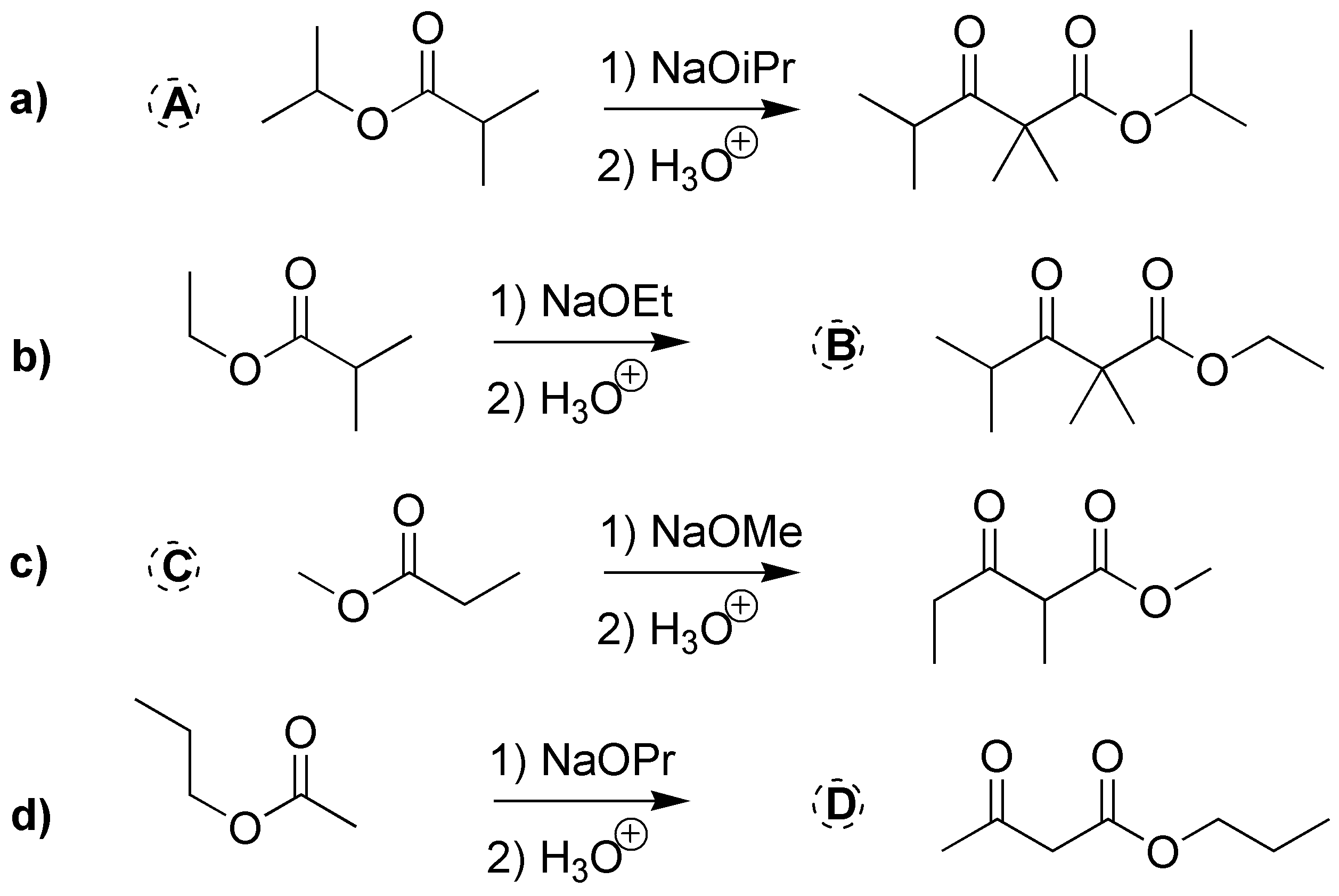
Solución 24:
Se tratarán de 4 reacciones de formación de anillo de Robinson, por lo que los compuestos carbonílicos necesarios se indican en el siguiente esquema:
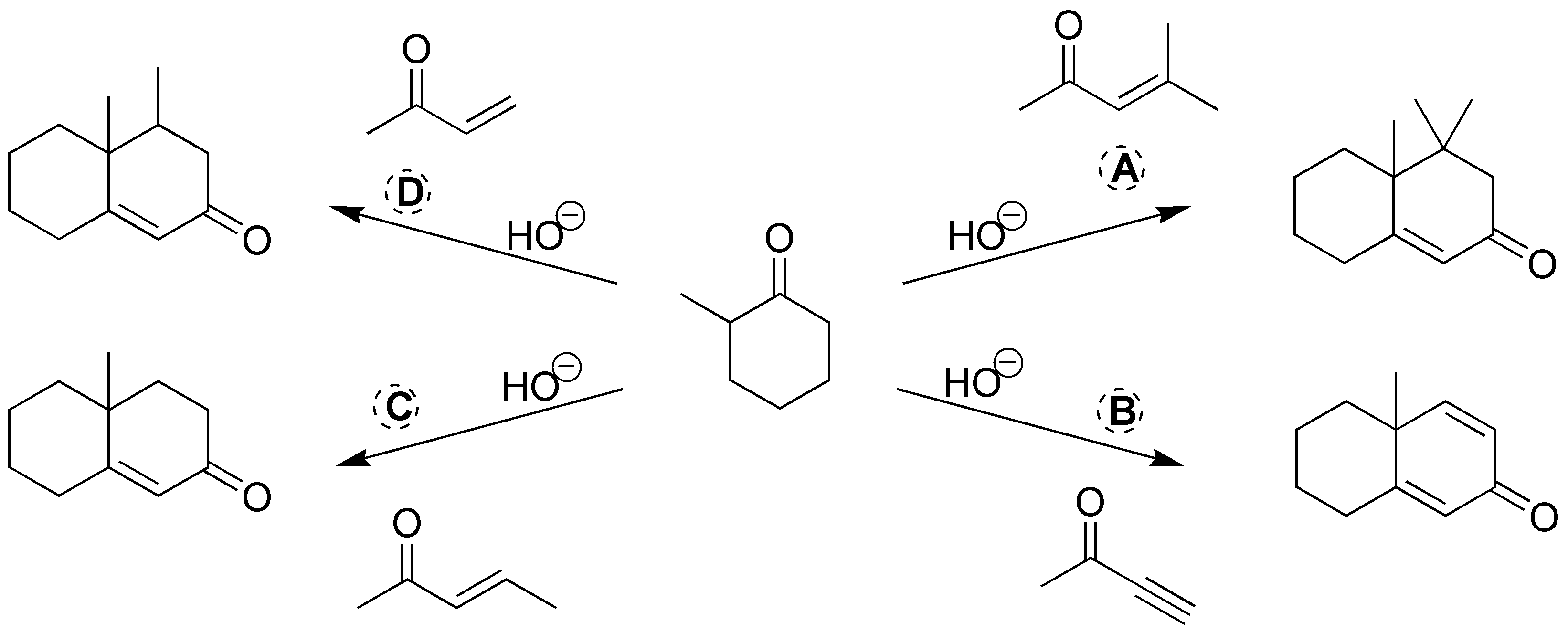
Solución 25:
Se tratarán de 4 reacciones de formación de anillo de Robinson, por lo que los compuestos que se formarán serán:
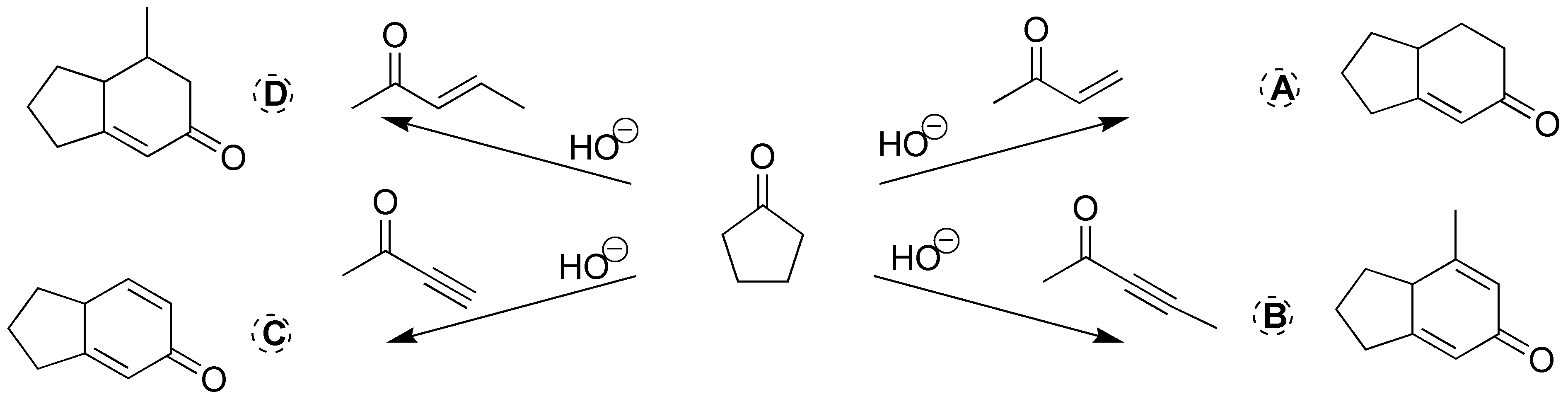
Solución 26:
Se tratarán de una reacción de formación de anillo de Robinson. El primer paso será el resultado de la formación del enolato y adición tipo Michael de este sobre el compuesto carbonílico insaturado:
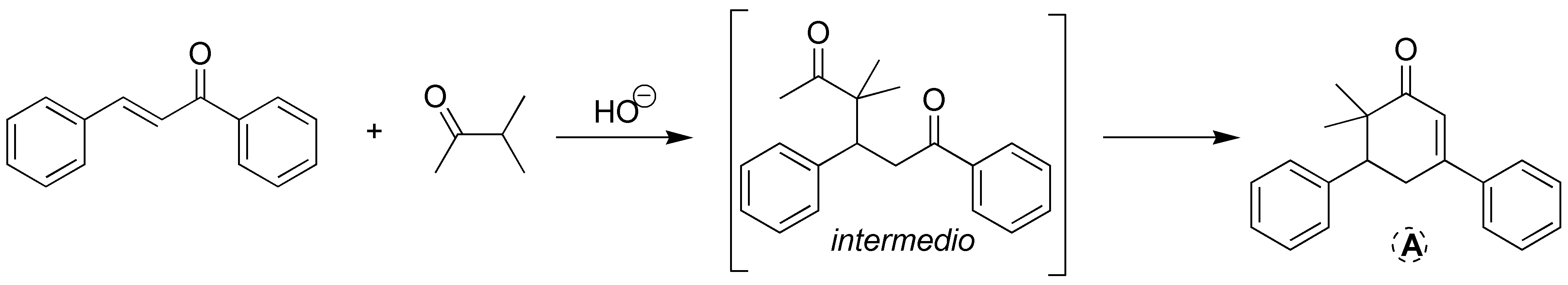
Solución 27:
a) Corresponde a una ciclación de Dieckmann. El enolato del éster ataca al otro éster dando un cetoéster cíclico; b) se trata de una condensación aldólica cruzada; c) es una adición tipo Michael de un compuesto metilén activo a un carbonílico insaturado; d) es una condensación aldólica intramolecular; e) es una reacción de formación de anillos de Robinson y f) es una condensación de Claisen cruzada. Los resultados de las mismas se indican en el siguiente esquema:
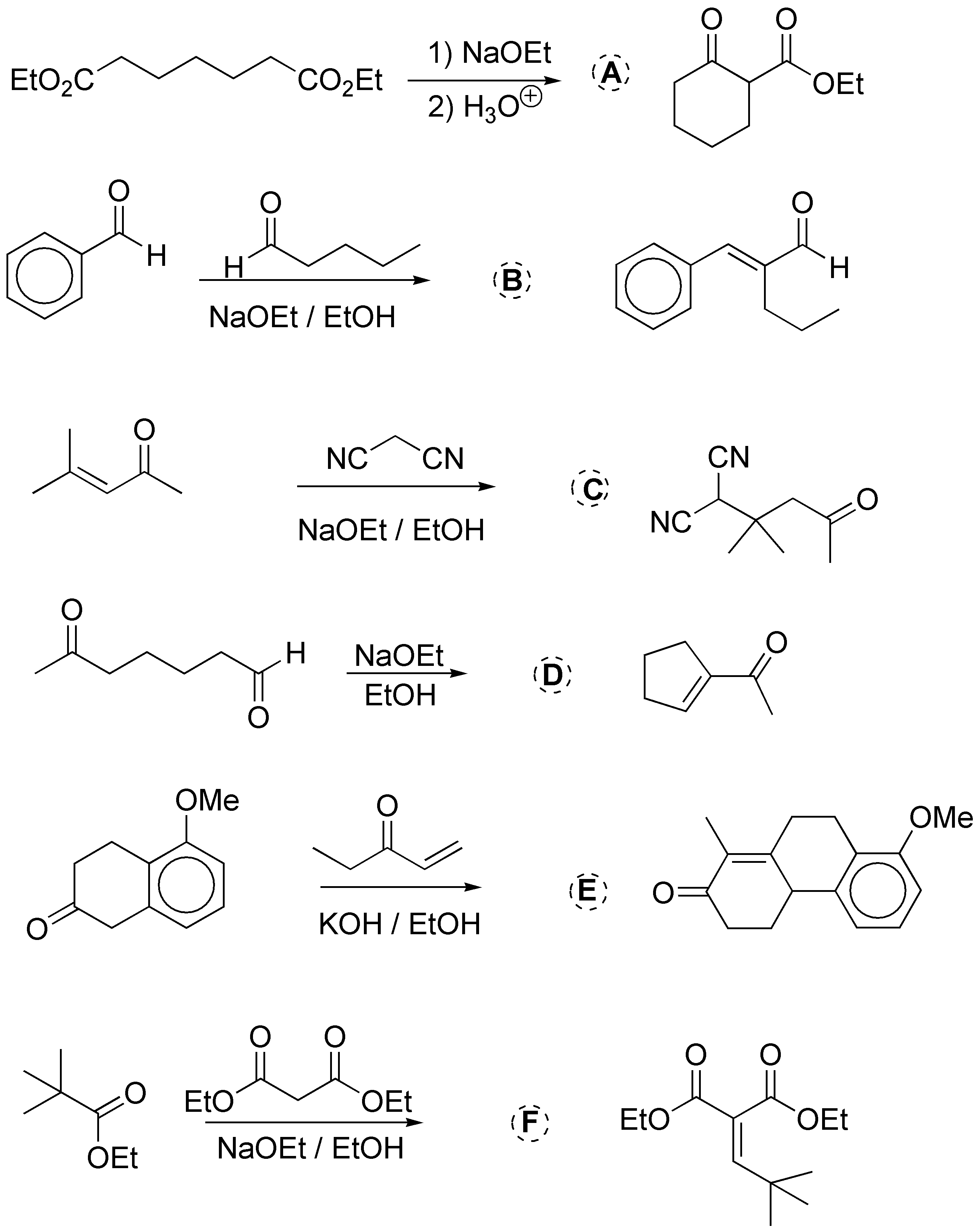
Solución 28:
Corresponde a dos reacciones de formación de anillos de Robinson. En la primera, debemos encontrar el compuestos carbonílico para lo que debemos indicar que parte de la estructura final corresponde al compuesto carbonílico insaturado. En la segunda, debemos indicar el intermedio que se forma por adición tipo Michael del enolato de la cetona sobre el triple enlace y después realizar una condensación aldólica.