Índice
¿Qué son los haloalcanos?
Los haloalcanos (o halogenuros de alquilo, o haluros de alquilo) son derivados de los hidrocarburos en los que uno o más de los hidrógenos se han sustituido por halógenos.
Cualquiera de los hidrógenos de un hidrocarburo puede reemplazarse por halógeno. En realidad, se pueden sustituir todos los hidrógenos de una molécula.
Por ejemplo, en los compuestos totalmente fluorados, se denominan fluorohidrocarbonos, y presentan gran interés industrial debido a su gran estabilidad térmica.
Como notación general para los haloalcanos, se emplea con frecuencia la expresión R—X, siendo R cualquier grupo alquilo y X cualquier halógeno.
Estructura y propiedades físicas
Para conocer mejor la estructura de estos compuestos, hay que considerar la configuración electrónica del estado fundamental de los halógenos.
| Halógeno | Configuración electrónica |
| F | 1s2 2s2 2p5 |
| Cl | 1s2 2s2 2p6 3s2 3p5 |
| Br | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
| I | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 |
A los halógenos les falta un único electrón (señalado en rojo en la tabla) para completar su última capa. Por consiguiente, es de esperar que los halógenos formen moléculas estables mediante un sólo enlace covalente o iónico con otro átomo.
Por otra parte, los halógenos presentan una tendencia a atraer un electrón y por tanto son átomos muy electronegativos (véase tabla de electronegatividad).
Además, tienen orbitales no enlazantes externos con pares de electrones sin compartir. De esta forma, se puede decir que las combinaciones covalentes de los halógenos podrán completarse como bases de Lewis (donante de electrones).
La estructura del fluoruro de metilo (CH3F) sería:
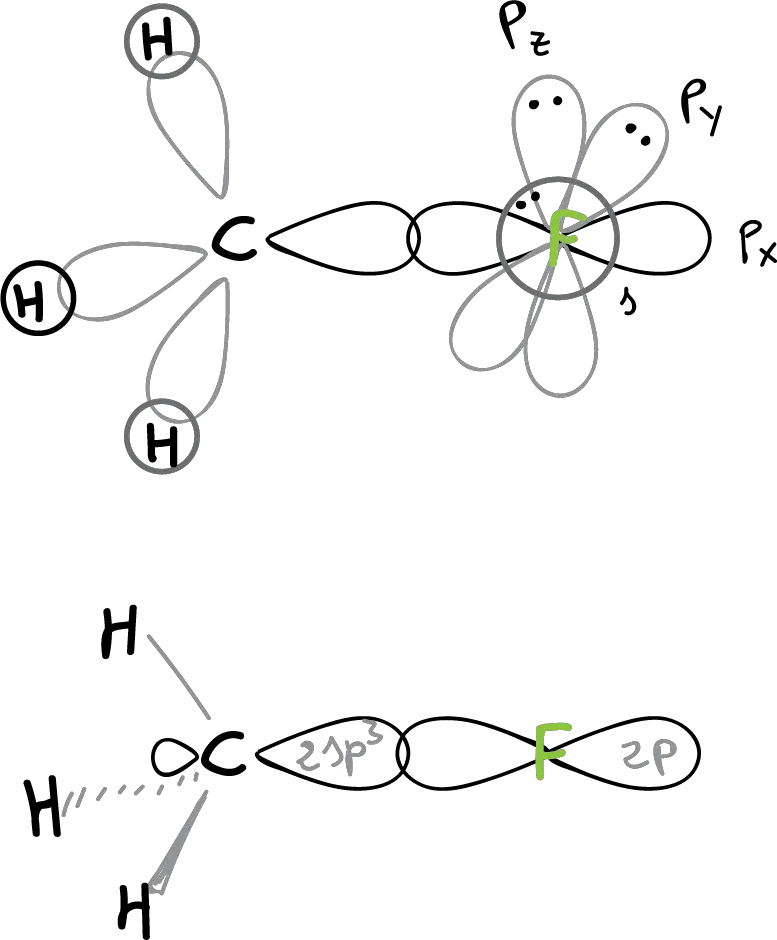
La unión C—F se realiza por solapamiento de un orbital híbrido 2sp3 del carbono con un orbital 2p del flúor. Los ángulos ∠H-C-H y ∠H-C-F son próximos al tetraédrico (109º). En esta estructura, se puede apreciar como en el fúor quedan tres orbitales no enlazantes con 3 pares de electrones sin compartir.
El cloruro, bromuro y yoduro de metilo, se forman por solapamientos análogos de un orbital híbrido 2sp3 del carbono con los orbitales 3p, 4p y 5p del Cl, Br y I, respectivamente.
La fortaleza del enlace C—X disminuye a medida que descendemos en el grupo de la tabla periódica. Esto es consecuencia del principio general de que el recubrimiento orbital es más efectivo entre orbitales del mismo nivel cuántico principal y la eficacia disminuye al aumentar la diferencia entre los números cuánticos principales.
Las energías de enlace y longitudes de enlace de los cuatro compuestos son:
| Enlace | Een (Kcal·mol-1) | Distancia (Å) |
| C—F | 105.4 | 1.42 |
| C—Cl | 78.5 | 1.77 |
| C—Br | 65.9 | 1.91 |
| C—I | 57.4 | 2.12 |
Si nos fijamos en la Tabla 2, y teniendo en cuenta que los átomos de halógeno aumentan en tamaño conforme se desciende en la tabla periódica. Así, las longitudes de enlace C—F (1.42 Å) es intermedia entre un enlace sencillo carbono-hidrógeno C—H (1.1 Å) y uno carbono-carbono C—C (1.54 Å). Todos las demás distancias de enlace del resto de halógenos son mayores que los del enlace C—C.
Aunque los enlaces C—X de los haluros de alquilo son covalentes, tienen un carácter polar, debido a que los halógenos son más electronegativos que el carbono. El centro de gravedad de la densidad electrónica no coincide con el centro de carga nuclear, y esto origina un momento dipolar.
Nomenclatura de haloalcanos
Propiedades físicas
Las propiedades físicas de los haloalcanos son bastante distintas de las de los correspondientes alcanos Esto es consecuencia del tamaño del halógeno y la polaridad del enlace C—X. Estos factores afectan a la fuerza y longitud de enlace, a la polaridad de la molécula y al punto de ebullición.
Los puntos de ebullición son generalmente más altos que los correspondientes alcanos y se incrementan con el tamaño del halógeno, debido al aumento del peso molecular, y del tamaño de la cadena.
Los haloalcanos son insolubles en agua pero solubles en disolventes orgánicos. Los bromo, yodo y policloroalcanos son más densos que el agua.
Síntesis de haloalcanos
Propiedades químicas
De todas las reacciones que pueden llevarse a cabo con los haloalcanos, hay dos fundamentales que son las reacciones de sustitución y las reacciones de eliminación.
El desplazamiento de un ión haluro por un nucleófilo se conoce como reacción de sustitución nucleófila. Los haloalcanos son uno de los tipos de compuestos en los que un átomo de carbono está enlazado a un átomo o grupo de átomos (grupo saliente) que puede ser desplazado en una reacción de sustitución. En estos compuestos la electronegatividad del grupo saliente polariza los enlaces, originando una carga positiva parcial en el átomo de carbono y otra en los átomos de hidrógeno más próximos.
fig-02
Un átomo de carbono que presente la carga parcial positiva es un centro electrófilo. Una base de Lewis que además sea un buen nucleófilo podrá reaccionar con dicho átoo desplazando al grupo saliente.
fig-03
Reacciones de haloalcanos
- Reacciones de sustitución nucleófila
- Clasificación
- Sustitución nucleófila bimolecular
- Reacciones SN2
- Cinética
- Mecanismo y estereoquímica
- Efecto de disolvente
- Reacciones SN2
Listado de ejercicios resueltos de haloalcanos
Siga el enlace para ver un listado de problemas resueltos sobre propiedades y reactividad de los haloalcanos.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
