Written by J.A. Dobado | Last Updated on 5 meses
¿Qué son los indoles?
La unidad indólica se presenta en la naturaleza en gran variedad de estructuras. Así, se conocen más de 100 alcaloides derivados del indol. Además, muchos de estos compuestos naturales tienen una actividad fisiológica relevante, por ejemplo, en el tratamiento de leucemia y cáncer.
Índice
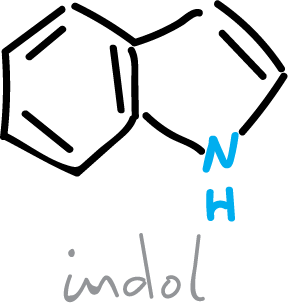
El indol es un sólido cristalino volátil de punto de fusión 52 ºC, y de olor persistente. Sus propiedades son las de un compuesto aromático. Gran parte de la Química del indol es análoga a la del pirrol.
Por ejemplo, es débilmente básico y el catión estable se forma por protonación del carbono. Los electrófilos, atacan al anillo de 5 miembros mas que al de 6.
Se han descrito varios métodos para la sintesis del indol que se resumen a continuación:
Síntesis de Fischer de indol
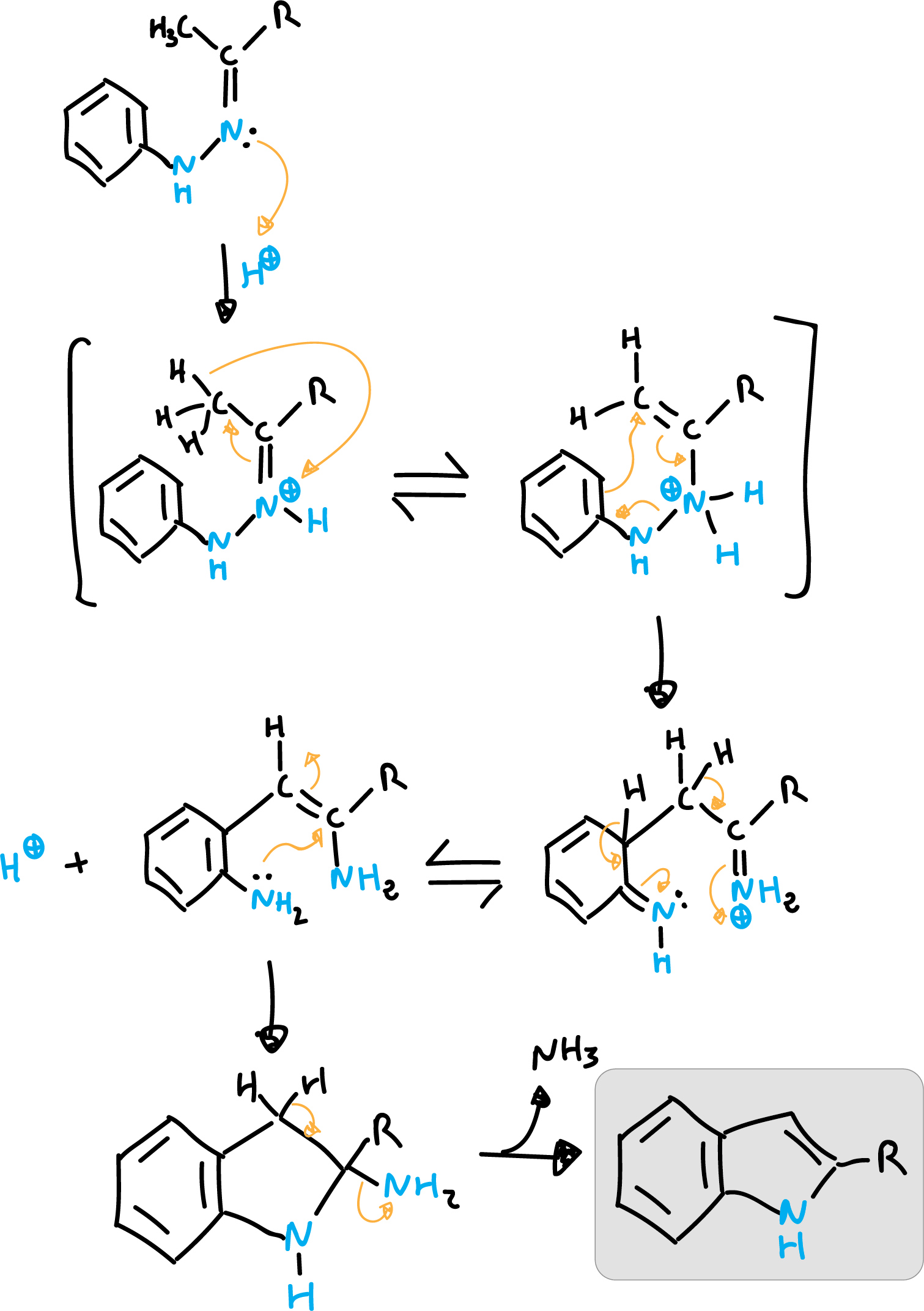
La síntesis de Fischer es el método más utilizado de obtención de indol. Consiste en la transposición de una fenilhidrazona de tipo orto-bencilénico, que cicla con pérdida de amoniaco. La reacción está catalizada por ácido clorhídrico (HCl).
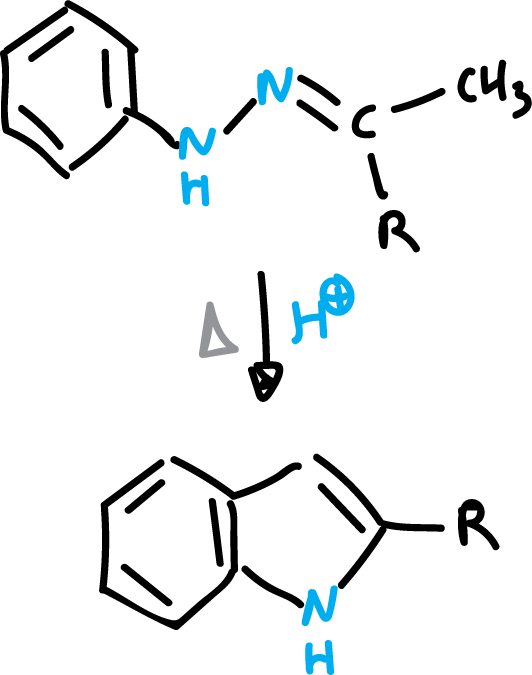
El mecanismo de reacción se inicia con una protonación.
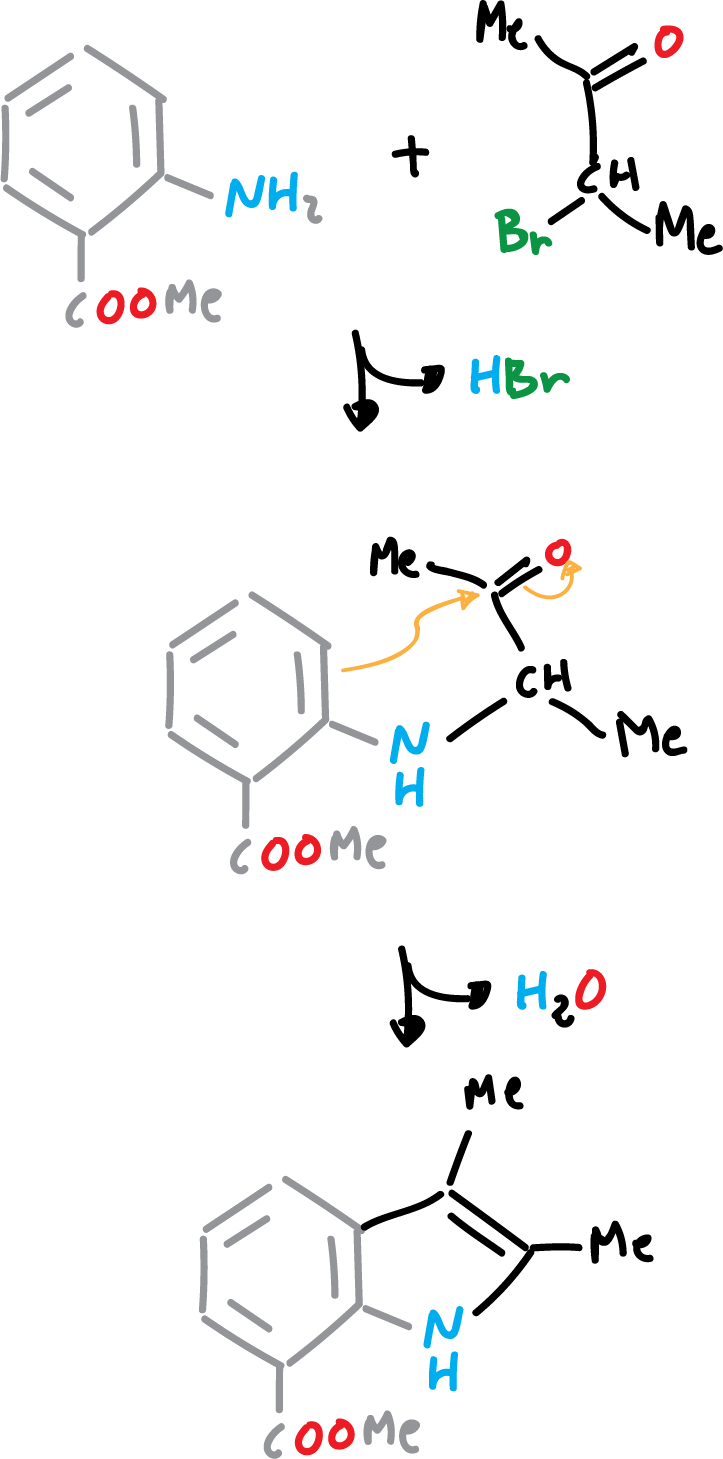
Síntesis de Bischler de indol
La síntesis de Bischler de indol se efectúa por la reacción de una arilamina con un compuesto α-halo-, α-hidroxi-, o α-arilamino-cetona, en presencia de ácido. Tiene especial utilidad para preparar indoles sustituidos idénticamente en posiciones 2 y 3.
Síntesis de Reissert de indol
La síntesis de Reissert de indol consiste en la acilación con oxalato de dietilo del grupo metilo, activado del o-nitro-tolueno, seguida de reducción y ciclación.
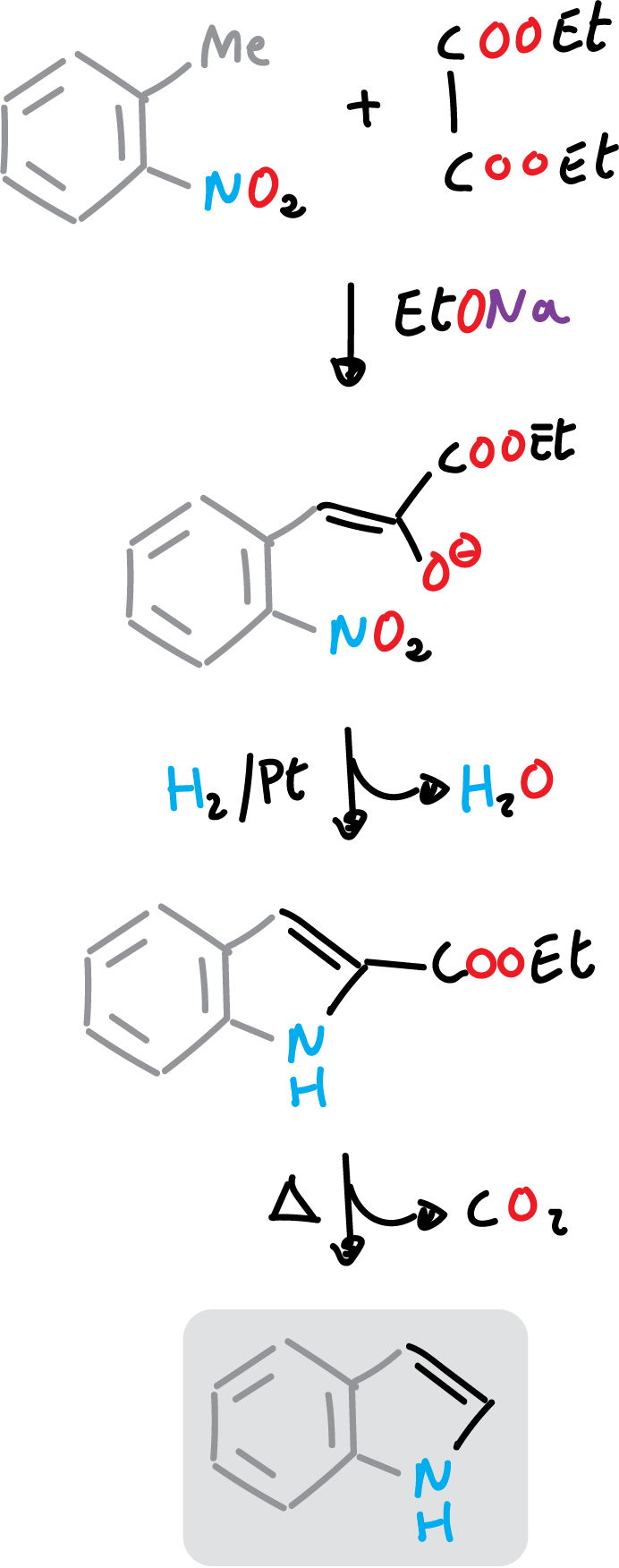
Además, el grupo ester que se queda en el derivado de indol se puede hidroliar y descarboxilar, como se muestra en la figura.
Síntesis de Nenitzescu de indol
La sintesis de Nenizescu de indol se lleva a cabo por consensación de 2-metil-1,4-benzoquinona con 3-metilamino-crotonato de etilo. Además, los 5-hidroxi-indoles obtenidos son compuestos con actividad biológica.
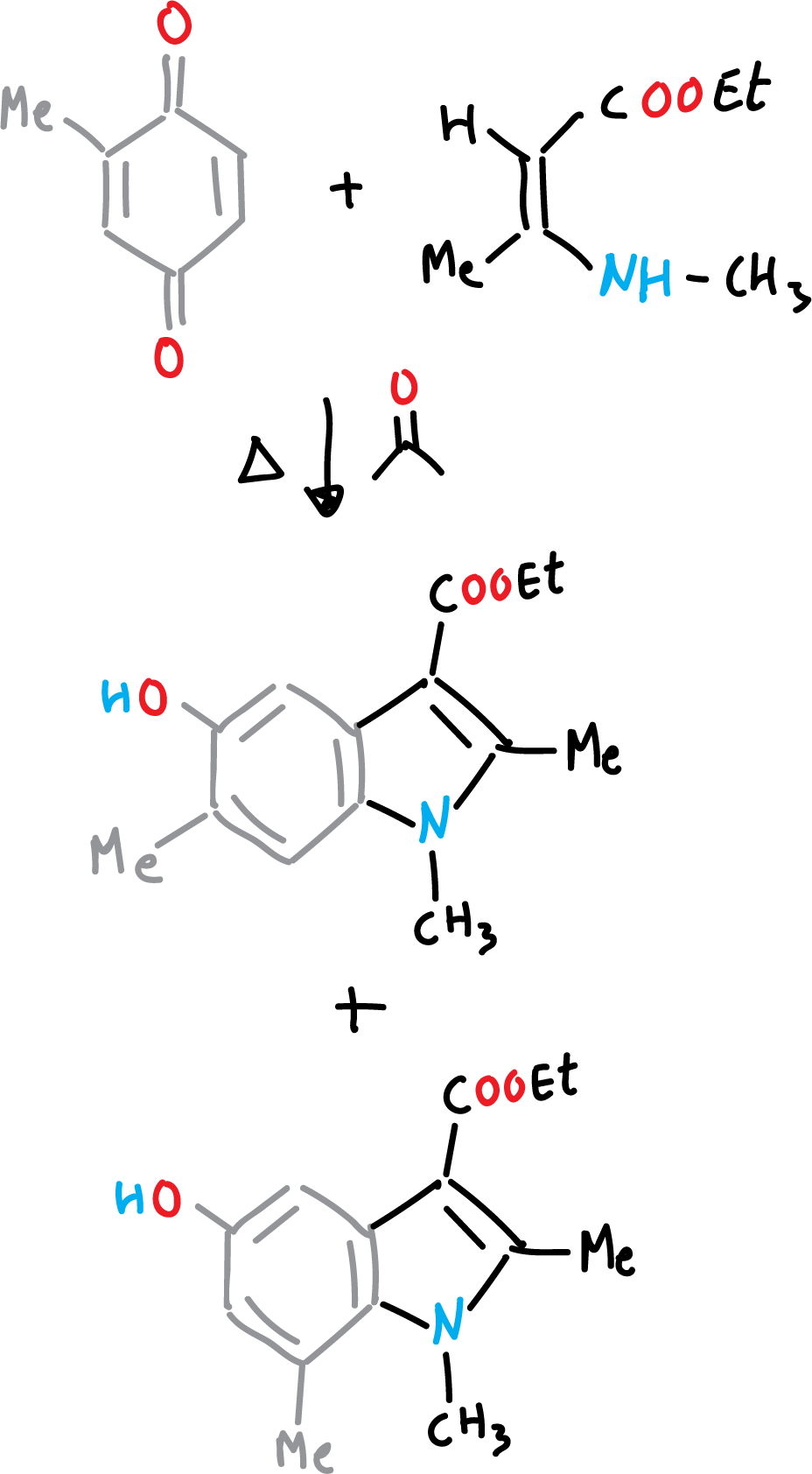
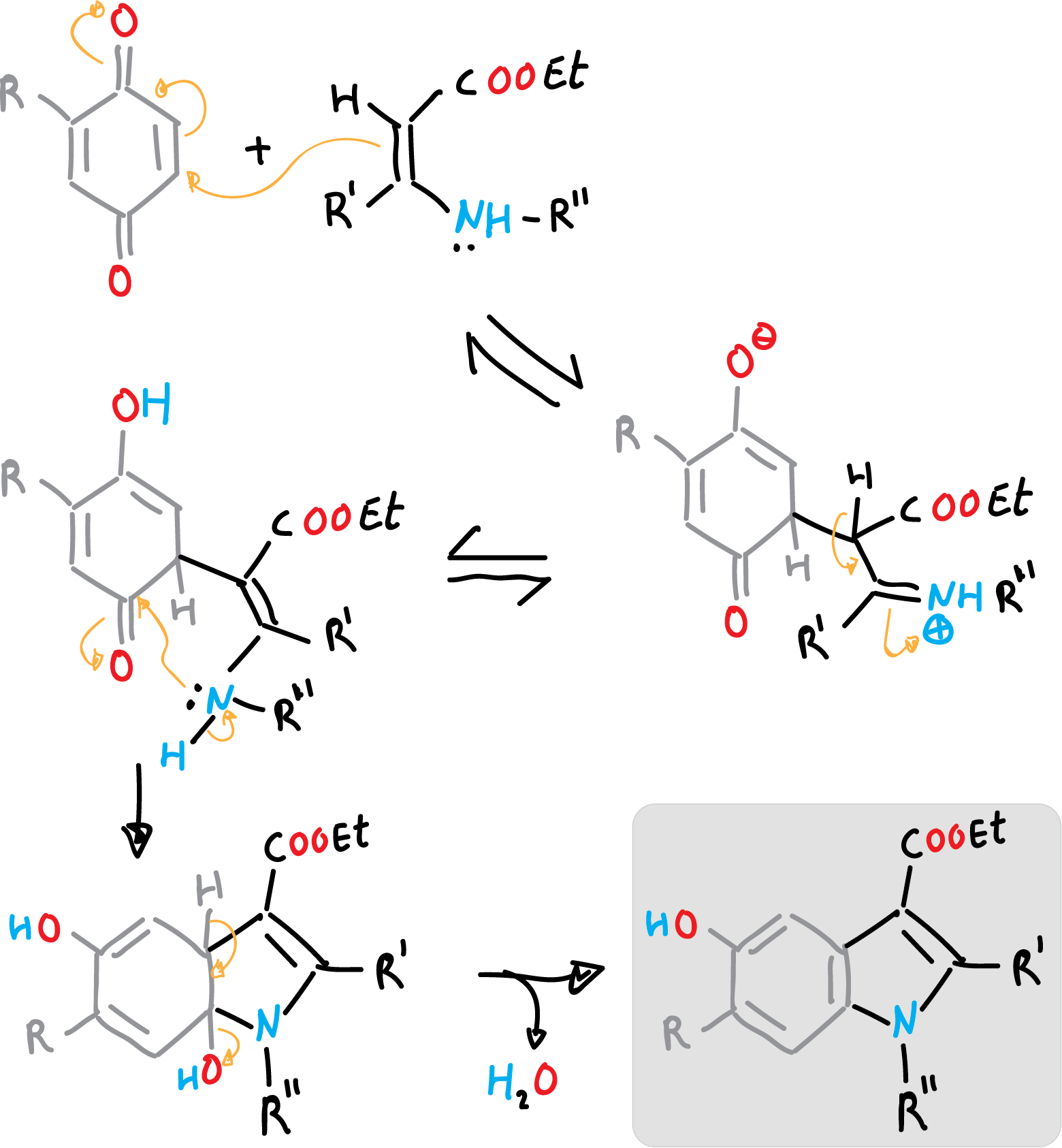
El mecanismo de reacción se puede describir como una adición tipo Michael, de la enamina a la benzoquinona, seguida de una ciclación, y un último paso de deshidratación.
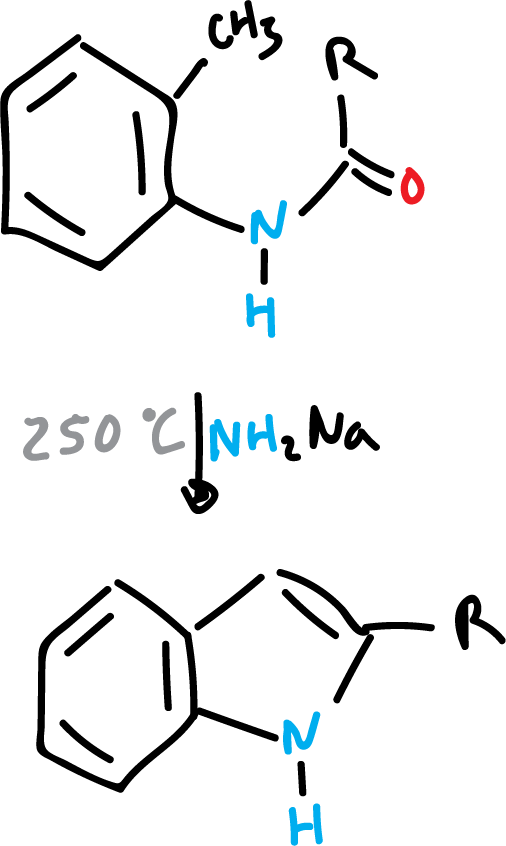
Síntesis de Madelung de indol
La síntesis de Madelund transcurre mediante una deshidratación con ciclación de: o-toluidinas de acilo, o-toluidinas de N-acilo, o bien o-aminotoluenos, con bases fuertes y a altas temperaturas, para producir indoles. Esta reacción se lleva a cabo en ausencia de aire.
Existe otra variante que consiste en realizarla a temperatura ambiente con n-butil-litio como base. De esta forma, se puede introducir en la estructura otros grupos R para formar indoles más complejos.
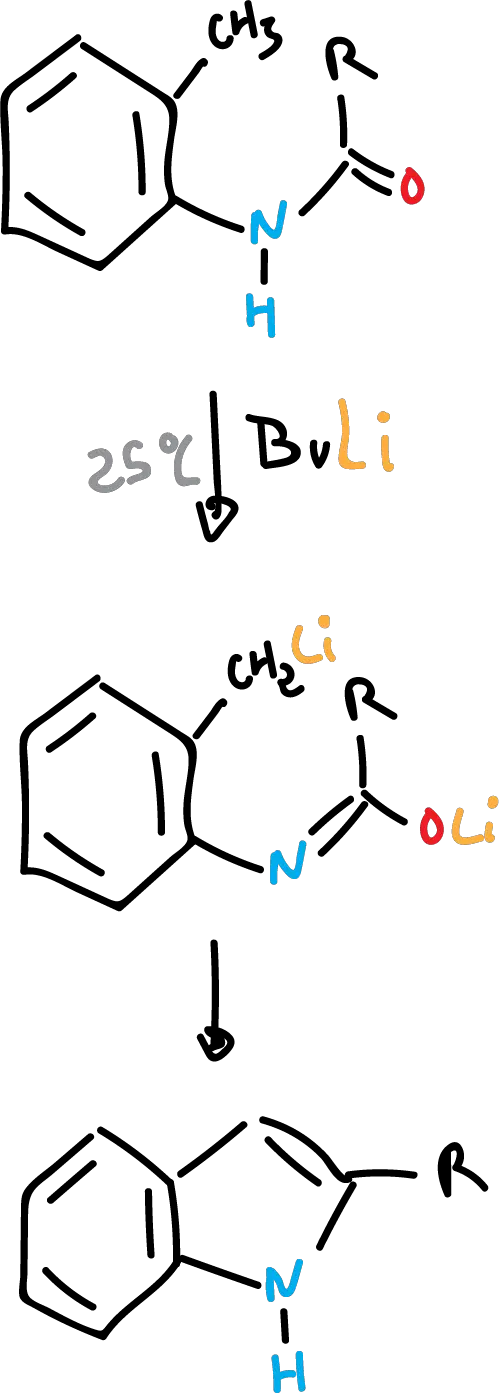
Reactividad
Indoles metalados (acidez)
El indol es un ácido debil (con valor de pKa = 16.97), con una acidez comparable al pirrol, ya a los alcoholes alifáticos. Se puede convertir en el derivado N-sódico, en amoniaco líquido, o con hidruro de sódio (NaH) en un disolvente orgánico.
Por otra parte, el indol puede dar sales de indolilo por abstracción del protón del nitrógeno mediante bases fuertes o reactivos de Grignard.
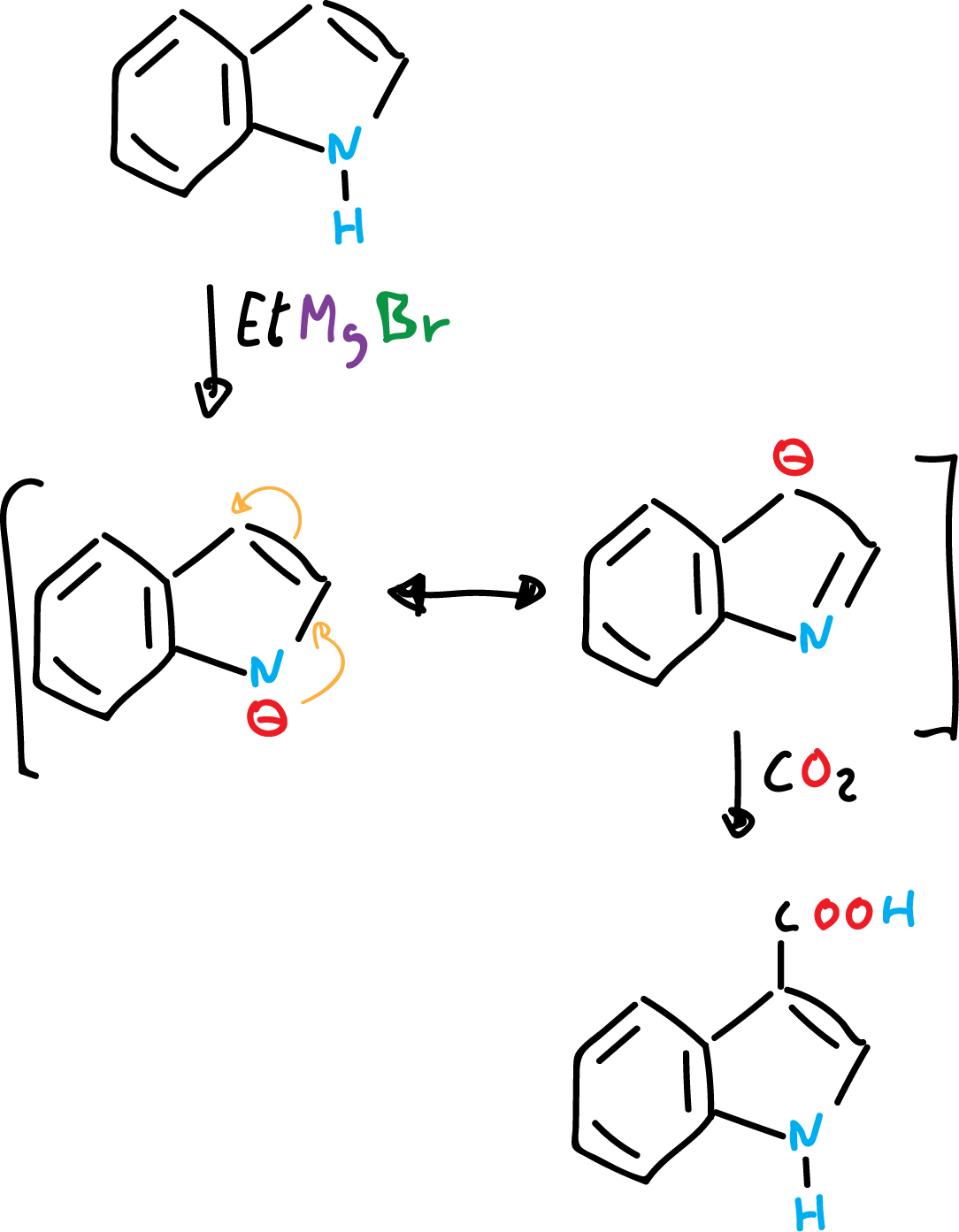
Las sales de indolilo pueden alquilarse en el nitrógeno o en el carbono C3, dependiendo de la temperatura, del disolvente, así como de la naturaleza del catión (ión positivo) con que se trate. De forma general, la alquilación está favorecida en C3, sobre todo a altas temperaturas.
Sustitución electrofílica de indoles
El indol es un heterociclo nucleofílico y reacciona muy fácilmente con electrófilos. En este caso, a diferencia del pirrol, la posición preferida es sobre el C3.
Esto se puede explicar debido a que un ataque de nucleófilo en la posición C2, sólo conlleva un intermedio carbocatiónico (que conserve la aromaticidad del anillo de benceno). Sin embargo, para el ataque en posción C3, se pueden escribir dos estructuras resonantes (manteniendo aromaticidad del anillo de benceno), siendo por tanto más estable un ataque en C3.
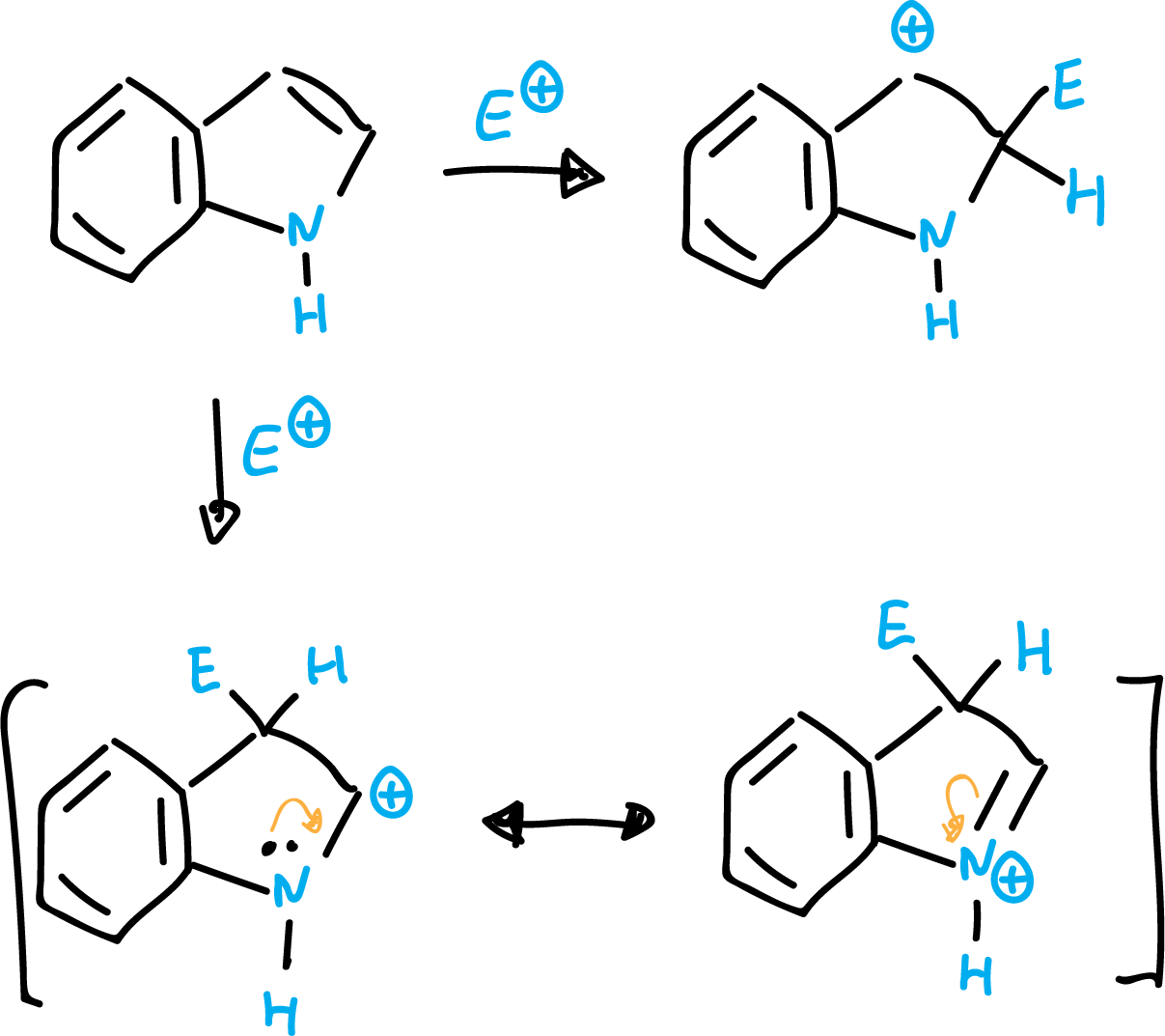
El indol es una base muy débil y el catión más estable resulta de la protonación en el carbono C3, más que en el nitrógeno.
Los indoles como sustituyentes alquilo en C3, también se protonan preferentemente en la posición 3 alquilada.
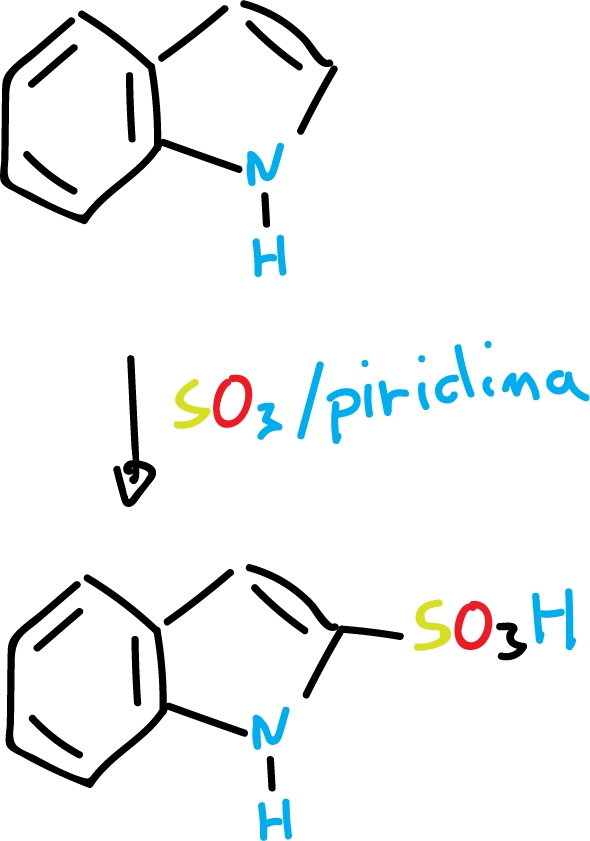
Por ejemplo, la reacción de sulfonación se lleva a cabo en condiciones suaves, usando SO3 y disolvente piridina, en C3, como se indica en el esquema.
Reacción de Mannich de indoles
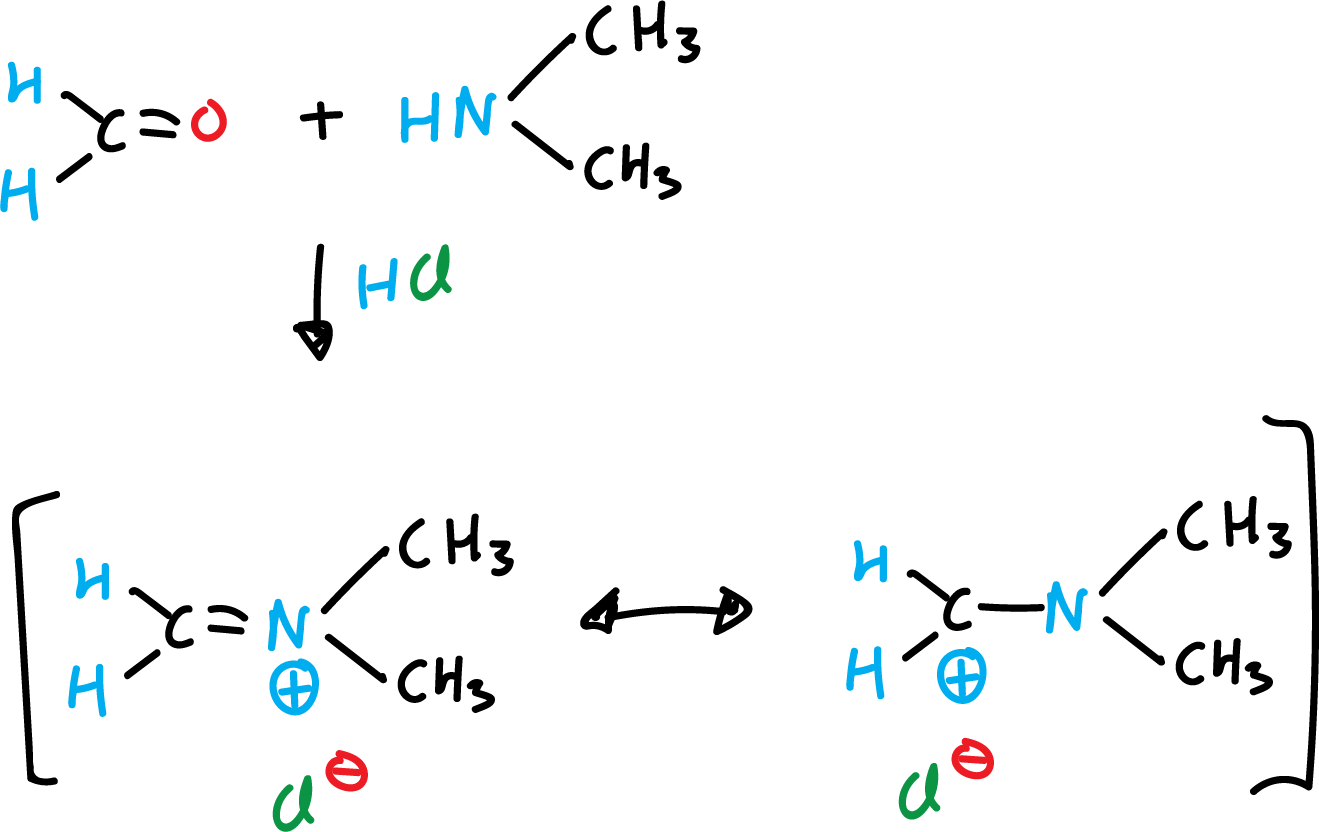
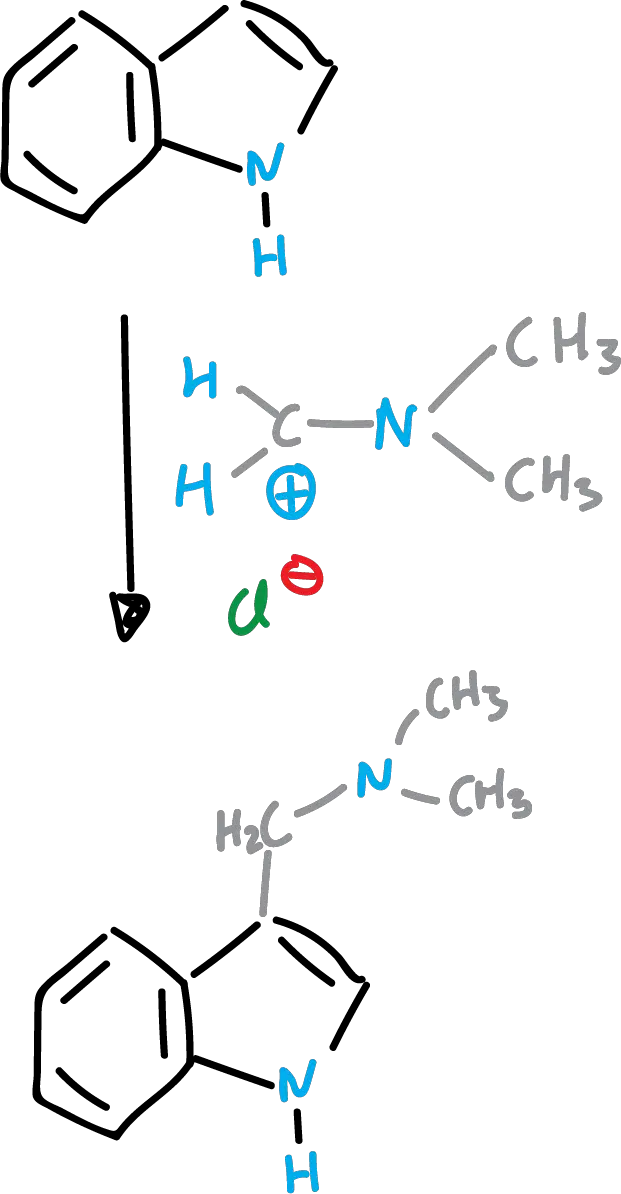
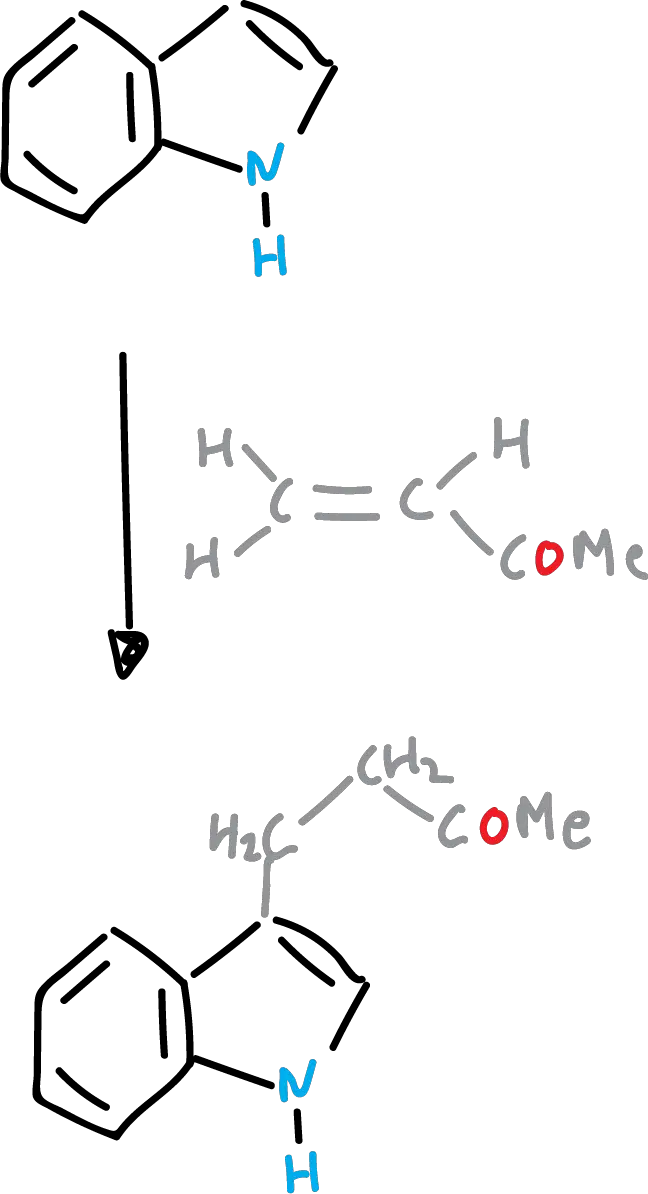
Reacción de Michael de indoles (o adición de Michael)
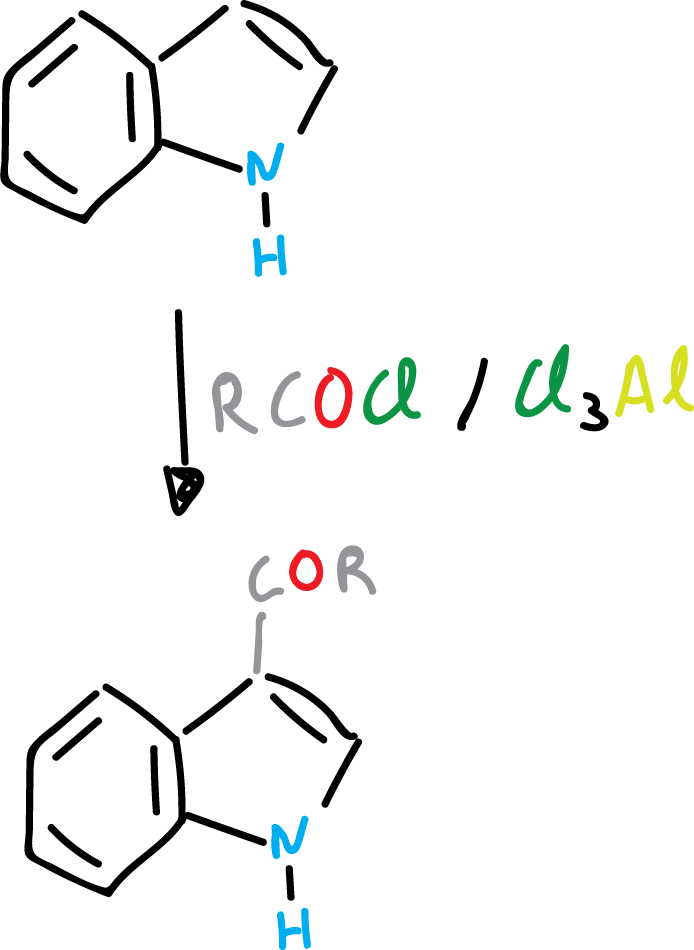
Reacción de Friedel-Crafts de indoles (o aciclación de Friedel-Crafts)
En la sustitución electrófila, puede ocurrir que la posición C3 del indol esté ocupada. Entonces, sigue siendo el heterociclo el que se sustituye y lo hace en la posición C2.
El mecanismo implica una sustitución en C3, dando lugar a un compuesto 3,3-disustituido que posteriormente migra. Si se lleva a cabo una metilación a fondo del indol el producto que se obtiene el el que se indica en la figura.
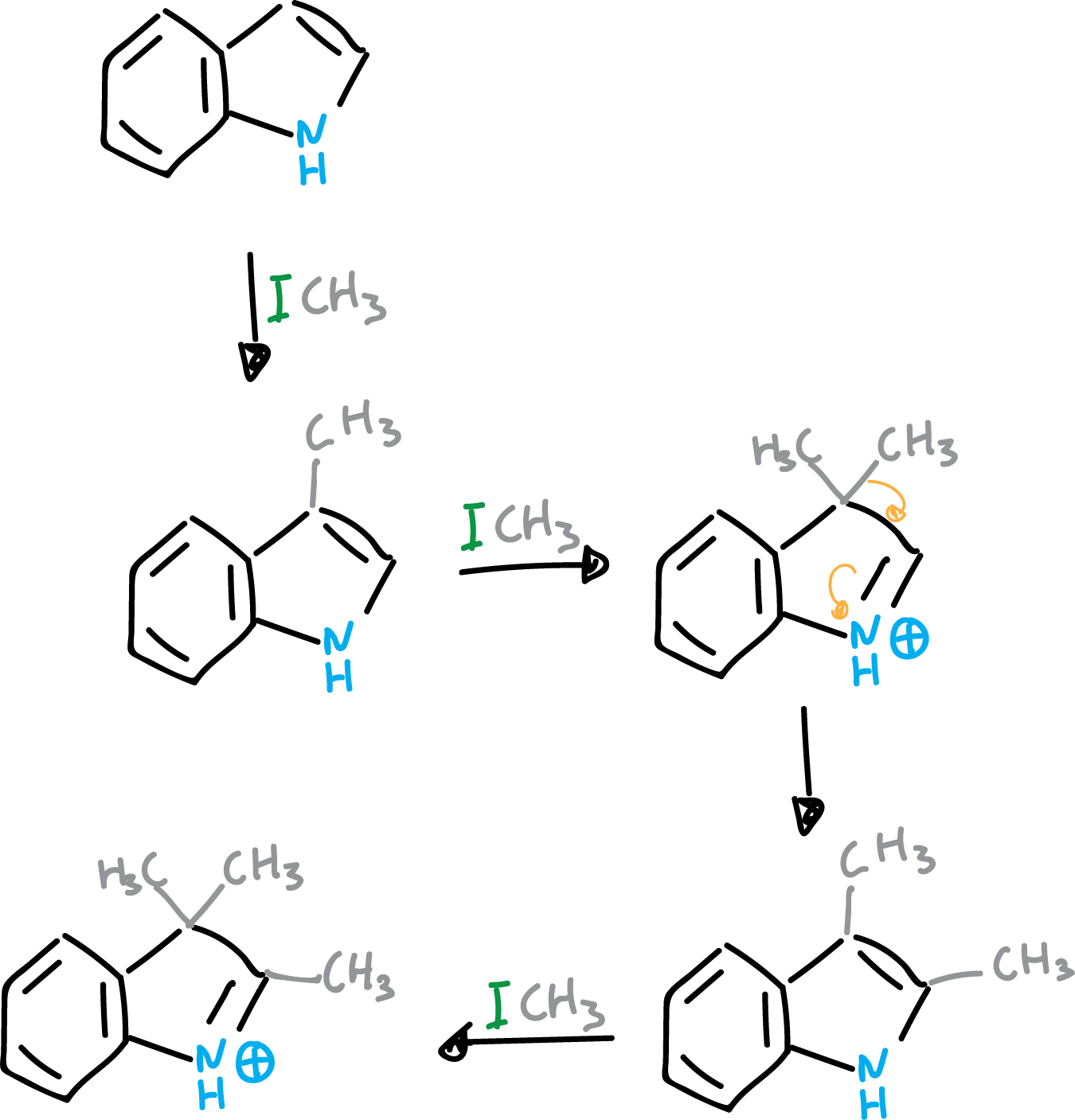
Cuando el indol presenta un sustituyente electrofílico, en el anillo heterocíclico (como por ejemplo –CHO), el anillo heterocíclico se desactiva. Entonces, se produce el ataque en el anillo bencénico.
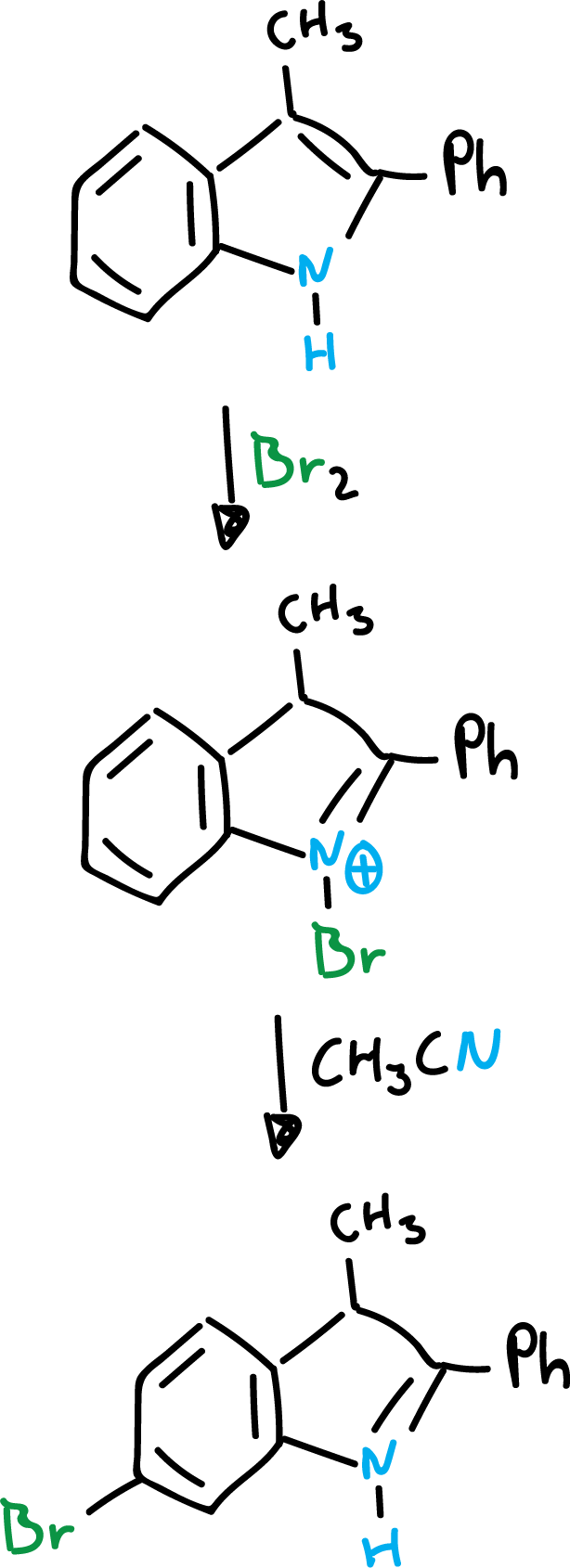
Por otro lado, cuando las dos posiciones del indol (C2 y C3) se encuentran bloqueadas, suele producierse una sustitución en el anillo bencénico, como se indica en el esquema.
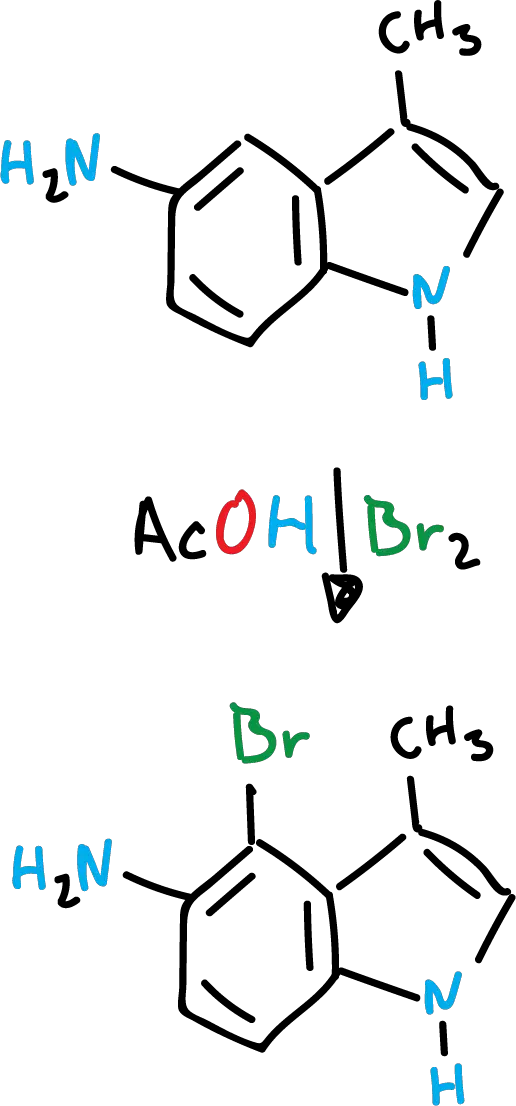
Finalmente, la presencia de una función amino o hidroxilo en el anillo de benceno, orientará exclusivamente al anillo de benceno, aunque las demás posiciones se encuentren vacías.
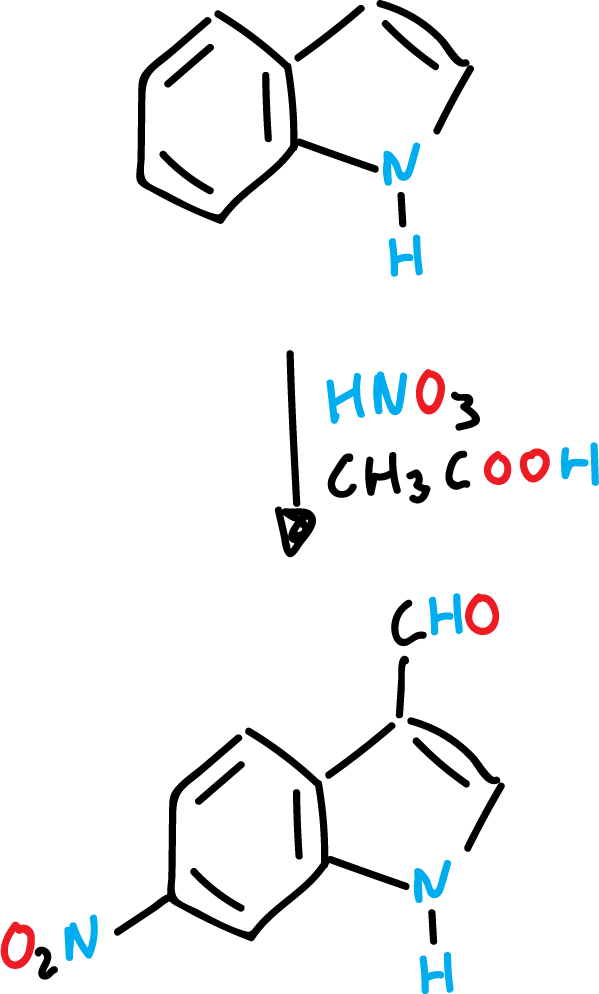
Nitración de indoles
La nitración del indol es muy sensible al medio de reacción. Así, con ácido nítrico (HNO3) concentrado y ácido acético (CH3COOH) glacial se forma el producto esperado en posición C3.
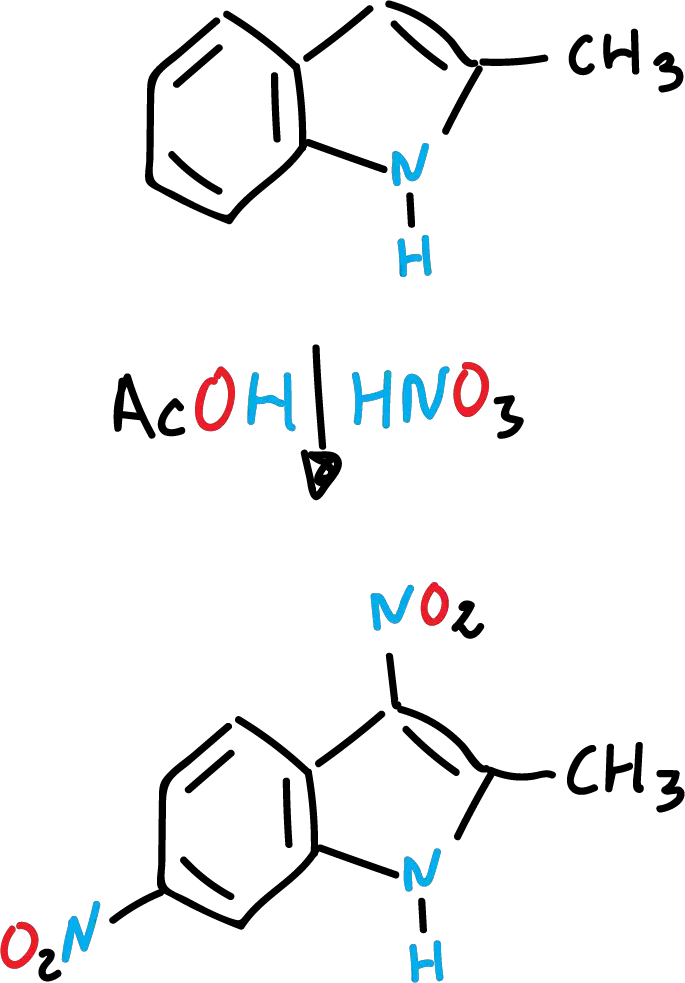
Sin embargo, en ácido sulfúrico (H2SO4), se produce casi exclusivamente derivados nitrados en posición C5 (en el anillo de benceno).
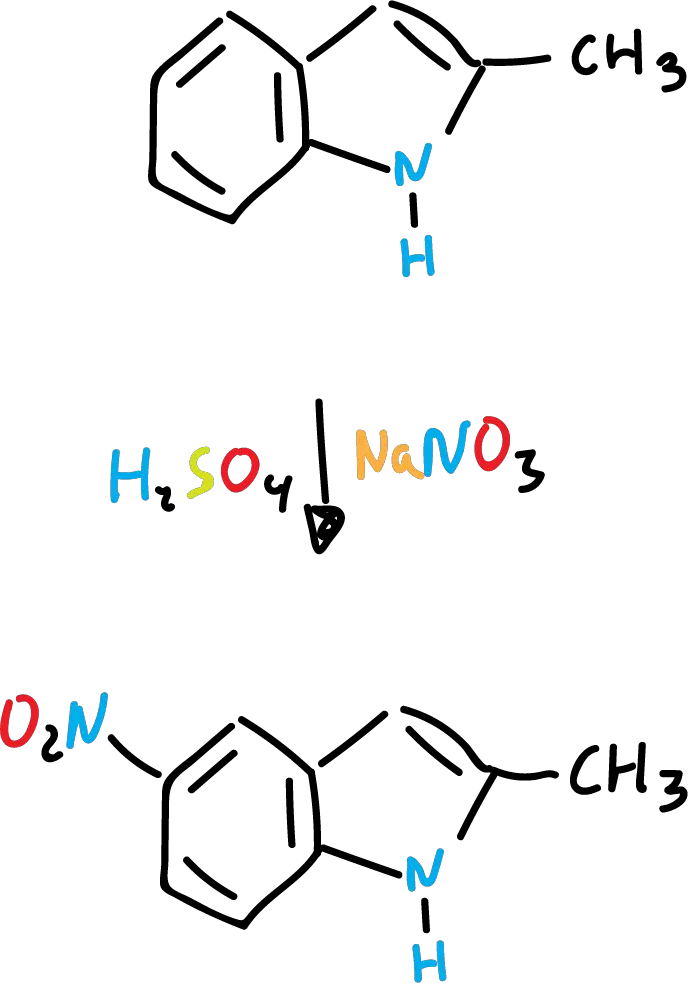
Una explicación posible sería que en el caso de la nitración se efectúa sobre el indol libre, mientras que con ácido sulfúrico, se lleve a cabo mediante un intermedio (ácido conjugado).
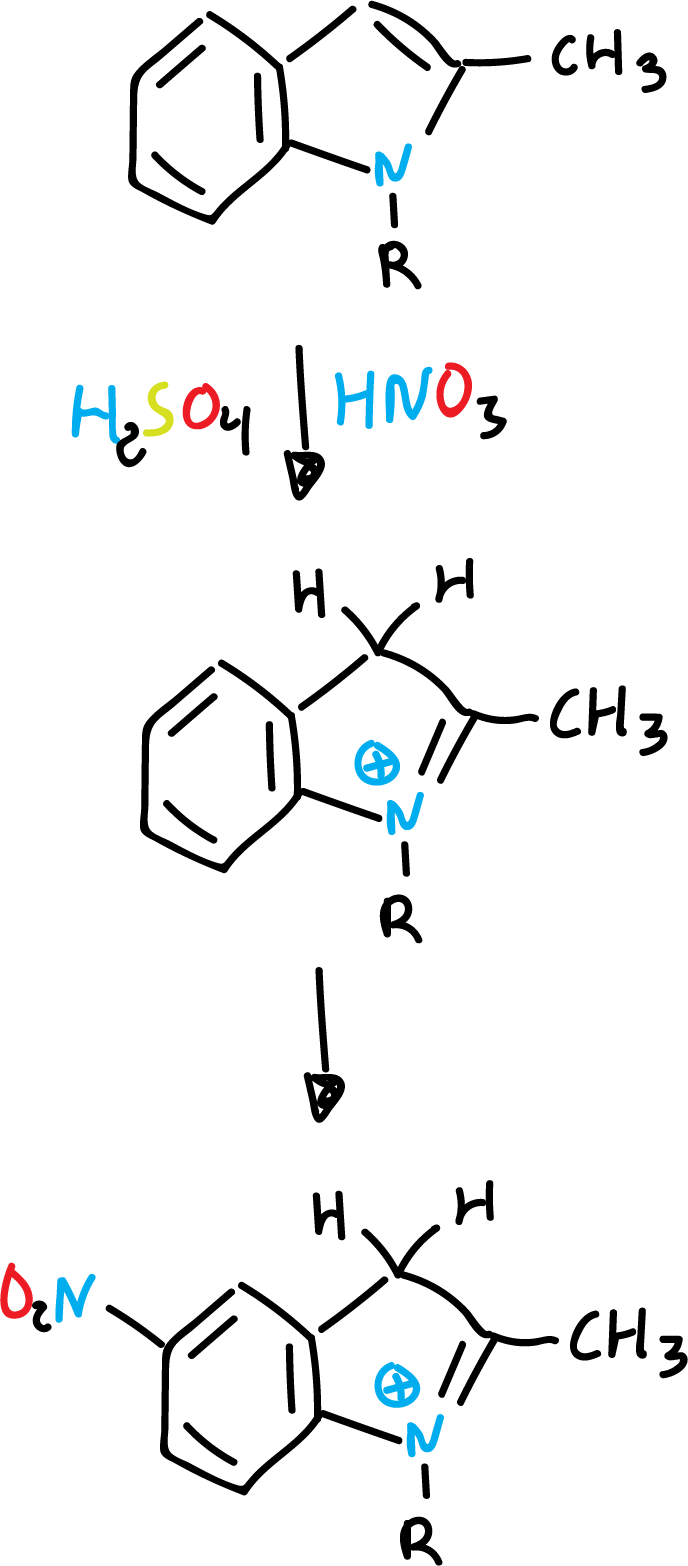
De esta forma, el heterociclo protonado está desactivado frente a electrófilos (E⊕).
Reacciones de autooxidación de indoles en medio básico
Sustitución electrófila o adición
La reacción se lleva a cabo en presencia de oxígeno y base fuerte como por ejemplo terbutóxido potásico (ButO⊖K⊕).
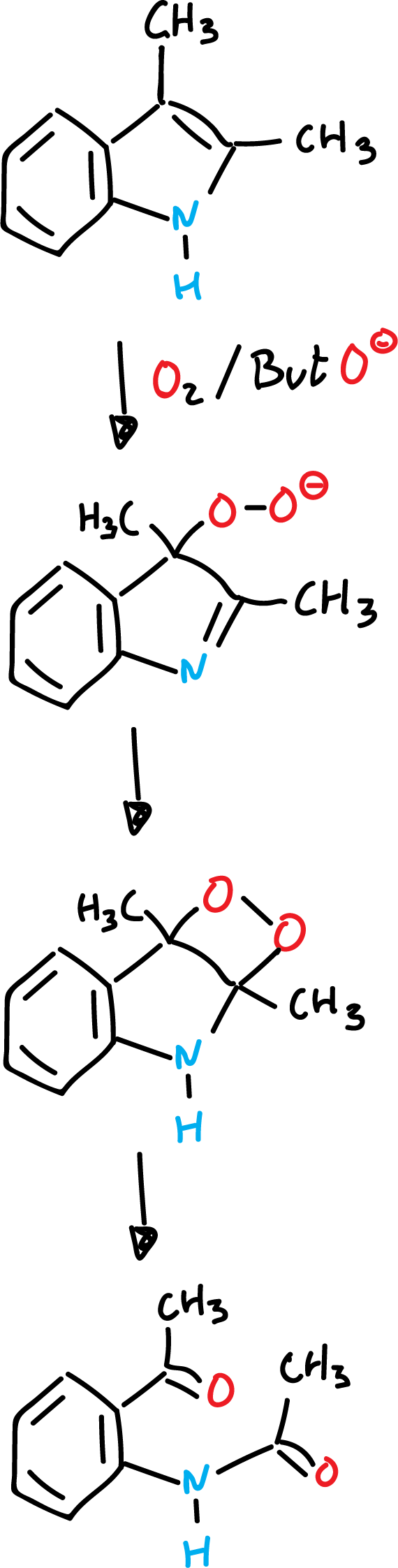
Cuando se abre el anillo dioxetánico en presencia de reactivos adecuados, se origina quimioluminiscencia.
Reacciones de adición
Cuando a los derivados de indol se les hace reaccionar con especies deficientes en electrones, como los carbenos, se puede llegar a producir la adición sobre el doble enlace C2=C3.
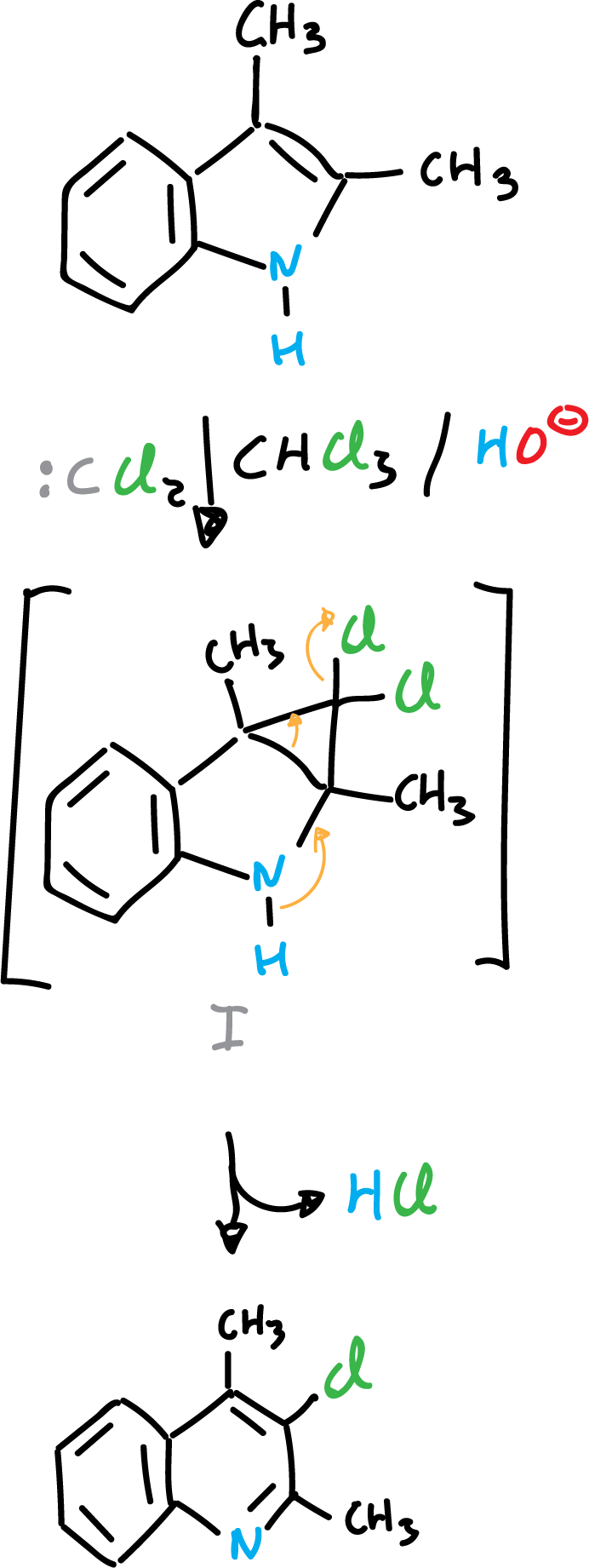
o bien la reacción transcurre hacia el siguiente producto:
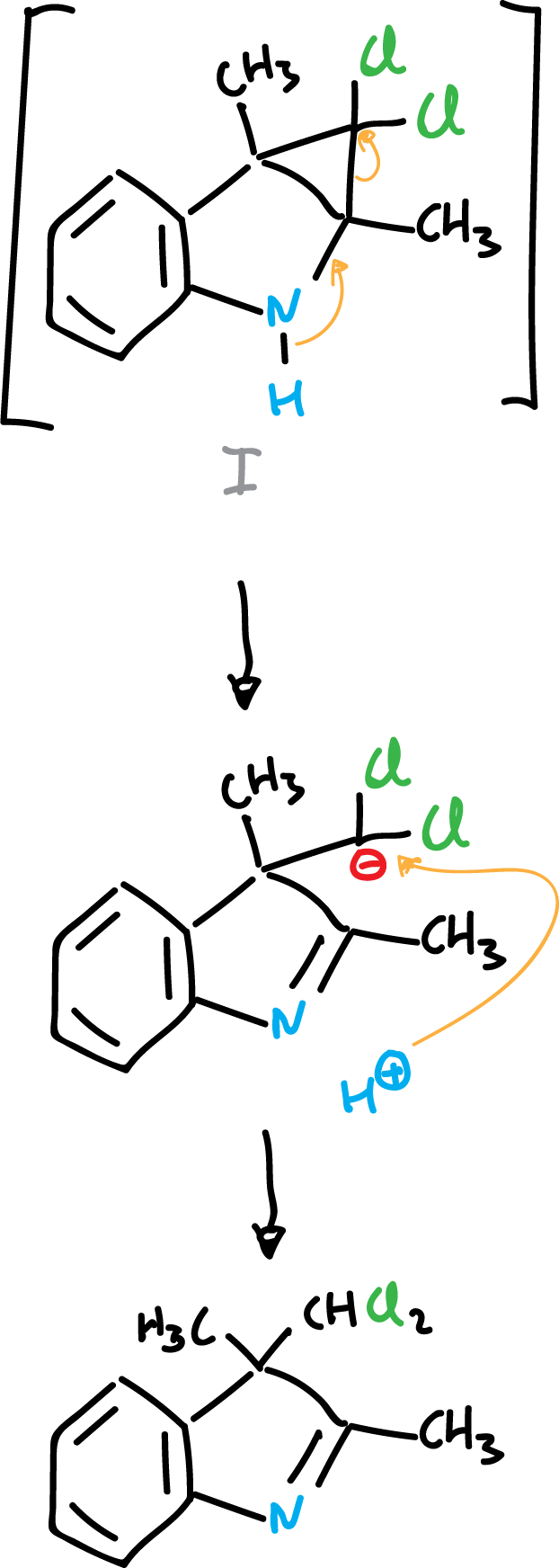
Propiedades de algunos indoles sustituidos
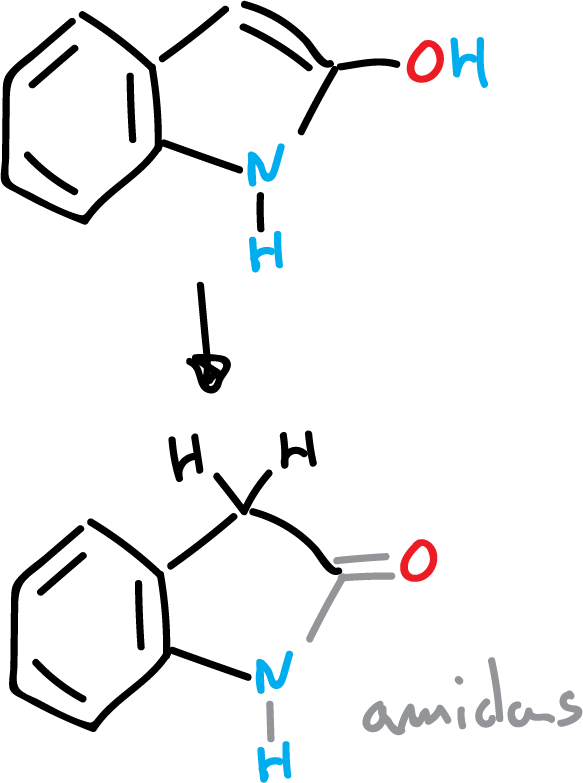
Los hidroxi-derivados en C2 y C3 de indoles, existen principalmente en la forma ceto.
Si el hidroxi-derivado esta en la posición C2 da lugar a amidas.
Sin embargo, si el hidroxi-derivado esta presente en posición C3, se obtiene el compuesto carbonílico denominado indoxilio.
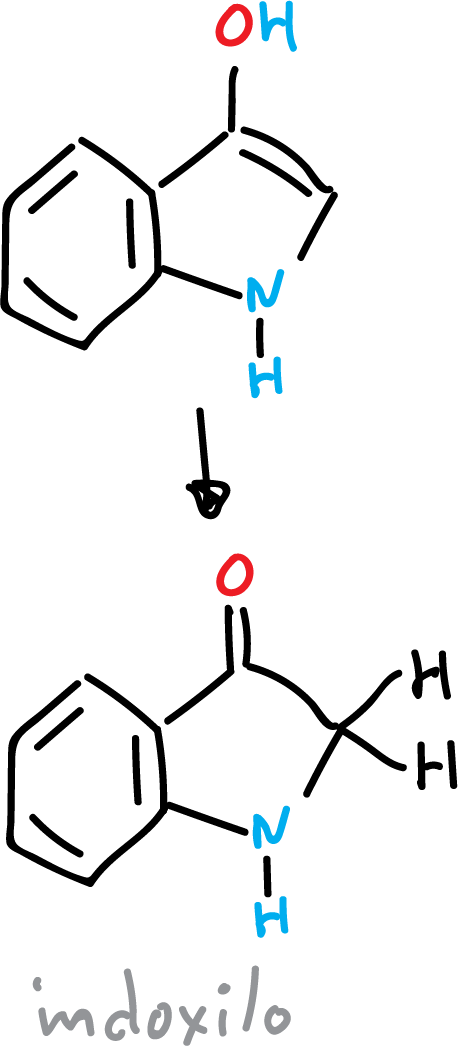
Los protones de los átomos de carbono adyacentes al grupo carbonilo son muy ácidos.
El indoxilo es muy inestable debido a su tendencia a formar un radical por extracción de un (H·).
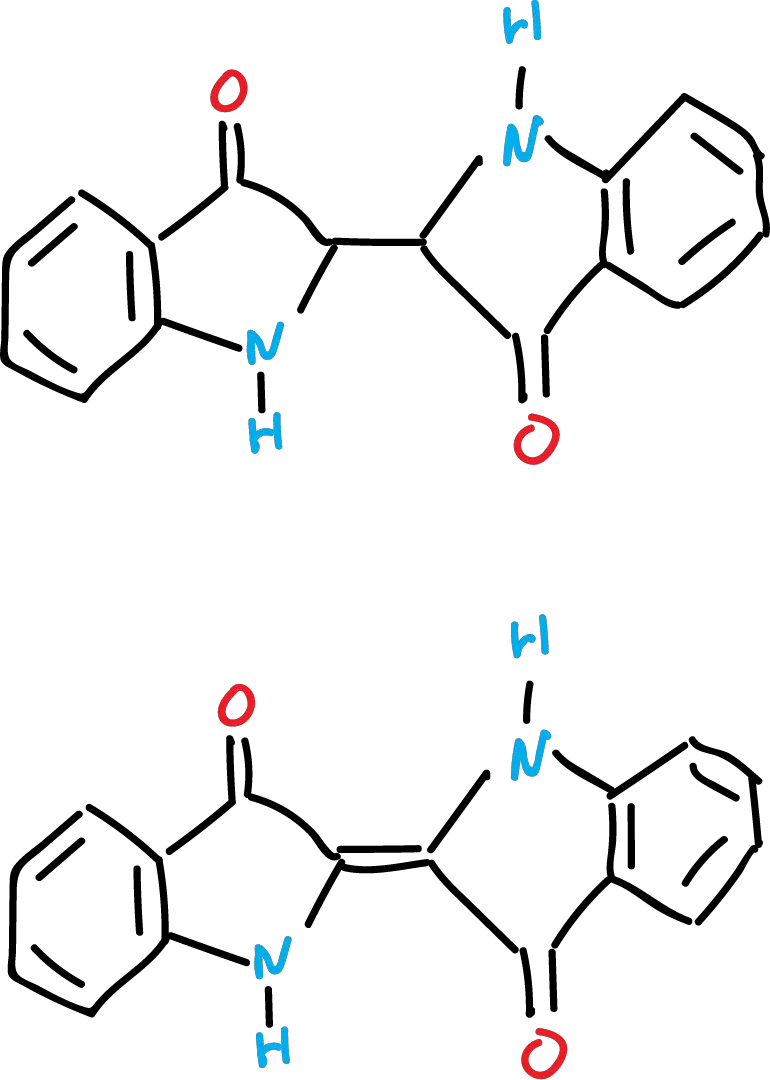
Estos radicales son relativamente estables y se acoplan para dar el dímero, que por posterior oxidación obtenemos el colorante índigo (de color azul).
Reactividad de 2-metil indoles
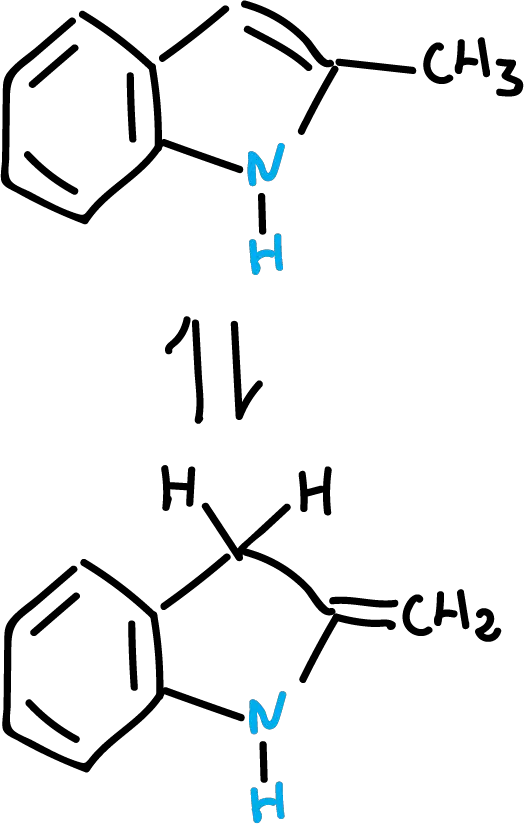
Los protones del metilo son más ácidos.
Además, el grupo metilo puede estar formando el siguiente equilibrio tautomérico.
Por otro lado, los ácidos carboxílicos de indol en posiciones C2 y C3, descarboxilan al calentarlos en disolución ácida. Además, en este caso la protonación en C3 favorece dicha reacción.
