Written by José | Last Updated on 2 meses
¿Qué son los isoxazoles, isotiazoles y sus benzoderivados?
El isoxazol e isotiazol son líquidos de punto de ebullición 95 y 113 ºC, respectivamente.
Índice

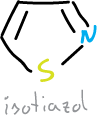
Existen varios isoxazoles naturales con actividad farmacológica importante, por ejemplo, el muscimol, que es un hongo (Amanita muscaria) con efectos psicotrópicos.
Se pueden dar dos tipos de isoxazoles e isotiazoles benzofusionados.
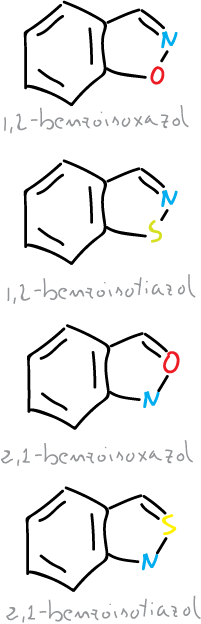
Así, se pueden considerar a los sistemas monocíclicos y sus benzoderivados como aromáticos, pero todos ellos tienen un enlace N—X débil, que es un centro de apertura potencial del anillo.
Síntesis de anillos
Se han descrito dos métodos principales para sintetizar estos anillos:
- Reacción de la hidroxilamina (NH2OH) con un componente de 3 átomos de carbono, como una 1,3-dicetona o una acetona α,β-insaturada.
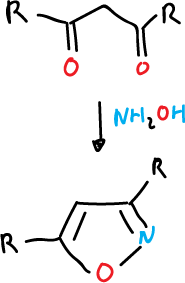
Este método de síntesis no se utiliza para isotiazoles ya que la tiohidroxilamina (NH2SH) no se encuentra disponible. Así, su equivalente mas cercano es la tiohidroxilamina-5-sulfonato de potasio.
Reacciona con el aldehído propargílico en el grupo carbonilo para dar una tioxima protegida intermedia que puede ciclar a isotiazol.
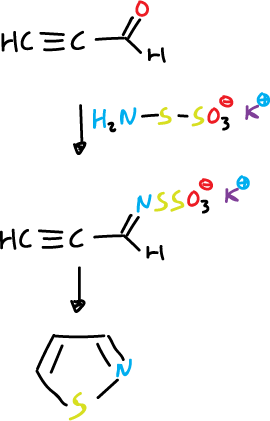
- Reacción de un óxido de nitrilo con un alqueno (C=C) o alquino (C≡C), generalmente, el oxido de nitrilo se produce in situ.
Los que tienen sustituyentes arilo, generalmente son aislables.
Se han descrito dos rutas para preparar óxido de nitrilo in situ y capturarlo.
a) A partir de aldoximas, se cloran en la posición α y la α–cloro oxima obtenida produce los óxidos de nitrilo al reaccionar con una base, que por lo general es trimetilamina.
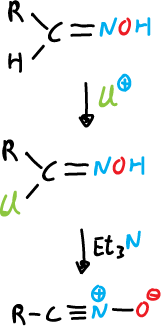
b) A partir de nitroalcanos por tratamiento con isocianato de fenilo.
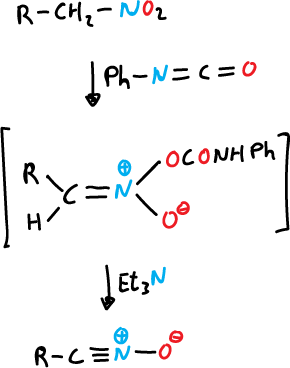
Una vez obtenido el óxido de nitrilo se le hace reaccionar con alquinos.
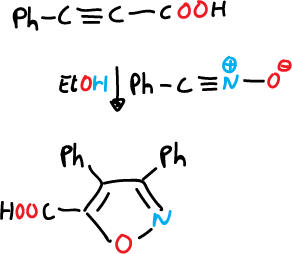
Otra reacción de este tipo que implica una adición tipo Michael se describe a continuación.
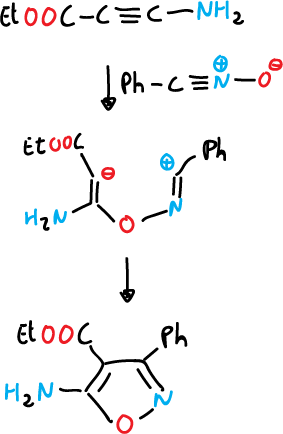
Las reacciones de cicloadición 1,3-dipolar de sulfuros de nitrilo, se pueden utilizar para la síntesis de isotiazoles, pero es una reacción más limitada.
Las rutas más importantes de síntesis de isotiazoles se basan en reacciones de ciclación en las que se puede formar el enlace N1—C5. El ataque nucleófilo puede ocurrir en el azufre cuando presenta un buen grupo saliente. Algunos ejemplos de esta reacción son:
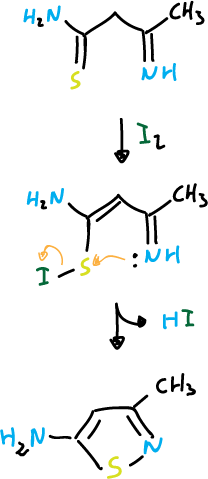
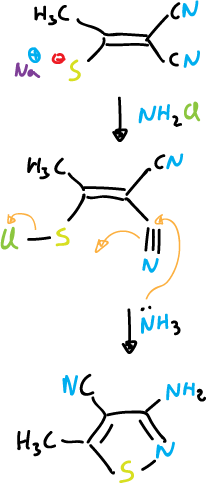
Otro ejemplo sería:
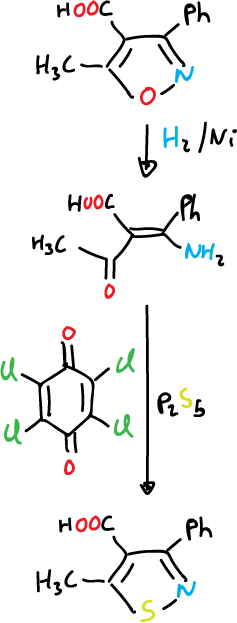
También se pueden preparar isotiazoles a partir del isoxazol, por apertura reductiva seguida de conversión a tioamida y ciclación oxidativa.
Síntesis de los sistemas benzofusionados
Para preparar los sistemas benzofusionados de isoxazoles e isotiazoles, se parte de bencenos orto- sustituidos convenientemente.
Para isoxazoles se realiza de la siguiente forma:
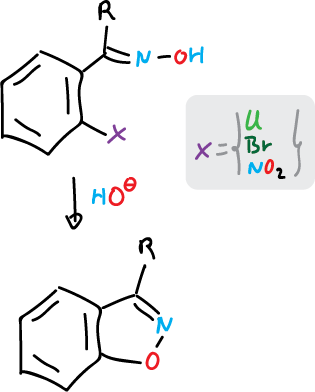
y para isotiazoles: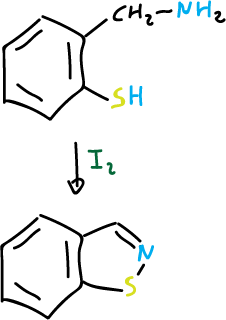
También, se pueden sintetizar a 1,2-benzisoxazoles por termólisis de 2-azidoarilcetonas.
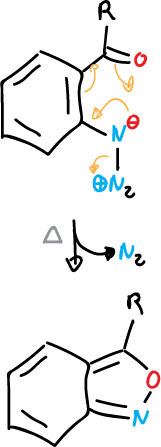
Este es un ejemplo general en el que ciclan azidas de arilo con sustituyente orto- con pérdida de nitrógeno.
Además, si esta reacción se lleva a cabo con 2-azidotiocetonas y se obtienen 1,2-benzisotiazoles.
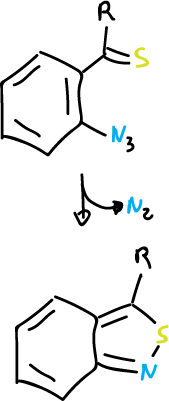
Reacciones
Una reacción muy característica es la fácil rotura del enlace N—O de los oxazoles. Los métodos generales de rotura son:
- Reducción catalítica para dar amidas de vinilo.
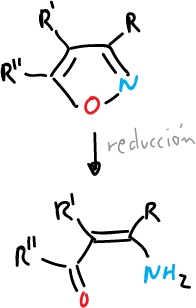
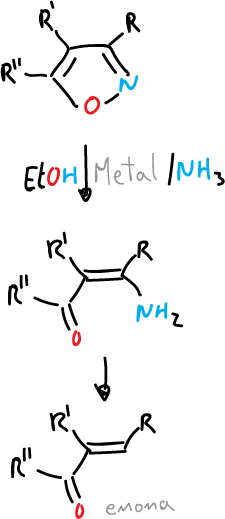
- Reducción con metal y amoniaco para dar β-aminocetonas y enonas.
- Apertura de aniones 3-isoxazolilo para dar α-cianocetonas.
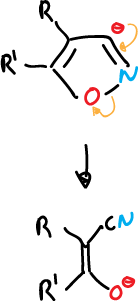
Los isoxazoles no sustituidos en la posición C3 se desprotonan con facilidad en C3 con iones hidroxilo. Así, los ácidos isoxazol-3-carboxílicos se abren por calentamiento, a través del mismo tipo de mecanismo.
La apertura de sales de isoxazolio no sustituidas en la posición C3 es bastante fácil.
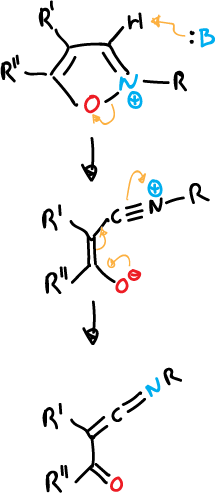
Se ha hecho uso de sales de isoxazolio como reactivos para acoplamiento de péptidos.
En los benzisoxazoles ocurren reacciones similares de apertura de anillo.
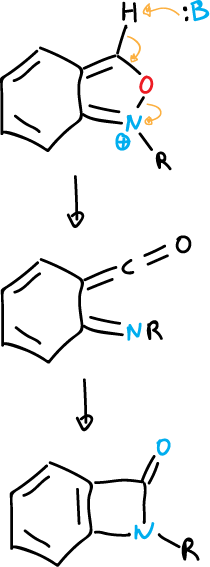
Los isotiazoles, también, se desprotonan en C5. Además, cuando la posición C5 se encuentra bloqueada se puede formar el anión 3-isotiazólico que sufre el mismo tipo de apertura que el isoxazol.
El átomo de azufre de los isotiazoles puede eliminarse reductivamente por hidrogenolisis empleando niquel Raney.
Reacciones de sustitución electrófila
Tanto los isoxazoles como los isotiazoles pueden sufrir esta reacción y se sustituyen preferentemente en el carbono C4.
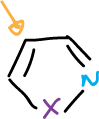
Los grupos alquilo en las posiciones C3 y C5 se hallan ligeramente activadas y se pueden desprotonar con bases fuertes.

