Índice
¿Qué son los oxazoles y tiazoles?
El oxazol y el tiazol son heterocíclos que están muy relacionados con el furano y tiofeno. El sistema anular del oxazol casi no se encuentra en la naturaleza y no tiene derivados naturales importantes.
En cambio el tiazol es muy frecuente en los productos naturales, por ejemplo, la vitamina B1 (tiamina) contiene un anillo de piridina y otro de tiazol.
Los 2,5-diaril oxazoles son fluorescentes en alto grado y se emplean, comercialmente como solutos en líquidos de centelleo y como agentes de blanqueo.
Estos sistemas se pueden considerar como aromáticos aunque los enlaces del oxazol están más localizados los del tiazol según los datos de las longitudes de enlace.
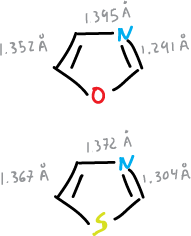
Igual que ocurria con el furano, tiofeno y pirrol, aquí el heterociclo oxigenado es el menos aromático que el tiazol e imidazol y muestra más carácter de dieno.
Así los oxazoles activados (ricos en electrónes) participan en la reacción de Diels-Alder con dienófilos deficientes en electrones, mientras que los tiazoles lo hacen raramente.
Sin embargo, el que el oxazol sea menos aromático no quieren decir que sea inestable. Algunos diariloxazoles son muy estables al calor y se les ha recuperado intactos después de calentarlos a 400 ºC.
Síntesis de los anillos de oxazol y tiazol
Algunos de los métodos básicos son análogos a la síntesis de furanos y tiofenos.
Síntesis de Paal-Knorr
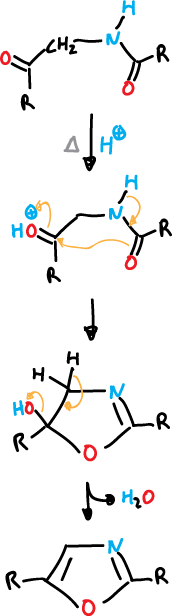
La síntesis de Paal-Knorr se basa en la ciclación de compuestos 1,4-dicarbonílicos con funciones apropiados.
Para el oxazol quedaría
y para el tiazol se utiliza P2S5
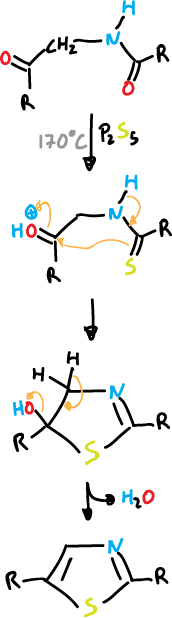
A partir de compuestos α-halocarbonílicos haciéndolos reaccionar con los reactivos adecuados.
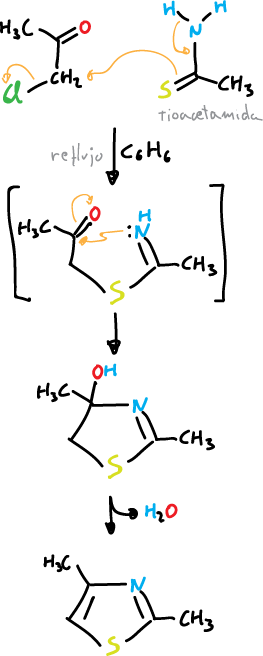
Para el tiazol la sintesis quedaría:
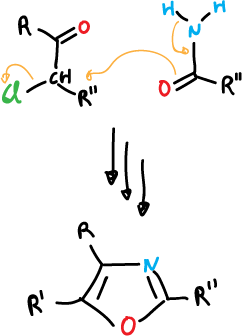
Y para el oxazol:
Otro procedimiento general es mediante reacciones de adición [4+2] del tipo 1,3-dipolar.
Los compuestos generalmente tienen un triple enlace R—C≡C—R o R—C≡N, pero también puede utilizarse olefinas.
Generalmente, tanto unos como otros, suelen tener uno o mas atrayentes de electrones y generalmente distintos.
Reacciones
El oxazol es una base muy debil y sus sales son inestables. Se han formado sales de N-alquil oxazolio de varios oxazoles sustituidos y es posible cuaternizar los tiazoles en el nitrógeno diversos agentes alquilantes.
Estas sales pueden sufrir con facilidad intercambio hidrógeno-deuterio en C2 y en el proceso se generan como intermedios los iluros.
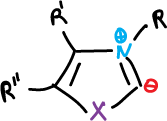
La velocidad de intercambio es mayor para los sales de oxazolio, pero los iluros de tiazolio son más estables debido a la capacidad del azufre para estabilizar el carbanión.
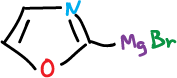
Los oxazoles y tiazoles neutros también se desprotonan de manera preferente en C2 por bases fuertes. Se litia también por reacciones con fenil-litio a -60 ºC.
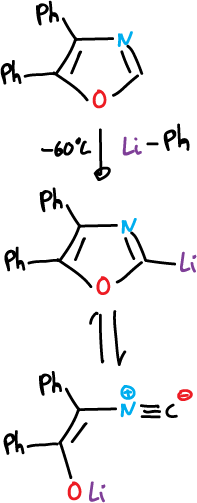
Este compuesto litiado es inestable y se abre el anillo para dar el isonitrilo.
Los grupos alquilo en posición C2 pueden perder protones y los aniones resultantes pueden reaccionar con reactivos.
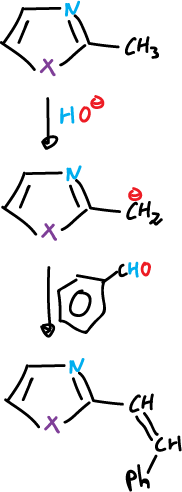
Reactivos electrófilos
La entrada de un nitrógeno en el heterociclo disminuye la facilidad del ataque de los reactivos electrófilos. Esta desactivación es mayor en aquellas reacciones que necesitan medio ácido, como por ejemplo, nitración, sulfonación y reacciones Friedel-Crafts.
Los electrófilos atacan a oxazoles y tiazoles en posición C5 preferente y luego en C4.
El oxazol no sufre ataque electrófilo con facilidad a menos que tenga sustituyentes electrón donantes. Los sustituyentes, en general, actúan de la misma forma que en el benceno.
Si el anillo tiene un sustituyente fuertemente desactivante, la nueva sustitución no tiene lugar.
Si la posición idónea, para la sustitución, está ocupada los sustituyentes fuertemente activantes la facilitan a otras posiciones.
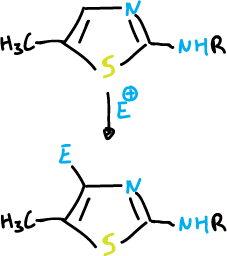
Los oxazoles y tiazoles con un grupo saliente en posición C2 reaccionan con los nucleófilos para dar productos de desplazamiento.
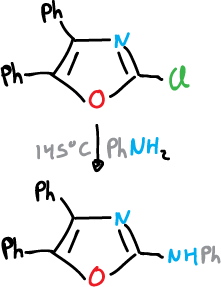
Para los tiazoles la reacción es la siguiente.
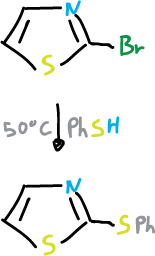
El tiazol sufre una aminación nucleófila en posición C2 que es análoga a la reacción de Chichibabin de la piridina.
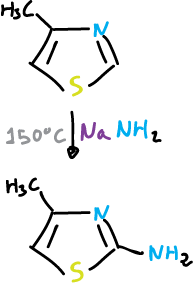
Una de las reacciones más relevantes del oxazol es la de Diels-Alder, típica de dieno. Un grupo electrón donante (etoxilo) facilita la reacción con dienófilos.
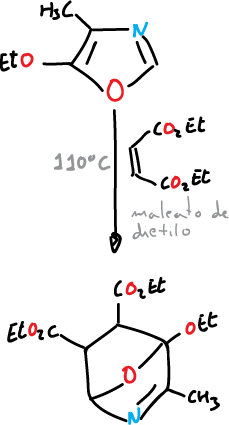
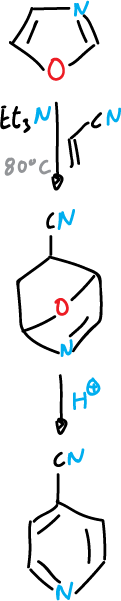
Esta reacción ofrece una buena ruta para síntesis, por ejemplo, piridinas.
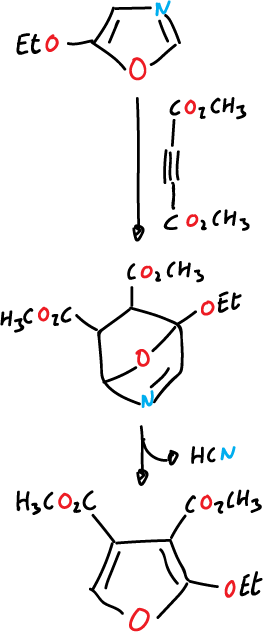
Cuando el dienófilo es acetilénico llegamos al furano.
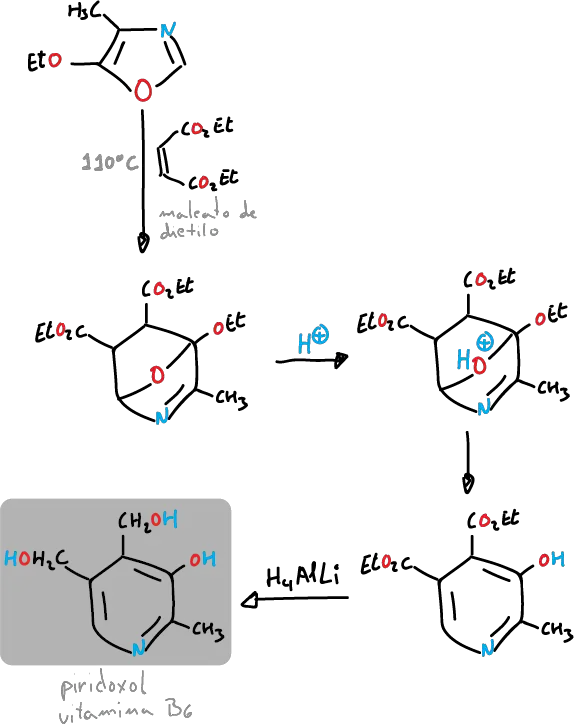
y también se puede emplear para la síntesis del piridoxol (vitamina B6).
Fotooxigenación
La fotooxigenación en oxazoles implica la adición de oxígeno singlete entre las posiciones C2 y C5. La forma de descomposición del endoperóxido inestable depende del disolvente, pero es posible aislar las tiamidas a partir de oxazoles trisustituidos.
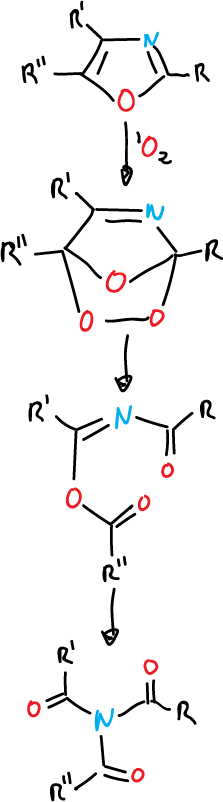
Los tiazoles trisustituidos reaccionan de la misma forma con el oxígeno singlete.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
