Índice
¿ Qué son los pirazoles, triazoles y tetrazoles?
Los derivados de pirazoles, triazoles y tetrazoles son compuestos aromáticos estables. Muchos de ellos han sido utilizados como productos farmacéuticos, colorantes y plaguicidas.
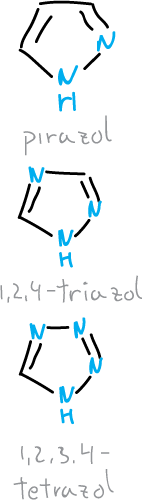
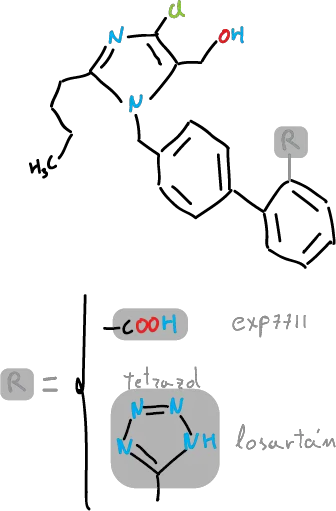
Los tetrazoles son relevantes en la química medicinal. Esto es debido a que el grupo tetrazol se comporta similar a los ácidos carboxílicos. Ambos sistemas son planos, presentan pKa comparables (el del tetrazol es ligeramente mayor) y en ambos la densidad electrónica está deslocalizada. Cuando dos grupos son intercambiables en fármacos sin cambiar sus propiedades biológicas se les denomina bioisósteros. Se pueden diseñar compuestos con tetrazoles análogos de aminoácidos y de ácidos carboxílicos naturales.
Por ejemplo, en el caso del hipertensivo losartán y el derivado con el grupo ácido carboxílico correspondiente (Exp7711):
Las síntesis de los anillos se pueden realizar tanto por reacciones de ciclación como de cicloadición.
Síntesis de anillos de pirazoles
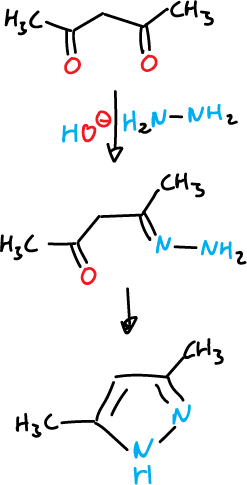
La ruta más general de síntesis es la reacción de compuestos 1,3-dicarbonílicos o equivalentes con hidrazinas.
Por ejemplo, a partir de pentano-2,4-diona e hidrazina se obtiene el 3,4-dimetil-pirazol.
Otro método de obtención de pirazoles es mediante reacción de α-halocetonas con hidrazinas del tipo XC(S)-NH–NH2 (donde X = SR o NR2).
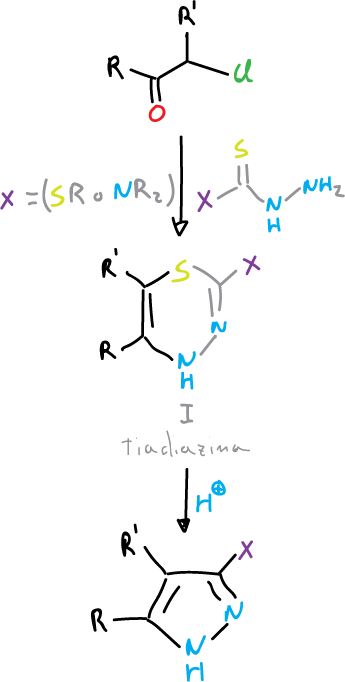
Se produce la tiadiazina como intermedio (I), ye esta ya sea de forma espontánea o bien por tratamiento con ácido, desprende azufre para dar pirazoles con buen rendimiento.
Otro método de síntesis de pirazoles se consigue mediante la ciclación de hidrazonas acetilénicas.
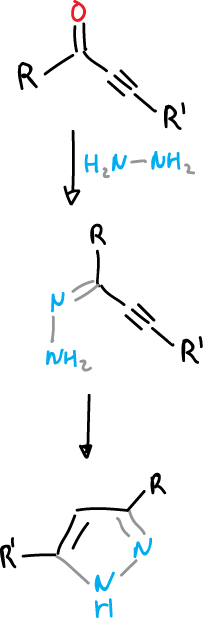
También se pueden llevar a cabo síntesis de pirazoles por electrocilación de diazocompuestos insaturados.
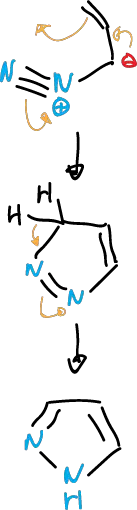
Síntesis de anillos de 1,2,4-triazoles
Los métodos más importantes de síntesis de 1,2,4-triazoles se basan en la construcción y ciclación de estruturas con esqueletos: N—C—N—N y C—N—C—N—N.
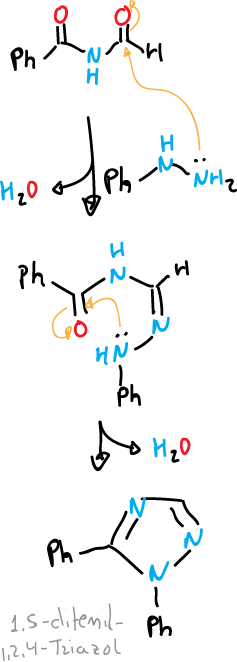
Un ejemplo del tipo N—C—N—N sería la reacción de Pellizzari, que consiste en la condensación térmica de una acilhidrazina con una amida o una tiamida.
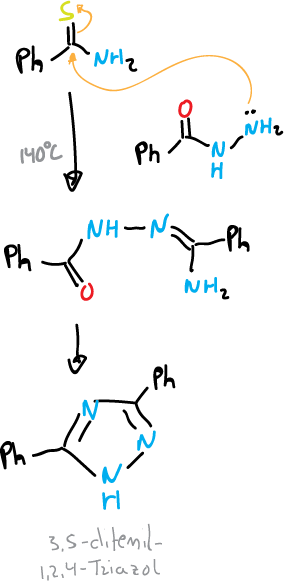
El segundo tipo C—N—C—N—N de reacción estaría representado por la reacción de Einhorn-Brunner. Esta reacción consiste en la condensación de una hidrazina o una hidrazina monosustituida con una diacilamina en presencia de un ácido débil. Se obtienen los 1,2,4-triazoles con buen rendimiento.
Síntesis de anillos de 1,2,3-triazoles
El método mas utilizado de síntesis de 1,2,3-triazoles es la cicloadición 1,3-dipolar de gran variedad de azidas orgánicas con acetilenos.
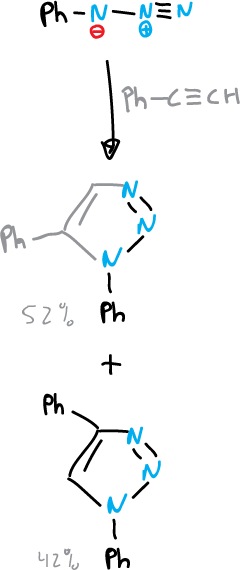
Síntesis de anillos de tetrazoles
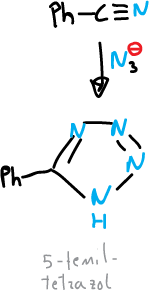
Normalmente, la síntesis de tetrazoles se realiza a partir de azidas, por adición a compuestos con enlace múltiple carbono-nitrógeno.
Por ejemplo, la síntesis del 5-fenil-tetrazol a partil de benzonitrilo y azida sódica.
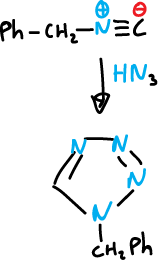
O también, la síntesis a partir de isocianuro de bencilo y ácido hidrazoíco en presencia de trazas de ácido sulfúrico.
Por otro lado, los tetrazoles 2,5-disustituidos se pueden obtener por reacción de amidrazonas con ácido nitroso.
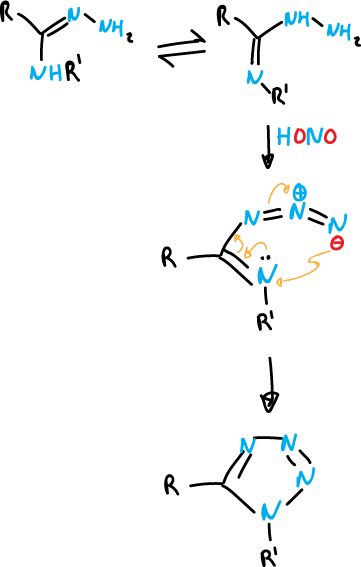
donde R es un grupo iminoalquil (R—NH—) y R‘ es (H).
Se favorece la ciclación del nitrógeno imínico de mayor densidad de carga.
Reacciones de pirazoles, tiazoles, tetrazoles
La química de estos azoles se aparta cada vez más de la del pirrol, conforme aumenta el número de átomos de nitrógeno.
Las reacciones de sustitución electrófila en el carbono son poco comunes. Esto es debido a que el número de átomos de carbono es menor y a que los electrófilos atacan preferentemente al nitrógeno.
Sustitución electrófila sobre un nitrógeno anular unido con enlace múltiple
En los azoles que contienen dos átomos de nitrógeno anulares, el nitrógeno imínico (=N) es atacado fácilmente por electrófilos y, generalmente, el ataque va seguido de la perdida del protón del otro nitrógeno (>N—H).
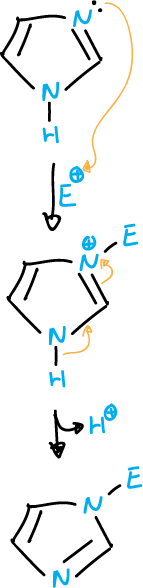
Como el reactivo electrófilo ataca al átomo de nitrógeno unido con enlace múltiple (resaltado con flechas ⇒ en el esquema).
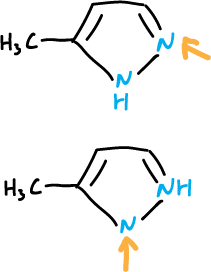
La orientación de la sustitución está relacionada con la estructura del tautómero de partida.
Sin embargo, hay que considerar, también, que con independencia a los porcentajes de las formas tautoméricas, si una de ellas reacciona más rápidamente este puede controlar la reacción.
Los pirazoles se alquilan fácilmente con yodometano (CH3I) o sulfato de metilo (CH3SO4). Generalmente, los compuestos asimétricos son una mezcla de productos cuya composición de pende de las condiciones.
El pirazol se puede bromar en la posición C4 en condiciones suaves.
El 4-nitro pirazol se puede preparar también en forma directa a partir del pirazol.
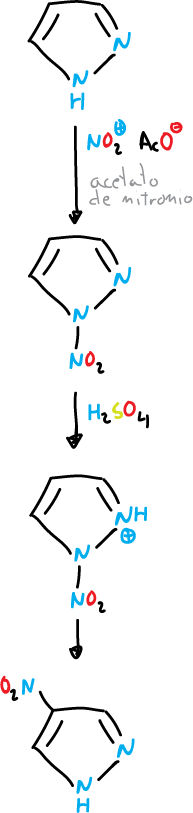
El 1-nitro pirazol es un agente nitrante eficaz de hidrocarbutos aromátios en presencia de ácidos.
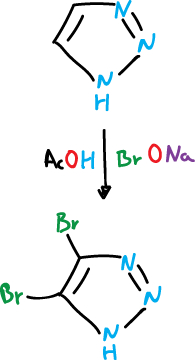
El 1,2,3-triazol, por tratamiento con hipobromito sódico (BrONa) en ácido acético (AcOH), se convierte en el 4,5-bromo derivado.
El 1,2,4-triazol se clora en el carbono C3.
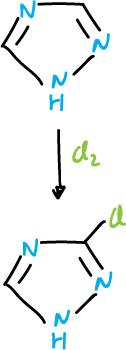
A partir de azoles N-sustituidos y agentes alquilantes, se pueden formar sales cuaternarias, por ejemplo, 1-metil-1,2,4-triazol se metila sucesivamente en N4 y N2 con un exceso de tetrafluoroborato de trimetiloxonio.
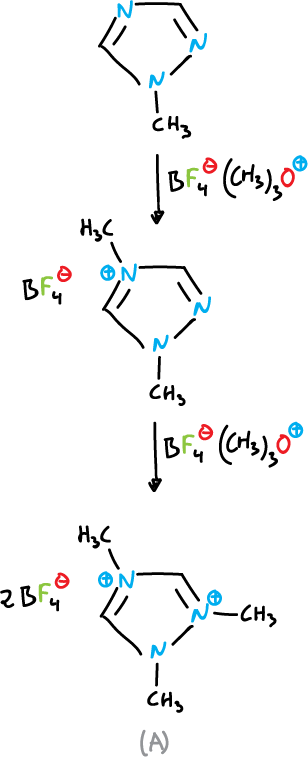
La sal dicuaternaria (A) se puede aislar como un sólido cristalino.
Sustitución nucleófila
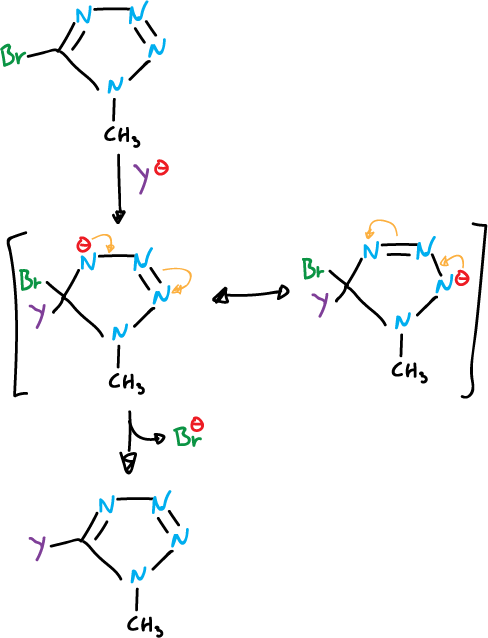
En varios azoles ocurren reacciones de sustitución nucleófila con sustituyentes en el carbono, que son buenos grupos salientes 5-bromo y 5-cloro-tetrazoles 1-sustituidos.
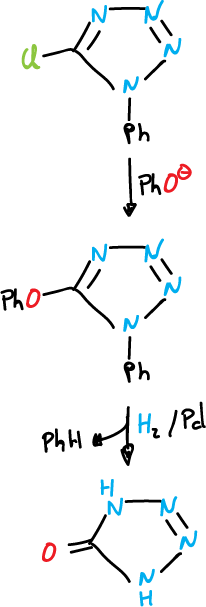
La reacción de 5-cloro-1-fenil tetrazol con fenoles catalizada con base conduce a la formación de éteres.
Los éteres se pueden romper en forma reductiva por tratamiento con hidrógeno y paladio (H2/Pd). Este es un procedimiento útil para desoxigenar fenoles.
La facilidad para desplazar haluros de estos azoles aumenta con la presencia de grupos electrón atrayentes adicionales en los átomos de carbono del anillo o por cuaternización del nitrógeno.
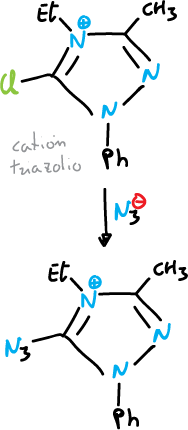
Apertura del anillo
Algunos 1,2,3-triazoles y tetrazoles se rompen por calentamiento.
La tautomería anillo-cadena es común en el caso de los tetrazoles 1,5-disustituidos.
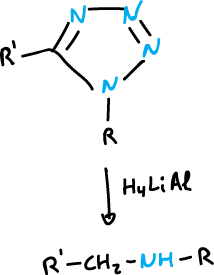
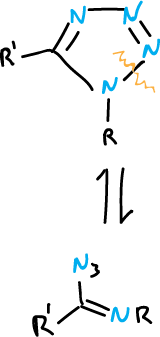
También, ocurre con más dificultad en los 1,2,3-triazoles sustituidos en la posición N1.
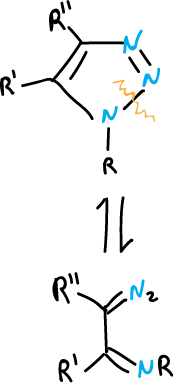
La apertura del anillo se facilita cuando hay grupos electrón atrayentes en la posición N1. Los tautómeros de cadena abierta pueden ciclarse de manera reversible, o también transponerse o sufrir otras reacciones en las que pierden nitrógeno. Esto ocurre dependiendo de la naturaleza de los sustituyentes y de las condiciones de reacción.
Un ejemplo del primer caso es la transposición de Dimroth, que tienen lugar cuando se calientan tetrazoles o 1,2,3-triazoles con un sustituyente amino en la posición C5.
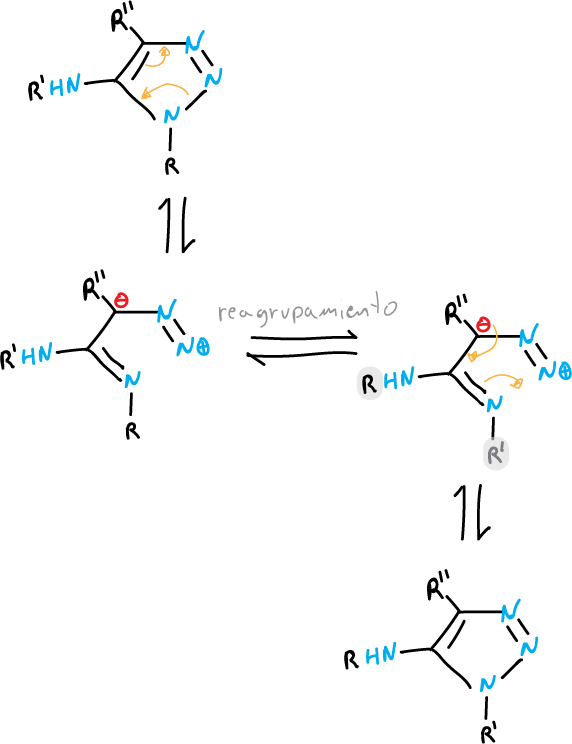
La posición del equilibrio está influida por la naturaleza de los sustituyentes y el pH del disolvente.
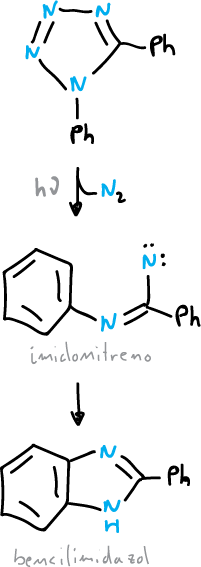
La acción del calor (Δ) o de la luz (hν) puede provocar la expulsión del nitrógeno de los tetrazoles y de los 1,2,3-triazoles.
Una aplicación importante de esta reacción es el empleo de cloruro de tetrazol-5-diazonio como fuente de átomos de carbono.
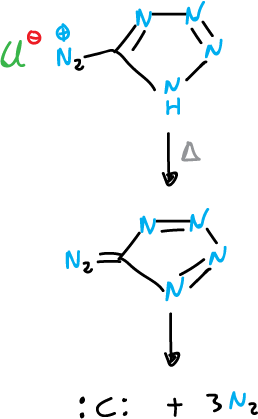
La reacción se hace en presencia de reactivos capaces de interceptar el carbono monocíclico que se produce.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
