Written by J.A. Dobado | Last Updated on 1 año
¿Qué son los imidazoles?
Los imidazoles son heterociclos nitrogenados, con dos nitrógenos en posiciones 1 y 3. Son planos y presentan una apreciable energía de resonancia, esta algo mayor que la del pirrol.
Índice
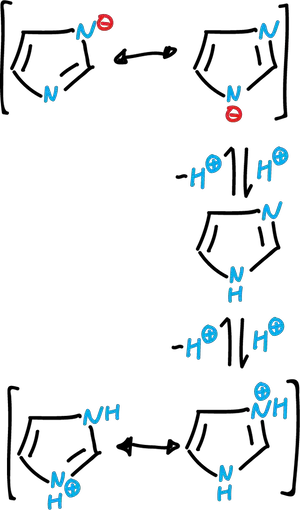
El sistema imidazólico puede actuar como base y como ácido. El imidazol libre es una base orgánica moderadamente fuerte (pKa 7.0). También, puede actuar como ácido débil (pKa 14.5). Tanto el catión como el anión poseen estructuras deslocalizadas simétricas.
Síntesis de imidazoles por ciclación de compuestos 1,4-dicarbonílicos
La síntesis de imidazol se lleva a cabo entre compuestos 1,4-dicarbonílicos y funciones apropieadas. Este proceso es análogo a la síntesis de Paal-Knorr de pirroles.

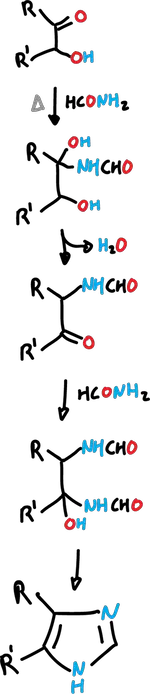
Reacción de Bredereck de formación de imidazoles
La reacción de Bredereck se realiza cuando una α-hidroxicetona (o α-halocetona) se calienta con formamida (HCONH2).
Síntesis de Mackwald
Se trata de la reacción de α-aminocetonas con tiocianatos (o isotiocianatos) para dar imidazol-2-tioles,
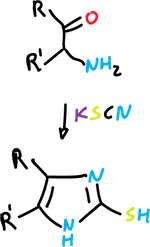
y con cianamida para dar 2-aminoimidazoles.
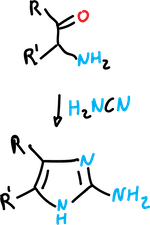
Reacciones de imidazoles
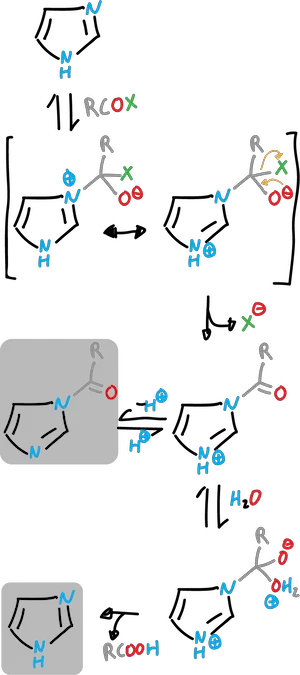
El imidazol es un nucleófilo excelente y puede raccionar con facilidad en el nitrógeno con agentes alquilantes y acilantes.
N-acilación
Se puede N-acilar imidazoles por tratamiento con haluro de acilo en un disolvente aprótico.
Los N-acilimidazoles son reactivos de «transferencia de acilo» muy útiles y su reactividad es comparable a la de los haluros o anhídridos de ácido.
Los acilimidazoles sufren reacciones típicas de adición-eliminación, por ejemplo, con alcoholes para dar ésteres, aminas para dar amidas y reactivos de Gridnard para dar cetonas.
También, el imidazol puede catalizar la hidrólisis de ésteres y otros acilderivados.
Con los acilderivados (R—COX) en que X es un buen grupo saliente, el imidazol actúa como nucleófilo atacando al grupo carbonilo.
N-alquilación
La N-alquilación se lleva a cabo en presencia de base. Esto se realiza de forma que la especie que se alquila es el anión.
Se puede emplear haluros de alquilo y compuestos similares.
En condiciones neutros se puede producir la alquilación adicional y la formación de sales cuaternarias.
Los imidazoles sustituidos en C4, dan dos productos de N-alquilación posibles. Esto va a depender de las condiciones de alquilación y de los efectos estéricos y electrónicos del sustituyente.
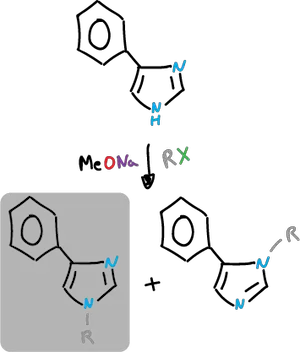
Se puede obtener el producto secundario acilandolo (cuaternizándolo) y eliminado posteriormente el grupo acilo.
Reacciones en los carbonos del anillo imidazólico
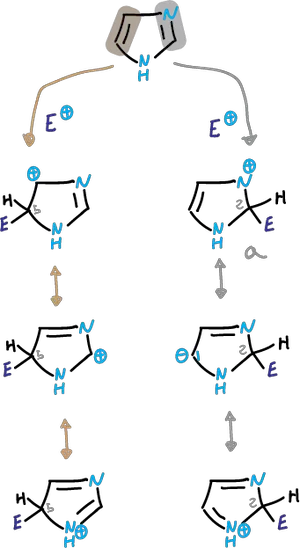
Estas reacciones son las que cabria esperar de un heterociclo aromático estable. Está menos activado para el ataque electrófilo comparado con el pirrol o tiofeno.
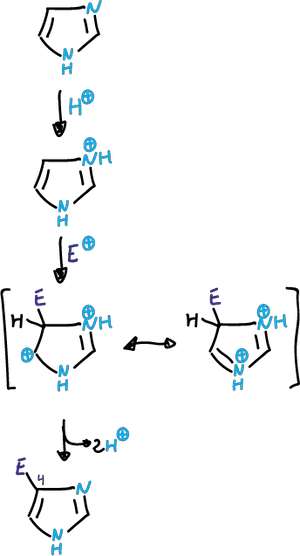
En la sustitución electrófila se complica debido a que en media ácido se protona el N3.
Dependiendo de las condiciones, la reacción puede tener lugar en el imidazol neutro o en un catión imidazólico.
En las reacciones que se efectúan en ácido fuerte, participa el catión que está desactivado frente a electrófilos.
Alquilación y acilación Friedel-Crafts
Así, la alquilación o acilación de Friedel-Crafts casi siempre fracasa.
En los casos en que la sustitución se da (difícil nitración y sulfonación), se efectúa sobre al ácido conjugado obtenido en el primer paso de protonación, y se lleva a cabo sobre el carbono C4.
Bromación
La bromación tiene lugar en la posición C4. y se realiza con disolventes orgánicos y en ausencia de catalizador.
Se podría pensar que la sustitución en la posición C2 fuera favorable en relación a la C5.
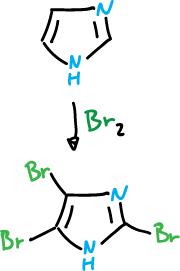
Sin embargo, la estructura (a) presenta carga que tiene que deslocalizarse a través del nitrógeno imínico y por tanto es muy inestable. Sin embargo, con bromo el imidazol llega hasta el 2,4,5-tribromo-imidazol, en ausencia de catalizador.
También, sufre bromación en la posición C5, cuando la posición C4 está ocupada por un sustituyente donante de electrones.
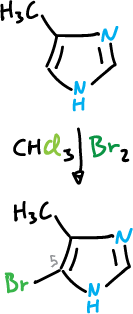
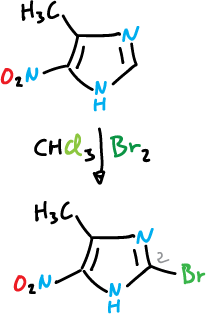
Cuando tanto la posición C4 como la C5 están ocupadas, a menudo, se produce la sustitución en C2.
Eliminación del hidrógeno en C2
Un aspecto excepcional en la química de los imidazoles es la facilidad con que se pueden perder el protón en C2 en condiciones neutras o básicas.
Este proceso parece implicar la formación de un iluro de imidazolio (a).
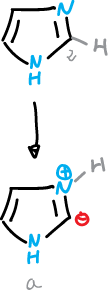
El iluro de imidazolio se puede generar a partir del catión 1,3-dimetil imidazolio, y después se puede sustituir en C2 con haluros de alquilo y otros electrófilos.
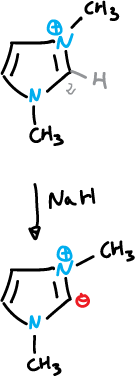
Reacciones de sutitución nucleófila
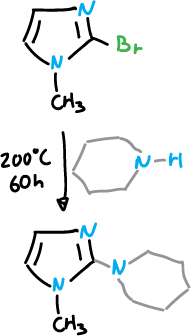
Las reacciones de sustitución nucleófila en imidazoles tienen ligar con más facilidad en C2, pero, de forma general, son difíciles en cualquier posición, a menos que estén presentes grupos activantes adicionales.
El anillo imidazólico se rompe en condiciones fuertemente básicas lo que imposibilita ciertas reacciones de desplazamiento con nucleófilos básicos.
Por ejemplo con piperidina.
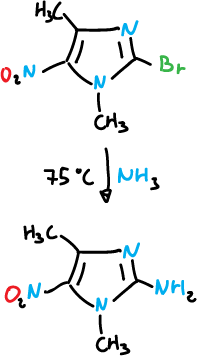
O también con amoniaco.