Written by José | Last Updated on 2 meses
¿Qué es la Quiralidad?
Dos moléculas son quirales cuando no son superponibles a su imagen especular. Además, la quiralidad es esencial para que dos molécular puedan ser enantiómeros. Dos moleculas aquirales no pueden ser enantiómeros.
Índice
Lord Kelvin (William Thomson) en 1893, definió la quiralidad como:
«Denomino quiral y digo que tiene quiralidad toda figura geométrico, o todo grupo de puntos, si su imagen en un espejo plano, idealmente realizada, no puede hacerse coincidir consigo misma»
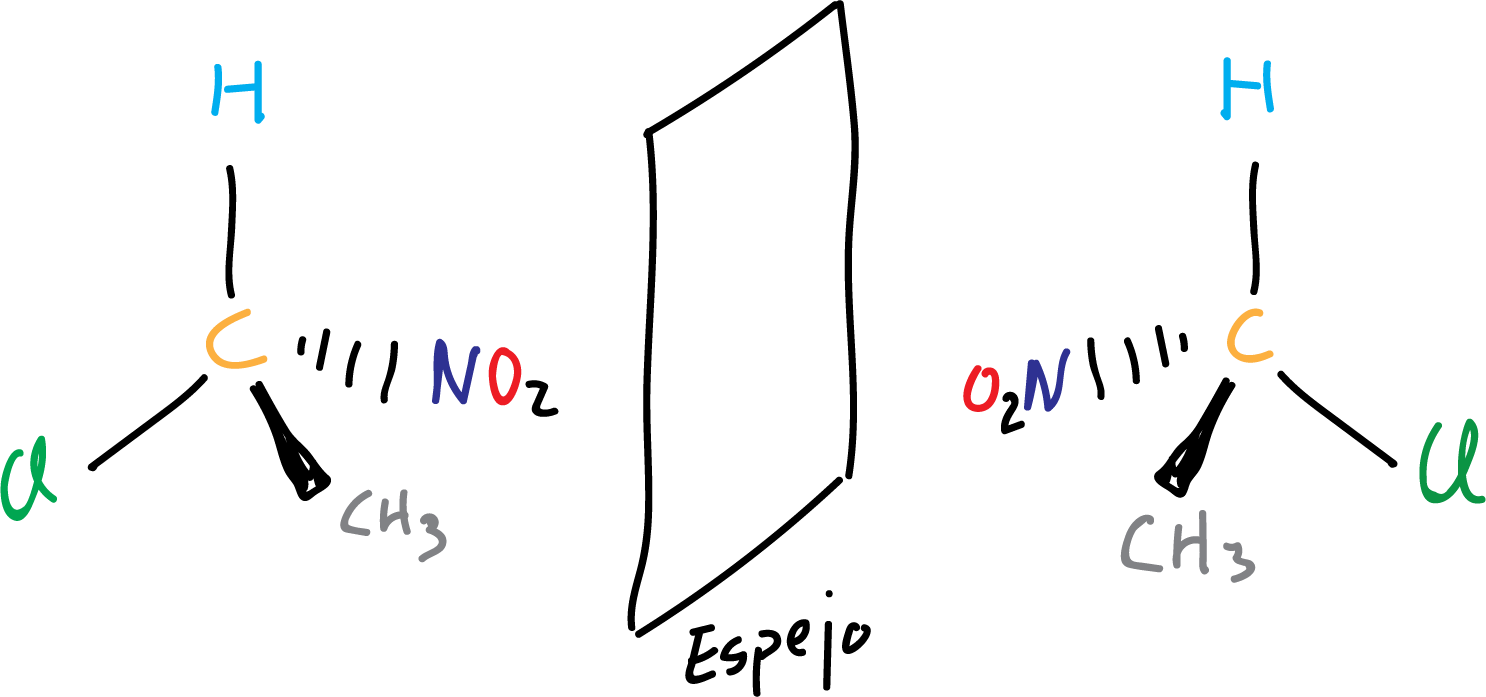
De esta manera para saber si dos moleculas son quirales o no, hacemos una representación de la molécula y otra de su imagen especular y si no se pueden superponer ambas (no son idénticas) significa que son quirales.
Se suele utilizar como un símil de quiralidad las manos, ambas manos no son exactamente iguales porque no se pueden superponer, y por tanto serían quirales. De hecho, la palabra quiralidad proviene de la palabra griega «cheir» (mano), y significa «sentido de las manos«, refiriendose a ese par de manos que no son superponibles.

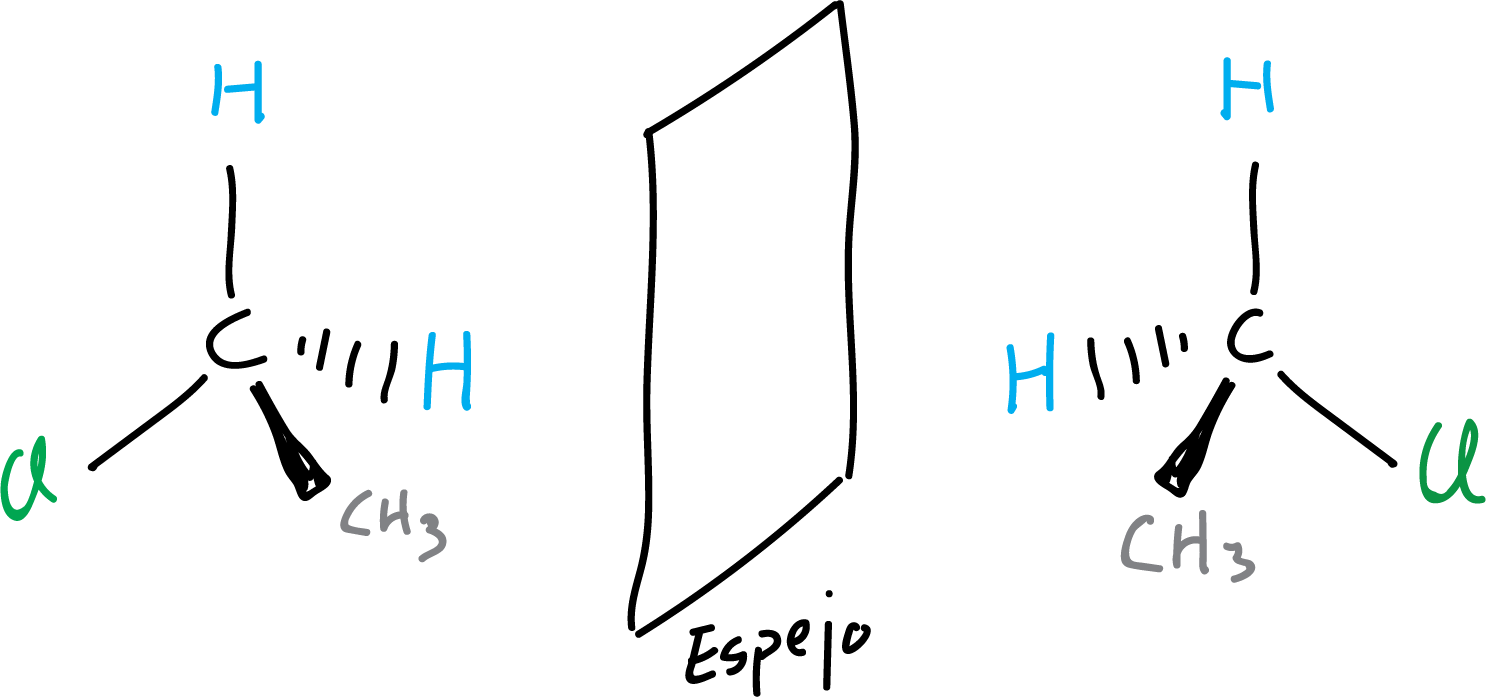
En el siguiente ejemplo, se ilustra una molécula aquiral, ya que ambas representaciones de dicha molécula y su imagen especular se pueden superponer (coinciden espacialmente cuando se superponen).
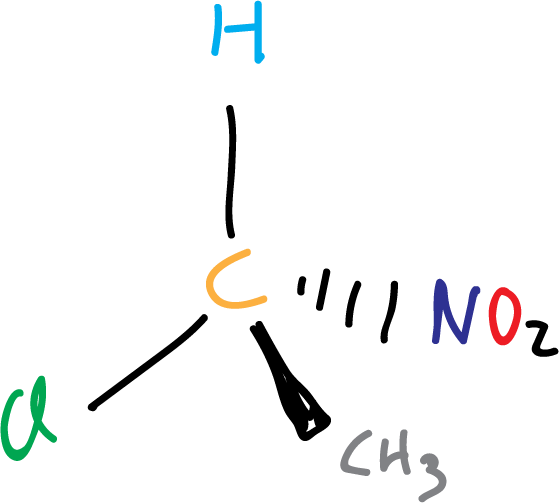
Centro quiral
Se denomina centro quiral a un carbono unido a cuatro grupos diferentes. También, se le denomina carbono quiral, cuando hay que distinguirlo de un nitrógeno quiral o fosforo quiral.
Casi todas las moléculas que presentan centros quirales son quirales (pero no todas), y casi todas las moléculas quirales presentan centros quirales (pero no todas).
Ejemplos
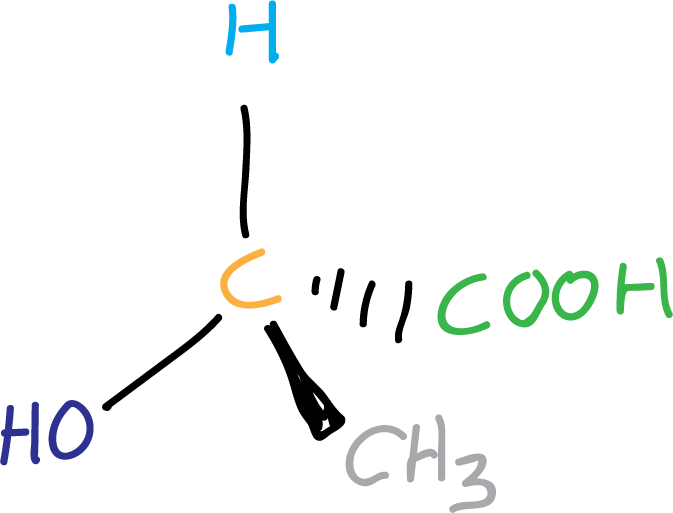
Para explicar esto veamos algunos ejemplos, en la figura se ilustra una molécula que aunque presenta dos centros quirales (resaltados en naranja) es aquiral.
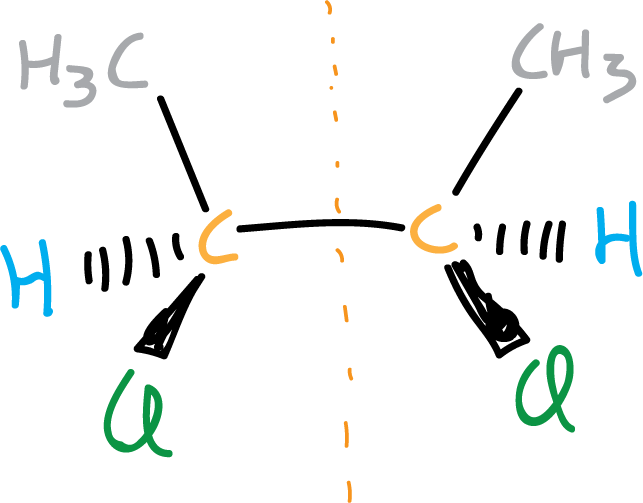
Sin embargo, si en una molécula sólo existe un centro quiral podemos afirmar que dicha molécula es quiral.
fig-1 molecula con un centro quiral.
Por otro lado, existen casos en los que una molécula no presenta centros quirales y es quiral.
fig-2 sin centros quirales bisfenilo susbstituido
Centros quirales y enantiómeros
Por tanto, la presencia o no de centros quirales no es un criterio de quiralidad en una molécula. Sin embargo, la mayoría de las moléculas quirales presentan dichos centros, por tanto es muy importante que se sepan reconocer estos centros quirales. Así, si detectamos un centro quiral es muy probable que la molecula sea quiral y que se puedan dar dos formas enantioméricas de dicha molécula.
Por ejemplo, el limoneno presenta un carbono asimétrico como estereocentro. En consecuencia, existen dos isómeros ópticos: el enantiómero R-limoneno y el S-limoneno. Tambien se les denomina D-limoneno y L-limoneno (antiguamente se les denominaba dextro y levo, respectivamente).
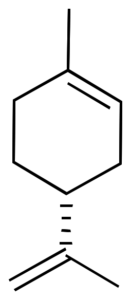 | 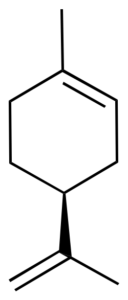 |
| Estructura 3D | Estructura 3D |
El R-limoneno se obtiene comercialmente a partir del limón y presenta una rotación quiral, [α]D, de 87–102°.
Para identificar centros quirales y enantiómeros se pueden utilizar diferentes tipos de representaciones moleculares.
¿Qué son los enantiómeros?
Se denominan enantiómeros a los isómeros que son imágenes especulares. La palabra enantiomero proviene del griego que significa «opuesto«.
Lo interesante de los enantiómeros es que tienen las mismas propiedades físicas (punto de ebullición, punto de fusión, indice de refracción, densidad, etc.), excepto que desvían la luz polarizada en diferente dirección de giro.
Es decir, la dirección de rotación de la luz polarizada uno de los enantiómeros la desvía hacia la derecha y otro hacia la izquierda, presentando un valor absoluto igual pero signo opuesto
Por otro lado, dos enantiómeros también presentan propiedades químicas idénticas (constantes de acidez, basicidad reactividad, velocidad de reacción, etc.), exceptuando cuando se utilizan reactivos ópticamente activos.
Para más información véase enantiómero.

