Índice
Hay reactivos o productos que son sensibles a la humedad, al oxígeno del aire e incluso al CO2. En estos casos es necesario realizar una protección eficaz de las reacciones en atmósfera inerte. Esto se debe a que los rendimientos se puedan ver afectados por la destrucción parcial o total de alguna sustancia sensible a lo largo de la reacción. También, a que algunas de estas transformaciones no deseadas pueden llegar a ser violentas dando lugar a explosiones o incendios. Por todo lo anterior, las reacciones de este tipo son de los procesos más complejos que pueden darse en un laboratorio de Química Orgánica. Y por este motivo, es importante tratarlas una vez que se conocen las principales operaciones básicas de laboratorio.
Con unas directrices relativamente sencillas, es posible mantener una atmósfera inerte en el interior de un montaje usando material de laboratorio convencional.
Son varios aspectos los que hay que tener en cuenta:
- El material debe estar perfectamente seco.
- Los disolventes deben ser anhidros.
- En el interior del montaje se debe sustituir el aire por un gas inerte, como nitrógeno o argón. Por tanto, se debe realizar la reacción bajo un flujo constante de gas inerte, o al menos se debe desplazar dicho aire con un gas inerte y mantener el interior con una ligera presión de dicho gas.
Precauciones con el material
El material debe estar perfectamente seco y se debe usar inmediatamente después de sacarlo de la estufa. Incluso puede resultar conveniente tratar con un secador de aire caliente los distintos componentes de los montajes mientras se ensamblan, para evitar la acumulación de humedad.
- Disolventes: Una primera consideración a tener en cuenta, es que en este tipo de reacciones los disolventes deben ser anhidros. Es decir, totalmente exentos de humedad. Para ello, los disolventes han de ser de calidad y recibir un tratamiento especial para la completa eliminación de las trazas de agua. Aunque hay muchos proveedores que comercializan disolventes envasados como «anhidros» la eliminación de los precintos y la exposición a la atmósfera, aunque sea mínima, puede invalidar su uso para algunas reacciones especialmente sensibles. En estos casos, se requiere que la condición de «disolvente anhidro» se alcance inmediatamente antes de su utilización.
Uso de disolventes anhidros
Existen básicamente dos procedimientos para obtener disolventes anhidros:
Tratamientos químicos individualizados
Secado de los disolventes más comunes:
- THF (tetrahidrofurano): Previamente se trata con hidruro de calcio o tamices moleculares 4 Å y seguidamente se calienta a reflujo bajo atmósfera inerte en presencia de sodio hilado y benzofenona durante varias horas hasta que el disolvente se vuelve azul intenso. Esto indica que el disolvente está seco. A partir de este momento, se puede tomar la cantidad necesaria. Si la mezcla se vuelve de color naranja indica que hay que preparar una nueva cantidad.
- Éter dietílico. Se seca de la misma manera que el THF. Para este tipo de disolventes se suele usar un montaje en el que se realiza el reflujo con el agente desecante hasta que el indicador colorimétrico muestre que el disolvente está exento de agua. A partir de este momento, el disolvente se puede empezar a recoger en un matraz que actúa como depósito, accionando un sistema de llaves. Si no se usa, el disolvente se puede devolver al matraz donde se lleva a cabo el reflujo para que siga en contacto con el desecante. Todo el proceso se realiza bajo atmósfera inerte.
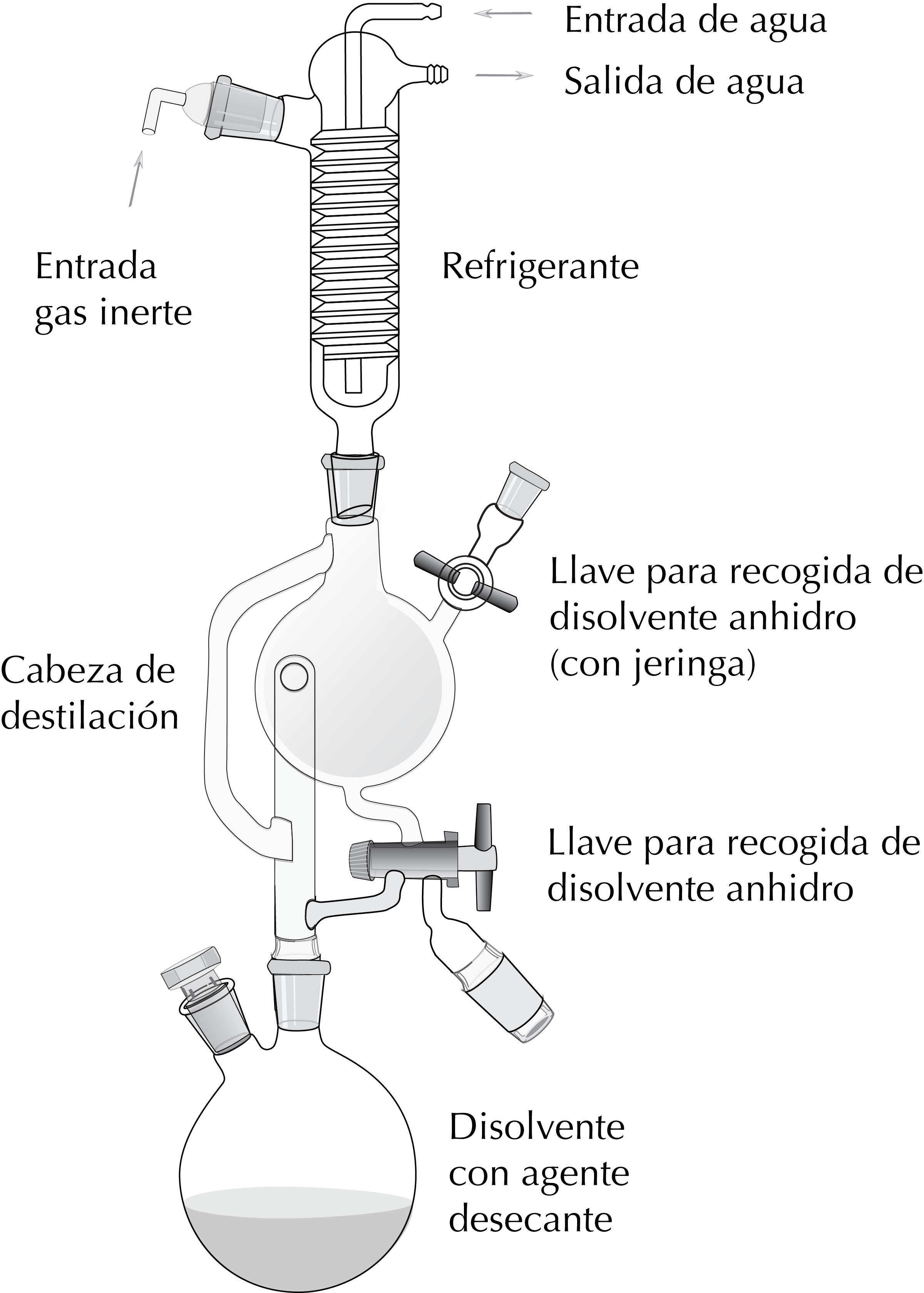
| ¡PELIGRO! «Para eliminar el sodio residual de este procedimiento, se adiciona lentamente EtOH. Este proceso es lento y se ve facilitado por la agitación ocasional del matraz. Una vez que se esté seguro de que no se desprende más hidrógeno, se puede añadir muy lentamente pequeñas cantidades de mezclas hidroalcohólicas 1:1. Cuando se observa que no hay más reacción, se añade agua hasta la formación de dos fases bien diferenciadas que se deben separar y verter en el contenedor de residuos apropiado.« |
- CH2Cl2: Se trata previamente con hidruro de calcio, y a continuación, se destila sobre este mismo compuesto. No hay ningún indicador colorimétrico que indique que el disolvente esté seco.
- MeOH: Para la mayoría de los usos, se seca sobre tamices moleculares de 3 Å una noche y seguidamente se destila. Alternativamente, el MeOH se puede secar con metóxido de magnesio. Para un volumen de 1 l se toman 100 ml de MeOH seco por el procedimiento anterior y se refluyen con virutas de magnesio (5 g) y yodo (0.5 g) hasta que todo el magnesio ha reaccionado. Se añade MeOH hasta un volumen de 1 l y se mantiene a reflujo durante 2-3 h bajo atmósfera inerte.
- MeCN: Se agita con tamices moleculares de 4 Å, y se destila sobre hidruro de calcio.
| ¡PELIGRO! «El proceso de eliminación del magnesio o del hidruro cálcico es similar al utilizado para el sodio. Cuando cesa el desprendimiento de hidrógeno al añadir EtOH, se puede adicionar agua con precaución hasta que no se observe formación de burbujas. Si se forman una fase acuosa y una capa orgánica deben separarse y verterse en el contenedor de residuos adecuado. Si el agua y disolvente son miscibles se añade más agua y se vierte en el contenedor de residuos.« |
- DMF (N,N-dimetilformamida): Tiene el inconveniente de que descompone lentamente a temperatura ambiente y con mayor rapidez a reflujo, dando dimetilamina y CO. La descomposición está catalizada por trazas de ácidos y bases o con agentes de secado básicos tales como hidruro de calcio. Se puede secar con óxido de bario o tamices moleculares de 4 Å a temperatura ambiente durante una noche, eliminado el agente desecante por decantación y destilación a vacío ∼ 20 mmHg es un vacío suficiente para reducir el punto de ebullición más de DMF).
Para almacenar durante un tiempo los disolventes anhidros es conveniente guardarlos en un recipiente sobre tamices moleculares de 4 Å.
Cualquier reacción o destilación se debe realizar bajo atmósfera inerte.
Dispensadores de disolventes
Cada vez es más frecuente disponer en los laboratorios de Química Orgánica de dispensadores de disolventes anhidros. Se usan disolventes de alta calidad que se almacenan en recipientes metálicos de seguridad y que pasan por columnas con un relleno específico que retiene el agua u otras moléculas residuales como alcoholes o aminas, antes de salir por la correspondiente válvula. Este proceso se realiza por arrastre del disolvente mediante una corriente de gas inerte. Las válvulas permiten el llenado de matraces de todo tipo sin que haya contacto con el aire.
Origen del gas inerte
Bala de gases o circuito centralizado
Los gases inertes pueden estar almacenados en una bala de gases o disponibles en un sistema centralizado. En cualquier caso, la presión del gas se regula con un manoreductor que es un dispositivo que permite reducir la presión de un fluido y mantener el caudal de salida a una presión constante fija o seleccionada.
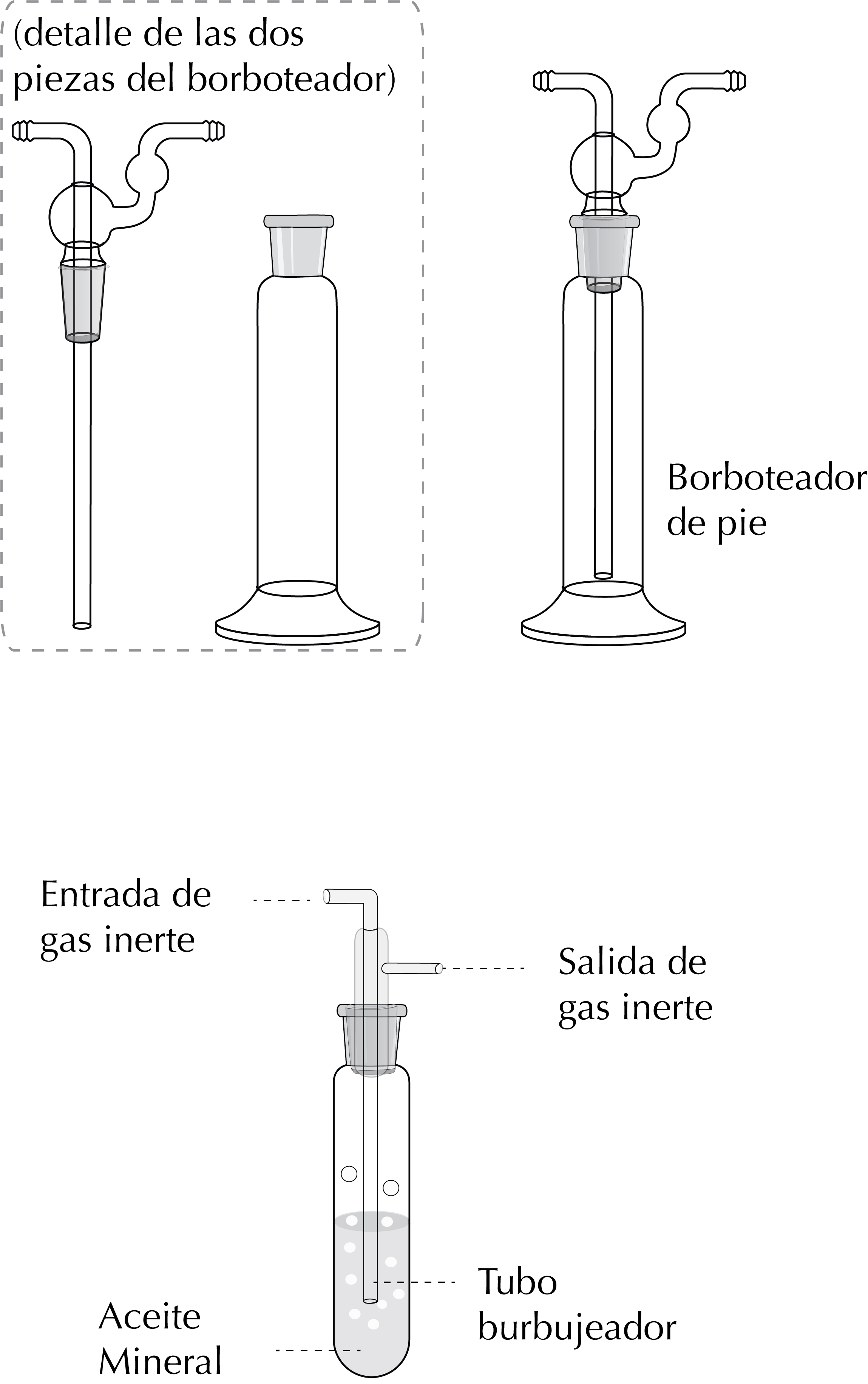
Para controlar el caudal de gas inerte en un montaje se usa un burbujeador al final del montaje. Un burbujeador es un dispositivo de vidrio que tiene glicerina o un aceite mineral por el que pasa el gas. Se regula el caudal en función del burbujeo de este en el fluido.
Mediante un globo
Un globo de caucho lleno de gas inerte conectado a una jeringa con aguja se pincha en un septum, de esta manera se mantiene una ligera presión en el interior con el gas inerte.
Transferencia de reactivos y disolventes sensibles al aire o la humedad
En las reacciones bajo atmósfera inerte resulta frecuente manipular reactivos que son sensibles a la humedad o al oxígeno del aire. Para transferir dichos reactivos a los recipientes en donde se efectúa la reacción se puede hacer de varias formas. A continuación, se describen algunas de estas formas.
En primer lugar hay que indicar que para el caso de reactivos líquidos en disolución, los frascos están sellados por un doble cierre formado por una cápsula metálica similar a la de los botellines de refrescos con un orificio en el centro que deja al descubierto una pequeña superficie de un material polimérico (como polipropileno o similar) que permite ser perforado por agujas o cánulas repetidas veces sin que el reactivo entre en contacto con el aire. Para botellas convencionales se puede usar un septum como tapón.[1]
Mediante una simple jeringa con aguja se pueden tomar las cantidades que se necesite. Para facilitar el llenado de la jeringa y evitar la entrada de humedad o aire, es conveniente pinchar otra aguja unida a un tubo flexible con nitrógeno o argón. El aumento de la presión de gas inerte impulsa al líquido llenando la aguja.
Para transferir cantidades mayores se puede usar una cánula, que es un tubo de acero que a ambos extremos presenta la terminación de una aguja. El recipiente con el reactivo o disolvente se pincha con un tubo flexible con gas inerte y la cánula por un extremo y por el otro se pincha en un matraz con un septum y una salida de gases, como puede ser otra aguja o incluso un borboteador. Al aumentar la presión de gas inerte en el recipiente del reactivo o del disolvente, este pasa a través de la cánula al matraz. Si se deja de pasar gas inerte cesa el trasvase.
Referencias y notas
[1] El cierre del septum se puede asegurar con Parafilm® ya que es ideal para sellar tubos, frascos, placas petri y vasos entre otros contenedores. Es durable, resiste a la humedad y se adhiere a diferentes superficies.
Catedrático de Química Orgánica en la Universidad de Granada, con una larga trayectoria en Química Computacional, en modelado y diseño molecular.
